高中化学方程式大全(默写训练版)
- 格式:doc
- 大小:1.63 MB
- 文档页数:35

化学方程式默写1.碱式碳酸铜受热分解:Cu(OH)2CO3△2CuO+H2O+CO2↑2.碳酸氢铵受热分解:NH4HCO3△NH3↑+H2O+CO2↑3.高锰酸钾制取氧气:2KMnO4△K2MnO4+MnO2+O2↑4.双氧水、二氧化锰制取氧气:2H2O2 MnO2 2H2O+O2↑5.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑6.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑7.碳完全燃烧:C+O2点燃CO28.碳不完全燃烧:2C+O2点燃2CO9.硫在氧气中燃烧:S+O2点燃SO210.铁在氧气中燃烧:3Fe+2O2点燃Fe3O411.磷燃烧,产生大量白烟(军事上做烟幕弹):4P+5O2点燃2P2O512.煤燃烧:Mg+O2点燃2MgO(军事上做照明弹)13.铝在空气中形成致密的氧化铝薄膜:4AI+3O2=2AI2O314.用灼热的铜网除去氧气:2Cu+O2△2CuO15.电解水,正氧气负氢气,体积比1:2,质量比8:1 2H2O2通电2H2↑+O2↑16.氢气燃烧:2H2+O2点燃2H2O17.二氧化碳和水反应:CO2+H2O=H2CO318.加热含有二氧化碳的水溶液:H2CO3△H2O+CO2↑19.二氧化碳通入澄清石灰水中(检验二氧化碳):CO2+Ca(OH)2=CaCO3↓+H2O20.一氧化碳(煤气)燃烧:2CO+O2点燃2CO221.甲烷(天然气)燃烧:CH4+2O2点燃CO2+2H2O22.硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓23.铁和稀盐酸或稀硫酸反应:Fe+2HCI=FeCI2+H2↑; Fe+H2SO4=FeSO4+H2↑24.镁和稀盐酸或稀硫酸反应:Mg+2HCI=MgCI2+H2↑; Mg+H2SO4=MgSO4+H2↑25.铝和稀盐酸或稀硫酸反应:2Al+6HCI=2AICI3+3H2↑; 2AI+3H2SO4=AI2(SO4)3+3H2↑26.锌和稀盐酸反应:Zn+2HCI=ZnCI2+H2↑27.铁和硫酸铜溶液反应,固体质量增加,溶液质量减少:Fe+CuSO4=Cu+FeSO4现象:铁丝表面出现红色固体,溶液由蓝色变成浅绿色28.赤铁矿炼铁:现象:红棕色固体变成黑色,生成气体能使澄清石灰水变浑浊。

高一化学方程式默写(精较、分9张)1.Na + H2O = NaOH + H22.Na2O + H2O = 2NaOH3.2NaOH + H2O = Na2O + 2H2O4.4Na + O2 = 2Na2O5.2Na2O + 2CO2 = 2Na2CO36.2NaHCO3 = Na2CO3 + H2O + CO27.Na2CO3 + CO2 + H2O = 2NaHCO38.Na2CO3 + 2HCl = 2NaCl + H2O + CO29.NaHCO3 + NaOH = Na2CO3 + H2O10.Mg + CO2 = MgO + C11.2Mg + N2 = 2Mg3N212.Mg + 2HCl = MgCl2 + H213.2NaCl + CaCO3 = Na2CO3 + CaCl214.MgO + C = Mg + CO15.2Al + 6HCl = 2AlCl3 + 3H216.2Al + 2NaOH + 6H2O = 2NaAl(OH)4 + 3H217.4Al + 3Fe2O3 = 2Fe2O3 + 12AlO18.2Al(OH)3 + 3NaOH = 2NaAl(OH)419.AlCl3 + 3NaOH = Al(OH)3 + 3NaCl20.AlCl3 + 3NH3 + 3H2O = [Al(NH3)6]Cl321.NaAlO2 + CO2 + H2O = NaHCO3 + Al(OH)322.Al2(SO4)3 + 3CaCO3 + 3H2O = 3CaSO4 + Al2(CO3)3 + 3H2O23.2Al(OH)3 = Al2O3 + 3H2O24.2Al2O3 + 3C = 4Al + 3CO225.Fe2O3 + 3CO = 2Fe + 3CO226.CaCO3 = CaO + CO227.4Fe(OH)2 + O2 + 6H2O = 4Fe(OH)328.FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl29.Fe2+ + 2SCN- = Fe(SCN)230.FeCl2 + Cl2 = 2FeCl331.Fe2+ + Cl2 = FeCl2 + Cl-32.Fe + 2FeCl3 = 3FeCl233.Fe2+ + 2Cl- = FeCl234.Cu + 2FeCl3 = 2FeCl2 + CuCl235.Cu2+ + 2Cl- = CuCl236.2NaCl + 2H2O + electricity = Cl2 + 2NaOH + H237.MnO2 + 4HCl = MnCl2 + 2H2O + Cl238.FeSO4 + 2HCl = FeCl2 + H2SO439.Cl2 + H2O = HCl + HClO40.Cl2 + 2NaOH = NaCl + NaClO + H2O41.Cl2 + Ca(OH)2 = Ca(ClO)2 + 2H2O42.Ca(ClO)2 = CaOCl2 + CaCl243.2HClO = 2HCl + O244.Cl2 + 2NaBr = 2NaCl + Br245.Cl2 + 2KI = 2KCl + I246.2KBr + Cl2 = 2KCl + Br247.AgNO3 + NaBr = AgBr + NaNO3.AgNO3 + KI = AgI + KNO348.NaOH + SO2 = NaHSO349.2SO2 + 2Cl2 + 2H2O = 4HCl + H2SO450.SO2 + H2O2 = H2SO451.SO2 + H2O2 = H2SO452.工业生产硫酸的化学方程式是FeS2 + O2 + H2O → FeSO4 + H2SO4.53.铜和浓硫酸在加热条件下反应的方程式是Cu +2H2SO4 → CuSO4 + SO2 + 2H2O。

高考总复习之高中化学方程式总结 化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀) 24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na 69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓) 82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )( 90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+120、HCl NaHSO +3第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。

1、小苏打的电离方程式2、电解的MgCl2溶液离子方程式3、水只作还原剂4、工业制漂白粉5、生成一种黑色和一种白色物质的置换反应6、钢铁的吸氧腐蚀的正极反应7、硫酸铵水解的离子方程式8、乙醇氧化为乙醛9、丙烯与Br2的四氯化碳溶液反应10、实验室制氯气11、氯气与水反应的离子方程式12、工业上合成SO313、大理石与醋酸溶液反应的离子方程式14、草酸(乙二酸)的电离方程式15、工业上炼铁的原理16、偏铝酸钠水解的离子方程式17、乙烯使酸性高锰酸钾溶液褪色的离子方程式18、乙醛与新制的氢氧化铜悬浊液反应19、稀盐酸与稀NaOH反应的中和热的热化学反应方程式20、工业上制Na[1、看清题目2、注意条件的有无3、配平4、符号]1、硫酸氢钠的电离方程式2、电解CuSO4溶液的离子方程式3、水只作氧化剂4、工业制水煤气5、生成两种强酸的反应6、铜作电极电解饱和食盐水阳极的反应7、氨水显碱性的原因8、2-丙醇的催化氧化9、丙烯的加聚10、实验室不加热制氯气11、氯气与过量氨气反应12、工业上合成氨气13、Al(OH)3与高氯酸溶液反应的离子方程式14、HI的电离方程式15、工业上用黄铁矿制SO216、化合反应生成NaHCO317、盛放硝酸溶液的试剂瓶为棕色的原因18、亚硫酸的电离方程式19、氢气的燃烧热热化学方程式(氢气的热值为142.9kJ/g)20、工业上制Al[1、看清题目2、注意条件的有无3、配平4、符号]1、除去溴苯中混有的溴2、甲酸乙酯与NaOH溶液反应3、稀硫酸表现出氧化性4、不能用石英坩埚煅烧石灰石的原因5、硫酸铝溶液与小苏打溶液混合的离子方程式6、酸性条件下的甲烷燃料电池的负极反应7、NaHCO3显碱性的原因(离子方程式)8、1-丙醇的催化氧化9、2-羟基丙酸(乳酸)发生缩聚反应10、Cu与浓硫酸反应实验室制SO2气体11、SO2气体表现出氧化性12、工业上制NO13、葡萄糖转化为乙醇14、用两种固体物质实验室制氨气15、硫代硫酸钠与稀硫酸反应的离子方程式16、化合反应生成FeCl217、乳酸(2-羟基丙酸)发生消去反应18、Al与NaOH溶液反应的离子方程式19、草酸(乙二酸)与乙二醇反应生成环状化合物20、乙醛发生银镜反应的离子方程式[1、看清题目2、注意条件的有无3、配平4、符号]1、乙酸甲酯在稀硫酸溶液中水解2、电解NaOH溶液3、钢铁在食盐水中发生腐蚀的负极反应4、苯与溴反应中溴苯5、苯与乙烯发生加成反应6、碱性条件下的甲烷燃料电池的负极反应7、氯化铝溶液显酸性的原因(离子方程式)8、实验室制乙烯9、2-羟基丙酸被氧气催化氧化10、SO2气体通入碘水中的离子方程式11、SO2气体通入FeCl3溶液中的离子方程式12、淀粉水解成葡萄糖13、碳铵受热分解14、乙二醇生成分子式为C4H8O2的有机物的反应15、化合反应生成硝酸铵16、除去洒落在地上的水银17、饱和碳酸钠溶液中通入CO2气体的离子方程式18、Si与NaOH溶液反应的离子方程式19、铁与水蒸气在高温下反应20、AlCl3溶液中加入过量的氨水的离子方程式[1、看清题目2、注意条件的有无3、配平4、符号]高中化学方程式默写训练(五)1、乙酸与CH3CH218OH发生酯化反应2、电解NaOH溶液的阴极反应3、钢铁在NaOH溶液中发生腐蚀的负极反应4、苯与丙烯加成5、Na在空气中燃烧6、碱性条件下的甲醇燃料电池的负极反应7、NaAlO2溶液中加入过量的盐酸(离子方程式)8、用酚酞作指示剂时用盐酸滴定碳酸钠溶液9、2-羟基丙酸(乳酸)生成六元环状化合物10、苯制硝基苯11、足量SO2气体通入Ba(OH)2溶液中的离子方程式12、BrCl与水反应(非氧化还原反应)13、CuH在氯气中点燃14、检验铵根离子的离子方程式15、化合反应生成Fe(OH)316、NO2通过一步反应转化为NO17、碳酸钠溶液中加入少量的盐酸18、Be(与Al相似)与NaOH溶液反应的化学方程式19、用稀盐酸酸化硝酸亚铁溶液的离子方程式20、氨基乙酸(最简单的氨基酸)与盐酸反应[1、看清题目2、注意条件的有无3、配平4、符号]。

一、高化学方程式总结(1) 硫酸根离子的检验:(2) 碳酸根离子的检验:(3) 碳酸钠与盐酸反应:(4) 木炭还原氧化铜:(5) 氯化钙与碳酸钠溶液反应:(6) 氧化物的反应a) 氧化铁与盐酸反应:b) 氧化钙与水反应:c) 氧化铝与盐酸反应:d) 氧化铝与氢氧化钠溶液反应:e) 氯化铁与氢氧化钠溶液反应:(7) 的化学反应方程式a) 钠在空气中燃烧:b) 钠与氧气反应:过氧化钠c) 过氧化钠与水反应:d) 过氧化钠与二氧化碳反应:e) 钠与水反应:(8) 及化合物的化学反应方程式a) 铁与水蒸气反应:b) 铁片与硫酸铜溶液反应:c) 氧化铁与盐酸反应:d) 氯化铁与氢氧化钠溶液反应:e) 硫酸亚铁与氢氧化钠溶液反应:f) 氢氧化亚铁被氧化成氢氧化铁:g) 氢氧化铁加热分解:h) 三氯化铁溶液与铁粉反应:i) 氯化亚铁中通入氯气:(9) 及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:b) 实验室制取氢氧化铝:·c) 氢氧化铝与盐酸反应:d) 氢氧化铝与氢氧化钠溶液反应:e) 氢氧化铝加热分解:f) 二氧化硅与氢氟酸反应:g) 硅单质与氢氟酸反应:h) 二氧化硅与氧化钙反应:i) 二氧化硅与氢氧化钠溶液反应:j) 往硅酸钠溶液中通入二氧化碳:k) 硅酸钠与盐酸反应:a) 氯气与金属铁反应:b) 氯气与金属铜反应:c) 氯气与金属钠反应:d) 氯气与水反应:e) 次氯酸光照分解:f) 氯气与氢氧化钠溶液反应:g) 氯气与消石灰反应:h) 盐酸与硝酸银溶液反应:i) 漂白粉长期置露在空气中:(11) 及其化合物的反应方程式a) 氮气与氧气在放电下反应:b) 氧化氮与氧气反应:c) 二氧化氮与水反应:d) 二氧化硫与氧气在催化剂的作用下反应:e) 三氧化硫与水反应:(12) 氨及其反应方程式a) 氨水受热分解:·b) 氨气与氯化氢反应:c) 氯化铵受热分解:d) 碳酸氢氨受热分解:e) 硝酸铵与氢氧化钠反应:f) 氨气的实验室制取:g) 氯气与氢气反应:h) 硫酸铵与氢氧化钠反应:i)(13) 及其化合物的化学反应方程式a)b)c) d)e)f) 二氧化硫与水反应:≈g) 浓硫酸与铜反应:(浓h) 浓硫酸与木炭反应:(浓i) 硫酸铵与氢氧化钠反应:j)(14) 及其化合物的反应方程式a) 、的回收:b) 浓硝酸与铜反应:(浓c) 稀硝酸与铜反应:(稀(15) 硅的反应方程式冶炼纯硅a)b) 硅单质的实验室制法:c) 粗硅转变为纯硅:(粗(纯二、氯的化学方程式:1)2)3)4)5)(粗6)7)8)9)10)11)12)13)14)15) 16)17)18)19)20)21) 与浓发生如下反应: →,该反应中被氧化的氯元素与被还原的氯元素的质量比是:. : . : . : . :个由到,未变。

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。

高中化学方程式默写.写出下列反应的化学方程式(是离子反应的还要写出离子方程式)1.钠在氧气中燃烧:2.钠与氧气在常温下反应3.钠与水反应4.氧化钠与水反应6.过氧化钠与水反应7.过氧化钠与二氧化碳反应8.碳酸钠与盐酸反应9.碳酸氢钠与盐酸反应10.碳酸氢钠与氢氧化钠反应11.碳酸氢钠加热分解12.二氧化碳通入碳酸钠溶液13.碳酸钙加盐酸14.碳酸氢钠加过量氢氧化钙15.碳酸氢钠加少量氢氧化钙16.氢氧化钠中通入少量的二氧化碳气体氢氧化钠中通入过量的二氧化碳气体17.氢氧化钙溶液中通入过量的二氧化碳气体18.碳酸氢钙加过量氢氧化钠19.氢氧化钠加过量碳酸氢钙20.实验室制氯气21.浓盐酸加高锰酸钾22.氯气与水反应23.氟气与水反应24.工业上制漂粉精(或漂白粉)25.氯气与氢氧化钠溶液反应26.氯气与铁反应27.氯气与铜反应28.氯气与钠反应29.氯气与溴化钠反应30.氯气与碘化氢反应31.溴与碘化钾反应32.溴化银见光分解33.在高温下氧化铁与一氧化碳气体反应34.硫与铜加热反应35.硫与铁加热反应36.过氧化氢与二氧化锰制氧气37.臭氧层破坏38.二氧化硫与硫化氢反应39.卤素单质溶液X2(X=Cl、Br、I)中通入SO241.氯气与亚硫酸钠溶液反应42.铜与浓硫酸反应43.碳与浓硫酸反应44.二氧化硫制三氧化硫三氧化硫与水反应45.硫化氢与浓硫酸反应46.硅与氢氧化钠溶液反应47.二氧化硅与碳反应48.二氧化硅与氢氧化钠反应、49.二氧化硅与碳酸钙反应50.二氧化硅与氢氟酸反应51.工业上制取氨气的方法:52.在放电条件下氮气与氧气的反应53.一氧化氮遇到空气变成红棕色的气体:54. NO2 + O2 + H2O= HNO355. NO + O2 + H2O = HNO356. P+ O257. P2O5+ H2O H3PO458. P+ Cl2(不足)59. P+ Cl2(足量)60.氨溶于水显碱性的原因:61.NH3?H2O不稳定,受热易分解:62.将蘸有浓氨水的玻璃棒和蘸有弄盐酸的玻璃棒相互靠近时,产生大量的白烟:63.氨的催化氧化:64.将NH4Cl晶体加热,在试管上端的试管壁上有白色固体附着,此过程发生的反应是:65.NH4HCO3 受热时的分解反应:66. (NH4)2SO4固体和NH4NO3固体,分别与NaOH加热反应:67.实验室制取氨气的反应原理:68.浓硝酸呈黄色的原因是:69.铜和稀硝酸反应时,放出无色的气体,当接触空气后,气体变成了红棕色,写出上述过程中发生的反应:70.木炭与浓硝酸的反应:71.将CO2通入石灰水中,先有白色沉淀产生,随CO2的继续通入,白色沉淀消失,请写出上述过程中发生的化学方程式:72.氧化铁被CO还原:73.工业上用黄铁矿石(主要成分是FeS2)来制取硫酸,主要的反应为:74.将NO2气体压缩加压,发现气体颜色变浅:75.写出下列电解质的电离方程式:①CH3COOH:②NH3 ?H2O:③H3PO4:④Mg(OH)2:⑤NaHSO4在熔融状态下电离:⑥NaHSO4在水中电离:⑦明矾溶于水电离:76.写出下列盐发生的水解反应的方程式:①NH4NO3:②Na2S:③Fe2(SO4)3:77.Na2CO3溶于水显碱性的原因(用离子方程式表示):78.明矾和FeCl3可用作净水剂的原因(用离子方程式表示):79.泡沫灭火器包含Al2(SO4) 3和NaHCO3溶液,使用时的离子反应方程式:80.在NH4Cl溶液中加入镁条会产生气泡(用离子方程式表示):81.纯碱溶液中逐滴加盐酸至过量(用离子方程式表示):82.镁与CO2反应的化学方程式:83.实验室制取Al(OH)3离子反应方程式:84.把AlCl3溶液滴入NaOH溶液中的离子反应方程式:85.把NaOH溶液逐滴滴入AlCl3溶液中至过量(用离子方程式表示):86.Al2O3溶于NaOH溶液中(用离子方程式表示):87.把过量的CO2通入偏铝酸钠溶液中(用离子方程式表示):88.把CO2通入过量的偏铝酸钠溶液中(用离子方程式表示):89.把盐酸滴入偏铝酸钠溶液中至过量(用离子方程式表示):90.氮气和镁反应:91.过量的铁和不足的铁分别与稀硝酸反应的离子方程式:铁过量:铁不足:92.在空气中加热FeO:93.把Fe2O3放入盐酸中的离子方程式:94.实验室制取Fe(OH)2,观察到有白色沉淀产生,但沉淀马上变为灰绿色,最后变为红褐色,写出此过程的有关化学方程式:95.AlCl3溶液与氨水混合的离子方程式:96.写出下列的铝热反应:①铝粉与氧化铁:②铝粉与磁性氧化铁:③铝粉与二氧化锰:97.铝与氢氧化钠反应的离子方程式:98.Al(OH)3既可以与酸反应又可以与碱反应的原因(即Al(OH)3的电离方程式)是:99.氯化铝溶液中滴加过量的NaOH溶液的化学和离子方程式100.偏铝酸钠溶液滴加盐酸直到过量的现象、离子方程式。

钠的化合物的反应方程式的默写一、氧化钠(化学式和物理性质 )1.氧化钠与水反应化学方程式离子方程式2.氧化钠与二氧化碳的反应化学方程式3.氧化钠与稀硫酸的反应化学方程式离子方程式二、过氧化钠(化学式、俗称和物理性质)4.过氧化钠与水反应化学方程式离子方程式5.过氧化钠与二氧化碳的反应化学方程式6.过氧化钠与稀盐酸的反应化学方程式离子方程式三、氢氧化钠(化学式和物理性质 )碱的通性:a:b:碱+酸=盐+水化学方程式c:化学方程式d:化学方程式四、碳酸钠(化学式、俗称和物理性质 ) 7.向碳酸钠中逐滴加入稀盐酸化学方程式 a:b:离子方程式 a:b:8.向盐酸中加入碳酸钠溶液化学方程式离子方程式9.向碳酸钠溶液中通入二氧化碳的反应化学方程式离子方程式10.碳酸钠与氢氧化钙的反应化学方程式离子方程式五、碳酸氢钠(化学式、俗称和物理性质 )9.碳酸氢钠与盐酸的反应化学方程式离子方程式10.碳酸氢钠固体受热分解化学方程式11.碳酸氢钠与氢氧化钠的反应化学方程式离子方程式12.碳酸氢钠与少量氢氧化钙的反应化学方程式离子方程式13.碳酸氢钠与过量氢氧化钙的反应化学方程式离子方程式14.氢氧化钠与少量二氧化碳的反应化学方程式离子方程式15.氢氧化钠与过量二氧化碳的反应化学方程式离子方程式16.十水合碳酸钠的风化化学方程式铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:;2、铝在氯气中燃烧:;3、铝和硫共热:;4、铝与稀硫酸反应:;5、铝和氢氧化钠溶液反应:;6、铝和浓硫酸共热:;7、铝和浓硝酸共热:;8、铝和稀硝酸反应:;9、铝和硝酸银溶液反应:;10、铝与硫酸铜溶液反应:;11、铝和氧化铁高温下反应:;12、铝和四氧化三铁高温共热:;13、铝和氧化铜高温共热:;14、铝和二氧化锰高温共热:;二、氧化铝1、氧化铝与稀硫酸反应:;2、氧化铝与氢氧化钠溶液反应:;3、电解氧化铝的熔融液:;三、氢氧化铝1、氢氧化铝与稀硫酸反应:2、氢氧化铝与氢氧化钠溶液反应:;3、加热氢氧化铝:;四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:;2、硫酸铝的水溶液呈酸性:;3、硫酸铝溶液中加入少量的氢氧化钠溶液:;4、向硫酸铝溶液中加足量的氢氧化钠溶液;5、向硫酸铝溶液中加入少量的氢氧化钡溶液:;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:;7、向明矾溶液中加入少量的氢氧化钡溶液:;8、向明矾溶液中加入足量的氢氧化钡溶液:;9、向硫酸铝溶液中加入氨水:;10、向硫酸铝溶液中加入碳酸钠溶液:;11、向硫酸铝溶液中加入碳酸氢钠溶液:;12、向硫酸铝溶液中加入硫化钠溶液:;13、向硫酸铝溶液中加入硫氢化钠溶液:;14、向硫酸铝溶液中加入硅酸钠溶液:;15、向硫酸铝溶液中加入偏铝酸钠溶液:;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:;2、偏铝酸钠溶液滴入少量盐酸:;3、向偏铝酸钠溶液加入足量盐酸:;4、向偏铝酸钠溶液通入少量二氧化碳气体:;5、向偏铝酸钠溶液通入足量二氧化碳气体:;6、向偏铝酸钠溶液中加入硫酸铝溶液:;7、向偏铝酸钠溶液中加入氯化铵溶液:;8、向偏铝酸钠溶液中加入氯化铁溶液:;铁及其化合物化学方程式及离子方程式1、铁与非金属单质反应:(1) Fe在纯O2中燃烧:化学方程式:;(2) Fe与S的反应:化学方程式:;(3) Fe与Cl2点燃:化学方程式:;(4) Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。

高考总复习之高中化学方程式总结化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuClCl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl ClPCl→+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCOO H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222ClO H 2MnClMnO HCl 412、O H 8Cl5KCl 2MnCl2HCl 16KMnO22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHSO SO H NaCl 442(浓)15、↑+−→−+∆HCl SONa NaCl NaHSO42416、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合)17、33HNOAgCl AgNO HCl +↓→+化学 第一册第一章 卤素第一节 氯气 1、−−→−+点燃2Cl Na 2、−−→−+点燃2Cl Cu 3、−−→−+点燃2Cl Fe 4、−−−−→−+点燃(光照)22Cl H 5、−−→−+点燃2Cl P 6、→+23Cl PCl7、→+O H Cl 22 8、→+22Cl OH Ca )( 9、→++O H CO ClO Ca 222)( 10、→+2Cl NaOH 11、−→−+∆2MnO HCl12、→+(浓)HCl KMnO413、−−→−见光HClO 第二节 氯化氢14、→+(浓)42SO H NaCl 15、−→−+∆NaCl NaHSO416、−→−+∆(浓)42SO H NaCl (14、15结合) 17、→+3AgNO HCl18、33NaNOAgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223COO H CaClCaCOHCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO4COHNO4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15POH 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl3HCl 6KClO223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO3N S K S C 3KNO2第四节 卤族元素 29、HF 2F H 22→+ 30、HB r 2B r H 22→+ 31、HI 2I H 22→+32、22B r NaCl 2Cl NaB r 2+→+ 33、22I KCl 2Cl KI 2+→+ 34、22I KB r 2B r KI 2+→+ 35、33NaNOAgBr AgNO NaBr +↓→+36、33KNOAgI AgNOKI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔18、→+3AgNO NaCl19、→+3AgNO KCl 20、→+3CaCOHCl第三节 氧化还原反应21、−→−+∆2H CuO22、→+3HNOC23、−→−+∆(极稀)3HNO Zn 24、→++O H CuSO P 2425、→+(浓)HCl KClO326、−→−+∆(极稀)3HNO Mg 27、→++4243722SO H O Fe O Cr K 28、→++S C KNO3第四节 卤族元素 29、→+22F H 30、→+22Br H 31、→+22I H 32、→+2Cl NaBr 33、→+2Cl KI 34、→+2Br KI 35、→+3AgNO NaBr36、→+3AgNOKI37、−−→−光照AgBr 第二章 摩尔 反应热第一节 摩尔38、22CO O C →+ 39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积 40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+ 第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足) 54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SOS H 2222点燃56、HBr 2S Br S H 22+↓→+38、→+2O C 39、→+HCl Mg 第二节 气体摩尔体积 40、→+HCl Zn第三节 物质的量浓度 41、→+42SO H NaOH 第四节 反应热42、−−→−+点燃(气)(固)2O C 43、→+(气)(气)22O H 44、→+(气)(气)22O H 45、−→−+∆(气)(固)O H C 2第三章 硫 硫酸第一节 硫46、−→−+∆S Cu47、−→−+∆S Fe 48、−→−+∆2H S 49、−−→−+高温C S 50、−−→−+点燃2O S 51、−→−+∆KOH S 第二节 硫的氢化物和氧化物52、−→−∆S H 2 53、−−→−+点燃足)(22O S H 54、−−→−+点燃不足)(22O S H 55、−−→−+点燃22SO S H 56、→+22Br S H 57、↑+→+S H FeClHCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+ 59、HAc 2PbS S H PbAc22+↓→+60、O H NaHS NaOH S H 22+→+ 61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl2S FeCl2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀)65、3222SO H O H SO⇔+66、3O V 22SO 2O SO252∆−−→←+67、4223SO H O H SO →+ 68、↑++→+22424232SOO H SONa SOH SO Na69、O H SO Na NaOH 2SO 2322+→+ 70、32CaSOCaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSOSO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HB r 2O H 2B r SO +→++ 76、42424422SO H 2SOK MnSOKMnO 2O H 2SO 5++→++第三节 硫酸的工业制法 77、↑+−−→−+23222SO8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO252∆−−→←+57、→+HCl FeS58、→+S H CuSO 2459、→+S H PbAc2260、→+NaOH S H 2 61、→+NaOH NaHS62、→+NaOH S H 2(60、61结合) 63、→+32FeClS H64、→+FeS SO H (稀)42 65、⇔+O H SO 22 66、∆−−→←+5222O V O SO 67、→+O H SO 23 68、→+4232SO H SO Na 69、→+NaOH SO 2 70、→+CaO SO 2 71、→+22)(OH Ca SO 72、→++O H CaSOSO 23273、→+S H SO 22 74、→++O H Cl SO 222 75、→++O H Br SO 222 76、→++422KMnO O H SO第三节 硫酸的工业制法 77、−−→−+高温22O FeS78、∆−−→←+5222O V O SO 79、4232SO H SO O H →+80、O H 2SO2CO SO H 2C 22242+↑+↑−→−+∆(浓)81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SOPO H SO H P 224342+↑+−→−+∆(浓)83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SOCuSO SO H 2Cu 22442+↑+−→−+∆(浓)85、HCl 2BaSO SOH BaCl 4422+↓→+ 86、NaCl 2BaSOSO Na BaCl 4422+↓→+ 87、NaCl 2BaCOCONa BaCl 3322+↓→+88、↑++→+2223COO H BaClHCl 2BaCO89、↑++→+222333CO O H NO Ba HNO2BaCO)(90、↑++→+2223232COO H S Na SOH CONa91、42232SO H 2O SO H 2→+ 92、42232SO Na 2O SO Na 2→+ 93、423CaSO2O CaSO2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓)95、O H SONa SO B r SO H 2NaB r 22422242++↑+−→−+∆(浓)96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+ 99、222O Na O Na 2→+ 79、→+32SO O H80、−→−+∆(浓)42SO H C 81、−→−+∆(浓)42SO H S 82、−→−+∆(浓)42SO H P 83、−→−+∆(浓)422SO H S H 84、−→−+∆(浓)42SO H Cu 85、→+422SO H BaCl 86、→+422SO Na BaCl87、→+322CO Na BaCl88、→+HCl BaCO 389、→+33HNOBaCO90、→+3232SO H CO Na 91、→+232O SO H 92、→+232O SO Na 93、→+23O CaSO94、−→−+∆(浓)42SO H Fe 95、−→−+∆(浓)42SO H NaBr 96、−→−+∆(浓)42SO H NaCl 97、−−−→−42112211SO H O H C 浓 第四章 碱金属第一节 钠 98、→+2O Na 99、→+2O Na100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2 103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2 106、3222CO Na COO Na →+107、232222O CONa 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H COCONa NaHCO 222323+↑+−→−∆113、O H CONa NaOH NaHCO 2323+−→−+∆114、O H 2CONa CaCO OH Ca NaHCO 2232323++↓→+(少量))(115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))(116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCOCaClCONa 3232+↓→+118、O H 2CO2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CONa CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SONaCl HCl NaHSO223+↑+→+第三节 碱金属元素100、−−→−+点燃2Cl Na101、−−→−+研磨S Na 102、→+O H Na 2 103、→++42CuSO O H Na第二节 钠的氧化物 104、→+O H O Na 22 105、→+O H O Na 222 106、→+22CO O Na 107、→+222CO O Na 108、→+HCl O Na 2 109、→+HCl O Na 22 110、→+HCl CO Na 32 111、→+HCl NaHCO 3112、−→−∆3NaHCO113、−→−+∆NaOH NaHCO 3114、→+(少量))(23OH Ca NaHCO 115、→+(足量))(23OH Ca NaHCO116、→+232BaCl CO Na 117、→+232CaClCO Na118、→+HCl HCO Ca 23)( 119、→+NaOH HCO Ca 23)( 120、HCl NaHSO+3第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。

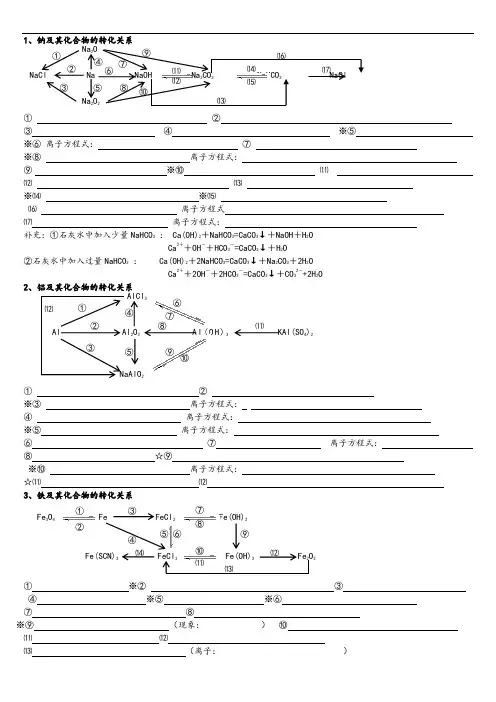
1、钠及其化合物的转化关系 ① ② ③ ④ ※⑤ ※⑥ 离子方程式: ⑦※⑧ 离子方程式:⑨ ※⑩ ⑾ ⑿ ⒀※⒁ ※⒂⒃ 离子方程式 ⒄ 离子方程式:补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O2、铝及其化合物的转化关系① ② ※③ 离子方程式:④ 离子方程式: ※⑤ 离子方程式:⑥ ⑦ 离子方程式: ⑧ ☆⑨※⑩ 离子方程式:☆⑾ ⑿3、铁及其化合物的转化关系① ※② ③ ④ ※⑤ ※⑥⑦ ⑧※⑨ (现象: ) ⑩ ⑾ ⑿⒀ (离子: )NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂ ⒃ ⒄ ④ Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe 2O 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒁ ⒀ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 NaAlO 2 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦⑧ ⑨ ⑩ ⑾ ⑿4、硅及其化合物的转化关系 ① ② ※③(刻蚀玻璃) ④⑤ 或 ※⑥ ※⑦ ⑧ ⑨5、氯及其化合物的转化关系① ② ③ 离子方程式 ④※⑤ 离子方程式: ※⑥ 离子方程式 ※⑦※⑧ 离子方程式: ※⑨工业制漂白粉※⑩漂白粉的漂白原理6、硫及其化合物的转化关系①② ※③ ④ ⑤⑥ ⑦※⑧ 离子方程式※⑨ 离子方程式※⑩7、氮及其化合物的转化关系※① ※② ※③ 离子方程式 以上三个反应为“雷雨发庄稼”原理 ※④ Cu +4HNO 3(浓) 离子方程式: 或 C +4HNO 3(浓) 或硝酸见光易变黄的原因※⑤ 离子方程式 ⑥ 合成氨反应是人工固氮的主要途径⑦ ⑧补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑ 氨气与酸均能反应生成铵盐,且与挥发性酸(如浓HCl 、浓HNO 3)相遇时空气中有白烟,铵盐受热都易分解,但并不是所有的铵盐都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH※⑧ 实验室制氨气,此反应为固体反应,不能写成离子方程式 。
化学必修1化学方程式默写表一、钠及其化合物1.钠与氧气:常温:点燃:2.钠与水反映:____________________________离子方程式:____________________________3.钠与硫酸反映:4.氧化钠与水反映:___________________________5.过氧化钠与二氧化碳反映:6.过氧化钠与水反映: _离子方程式:_______________________:7.NaOH溶液中通入少量CO2离子方程式:__ ________________:NaOH溶液中通入过量CO2离子方程式:___________ __________8.①向碳酸钠溶液滴入少量稀盐酸:向稀盐酸滴入少量碳酸钠溶液:②除去碳酸氢钠溶液中混有的碳酸钠:③碳酸钠与氢氧化钙:④碳酸氢钠与盐酸:⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:少量氢氧化钙溶液滴入碳酸氢钠溶液中:⑥除去碳酸钠溶液中的碳酸氢钠:⑦除去碳酸钠固体中的碳酸氢钠:⑧鉴别碳酸钠和碳酸氢钠溶液:二、铝及其化合物1.铝与氧气的反映:2.铝与氧化铁反映(铝热反映):3.铝和稀盐酸:_______________________________离子方程式:_________________________4.铝和NaOH溶液:______________________________离子方程式:_________________________5.氧化铝和稀硫酸:_____________________________离子方程式:_________________________6.氧化铝和NaOH溶液:__________________________离子方程式:_________________________7.氢氧化铝和盐酸:_____________________________离子方程式:_________________________8.氢氧化铝和NaOH溶液:________________________离子方程式:_________________________9.氢氧化铝受热分解:_____________________________10.硫酸铝与氨水反映:_____________________________离子方程式:______________________11.AlCl溶液中加入少量NaOH溶液:3溶液中加入过量NaOH溶液:AlCl3:12.往偏铝酸钠溶液中通入少量CO2:往偏铝酸钠溶液中通入足量CO213.电解氧化铝:三、铁及其化合物1.铁与氧气反映:铁与硫反映:2.铁与盐酸反映:离子方程式:___________________________铁与CuSO溶液:4离子方程式:___________________________3.铁和水蒸气:_______________________________________________4.氧化亚铁与盐酸反映:离子方程式:_____________________5.氧化铁与盐酸反映:____________________ _离子方程式:_____________________6.CO还原氧化铁:__________________________________________7.氯化铁与氢氧化钠溶液:____________________________离子方程式:_____________________8.硫酸亚铁与氢氧化钠溶液:__________________________离子方程式:_____________________9.氢氧化铁加热分解:__________________________________________10.氢氧化亚铁被氧化成氢氧化铁:__________________________________________11.除去FeCl2中的FeCl3:____________________________离子方程式:_______________________12.FeCl2和Cl2反映:________________________________离子方程式:________________________13.FeCl3和Cu反映:________________________________离子方程式:________________________14.氯化铁与硫氰化钾溶液反映:________________________________四、硅及其化合物1.硅与氧气加热:硅与氟气:________________________2.硅单质与氢氟酸反映:3.硅与氢氧化钠溶液反映:____4.二氧化硅与氢氟酸反映:_______________________________________5.二氧化硅与氧化钙高温反映:__________________________________6.二氧化硅与氢氧化钠溶液反映:_____________________________________________7.二氧化硅与碳反映:____________________________________8.硅酸钠与盐酸反映:______________________________离子方程式:_________________________9.往硅酸钠溶液中通入二氧化碳:________________ _______ ______10.二氧化硅与纯碱反映:_______________________ ___ _______11.二氧化硅与石灰石反映:______________________ ___ ________12.加热硅酸:五、氯及其化合物1.实验室制氯气:______________________________________离子方程式:______________________2.钠在氯气中燃烧:____________________________________铁在氯气中燃烧:____________________________________铜在氯气中燃烧:___________________________________氢气在氯气中燃烧:___________________________3.氯气和水反映:______________________________离子方程式:_____________________________4.次氯酸光照分解:__________________________________5.氯水中通入二氧化硫: ___离子方程式:_________________________6.氯气与氢氧化钠溶液:________________________________离子方程式:_______________________7.工业生产漂白粉:__________________________________________________8.漂白粉漂白原理:________________________________________________________9.向漂白粉溶液中加入稀盐酸:10.氯气通入溴化钾溶液:离子方程式:_____________________氯气通入碘化钾溶液:离子方程式:_____________________溴水和碘化钾溶液反映: 离子方程式:_____________________11.氯化钠和硝酸银溶液: 离子方程式:_____________________溴化钠和硝酸银溶液: 离子方程式:_____________________碘化钠和硝酸银溶液: 离子方程式:_____________________ 六、硫及其化合物1.硫在空气中燃烧:___________________________________ 硫与氢气加热: ________2.二氧化硫与水:______________________________________ 二氧化硫与氧化钙:__________________________________ 少量SO 2与氢氧化钠:______________________________ 离子方程式:_______________________过量SO 2与氢氧化钠:______________________________ 离子方程式:_______________________3.SO 2通入过量的澄清石灰水: 过量的SO 2通入澄清石灰水:4.二氧化硫与硫化氢: _____5.SO 2的催化氧化:____________________________________6.亚硫酸钠和硫酸反映:____________________________________________________7.Na 2SO 3与氧气反映:__________________________________8.三氧化硫和水反映:____________________________________9.三氧化硫与氧化钙:___________________________ 10.三氧化硫与氢氧化钙:___________________________11.铜与浓硫酸反映:________________________________________________________12.碳与浓硫酸反映:______________________________________________________七、氮及其化合物1.氮气和氧气反映:____________________________2.工业合成氨:____________________________________3.一氧化氮与氧气反映: ____________________4.NO2溶于水:____________________________________5.氨气溶于水:___________________________氨水显弱碱性(电离方程式):____________________6.浓氨水受热分解___________________________7.氨气和氯化氢:____________________________________8.氨的催化氧化_________________________________________9.氯化铵受热分解: ____________________________________10.碳酸氢铵受热分解:___________________________________11.硝酸铵和NaOH:__________________________________离子方程式:_________________________12.实验室制氨气:_______________________________________13.浓硝酸与铜反映:_________________________________离子方程式:_________________________14.稀硝酸与铜反映:________________________________离子方程式:________________________15.硝酸见光分解:_____________________________________________16.NH4+的检查离子方程式:___________________________17.NO2、O2混合气通入水中无剩余气体:18.NO、O2混合通入水中无剩余气体:化学必修1化学方程式归纳表一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O 点燃:2Na + O2Na2O22.钠与水反映:_2Na + 2H2O = 2NaOH + H2↑_离子方程式:2Na + 2H2O = 2Na++2OH-+ H2↑3.钠与硫酸反映:2Na +H2SO4= Na2SO4+H2↑4.氧化钠与水反映:Na2O+H2O=2NaOH5.过氧化钠与二氧化碳反映:2Na2O2+ 2CO2= 2Na2CO3+O2↑6.过氧化钠与水反映:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑7.NaOH溶液中通入少量CO2:2NaOH+CO2= Na2CO3+H2O 离子方程式:2OH-+CO2= CO32-+H2ONaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3离子方程式:_ OH-+CO2= HCO3-_____8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3+ HCl = NaHCO3+ NaCl向稀盐酸滴入少量碳酸钠溶液: Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑②除去碳酸氢钠溶液中混有的碳酸钠: Na2CO3+ H2O +CO2=2NaHCO3③碳酸钠与氢氧化钙: Na2CO3+ Ca(OH)2=CaCO3↓ + 2NaOH④碳酸氢钠与盐酸: NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: NaHCO3+ Ca(OH)2=CaCO3↓ + NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中: 2NaHCO3+ Ca(OH)2=CaCO3↓ + Na2CO3+2H2O⑥除去碳酸钠溶液中的碳酸氢钠: NaHCO3 + NaOH Na2CO3+ H2O⑦除去碳酸钠固体中的碳酸氢钠: 2NaHCO3 Na2CO3+ H2O +CO2↑⑧鉴别碳酸钠和碳酸氢钠溶液: Na2CO3+ CaCl2=CaCO3↓ + 2NaCl二、铝及其化合物1.铝与氧气的反映:4Al + 3O2 2Al2O32.铝与氧化铁反映(铝热反映):2Al + Fe2O3高温2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3+ 2NaOH = 2NaAlO2+H2O离子方程式:Al2O3+ 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3 +NaOH = NaAlO2+2H2O离子方程式:Al(OH)3+OH-=AlO2-+2H2O9.氢氧化铝受热分解:_2Al(OH)3Al2O3+3H2O_10.硫酸铝与氨水反映:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=A l(O H)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3+ 4NaOH =NaAlO2+ 3NaCl+2H2O12.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2A l(O H)3↓+Na2CO3往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO313.电解氧化铝: 2Al2O34Al+3O2↑三、铁及其化合物1.铁与氧气反映:3Fe + 2O2Fe3O4铁与硫反映:Fe + S FeS2.铁与盐酸反映:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑_铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu_3.铁和水蒸气:_3Fe + 4H2O(g) 高温 Fe3O4+ 4H2_4.氧化亚铁与盐酸反映:FeO+2HCl=FeCl2+H2O 离子方程式:FeO+2H+=Fe2++H2O _5.氧化铁与盐酸反映:_ Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O_6.CO还原氧化铁:_ Fe2O3+ 3CO高温2Fe + 3CO2_7.氯化铁与氢氧化钠溶液:FeCl 3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe 3++3OH -= Fe(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO 4+2NaOH=Fe(OH)2↓+Na 2SO 4离子方程式:Fe 2++2OH -= Fe(OH)2↓9.氢氧化铁加热分解:__2Fe(OH)3Fe 2O 3+3H 2O_____10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3 _11.除去FeCl 2中的FeCl 3:2FeCl 3 + Fe = 3FeCl 2 _离子方程式:2Fe 3+ + Fe = 3Fe 2+_ 12.FeCl 2和Cl 2反映:_2FeCl 2 + Cl 2 = 2FeCl 3_离子方程式:_2Fe 2+ + Cl 2 = 2Fe 3++2Cl-13.FeCl 3和Cu 反映:2FeCl 3+Cu =2FeCl 2+CuCl 2_离子方程式:2Fe 3++Cu =2Fe 2++Cu 2+ 14.氯化铁与硫氰化钾溶液反映:_ Fe 3+ + 3SCN - = Fe(SCN)3 ___四、硅及其化合物 1.硅与氧气加热:Si+O 2SiO 2硅与氟气:_ Si+2F 2=SiF 4 __2.硅单质与氢氟酸反映:Si+4HF=SiF 4+2H 23.硅与氢氧化钠溶液反映:Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑4.二氧化硅与氢氟酸反映:_4HF+SiO 2=SiF 4↑+2H 2O _5.二氧化硅与氧化钙高温反映:SiO 2+CaO高温CaSiO 3__6.二氧化硅与氢氧化钠溶液反映:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O __7.二氧化硅与碳反映:_ SiO 2 + 2C高温Si + 2CO ↑_8.硅酸钠与盐酸反映:_ Na 2SiO 3+2HCl =H 2SiO 3↓+2 NaCl__离子方程式: SiO 32-+2H +=H 2SiO 3↓9.往硅酸钠溶液中通入二氧化碳:_ Na 2SiO 3 +CO 2+H 2O == H 2SiO 3↓+ Na 2CO 3_ 10.二氧化硅与纯碱反映:SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑_11.二氧化硅与石灰石反映:_ SiO 2+CaCO 3高温CaSiO 3+CO 2↑_12.加热硅酸:H2SiO3SiO2+H2O五、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O2.钠在氯气中燃烧:_2Na+Cl22NaCl _铁在氯气中燃烧:2Fe+3Cl2 2FeCl3_铜在氯气中燃烧:Cu + Cl2 CuCl2氢气在氯气中燃烧:H2 + Cl22HCl _3.氯气和水反映:Cl2 + H2O = HCl + HClO 离子方程式:Cl2+ H2O = H++Cl- + HClO4.次氯酸光照分解:_2HClO 2HCl + O2↑_5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2=Ca(ClO)2+ CaCl2+ 2H2O _8.漂白粉漂白原理:_ Ca(ClO)2 + CO2+ H2O =CaCO3↓ + 2HClO _9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2+ 2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2+ 2KCl离子方程式:Cl2+ 2Br- = Br2+ 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2+ 2KCl 离子方程式:_ Cl2+ 2I- = I2+ 2Cl-溴水和碘化钾溶液反映:Br2 +2KI = I2+2KBr 离子方程式:Br2+2I- = I2+2Br-11.氯化钠和硝酸银溶液:AgNO3+ NaCl =AgCl↓+ NaNO3离子方程式:Ag++Cl-=AgCl↓溴化钠和硝酸银溶液:AgNO 3 + NaBr = AgBr↓ + NaNO 3 离子方程式:Ag ++Br-= AgBr↓_碘化钠和硝酸银溶液:AgNO 3 + NaI = AgI↓ + NaNO 3 离子方程式:Ag ++I-= AgI ↓_六、硫及其化合物1.硫在空气中燃烧:_ S+O 2SO 2__ 硫与氢气加热: S+H 2H 2S2.二氧化硫与水:_ SO 2+H 2OH 2SO 3_二氧化硫与氧化钙:_ SO 2+CaO =CaSO 3_少量SO 2与氢氧化钠:_2NaOH+SO 2=Na 2SO 3+H 2O _离子方程式:_2OH -+SO 2= SO 32-+H 2O_ 过量SO 2与氢氧化钠:_ NaOH+SO 2=NaHSO 3_离子方程式:_ OH -+SO 2= HSO 3-_ 3.SO 2通入过量的澄清石灰水: Ca(OH)2+SO 2=CaSO 3↓+H 2O 过量的SO 2通入澄清石灰水: Ca(OH)2+2SO 2=Ca(HSO 3)2 4.二氧化硫与硫化氢:SO 2 + 2H 2S =3S ↓+2H 2O 5.SO 2的催化氧化:__2SO 2 + O 2催化剂 加热2SO 3_6.亚硫酸钠和硫酸反映:_ Na 2SO 3+H 2SO 4=Na 2SO 4 +SO 2↑+H 2O __7.Na 2SO 3与氧气反映:_2Na 2SO 3+O 2=2Na 2SO 4_8.三氧化硫和水反映:_ SO 3+H 2O =H 2SO 4_9.三氧化硫与氧化钙:__ SO 3+CaO= CaSO 4_10.三氧化硫与氢氧化钙:_ Ca(OH)2+SO 3=CaSO 4↓+H 2O _ 11.铜与浓硫酸反映:_ Cu + 2H 2SO 4 (浓)CuSO 4 + 2H 2O+SO 2 ↑_12.碳与浓硫酸反映:_ C + 2H 2SO 4(浓) 2H 2O+CO 2↑+2SO 2↑_七、氮及其化合物1.氮气和氧气反映:_ N 2 + O2 2NO _ 2.工业合成氨:_ N 2 + 3H 2催化剂 高温高压2NH 3_放电3.一氧化氮与氧气反映:2NO + O2= 2NO2_4.NO2溶于水:_3NO2+ H2O = 2HNO3+ NO _5.氨气溶于水: NH3+ H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O NH4++ OH-6.浓氨水受热分解_ NH3·H2O△NH3↑+H2O __7.氨气和氯化氢:_ HCl + NH3 = NH4Cl _8.氨的催化氧化_4NH3 +5O24NO + 6H2O _9.氯化铵受热分解: _ NH4Cl NH3+HCl _10.碳酸氢铵受热分解:_ NH4HCO3NH3↑+ H2O↑ + CO2↑_11.硝酸铵和NaOH:NH4NO3+ NaOH NaNO3+ NH3↑+H2O _离子方程式:NH4++ OH-NH3↑+H2O12.实验室制氨气:_2NH4Cl + Ca(OH)2CaCl2+ 2NH3↑ + 2H2O13.浓硝酸与铜反映:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O14.稀硝酸与铜反映:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O15.硝酸见光分解:_4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_16.NH4+的检查离子方程式:NH4++ OH-NH3↑+H2O17.NO2、O2混合气通入水中无剩余气体:4NO2+ O2+ 2H2O = 4HNO318.NO、O2混合通入水中无剩余气体:4NO+ 3O2+ 2H2O = 4HNO3。
1-9单元化学方程式默写姓名__________
一、化合反应:A+B→AB
1. 镁在空气中燃烧:
2. 铁在氧气中燃烧:
3. 铝在空气中燃烧:
4. 氢气中空气中燃烧:
5. 红磷在空气中燃烧:
6. 硫粉在空气中燃烧:
7. 碳在氧气中充分燃烧:
8. 碳在氧气中不充分燃烧:
9. 铜在空气中受热:
10. 一氧化碳在氧气中燃烧:
11. 二氧化碳溶解于水:
12. 生石灰溶于水:
13. 二氧化碳通过炽热的炭层:
二.几个分解反应:AB→A+B
14. 水在直流电的作用下分解:
15. 双氧水分解:
16. 加热氯酸钾(有二氧化锰):
17. 加热高锰酸钾:
18. 碳酸不稳定而分解:
19. 高温煅烧石灰石:
三.置换反应:A+BC→AC+B
20. 氢气还原氧化铜:
21. 木炭还原氧化铜:
22. 焦炭还原氧化铁:
23. 锌和稀硫酸反应:
24. 锌和稀盐酸反应:
25. 铁和稀硫酸反应:
26. 铁和稀盐酸反应:
27. 镁和稀盐酸反应:
28. 镁和稀硫酸反应:
29. 铝和稀硫酸反应:
30. 铁和硫酸铜溶液反应:
31. 锌和硫酸铜溶液反应:
32. 铜和硝酸银溶液反应:四.其它反应:
33. 大理石与稀盐酸反应:
34. 碳酸钠与稀盐酸反应:
35. 甲烷在空气中燃烧:
36. 酒精(乙醇)在空气中燃烧:
37. 一氧化碳还原氧化铜:
38. 一氧化碳还原氧化铁:
39.一氧化碳还原磁铁矿:
40. 检验二氧化碳的反应:。
钠的化合物的反应方程式的默写一、氧化钠(化学式与物理性质) 1.氧化钠与水反应化学方程式离子方程式2.氧化钠与二氧化碳的反应化学方程式3.氧化钠与稀硫酸的反应化学方程式离子方程式二、过氧化钠(化学式、俗称与物理性质)4.过氧化钠与水反应化学方程式离子方程式5.过氧化钠与二氧化碳的反应化学方程式6.过氧化钠与稀盐酸的反应化学方程式离子方程式三、氢氧化钠(化学式与物理性质)碱的通性:a:b:碱+酸=盐+水化学方程式c:化学方程式d:化学方程式四、碳酸钠(化学式、俗称与物理性质)7.向碳酸钠中逐滴加入稀盐酸化学方程式a:b:离子方程式a:b:8.向盐酸中加入碳酸钠溶液化学方程式离子方程式9.向碳酸钠溶液中通入二氧化碳的反应化学方程式离子方程式10.碳酸钠与氢氧化钙的反应化学方程式离子方程式五、碳酸氢钠(化学式、俗称与物理性质)9.碳酸氢钠与盐酸的反应化学方程式离子方程式10.碳酸氢钠固体受热分解化学方程式11.碳酸氢钠与氢氧化钠的反应化学方程式离子方程式12.碳酸氢钠与少量氢氧化钙的反应化学方程式离子方程式13.碳酸氢钠与过量氢氧化钙的反应化学方程式离子方程式14.氢氧化钠与少量二氧化碳的反应化学方程式离子方程式15.氢氧化钠与过量二氧化碳的反应化学方程式离子方程式16.十水合碳酸钠的风化化学方程式铝及其化合物的化学方程式与离子方程式一、铝1、铝在氧气中燃烧:;2、铝在氯气中燃烧:;3、铝与硫共热:;4、铝与稀硫酸反应:;5、铝与氢氧化钠溶液反应:;6、铝与浓硫酸共热:;7、铝与浓硝酸共热:;8、铝与稀硝酸反应:;9、铝与硝酸银溶液反应:;10、铝与硫酸铜溶液反应:;11、铝与氧化铁高温下反应:;12、铝与四氧化三铁高温共热:;13、铝与氧化铜高温共热:;14、铝与二氧化锰高温共热:;二、氧化铝1、氧化铝与稀硫酸反应:;2、氧化铝与氢氧化钠溶液反应:;3、电解氧化铝的熔融液:;三、氢氧化铝1、氢氧化铝与稀硫酸反应:2、氢氧化铝与氢氧化钠溶液反应:;3、加热氢氧化铝:;四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:;2、硫酸铝的水溶液呈酸性:;3、硫酸铝溶液中加入少量的氢氧化钠溶液:;4、向硫酸铝溶液中加足量的氢氧化钠溶液;5、向硫酸铝溶液中加入少量的氢氧化钡溶液:;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:;7、向明矾溶液中加入少量的氢氧化钡溶液:;8、向明矾溶液中加入足量的氢氧化钡溶液:;9、向硫酸铝溶液中加入氨水:;10、向硫酸铝溶液中加入碳酸钠溶液:;11、向硫酸铝溶液中加入碳酸氢钠溶液:;12、向硫酸铝溶液中加入硫化钠溶液:;13、向硫酸铝溶液中加入硫氢化钠溶液:;14、向硫酸铝溶液中加入硅酸钠溶液:;15、向硫酸铝溶液中加入偏铝酸钠溶液:;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:;2、偏铝酸钠溶液滴入少量盐酸:;3、向偏铝酸钠溶液加入足量盐酸:;4、向偏铝酸钠溶液通入少量二氧化碳气体:;5、向偏铝酸钠溶液通入足量二氧化碳气体:;6、向偏铝酸钠溶液中加入硫酸铝溶液:;7、向偏铝酸钠溶液中加入氯化铵溶液:;8、向偏铝酸钠溶液中加入氯化铁溶液:;铁及其化合物化学方程式及离子方程式1、铁与非金属单质反应:(1) Fe在纯O2中燃烧:化学方程式:;(2) Fe与S的反应:化学方程式:;(3) Fe与Cl2点燃:化学方程式:;(4) Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。
高考总复习之高中化学方程式总结 化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+化学 第一册第一章 卤素第一节 氯气1、−−→−+点燃2Cl Na 2、−−→−+点燃2Cl Cu 3、−−→−+点燃2Cl Fe 4、−−−−→−+点燃(光照)22Cl H 5、−−→−+点燃2Cl P 6、→+23Cl PCl7、→+O H Cl 228、→+22Cl OH Ca )(9、→++O H CO ClO Ca 222)(10、→+2Cl NaOH 11、−→−+∆2MnO HCl 12、→+(浓)HCl KMnO 4 13、−−→−见光HClO 第二节 氯化氢 14、→+(浓)42SO H NaCl 15、−→−+∆NaCl NaHSO 4 16、−→−+∆(浓)42SO H NaCl (14、15结合) 17、→+3AgNO HCl18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔18、→+3AgNO NaCl19、→+3AgNO KCl20、→+3CaCO HCl第三节 氧化还原反应21、−→−+∆2H CuO 22、→+3HNO C 23、−→−+∆(极稀)3HNO Zn 24、→++O H CuSO P 24 25、→+(浓)HCl KClO 3 26、−→−+∆(极稀)3HNO Mg 27、→++4243722SO H O Fe O Cr K28、→++S C KNO 3第四节 卤族元素29、→+22F H30、→+22Br H31、→+22I H32、→+2Cl NaBr33、→+2Cl KI34、→+2Br KI35、→+3AgNO NaBr36、→+3AgNO KI 37、−−→−光照AgBr 第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+38、→+2O C39、→+HCl Mg第二节 气体摩尔体积40、→+HCl Zn第三节 物质的量浓度41、→+42SO H NaOH第四节 反应热42、−−→−+点燃(气)(固)2O C 43、→+(气)(气)22O H 44、→+(气)(气)22O H 45、−→−+∆(气)(固)O H C 2 第三章 硫 硫酸第一节 硫46、−→−+∆S Cu 47、−→−+∆S Fe 48、−→−+∆2H S 49、−−→−+高温C S 50、−−→−+点燃2O S 51、−→−+∆KOH S 第二节 硫的氢化物和氧化物 52、−→−∆S H 2 53、−−→−+点燃足)(22O S H 54、−−→−+点燃不足)(22O S H 55、−−→−+点燃22SO S H 56、→+22Br S H57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na 69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HBr 2O H 2Br SO +→++ 76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 57、→+HCl FeS58、→+S H CuSO 2459、→+S H PbAc 2260、→+NaOH S H 261、→+NaOH NaHS62、→+NaOH S H 2(60、61结合) 63、→+32FeCl S H64、→+FeS SO H (稀)42 65、⇔+O H SO 2266、∆−−→←+5222OV O SO 67、→+O H SO 2368、→+4232SO H SO Na69、→+NaOH SO 270、→+CaO SO 271、→+22)(OH Ca SO72、→++O H CaSO SO 23273、→+S H SO 2274、→++O H Cl SO 22275、→++O H Br SO 22276、→++422KMnO O H SO第三节 硫酸的工业制法77、−−→−+高温22O FeS 78、∆−−→←+5222OV O SO 79、4232SO H SO O H →+80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+ 86、NaCl 2BaSO SO Na BaCl 4422+↓→+ 87、NaCl 2BaCO CO Na BaCl 3322+↓→+ 88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na 91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+ 93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+79、→+32SO O H80、−→−+∆(浓)42SO H C 81、−→−+∆(浓)42SO H S 82、−→−+∆(浓)42SO H P 83、−→−+∆(浓)422SO H S H 84、−→−+∆(浓)42SO H Cu 85、→+422SO H BaCl 86、→+422SO Na BaCl 87、→+322CO Na BaCl 88、→+HCl BaCO 3 89、→+33HNO BaCO 90、→+3232SO H CO Na 91、→+232O SO H 92、→+232O SO Na 93、→+23O CaSO 94、−→−+∆(浓)42SO H Fe 95、−→−+∆(浓)42SO H NaBr 96、−→−+∆(浓)42SO H NaCl 97、−−−→−42112211SOH O H C 浓 第四章 碱金属第一节 钠98、→+2O Na 99、→+2O Na100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+ 118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素100、−−→−+点燃2Cl Na101、−−→−+研磨S Na 102、→+O H Na 2103、→++42CuSO O H Na第二节 钠的氧化物104、→+O H O Na 22105、→+O H O Na 222106、→+22CO O Na107、→+222CO O Na108、→+HCl O Na 2109、→+HCl O Na 22110、→+HCl CO Na 32111、→+HCl NaHCO 3 112、−→−∆3NaHCO 113、−→−+∆NaOH NaHCO 3 114、→+(少量))(23OH Ca NaHCO 115、→+(足量))(23OH Ca NaHCO 116、→+232BaCl CO Na117、→+232CaCl CO Na118、→+HCl HCO Ca 23)(119、→+NaOH HCO Ca 23)(120、HCl NaHSO +3第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2 第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。