第八章 酮
- 格式:ppt
- 大小:1.34 MB
- 文档页数:44
二、醛酮的物理性质羰基是极性基团,羰基中的氧原子可以与水形成氢键,醛酮的沸点比相应分子质量的烷烃高得多,而比相应分子质量的醇低得多。
三、醛酮的化学性质(一)羰基的加成羰基碳原子带部分正电荷,显正电性,易发生羰基的亲核加成反应醛、酮亲核加成反应的活泼性z空间效应考虑:醛羰基中有一个小的氢原子,酮羰基中有两个烃基,加成产物的中心碳原子周围较拥挤,反应平衡中产率较低z电子效应考虑:烃基是推电子的基团,醛只连有一个推电子的基团,而酮则连有两个推电子基团z直接连有吸电子基可使羰基碳原子正电性增高,更易于发生加成反应CCl3CHO>HCHO>RCHO>CH3COCH3>RCOCH3>ArCOCH3>ArCOAr常见醛酮的相对活泼性顺序为:(二)与氨的衍生物的加成—消除反应氨的衍生物通式H 2N-X 。
氨的衍生物氮原子上仍保留一对孤电子,容易与醛酮发生反应最常见的有:羟胺H 2N-OH 肼H 2N-NH 2;苯肼、H 2N-NHC 6H 52,4-二硝基苯肼H 2N-NHC 6H 5(NO 2)2 -2,4氨基脲H 2N-NHCONH 2醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应还原。
反应机理本反应的反应机理较复杂,目前尚不很清楚。
参考文献[1]E. Clemensen, Ber.,1913, 46, 1837.[2]S. Yamamura, S. Ueda, Y. Hirata, Chem. Commun., 1967, 1049.[3]S. Yamamura, Y. Hirata, J.Chem. Soc.,C,1968, 2887.[4]S. Yamamura, Chem. Commun., 1968, 1494.[5]S. Yamamura,Tetrahedron Lett., 1967, 3361.[6]M. Toda, Y. Hirata, S.Yamamura,Chem. Commun., 1969, 919.。








⼤学有机化学练习题—第⼋章醛酮第⼋章:醛酮学习指导 1、醛酮构造和命名2、酮的化学性质:羰基的加成反应(加氰化氢,加亚硫酸氢钠,加醇,加Grignard试剂,与氨衍⽣物的缩合)及亲核加成反应历程,—氢原⼦的反应(羟醛缩合及反应历程,卤代反应,卤仿反应)氧化和还原反应(银镜反应,Fehling试剂反应,还原反应,Cannizzaro反应)⼀.命名下列各物种或写出结构式1、写出的系统名称。
2、⽤Fischer投影式表⽰(S)-3-甲基-4-庚酮。
3、写出的系统名称。
4、写出的系统名称。
5、写出的名称。
⼆.完成下列各反应式1、2、3、4、5、6、三.理化性质⽐较题1、⽐较下列化合物与ROH加成反应活性的⼤⼩:(A) CH3CHO (B) CH3COCH3(C) C2H5COC2H5(D) ClCH2CHO2、⽐较下列化合物与HCN加成速率的快慢:(A) CH2O (B) CH3CHO (C) (CH3)2CO (D)Cl3CCHO3、可发⽣碘仿反应的化合物有:(A) CH3COCH2CH3(B) (C2H5)2CO4、将下列化合物按烯醇式含量的多少排列成序:(A) CH3COCH3(B) CH3COCH2COCH3(C) CH3COCH2CH2COCH35、⽐较下列化合物羰基上亲核加成的活性⼤⼩:(A) CH3CHO (C) CH3COCH2CH3(D) CCl3CHO6、将下列化合物按亲核加成反应活性排列成序:(C) CH3CHO7、⽐较下列化合物与NaHSO3加成速率的快慢:四.基本概念题1、下列相对分⼦质量均为72的化合物中,沸点最⾼的是:1. CH 3CH 2CH 2CH 2CH 34.CH 3CH =CHCH 2OH2、指出下列化合物哪些能发⽣碘仿反应,哪些可发⽣银镜反应,哪些可发⽣⾃⾝羟醛缩合反应。
3、下列化合物中哪些分⼦内能形成氢键4、下列化合物中,可进⾏Cannizzaro 反应的有:1.⼄醛2.苯甲醛3.丙醛4.丙烯醛五. ⽤简便的化学⽅法鉴别下列各组化合物1、⽤简便的化学⽅法鉴别以下化合物的⽔溶液:(A) 甲醛 (B) ⼄醛 (C) 丙醛 (D) 丙酮 2、⽤简便的化学⽅法鉴别以下化合物:(A)1-戊醇 (B)2-戊醇 (C)3-戊醇 (D)2-甲基-2-丁醇六. 有机合成题1、⽤C 4以下的烃为原料(⽆机试剂任选)合成:2、以⼄酰⼄酸⼄酯为原料(其它试剂任选)合成:3、⽤苯和C 3以下的有机物为原料(⽆机试剂任选)合成:七、分离1、⽤化学⽅法分离3-戊醇、3-戊酮和戊醛的混合物。


第八章 醛、酮、醌第一节 醛、酮一、结构、命名1. 结构:羰基化合物:含有羰基( C=O )的化合物为羰基化合物。
R 1、R 2均为烷基时,分子称为酮;R 1、R 2有一个或二个为氢分子称为醛。
芳香醛酮:羰基与芳环直接相连的化合物。
醛、酮 脂肪醛酮:羰基与脂肪烃基相连的化合物。
不饱和醛酮:羰基与不饱和烃基相连的化合物。
羰基C 为sp 2杂化,杂化轨道分别与其他的原子形成三个σ键,余下的一个p 轨道与氧的p 轨道形成一个π键。
π键电子云偏向O 、C 上带部分正电荷利于亲核试剂的进攻。
2.命名:⑴ 普通命名法:① 简单醛 烷基+“醛”异丁醛 正十二醛 (月桂醛)② 简单酮:按羰基所连的两个烃基的名称来命名,按顺序规则,简单在前,名称为“甲酮”。
甲(基)乙(基)酮 二乙(基)酮 2-羟基丙醛(α-羟基丙醛) ⑵ 系统命名法:① 基本规则同前面讲过的其他化合物相似。
注意:选主链时,要选含羰基的最长链为主链,编号时从离羰基最近的一端开始编号,名称为“醛”或“酮”。
4-甲基-2-戊酮 3-甲基丁醛 ② 分子中含苯环的,常以苯环作为取代基。
1-苯基-1-丙酮 苯乙酮O R 1CR 2OR 1CR 2¨¨C HOC H CH 3C H 3C HOCH 3(CH 2)10CH 31C H 23C H 34OC2CH 31C H 22C H 24C H 35C3OC H1C H 2CH 33O H OC H1C H 22C H 3CH 34C H 3OC H 31C H 23C H 4CH 35C H 3C2OC1C H 22C H 33O C1C H 32O③ 复杂:2-丁烯醛 4-庚烯-2-酮 二、物理性质:常温下,除甲醛是气体外,,十二个碳原子以下的醛酮是液体,高级的醛酮和芳香酮多为固体。
分子一般具有较大的极性,因此沸点比分子量相近的烃和醚要高,但比相应的醇要低。
醛酮的分子可以与水形成氢键,低级的醛酮(四碳以下的脂肪醛酮)易溶于水,五碳以上的醛酮,微溶或不溶于水中,而易溶于有机溶剂中。
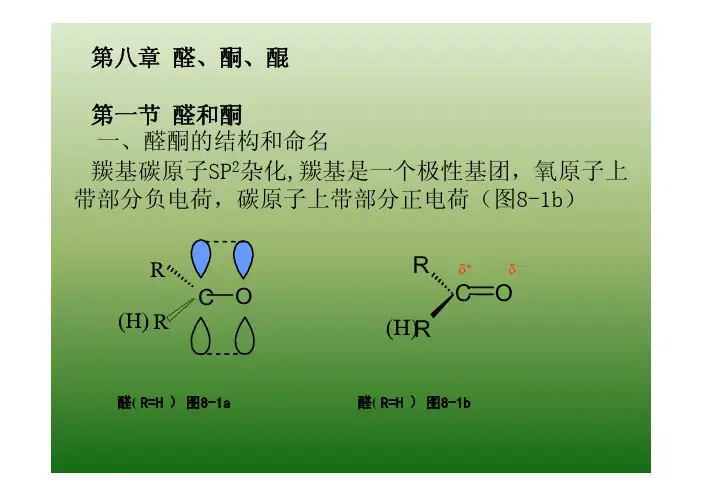
第八章醛、酮、醌官能团醛酮C O RR 1C O RH OO 醌C O 羰基第一节醛和酮一、醛酮的结构在羰基中,碳原子以SP 2杂化轨道与另外三个原子以σ键结合,这三个σ键都处于同一个平面上,键角约为120°。
碳原子未参与杂化的一个P轨道与氧原子的一个P轨道侧面重叠(肩并肩)形成一个π键。
δδC O R (R) H C OR(R) H二、醛酮的命名对苯二甲醛顺-丁烯二醛环己基甲醛3-甲基-2-乙基戊醛H CHOH CHOOHC CHOCHO CH 3CH 2CCH 2CHO O 3-氧代戊醛CH 3CH 2CH CHCHOCH 2CH 3H 3C1-苯基-1-丙酮3-乙基己醛3-甲基-5-庚烯-2-酮CCH 2CH 3OO HO CH 33-甲基环戊酮2,7-壬二酮OOOO O螺[2.5]辛-6-酮1,7,7-三甲基二环[2.2.1]庚-2-酮1-苯基-2-丙酮二苯甲酮OO3,3'-二甲基-4-甲氧基二苯甲酮C OH 3C CH 3OCH 3第二节物理性质由于羰基的偶极矩,增加了分子间的吸引力,因此醛酮的沸点比相应分子质量的烷烃高得多,但比相应分子质量的醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮可以与水混溶,随着相对分子质量的增加,在水中溶解度大大降低。
第三节化学性质一、羰基的加成由于羰基碳原子带部分正电荷,容易与一系列的亲核试剂发生加成反应,称羰基的亲核加成反应,或称1,2-亲核加成。
常见的亲核试剂:CN RNH2RSOHROH H2ONH3RMgX(一)与氢氰酸的加成醛及多种活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮)与氰基负离子的碳原子发生加成反应,生成α-羟基腈。
O +H CN C CNOHOHCH 3CHO HCN +OH CH 3CHCN OH H CH 3CHCO 2HOHCH 3C CH 3O +HCN NaOHCH 3C CH 3OHCNCH 3OHH 2SO 4CH2C CH 3C OOCH 390%(二)与亚硫酸氢钠的反应醛或活泼的酮(脂肪族甲基酮及少于8个碳原子的脂环酮)在室温下与过量的饱和亚硫酸氢钠(40%水溶液)溶液一起振荡,不需加任何催化剂反应即可发生。