第一类医疗器械备案信息表041119093103
- 格式:pdf
- 大小:594.92 KB
- 文档页数:18
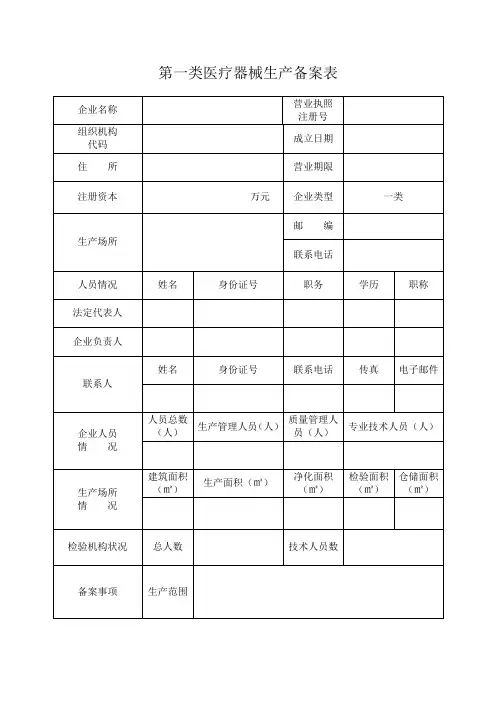
第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求
1.第一类医疗器械生产备案表;
2.所生产产品的医疗器械备案凭证复印件;
3.经备案的产品技术要求复印件;
4.营业执照和组织机构代码证复印件;
5.法定代表人、企业负责人身份证明复印件;
6.生产、质量和技术负责人的身份、学历职称证明复印件;
7.生产管理、质量检验岗位从业人员、学历职称一览表;
8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;
9.主要生产设备和检验设备目录;
10.质量手册和程序文件;
11.工艺流程图;
12.经办人授权证明;
13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证
备案号:XX食药监械生产备XXXXXXXX号
备案部门(公章)
备案日期:年月日。



第一类医疗器械备案资料品名: **************有限公司目录备案号:一、第一类医疗器械备案表产品名称(产品分类名称):备案人 :南平市食品药品监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明中文******产品名称/原文(产品分类名称)/英文分类编码******结构特征有源□无源■体外诊断试剂□型号/ 规格******(包装规格)******产品描述(主要组成成分)******预期用途产品有效期(体外诊断试剂适用)备案人生产地址代理人/中文**********名称原文/英文/中文************注册地址原文/英文/联系人******电话************传真******电子邮箱******邮编******备案人******所在地组织机构******代码中******文原/文英/文名称/注册地址/邮编/联系人/电话/传真/电子信箱/代理人/所在地应附资料1.产品风险分析资料■2.产品技术要求■3.产品检验报告■4.临床评价资料■5.生产制造信息■6.产品说明书及最小销售单元标签设计样稿■7.证明性文件■8.符合性声明■其他需要说明的问题备案人: *****************有限公司(签章)日期:年月日二、产品风险分析报告品名: ****************有限公司提示:医疗器械应按照0316 《医疗器械风险管理对医疗器械的应用》的有关要求编制。
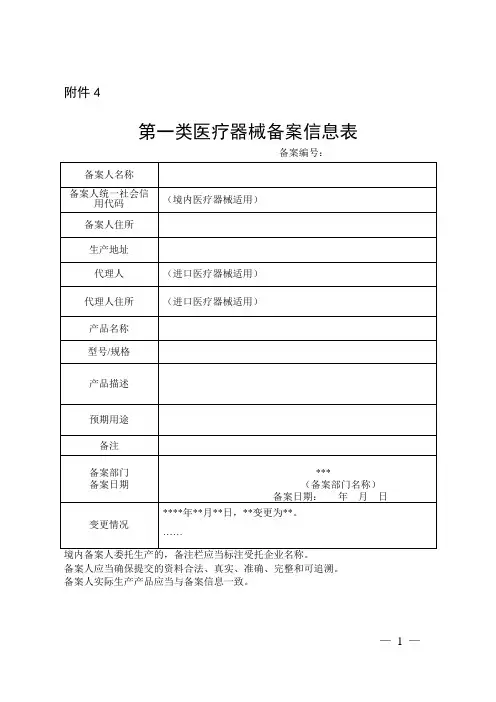

第一类医疗器械备案表产品名称(产品分类名称): 隔离衣备案人: 沈阳XX有限责任公司沈阳市市场监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(E×cel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明。

备案号:沪械备号第一类医疗器械备案表
产品名称(产品分类名称):
备案人:
以下由备案单位填写
申请类型:第一类医疗器械备案
资料号:沪备案- (例:2014沪浦备案-001)
备案日期:年月日
上海市药品监督管理局制
授权委托书
:
现委托以下人员作为我方(单位名称)行政许可申请一事的代理人,代理我(单位)办理(许可事项):
1、姓名:性别:身份证号码:
工作单位:
职务:电话:
委托权限:
□代为提出、变更、放弃行政许可申请;
□接收询问,行使陈述申辩权利;
□要求和参加听证;
□提交和接收法律文书。
代理期限:□自许可提出申请日起至年月日
□自许可提出申请日起至此次许可决定作出之日止
2、姓名:性别:身份证号码:
工作单位:
职务:电话:
委托权限:
□代为提出、变更、放弃行政许可申请;
□接收询问,行使陈述申辩权利;
□要求和参加听证;
□提交和接收法律文书。
代理期限:□自许可提出申请日起至年月日
□自许可提出申请日起至此次许可决定作出之日止
委托人:
法定代表人:
年月日
第一类医疗器械产品备案资料核对要点(首次备案)
上述1-6项,任意一项标注“×”或“否”则不予备案。
上述7-8项,标注“×”或“否”则表明提交资料不齐全,或不符合规定形式。

第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求
1.第一类医疗器械生产备案表;
2.所生产产品的医疗器械备案凭证复印件;
3.经备案的产品技术要求复印件;
4.营业执照和组织机构代码证复印件;
5.法定代表人、企业负责人身份证明复印件;
6.生产、质量和技术负责人的身份、学历职称证明复印件;
7.生产管理、质量检验岗位从业人员、学历职称一览表;
8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;
9.主要生产设备和检验设备目录;
10.质量手册和程序文件;
11.工艺流程图;
12.经办人授权证明;
13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证
备案号:XX食药监械生产备XXXXXXXX号
备案部门(公章)
备案日期:年月日。

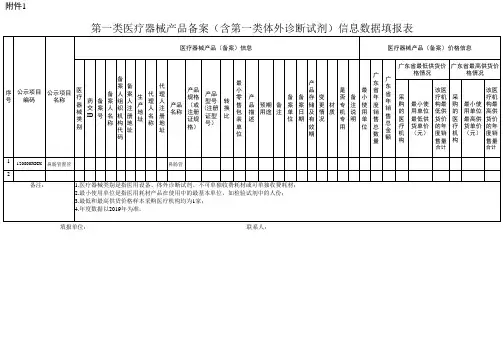
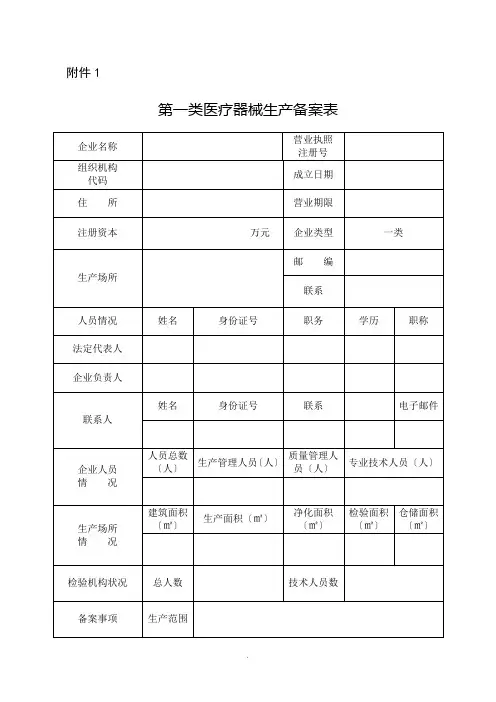
附件1第一类医疗器械生产备案表填表说明:一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局公布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求1.第一类医疗器械生产备案表;2.所生产产品的医疗器械备案凭证复印件;3.经备案的产品技术要求复印件;4.营业执照和组织机构代码证复印件;5.法定代表人、企业负责人身份证明复印件;6.生产、质量和技术负责人的身份、学历职称证明复印件;7.生产管理、质量检验岗位从业人员、学历职称一览表;8.生产场地的证明文件〔有特殊生产环境要求的,还应提交设施、环境的证明文件〕复印件;9.主要生产设备和检验设备目录;10.质量手册和程序文件;11.工艺流程图;12.经办人授权证明;13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证备案号:XX食药监械生产备XXXXXXXX号备案部门〔公章〕备案日期:年月日第二类医疗器械经营备案表填表说明一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局公布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
第二类医疗器械经营备案材料要求1.第二类医疗器械经营备案表;2.企业营业执照复印件;3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;4.企业组织机构与部门设置说明;5.企业经营地址、库房地址的地理位置图、平面图〔注明实际使用面积〕、房屋产权证明文件或者租赁协议〔附房屋产权证明文件〕复印件;6.企业经营设施和设备目录;7.企业经营质量管理制度、工作程序等文件目录;8.经办人授权证明;9.其他证明材料。