广东省揭西县河婆中学2019_2020学年高一化学上学期期中试题(含解析)
- 格式:pdf
- 大小:310.92 KB
- 文档页数:14

2019-2020年高一上学期期中考试化学试题含答案(VI)说明:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
第Ⅰ卷1至3页,第Ⅱ卷4至6页。
考试时间为100分钟,满分100分。
2.答题前请将答题卡上有关项目填、涂清楚。
将第Ⅰ卷题目的答案用2B铅笔涂在答题卡上,第Ⅱ卷题目的答案用0.5毫米黑色签字笔写在答题卡的相应位置上,写在试卷上的答案无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 Cu 64第Ⅰ卷(选择题共51分)一、选择题(共17个小题,每小题3分,共51分。
每小题只有一个选项符合题意)1.下列化学药品与其危险化学品图形标志不一致的一组是A.烧碱—1 B.甲烷—2 C.酒精—3 D.白磷—42.下列关于化学实验安全叙述错误的是A.浓H2SO4沾到皮肤上,先用干抹布擦干,再用氢氧化钠溶液冲洗B.实验室固体物质着火可以用细沙覆盖,液体物质着火可以用湿抹布扑盖C.H2还原金属氧化物时,需要先通H2,然后检验H2纯度,再加热金属氧化物D.闻气体气味时,用手在集气瓶口轻轻扇动,让少量气体飘进鼻孔3.下列实验操作中正确的是A.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出D.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸4. 下列说法中,正确的是A.22.4 L N2含阿伏加德罗常数个氮分子B.在标准状况下,22.4 L水的质量约为18gC.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数D.标准状况下,相同体积的任何气体单质所含的原子数相同5. 进入秋冬季节后,雾霾这种环境污染问题逐渐凸显。
从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是A.产生丁达尔现象B.胶体是混合物C.分散质粒子直径在1nm~100nm之间D.胶体的分散剂为气体6.下列反应既属于化合反应,又属于氧化还原反应的是A.Fe+2HCl=FeCl2+H2↑B.2FeCl2+Cl2=2FeCl3C.CaO+H2O=Ca(OH)2 D.2Fe(OH)3=Fe2O3+3H2O7.下列溶液与20mL 1 mol·L-1 NaNO3溶液中NO3-物质的量浓度相等的是A.10 mL 1 mol·L-1 Mg(NO3)2溶液B.5 mL 0.8 mol·L-1Al(NO3)3溶液C.10 mL 2 mol·L-1 AgNO3 溶液D.10 mL 0.5 mol·L-1Cu(NO3)2溶液8.在无色透明的溶液中滴入酚酞试剂溶液变红色,该溶液中能大量共存的离子组是A.K+、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32-C.Na+、H+、NO3-、SO42-D.Fe3+、Na+、Cl-、SO42-9.下列反应不能用离子方程式CO32-+2H+=CO2↑+H2O表示的是A.Na2CO3+2HCl=2NaCl+CO2↑+H2O B.CaCO3+2HCl=CaCl2+H2O+CO2↑C.K2CO3+H2SO4=K2SO4+CO2↑+H2O D.K2CO3+2HNO3=2KNO3+CO2↑+H2O10. 将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是A.银、干冰、硫酸、烧碱、食盐B.碘酒、冰、盐酸、烧碱、食盐C.氢气、二氧化硫、硝酸、纯碱、硝酸钾D.铜、氧化铜、醋酸、石灰水、氯化铜11.下列叙述中,正确的是A.氧化还原反应的本质是元素化合价发生了变化B.得到电子的物质被氧化C.所含元素化合价升高的反应物被氧化D.氧化还原反应中,氧化剂和还原剂一定是两种物质12.下列有关等质量的CO和CO2相比较,下列有关叙述中正确的是①所含分子数目之比为7:11 ②所含氧原子数目之比为11:14③相同条件下体积之比为11:7 ④相同条件下密度值比为11:7A.①和④B.②和③C.③和④D.②和④13. 设N A代表阿伏加德罗常数,下列说法正确的是A.2.4g金属镁变成镁离子失去电子数目为0.1N AB.2g氢气含有的原子数目为N AC.在25℃,1.01×105Pa时,11.2L氮气所含原子数目为N AD.17g氨气所含电子数目为10N A14. 下列关于氧化还原反应与四种基本反应类型的关系说法正确的是A. 化合反应都不是氧化还原反应B. 有单质生成的分解反应一定是氧化还原反应C.有一些置换反应不是氧化还原反应D. 有氧元素参与的复分解反应是氧化还原反应15.下列离子方程式书写正确的是A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32-=CO2↑+ H2OB.稀盐酸与氢氧化钡溶液反应:H++OH-=H2OC.硫酸铜溶液与氢氧化钡溶液反应:SO42-+ Ba2+== BaSO4↓D.稀硫酸与氢氧化钡溶液反应:Ba2++OH-+ SO42-+ H+= Ba SO4↓+H2O17.已知微粒MnO4-、Cl2、Fe3+、Cu2+、H+在溶液中的氧化性强弱顺序为MnO4->Cl2>Fe3+>Cu2+>H+,则下列反应能发生的是① 2 MnO4- + 10Cl- + 16H+===2Mn2+ + 5Cl2↑+ 8H2O ② Cl2+2Fe2+===2Fe3+ + 2Cl-③ 2Fe3+ + Cu===2Fe2+ + Cu2+④ Cu + 2 H+=== Cu2+ + H2↑A.①②B.①②④ C.①②③④ D.①②③第Ⅱ卷(非选择题共49分)二、非选择题(本题包括5小题,共49分)18.(9分)运用所学有关知识填空。

河婆中学2016——2017学年高一级化学期中考试第Ⅰ卷(选择题共42分)可能用到的原子量:H-1 C-12 O-16 N-14 Na-23 Cl-35.5一、单项选择题(本题包括14小题,每题3分,共42分,每题只有一个正确选项)1.中国女药学家屠呦呦获得了2015 年诺贝尔生理学或医学奖,以表彰她创新了具有国际影响的世界抗疟药——青蒿素(分子式为C15H22O5)其方法是用乙醚作为溶剂,提取青蒿中青蒿素。
这种方法的原理属于( )A. 过滤B. 蒸发C. 萃取D. 结晶2.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是()3.为了除去KCl中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是①过滤②加过量NaO H溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥加过量KOH溶液⑦加过量K2CO3溶液A.②⑤④①③B.⑥⑤⑦①③C.④①②⑤③D.④②⑤①③4.设阿伏加德罗常数的值为N A,下列说法正确的是()A.常温常压下,18g H2O中含有的原子总数为3N AB.在标准状况下,22.4LCCl4的物质的量为1molC.1mol/L NaOH溶液中含有的Na+ 数为N AD.22gCO2与标准状况下11.2LHCI所含的分子数不相同5.下列溶液中Cl﹣浓度最大的是()A.10ml 0.2 mol/L的FeC13溶液 B.10ml 0.1 mob/L的AlC13溶液C.20ml 0.l mol/L的MgCl2溶液 D.20ml l mol/L的KClO3溶液6.下表各组物质分类不正确...的是()7.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的A .②④⑥B .③⑤⑥C .①②④D .①③⑤8. 下列有关胶体的叙述正确的是A . 胶体粒子的大小通常在0.1~1nm 之间B . 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现C . 鸡蛋清溶液分类上属于悬浊液D . 向FeCl 3溶液中加入NaOH 溶液,会出现红褐色Fe(OH)3胶体 9. 下列物质都能导电,其中属于电解质的是A .NaCl 溶液B .铁丝C .稀硫酸D .熔融的NaOH10.下列物质在水溶液中的电离方程式书写正确的是( )A .KClO 3=K ++3O 2—+Cl 5+B .NaHCO 3 = Na ++H ++CO 32—C .H 2SO4=H ++ SO 42—D .Al 2(SO 4)3 = 2Al 3++3SO 42—11.下列各组离子中,能在无色透明溶液中大量共存的是( ) A. Na +、H +、Cl -、OH -B. K +、Na +、CO 32-、OH -C. K +、SO 42-、NO 3-、MnO 4- D. Na +、CO 32-、H +、、Ca 2+12.下列反应的离子方程式中正确的是( ) A . 铜片插入硝酸银溶液中: Cu + Ag += Cu 2++ AgB .氢氧化钡溶液与稀硫酸混合:Ba 2++ OH -+H ++SO 42—=BaSO 4↓+ H 2O C .碳酸钙溶于稀盐酸中: CaCO 3+2H +=Ca 2++H 2O +CO 2D .石灰乳与Na 2CO 3溶液混合:Ca 2++CO 32-==CaCO 3↓13.混合气体由N 2和CH 4组成,测得混合气体在标准状况下的密度为0.821g/L ,则混合气体中N 2和CH 4的体积比为( )A. 1:1B. 1:4C. 4:1D. 1:214.硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c (SO42—)=0.8 mol·L-1,则c(K+)为( )A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1第Ⅱ卷(非选择题共58分)二.非选择题15. (10分)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:(1CCl4(沸点为76.75℃)和甲苯(沸点为(2和CCl4(3填“上”或“下”)口进水。

2019-2020学年高一化学上学期期中试题(含解析)1.所有选择题答案必须答在答题卡上。
2.可能用到的相对原子质量:Na∶23 O∶16 Al:27 C∶12 Cl∶35.5 Ba:137 Fe:56K:39 Mn55一、选择题(本题包括25小题,1-15每小题2分,16-25每小题3分共60分,每小题只有一个选项符合题意)1. 下列说法不正确的是A. 磷酸溶液能够导电B. 水银属于单质C. CuSO4·5H2O是化合物D. “月落乌啼霜满天”——其中“霜”的形成属于升华现象【答案】D【解析】A、磷酸在溶液中能够电离出自由移动的磷酸根离子和氢离子,所以该溶液能导电,故A正确;B、水银属于金属单质,故B正确; C、CuSO4•5H2O是四种元素组成的纯净物,属于化合物,故C正确;D、霜是固态的小冰晶,是空气中的水蒸气快速放热后,由气态变为固态形成的,属于凝华现象,故D错误;故选D。
2. 下列五种物质都含有碘元素,它们按照化合价顺序进行排列:①KI ②I2③HIO ④X ⑤NaIO4则X 不可能是A. AgIB. KIO3C. I2O4D. I2O5【答案】A【解析】根据化合物中正、负化合价的代数和为零,KI中碘元素的化合价为-1价;I2中碘元素的化合价为0;HIO中碘元素的化合价为+1价;NaIO4中碘元素的化合价为+7价;则碘元素的化合价是按照从低到高的顺序排列的,X中碘元素的化合价为在+1到+7之间。
A、AgI中碘元素的化合价为:-1价,不符合这种排列规律,故A选;B、KIO3中碘元素的化合价为:+5价,符合这种排列规律,故B不选;C、I2O4中碘元素的化合价为:+4价,符合这种排列规律,故C不选;D、I2O5中氮元素的化合价为:+5价,符合这种排列规律,故D不选;故选A。
点睛:掌握利用化合价的原则计算指定元素的化合价,找到化合价的排列规律是解答的关键。
在化合物中正负化合价代数和为零,需要知道化合物中常见元素的化合价的标注方法,在化合物中一般不变的化合价有:钾为+1价,氢为+1价,钠为+1价,氧为-2价等。
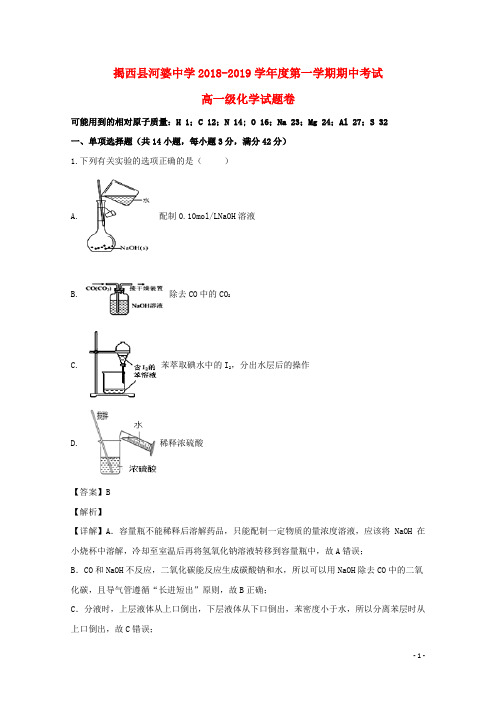
揭西县河婆中学2018-2019学年度第一学期期中考试高一级化学试题卷可能用到的相对原子质量:H 1;C 12;N 14; O 16;Na 23;Mg 24;Al 27;S 32一、单项选择题(共14小题,每小题3分,满分42分)1.下列有关实验的选项正确的是()A. 配制0.10mol/LNaOH溶液B. 除去CO中的CO2C. 苯萃取碘水中的I2,分出水层后的操作D. 稀释浓硫酸【答案】B【解析】【详解】A.容量瓶不能稀释后溶解药品,只能配制一定物质的量浓度溶液,应该将NaOH在小烧杯中溶解,冷却至室温后再将氢氧化钠溶液转移到容量瓶中,故A错误;B.CO和NaOH不反应,二氧化碳能反应生成碳酸钠和水,所以可以用NaOH除去CO中的二氧化碳,且导气管遵循“长进短出”原则,故B正确;C.分液时,上层液体从上口倒出,下层液体从下口倒出,苯密度小于水,所以分离苯层时从上口倒出,故C错误;D.稀释浓硫酸,应将浓硫酸沿器壁注入水中,并用玻璃棒搅拌,故D错误;故答案为B。
2.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。
”这里所用的“法”是指()A. 萃取B. 渗析C. 蒸馏D. 干馏【答案】C【解析】乙醇和水的沸点相差较大,因此涉及的操作方法是蒸馏,答案选C。
点睛:掌握常见物质分离与提纯的方法是解答的关键,易错选项是A,注意萃取与蒸馏的区别,蒸馏是依据混合物中各组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,二者的原理是不同的。
3.下列说法正确的是()A. 将饱和FeCl3溶液逐滴加入NaOH溶液中可制得Fe(OH)3胶体B. 雾属于分散系中的胶体,它的分散剂是水蒸气C. 胶体区别于其它分散系的本质特征是丁达尔效应D. 向Fe(OH)3胶体中逐滴加入稀硫酸至过量,先生成红褐色沉淀最后沉淀溶解【答案】D【解析】【详解】A.将饱和FeCl3溶液逐滴加入NaOH溶液中反应生成Fe(OH)3沉淀,而实验室制备氢氧化铁胶体是把饱和氯化铁溶液滴入沸水中加热到呈红褐色液体,即得到氢氧化铁胶体,故B 错误;B.雾是小液滴悬浮在空气中形成的分散系,属于胶体,它的分散剂是空气,故B错误;C.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm(10-7~10-9m)之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,丁达尔效应是胶体的特征性质,故C错误;D.氢氧化铁胶体滴入盐酸先聚沉生成沉淀氢氧化铁,继续滴入盐酸,氢氧化铁沉淀溶解,故D正确;故答案D。

2019学年广东省高一上学期期中考试化学试卷【含答案及解析】姓名___________ 班级____________ 分数__________一、选择题1. 下列物质中,属于电解质的是()A.氯化氢 B.石墨 C.NaCl溶液 D.蔗糖2. 下列应用或事实与胶体的性质没有关系的是()A.在江河入海处易形成三角洲B.用石膏或盐卤点制豆腐C.在FeCl 3 溶液中滴加NaOH溶液出现红褐色沉淀D.清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线3. 下列物质的分类正确的是()4. 酸碱盐碱性氧化物酸性氧化物 A H 2 SO 4 纯碱 NaOH Cu O CO 2 B HCl 烧碱NaCl Na 2 O CO C CH 3 COOH Ba( OH ) 2 CuSO 4 · 5 H 2 O 熟石灰 SO 2 D HNO 3 KOH CaCO 3 生石灰 SO 25. 下列物质在水溶液中的电离方程式错误的是()A.Na 2 CO 3 = 2Na + + CO 3 2- B. NaHSO 4 = Na + + H + + SO 4 2-C.KOH= K + + O 2- + H + ______________________________ D. H 2 SO 4 = 2H + + SO 4 2-6. 下列离子方程式书写正确的是()A.硫酸铜溶液与氢氧化钡溶液混合:Ba 2+ + SO 4 2 -=BaSO 4 ↓B.澄清的石灰水与稀盐酸反应:OH — + H + = H 2 OC.硝酸银溶液与氯化钠溶液混合: Ag NO 3 + Cl —=Ag Cl ↓ + NO 3 -D.铁与稀硫酸反应:2Fe + 6H + =2Fe 3+ + 3H 2 ↑7. 下列各组离子,溶液为无色透明并且能大量共存的是()A.Na + 、 NH 4 + 、 Cl —、 SO 4 2 -____________________ B.Na + 、 H + 、Cl —、 C O 3 2 -C.Cu 2+ 、 K + 、 Cl —、 NO 3 -____________________________ D.K + 、 Ba 2 + 、 SO 4 2 -、 OH —8. 下列有关氧化还原反应的说法中,正确的是()A.在氧化还原反应中,非金属单质一定是氧化剂B.还原剂在反应中发生还原反应C.氧化还原反应的本质是电子的转移D.有单质生成的反应一定是氧化还原反应9. 用 BaCl 2 检验SO 4 2- 离子时,先在待测溶液中加入盐酸,其作用是( )A.形成较多的白色沉淀 B.排除SO 4 2- 以外的其它阴离子及Ag + 的干扰C.形成的沉淀纯度更高 D.排除Ba 2+ 以外的其它阳离子的干扰10. 以下实验装置一般不用于分离物质的是()11. 下列实验目的可以实现或操作正确的是()A .用 50mL 的量筒量取 45.50mL 的水B .将 40 g NaOH 溶解于 1 L 水中配得1 mol/L 的溶液C . CCl 4 萃取碘水的实验中,分液时,水层液体从下口流出D .稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌12. 下列分离、提纯、鉴别物质的方法正确的是( )A.用丁达尔效应鉴别Fe(OH) 3 胶体和FeCl 3 溶液B.用溶解、过滤的方法提纯含有少量BaSO 4 的BaCO 3C.用过滤的方法除去蔗糖溶液中含有的少量淀粉胶体D.用加热、过滤、蒸发的方法可以除去粗盐中的泥沙、CaCl 2 、MgCl 2 等杂质13. 将5mol/L的Mg(NO 3 ) 2 溶液 a mL稀释至 b mL,稀释后溶液中NO 3 -的物质的量浓度为()A. 5a /b mol/L B. 10a /b mol/L________ C.b/5amol/L D.a/b mol/L14. 下列叙述正确的是 (________ )A. 1 mol 任何气体的气体摩尔体积都约为22.4 L/molB.常温常压下,11.2LO 3 中所含氧原子个数等于1.5N AC.标准状况下,1mol CCl 4 所占的体积约为 22.4LD .同温、同压下,相同体积的一氧化碳和二氧化碳的质量比为 7:1115. 现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表。
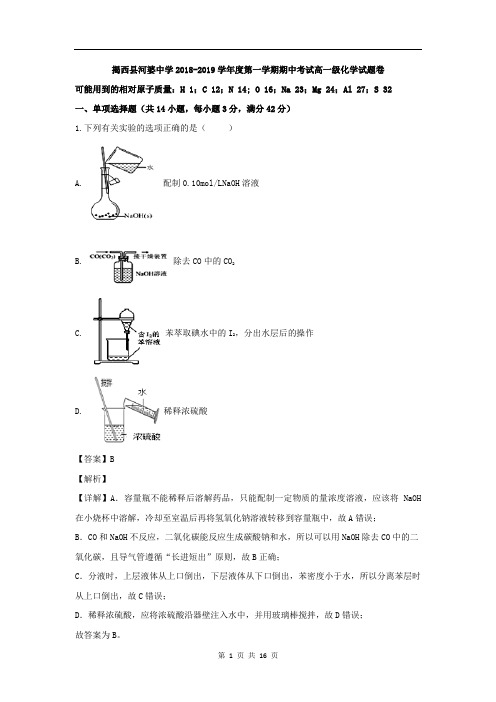
揭西县河婆中学2018-2019学年度第一学期期中考试高一级化学试题卷可能用到的相对原子质量:H 1;C 12;N 14; O 16;Na 23;Mg 24;Al 27;S 32一、单项选择题(共14小题,每小题3分,满分42分)1.下列有关实验的选项正确的是()A. 配制0.10mol/LNaOH溶液B. 除去CO中的CO2C. 苯萃取碘水中的I2,分出水层后的操作D. 稀释浓硫酸【答案】B【解析】【详解】A.容量瓶不能稀释后溶解药品,只能配制一定物质的量浓度溶液,应该将NaOH 在小烧杯中溶解,冷却至室温后再将氢氧化钠溶液转移到容量瓶中,故A错误;B.CO和NaOH不反应,二氧化碳能反应生成碳酸钠和水,所以可以用NaOH除去CO中的二氧化碳,且导气管遵循“长进短出”原则,故B正确;C.分液时,上层液体从上口倒出,下层液体从下口倒出,苯密度小于水,所以分离苯层时从上口倒出,故C错误;D.稀释浓硫酸,应将浓硫酸沿器壁注入水中,并用玻璃棒搅拌,故D错误;故答案为B。
2.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。
”这里所用的“法”是指()A. 萃取B. 渗析C. 蒸馏D. 干馏【答案】C【解析】乙醇和水的沸点相差较大,因此涉及的操作方法是蒸馏,答案选C。
点睛:掌握常见物质分离与提纯的方法是解答的关键,易错选项是A,注意萃取与蒸馏的区别,蒸馏是依据混合物中各组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,二者的原理是不同的。
3.下列说法正确的是()A. 将饱和FeCl3溶液逐滴加入NaOH溶液中可制得Fe(OH)3胶体B. 雾属于分散系中的胶体,它的分散剂是水蒸气C. 胶体区别于其它分散系的本质特征是丁达尔效应D. 向Fe(OH)3胶体中逐滴加入稀硫酸至过量,先生成红褐色沉淀最后沉淀溶解【答案】D【解析】【详解】A.将饱和FeCl3溶液逐滴加入NaOH溶液中反应生成Fe(OH)3沉淀,而实验室制备氢氧化铁胶体是把饱和氯化铁溶液滴入沸水中加热到呈红褐色液体,即得到氢氧化铁胶体,故B错误;B.雾是小液滴悬浮在空气中形成的分散系,属于胶体,它的分散剂是空气,故B错误;C.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm(10-7~10-9m)之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,丁达尔效应是胶体的特征性质,故C错误;D.氢氧化铁胶体滴入盐酸先聚沉生成沉淀氢氧化铁,继续滴入盐酸,氢氧化铁沉淀溶解,故D正确;故答案D。
广东省揭西县河婆中学2020-2021学年高一上学期期中考试化学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是A.腐蚀品B.有毒气体C.易燃液体D.易燃气体2.下列各组混合物中,能用分液漏斗进行分离的是( )A.碘和四氯化碳B.水和四氯化碳C.酒精和水D.汽油和植物油3.下列分类标准和分类结果不科学...的是A.A B.B C.C D.D4.下列实验操作中正确的是A.蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口B.过滤时,为加快过滤速度可用玻璃棒搅动漏斗内液体C.称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上D.皮肤上不慎沾洒上了浓硫酸,应先用水冲洗,再涂上一层氢氧化钠溶液5.下列关于胶体的叙述不正确的是()A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间B.胶体和溶液一样,其分散质可透过滤纸C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的6.2021年10月13日,无锡一家小吃店因燃气泄漏发生爆炸造成多人死亡。
已知瓦斯中甲烷(CH4)与氧气的质量比为1∶4时极易爆炸,此时甲烷与氧气的体积比为()A.1∶4 B.1∶2 C.1∶1 D.2∶17.用N A表示阿伏伽德罗常数的值,下列叙述正确的是()A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2N AB.标况下,11.2 L H2O所含电子数为5N AC.2.4 g镁变为镁离子时失去的电子数为0.1N AD.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2N A8.下列电离方程式正确的是()A.MgSO4=Mg+2+SO4-2B.Ba(OH)2=Ba2++OH2-C.Al2(SO4)3=2Al3++3SO42-D.KClO3=K++Cl-+3O2-9.下列各组中的离子在强酸性水溶液里能大量共存的是A.Ba2+、Na+、CO32-、NO3-B.K+、 CH3COO-、I-、Fe3+C.Cu2+、Fe2+、SO42-、Cl-D.K+、Cl-、NO3-、HCO3-10.科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27S 32 Cl 35.5 Cu 64 Zn 65一、选择题(本题包括16小题,每题只有一个选项符合题意,每题2分,共32分)2.下列不能用于分离混合物的实验操作装置图是【解析】3.下列实验操作均要用到玻璃棒,其中玻璃棒作用相同的是①过滤②蒸发③溶解④向容量瓶转移液体A.①和④B.①和③C.③和④D.①和②4.下列不存在丁达尔效应的分散系是A.食盐水B.稀豆浆C.有尘埃的空气D.向沸水中滴入FeCl3饱和溶液所得液体5.下列叙述中正确的是A.摩尔是物质的质量的单位B.碳的摩尔质量为12gC.阿伏加德罗常数约为6.02×1023 /mol D.气体摩尔体积为22.4L/mol6.将30.0mL0.5mol/LNaOH溶液加水稀释到500.0mL,稀释后溶液中NaOH的物质的量浓度为A.0.03mol/L B.0.04mol/L C.0.05mol/L D.0.3 mol/L7.下列四组溶液,其中可用稀硫酸进行鉴别的一组是A.BaCl2溶液、Ba(NO3)2溶液、Na2CO3溶液B.NaCl溶液、Ba(NO3)2溶液、Na2CO3溶液C.KCl溶液、Ba(NO3)2溶液、MgCl2溶液D.NaCl溶液、K2CO3溶液、Na2CO3溶液D选项,硫酸可以和K2CO3溶液、Na2CO3溶液反应,均会产生二氧化碳气体,无法鉴别现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是A.分液、蒸馏、萃取 B.萃取、蒸馏、分液C .分液、萃取、蒸馏D.蒸馏、萃取、分液9.已知3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是A.16g B.32g C.64g /mol D.32g /mol10.科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2 相同的是A.原子数B.分子数C.体积D.物质的量确;B选项,物质的量不同,由N=nN A可知,分子数不同,故B错误;C选项,物质的11.同温同压下,相同体积的下列气体,质量最大的是A.O2B.CH4C.CO2D.H2S12.下列溶液中的C1-的物质的量浓度与150.0mL l.0 mol/L CaCl2溶液中的Cl-物质的量浓度相等的是A.150 .0mL 1 .0 mol/L NaCl溶液B.75 .0mL 2.0 mol/L MgCl2溶液C.150 .0mL 2 .0 mol/L KCl溶液D.75.0 mL 1 .0 mol/L A1C13溶液13.下列变化需加入还原剂才能完成的是A.MnO2→MnO4-B.CO2→HCO3-C.HS-→S2-D.NO3-→NO【解析】14.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700o C时反应制造出纳米级金刚石粉末和另一种化合物。
2019-2020学年广东省高一(上)期中化学试卷一、选择题(本题包括20小题,每小题3分,共60分.每小题只有一个选项符合题意)1.(3分)(2018秋•湖北期中)清初《泉州府志》记载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。
”下列选项中,与文中“盖泥法”的原理相同的是()A.从地沟油中蒸馏出植物油B.活性炭除去水中的红色墨汁C.用结晶法除去KNO3中的NaClD.用过滤法除去河水中泥沙2.(3分)(2019秋•禅城区校级期中)下列试验中,所选装置不合理的是()A.粗盐提纯,选①和②B.用CCl4提取碘水中的碘,选③C.用NaOH溶液吸收少量CO2,选⑤D.分离Na2CO3溶液和CCl4,选④3.(3分)(2019•西湖区校级模拟)某溶液中含有较大量的Cl﹣、CO32﹣、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是()①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液。
A.①②④②③B.④②①②③C.①②③②④D.④②③②①4.(3分)(2019秋•娄星区期中)中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。
该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。
下列有关说法中,你认为错误的是()A.Na的还原性强于金刚石B .另一种化合物是NaClC .纳米级金刚石粉末可以透过半透膜D .这个反应是置换反应5.(3分)(2019秋•禅城区校级期中)若氖原子质量是ag ,12C 的原子质量是bg ,N A 是阿伏加德罗常数的值,下列说法不正确的是( ) A .该氖原子的相对原子质量是12abB .该氖原子的摩尔质量是aN A gC .Wg 该氖原子的物质的量是W aN AmolD .Wg 该氖原子所含质子数是10W/a6.(3分)(2019秋•禅城区校级期中)某溶液中只含有下列四种离子Fe 3+、SO 42﹣、Cl ﹣和M 离子,经测定Fe 3+、SO 42﹣、Cl ﹣和M 离子的物质的量浓度之比为2:4:4:3,则M离子可能是下列中的( ) A .Mg 2+B .Al 3+C .Ba 2+D .Na +7.(3分)(2016秋•西湖区校级期末)下列关于胶体和溶液的说法中,正确的是( ) A .许多胶体能进行电泳是因为这些胶体带电B .布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分C .光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应D .将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体8.(3分)(2019秋•禅城区校级期中)逻辑推理是化学学习常用的思维方法,下列推理正确的是( )A .酸都能电离出氢离子,电离出氢离子的化合物一定是酸B .氧化还原反应中有元素化合价的改变,有元素化合价改变的化学反应一定是氧化还原反应C .电解质是溶于水或熔融状态下能够导电的化合物,溶于水能导电的化合物一定是电解质D .中和反应有盐和水生成,有盐和水生成的反应一定是中和反应9.(3分)(2019秋•禅城区校级期中)下列关于物质分类的正确组合是( )纯净物混合物强电解质弱电解质非电解质A盐酸空气硫酸醋酸H2B胆矾石灰水硫酸钡Al(OH)3NH3C烧碱蔗糖溶液氯化钠氨水三氧化硫D冰醋酸汽油苛性钾氯化氢乙醇A.A B.B C.C D.D10.(3分)(2019秋•禅城区校级期中)用N A表示阿伏加德罗常数,下列说有关说法正确的是()A.32g O2和O3混合气体所含氧原子数目为2N AB.标准状况下,2.24L H2O含有的原子数为0.3N AC.将2mol/L的FeCl3溶液,其中含有Cl﹣为6N AD.在常温常压下,11.2L N2含有的分子数小于0.5N A11.(3分)(2019秋•禅城区校级期中)下列离子组一定能大量共存的是()①透明溶液中:Mg2+、SO42﹣、NO3﹣、MnO4﹣②使石蕊呈红色的溶液中:Ca2+、CH3COO﹣、Cl﹣、NH4+③所含溶质为NaHSO4的溶液中:HCO3﹣、Na+、Cl﹣、SO42﹣④含有大量Fe2+的溶液中:H+、Br﹣、K+、NO3﹣⑤加Fe 能产生H2的溶液中:CO32﹣、SO42﹣、Mg2+、Na+A.①B.②③④C.②④⑤D.①③④⑤12.(3分)(2019秋•禅城区校级期中)能够用离子方程式:Ca2++CO32﹣═CaCO3↓表示的反应是()A.石灰乳和碳酸钠溶液反应B.澄清石灰水和足量NaHCO3溶液反应C.氯化钙溶液和碳酸钾溶液反应D.硝酸钙溶液和少量CO2反应13.(3分)(2019秋•禅城区校级期中)下列过程的离子方程式正确的是()A.氨水与醋酸的反应:NH3•H2O+H+═NH4++H2OB.铜与AgNO3溶液反应:Cu+Ag+═Cu2++AgC.往一定量NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42﹣+OH﹣+Ba2+═BaSO4↓+H2OD.澄清石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O14.(3分)(2018秋•湖北期中)有下列三个氧化还原反应:①2FeCl2+2KI=2FeCl2+2KCl+l2②2FeCl2+Cl2═2FeCl3③2KMnO4+16HCl(浓)=2KC1+2MnCl2+5Cl2↑+8H2O,下列有关说法正确的是()A.还原性最强的是FeCl3B.氧化性的强弱顺序为:KMnO4>FeCl3>C12C.若溶液中Cl﹣与I﹣共存,为了氧化I﹣而不氧化Cl﹣可以向溶液中通入Cl2D.反应③中若生成2mol Cl2共转移5mol电子15.(3分)(2015秋•房山区期末)在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是()A.1:6B.1:5C.6:1D.5:116.(3分)(2019秋•禅城区校级期中)已知下列微粒在酸性条件下都能氧化KI(氧化产物为I2),自身发生如下变化:H2O2→H2O IO3﹣→I2MnO4﹣→Mn2+HNO2→NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是()A.H2O2B.IO3﹣C.MnO4﹣D.HNO217.(3分)(2019秋•禅城区校级期中)将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是()①稀硫酸②稀氢氧化钠溶液③硫酸铁溶液④氯化镁溶液⑤饱和澄清石灰水A.①②③B.①③⑤C.②③④D.③④⑤18.(3分)(2019秋•禅城区校级期中)由Zn、Fe、Mg、Al四种金属中两种组成的20 g混合物与足量的盐酸反应产生2.0 g H2,则混合物中一定含有的金属是()A.Zn B.Fe C.Al D.Mg19.(3分)(2016•永州校级模拟)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。