荧光光谱法研究除草醚与牛血清白蛋白的相互作用
- 格式:pdf
- 大小:430.47 KB
- 文档页数:5

收稿日期:2019-12-16 修回日期:2020-05-10基金项目:国家自然科学基金(N o .41602351) *通讯作者:顾佳丽,女,副教授,研究方向为分析化学㊂E -m a i l :g u ji a l i _99@163.c o m 第36卷第6期V o l .36 N o .6分析科学学报J O U R N A LO FA N A L Y T I C A LS C I E N C E2020年12月D e c .2020D O I :10.13526/j.i s s n .1006-6144.2020.06.014光谱法研究甲苯达唑与牛血清白蛋白的相互作用顾佳丽*,王思宇,杨 丹,黄曦瑶,何 茜,秦洪伟(渤海大学化学化工学院,辽宁锦州121013)摘 要:本文采用多种光谱法研究了甲苯达唑(M B Z )与牛血清白蛋白(B S A )之间的相互作用机制㊂荧光猝灭实验及时间分辨荧光实验结果表明:M B Z 对B S A 的荧光猝灭主要为静态猝灭;温度298K 时二者的结合常数与结合位点数分别为6.52ˑ104L㊃m o l -1和1.08;热力学参数ΔH 与ΔS 分别为-117.49k J ㊃m o l -1和-229.24J ㊃m o l-1㊃K -1,说明M B Z 与B S A 之间的作用力主要为范德华力和氢键㊂位点竞争实验结果表明M B Z 结合在B S A 亚结构域ⅡA 的S i t e Ⅰ㊂紫外-可见光谱㊁同步荧光光谱㊁红外光谱法以及圆二色光谱实验结果表明,M B Z 诱导B S A 的构象发生变化㊂关键词:甲苯达唑;牛血清白蛋白;相互作用中图分类号:O 657.3 文献标识码:A 文章编号:1006-6144(2020)06-857-06苯并咪唑(B M Z s)是一种合成的抗寄生虫药物,由于其高效性和广谱性,在农业和水产养殖中被广泛用于治疗吸虫和线虫感染[1]㊂但是不正确的使用会使B M Z s 在食用动植物产品中残留,并通过食物链在人体中累积,对人体健康构成潜在的危害[2]㊂动物实验证明,某些B M Z s 具有致畸和致突变的作用[3],因此,B M Z s 被中国㊁美国和欧盟等多个国家和地区列为兽药残留的重要监控对象[4],并制定了最大残留限量[5]㊂B M Z s 对人体的毒性与血清白蛋白(S A )的储运功能密切相关[6]㊂S A 作为人和动物血浆中重要的载体蛋白,可以与多种外源性物质结合,影响其在生物体中的储存㊁分布㊁代谢和毒性[7]㊂本文以B M Z s 中常用药物甲苯达唑(M B Z )为例,研究M B Z 与牛血清白蛋白(B S A )的相互作用机制,对于从分子水平上了解B M Z s 药物在生物体内的分布㊁吸收及潜在毒性具有一定的参考意义㊂1 材料与方法1.1 实验仪器与试剂F l u o r o m a x -4N I R 型荧光分光光度计(法国,堀场);F L S 1000型稳态瞬态荧光光谱仪(英国,爱丁堡);J a s c o J -810型圆二色光谱仪(日本,分光);U V 2800型紫外-可见分光光度计(上海舜宇恒平);傅里叶变换红外光谱仪(德国,布鲁克)㊂牛血清白蛋白(B S A ,S i gm a );甲苯达唑(M B Z )㊁华法林钠㊁布洛芬和8-苯胺-1-萘磺酸(阿拉丁);乙腈(国药试剂)㊂B S A 储备液(1.0ˑ10-4m o l ㊃L -1)用p H=7.4的T r i s -H C l 缓冲溶液配制,冷藏保存,现用现配;M B Z 储备液(1.0ˑ10-4m o l ㊃L -1)用乙腈溶解配制,避光保存;华法林钠与布洛芬储备液用乙醇配制㊂其它试剂均为分析纯㊂1.2 实验方法1.2.1 荧光光谱的测定 于比色管中加入1.0ˑ10-6m o l ㊃L -1的B S A 溶液10m L ,用微量进样器滴加M B Z 溶液(1.0ˑ10-3m o l ㊃L -1)㊂分别在温度298K ㊁303K 和310K 下记录B S A 及其与M B Z 作用的荧758第6期顾佳丽等:光谱法研究甲苯达唑与牛血清白蛋白的相互作用第36卷光光谱㊂激发波长280n m ,发射波长290~500n m ,激发狭缝和发射狭缝均为5n m ㊂研究了乙腈对荧光光谱的影响,结果表明在本实验范围内乙腈的影响可以忽略不计㊂记录空白的荧光光谱,以扣除配体和缓冲溶液的荧光影响㊂根据公式:F c o r =F o b s ˑe A e x +A e m2)[8]对荧光发射强度进行修正以消除内滤光效应㊂同步荧光光谱设置Δλ分别为15n m 和60n m ,其它条件同荧光光谱法㊂1.2.2 时间分辨荧光光谱的测定 室温下测定了B S A 及其与M B Z 作用的荧光寿命,激发波长290n m ,发射波长345n m ,量子点数收集5000,采用仪器自带软件进行荧光寿命拟合㊂1.2.3 紫外-可见吸收光谱(U V -V i s )的测定 于比色管中加1.0ˑ10-6m o l ㊃L -1的B S A 溶液3.0m L ,滴加M B Z 溶液(1.0ˑ10-4m o l ㊃L -1),分别测定B S A 及其与M B Z 作用的紫外-可见吸收光谱㊂1.2.4 圆二色光谱(C D )的测定 波长范围200~250n m ,扫描速度100n m ㊃m i n-1,样品池光径1m m ,分辨率0.1n m ,分别测定B S A 及其与M B Z 作用的C D 光谱㊂1.2.5 傅里叶红外(F T -I R )光谱的测定 采用衰减全反射法(A T R )记录了B S A 及其与M B Z 作用的F T -I R 光谱,分辨率为4c m -1,扫描分辨率为128㊂分别收集B S A 溶液和缓冲溶液的光谱,并做差谱得到作用前的B S A 的红外光谱,同样条件下扫描M B Z -B S A 体系和M B Z 的红外光谱,做差谱得到与M B Z 作用后的B S A 红外光谱㊂1.2.6 8-苯胺-1-萘磺酸(A N S )荧光光谱的测定 固定A N S 与B S A 的浓度比为5ʒ1,滴加M B Z 溶液,激发波长380n m ,发射波长400~600n m ,其它条件同荧光光谱法㊂1.2.7 共振散射荧光光谱(R L S )的测定 波长测定范围250~600n m ,Δλ=0n m 时同步扫描B S A 及其与M B Z 作用的R L S 光谱㊂其它参数设定同荧光光谱测定㊂1.2.8 位点竞争实验 固定B S A 与M B Z 的浓度比为1ʒ5,变化华法林或布洛芬的浓度从5.0ˑ10-7~2.5ˑ10-6m o l ㊃L -1,测定荧光光谱㊂2 结果与讨论2.1 M B Z 与B S A相互作用的荧光光谱图1 B S A 与M B Z 作用的荧光光谱F i g .1 F l u o r e s c e n c e o f s pe c t r a o fB S Aa n dM B Z c B S A =1.0ˑ10-6m o l ㊃L -1,c M B Z=0,2,4,6,8,10,12(ˑ10-6m o l ㊃L -1).B S A 与M B Z 作用的荧光光谱见图1㊂B S A 在波长347n m 处有较强吸收峰,随着M B Z 浓度的增大,B S A 的荧光强度降低且蓝移至344n m ㊂这表明M B Z 会猝灭B S A 的荧光强度,并影响氨基酸周围微环境,疏水性增加[9]㊂2.2 荧光猝灭机制荧光猝灭机制主要有动态猝灭和静态猝灭㊂猝灭过程符合S t e r n -V o l m e r 方程[10]:F 0/F =1+K q τ0[Q ]=1+K S V [Q ])㊂以F 0/F 对[Q ]作图,由曲线斜率求出M B Z 对B S A 的猝灭常数K S V 见表1㊂K S V 随温度的升高而减小,且三个温度下K q 均大于猝灭剂对蛋白质的最大扩散碰撞猝灭速率常数(2.0ˑ1010L ㊃m o l -1㊃s -1),因此推断M B Z对B S A 的猝灭主要为静态猝灭㊂表1 B S A 与M B Z 作用的猝灭常数㊁结合常数㊁结合位点数及热力学常数T a b l e 1 Q u e n c h i n g c o n s t a n t s ,b i n d i n g c o n s t a n t s a n d t h e r m o d y n a m i c s p a r a m e t e r s o fB S Aa n dM B Z T/KK S V /(L ㊃m o l -1)K q /(L ㊃m o l -1㊃s -1)K A /(L ㊃m o l -1)n ΔH /(k J ㊃m o l -1)ΔS /(J ㊃m o l -1㊃K -1)ΔG/(k J ㊃m o l -1)2982.62ˑ1042.62ˑ10126.52ˑ1041.08-49.183031.82ˑ1041.82ˑ10123.56ˑ1041.06-117.49-229.24-48.033101.44ˑ1041.44ˑ10121.06ˑ1040.97-46.432.3 结合常数及结合位点数M B Z 与B S A 形成复合物,可用双倒数方程:(l o g [(F 0-F )/F ]=l o g K A +n l o g [Q ])[11],以l o g [(F 0-F )/858第6期分析科学学报第36卷F ]对l o g[Q ]作图,由曲线的截距和斜率计算M B Z 与B S A 作用的结合常数K A 及结合位点数n (表1)㊂K A 均约为104L ㊃m o l -1,说明M B Z 和B S A 形成了较为稳定的复合物,B S A 可以携带转运M B Z ㊂n 约为1,表明M B Z 与B S A 之间存在一个结合位点㊂2.4 热力学参数及作用力类型药物和蛋白质之间的作用力主要有疏水作用㊁静电作用力㊁范德华力和氢键㊂根据热力学参数可以用来判断药物和蛋白质之间的作用力类型㊂热力学常数焓(ΔH )㊁熵(ΔS )和吉布斯自由能(ΔG )可以通过V a n tH o f f 方程:(l n K A =-ΔH R T +ΔS R)[12]及ΔG =ΔH -T ΔS 求得(表1)㊂ΔH 和ΔS 均小于零,说明M B Z 与B S A 的相互作用主要为范德华力和氢键㊂ΔG 小于零,说明反应是自发进行的㊂2.5 能量转移与结合距离的计算根据F ör s t e r 非辐射能量转移理论[13],当供体的荧光发射光谱和受体的吸收光谱之间有充分的重叠,且作用距离小于7n m 时,它们之间很可能发生非辐射能量转移㊂由M B Z 的吸收光谱和B S A 的发射光谱重叠求得积分J =2.8ˑ10-15c m 3㊃L ㊃m o l -1,临界距离R 0=1.98n m ,能量转移效率E =18.4%,作用距离r =3.84n m ,说明M B Z 和B S A 之间发生非辐射能量转移的可能性极高㊂r >R 0,说明M B Z 对B S A 荧光猝灭主要是由静态猝灭引起的㊂2.6 时间分辨荧光光谱对于动态猝灭,猝灭剂会缩短荧光分子激发态寿命,而对于静态猝灭,荧光分子激发态寿命则不会发生改变㊂将B S A 与M B Z 作用前后的荧光衰减曲线进行双指数拟合,并根据方程:<τ>=(B 1τ1+B 2τ2)/(B 1+B 2)[14]计算B S A 的荧光寿命为τ1=4.75n s (38.65%),τ2=6.75n s (61.35%),平均寿命5.98n s (χ2=1.16)㊂与M B Z 作用后,B S A 的荧光寿命变为τ1=4.26n s (52.95%),τ2=7.12n s (47.05%),平均寿命5.61n s (χ2=1.13)㊂M B Z 没有引起B S A 荧光寿命的明显改变,因此推断M B Z 对B S A 的猝灭主要为静态猝灭㊂2.7 M B Z 对B S A 构象的影响图2 B S A 与M B Z 相互作用的紫外-可见光谱F i g .2 U V -V i s a b s o r b a n c e s pe c t r a of B S Aa n dM B Z c B S A =1.0ˑ10-6m o l ㊃L -1,c M B Z =0,3,6,9,11.9,14.8,17.7(ˑ10-6m o l ㊃L -1).2.7.1 紫外-可见吸收光谱 图2为B S A 与M B Z 作用的吸收光谱,B S A 分别在波长208n m 和278n m 处有两个吸收峰,208n m 处的较强吸收峰与B S A 分子中肽链构象有关,278n m 处的较弱吸收峰与芳香氨基酸周围微环境的极性有关㊂随着M B Z 浓度的增大,B S A 在208n m 处的吸光度减小且红移至210n m ,278n m 处的吸收峰减小且略红移(1n m ),这说明M B Z 诱导B S A 二级结构发生改变,且影响氨基酸残基周围微环境的极性减小[15]㊂2.7.2 同步荧光光谱 同步荧光光谱可以提供发色团周围微环境的特征信息㊂当Δλ=15n m 或Δλ=60n m 时,B S A 的同步荧光光谱只显示酪氨酸或色氨酸的荧光光谱特征㊂由图3(A )可以看出,当Δλ=15n m 时,同步荧光光谱变化较小;而图3(B )表明,当Δλ=60n m 时,随着M B Z浓度的增加荧光强度减小且略有蓝移(349~347n m )㊂说明M B Z 主要猝灭的是色氨酸残基,并使其周围疏水性增加[16]㊂2.7.3 圆二色(C D )光谱 B S A 与M B Z 作用的C D 光谱如图4所示㊂B S A 在远紫外区的208n m 和220n m 处有两个负吸收峰,是典型的α-螺旋结构的特征,能够反映蛋白质主链的构象性质㊂随着M B Z 的加入,B S A 两个负峰强度改变,α-螺旋结构含量可用公式[17]:α-H e l i x (%)=-M R E 208-400033000-4000ˑ100,M R E =O b s e r v e d C D (m d e g )10ˑn ˑl ˑC p计算㊂结果表明,M B Z 使B S A 的α-螺旋含量降低(55.4%~51.2%),说明M B Z 诱导B S A 的二级结构发生了变化,这一结果与紫外-可见光谱实验结果是一致的㊂2.7.4 傅里叶变换红外光谱 红外光谱法是研究B S A 二级结构变化的常用方法㊂B S A 的红外光谱主958第6期顾佳丽等:光谱法研究甲苯达唑与牛血清白蛋白的相互作用第36卷图3 B S A 与M B Z 作用的同步荧光光谱F i g .3 S y n c h r o n o u s f l u o r e s c e n c e s pe c t r a o fB S Aw i t h M B Z c B S A =1.0ˑ10-6m o l ㊃L -1,c M B Z =0,2,4,6,8,10,12(ˑ10-6m o l ㊃L -1).图4 B S A 与M B Z 相互作用的C D 光谱F i g .4 C Ds pe c t r a o fB S Aa n dM B Z c B S A =1.5ˑ10-6m o l ㊃L -1,c M B Z /C B S A =0ʒ1,10ʒ1,20ʒ1.要分为位于1700~1600c m -1的酰胺Ⅰ带(C=O 的伸缩振动吸收),以及位于1600~1500c m -1的酰胺Ⅱ带(C -N 伸缩振动与N-H 面内弯曲振动)[18]㊂酰胺Ⅰ带对B S A 的二次结构变化比酰胺Ⅱ带更敏感㊂利用傅里叶去卷积和二阶导数技术处理红外光谱,将酰胺Ⅰ带分解为多个子峰,并估算子峰的位置和宽度(图5)㊂通过曲线拟合,定量分析B S A 二级结构各组分的含量为:反平行β-折叠(1680~1690c m -1)11.0%;β-转角(1680~1660c m -1)14.1%;α-螺旋(1660~1649c m -1)53.2%;无规则卷曲(1638~1648c m -1)13.5%;β-折叠(1615~1637c m -1)8.2%㊂与M B Z 作用后,B S A 的反平行β-折叠含量增加到13.6%,β-转角含量增加到15.4%,α-螺旋含量减少到43.8%;无规则卷曲含量增加到17.7%,β-折叠增加到9.5%㊂这一结果说明M B Z 使B S A 二级结构发生改变,这一结果与圆二色光谱是一致的㊂图5 B S A (A )与M B Z 作用(B )的红外(I R )光谱F i g .5 I Rs pe c t r a o fB S A (A )a n dM B Z (B )2.7.5 A N S 荧光光谱 A N S 是一种对于疏水性环境敏感的荧光探针,常用于研究蛋白质表面疏水性变化㊂B S A -A N S 体系与M B Z 作用的荧光光谱如图6所示㊂A N S 在水中的荧光强度很弱,但与B S A 的疏水性基团结合后荧光强度显著增强㊂随着M B Z 浓度的增大,B S A -A N S 体系的荧光强度降低,这说明M B Z 使B S A 表面疏水性减少[19]㊂2.8 共振散射光谱B S A 与不同浓度M B Z 作用的共振散射光谱见图7所示㊂B S A 的共振散射信号较弱,但随着M B Z 浓度的增大,体系的共振散射强度显著增强,其原因可能是M B Z 与B S A 形成粒径较大的复合物,导致共振散射信号增强[20]㊂068第6期分析科学学报第36卷图6M B Z对B S A-A N S体系的荧光猝灭光谱F i g.6F l u o r e s c e n c e q u e n c h i n g s p e c t r a o f B S A-A N S b y M B Za:B S A,c B S A=1.0ˑ10-6m o l㊃L-1.b:A N S,c A N S=1.0ˑ10-5 m o l㊃L-1,c M B Z(c-i)=0,2,4,6,8,10,12(ˑ10-6m o l㊃L-1).图7M B Z与B S A作用的共振散射光谱F i g.7R L S o fM B Za n dB S Ac B S A=1.0ˑ10-6m o l㊃L-1;c MB Z(aңe)=0,4.5,5.7,8.0,9.1(ˑ10-6m o l㊃L-1).2.9结合位点B S A通常有两个结合位点和药物发生结合,一是位于亚结构域ⅡA的色氨酸残基T r p212;二是位于亚结构域ⅢA的色氨酸残基T r p314,分别定义为S i t eⅠ和S i t eⅡ㊂华法林(S i t eⅠ)和布洛芬(S i t eⅡ)是最常用的位点探针㊂位点探针的百分数可用公式(P r o b eD i s p l a c e m e n t(%)=F2/F1ˑ100%)计算[21]㊂结果表明,华法林使得M B Z-B S A体系的P r o b eD i s p l a c e m e n t(%)由92.0%下降至61.5%,布洛芬使得M B Z-B S A体系的P r o b eD i s p l a c e m e n t(%)由95.2%下降至94.0%㊂这说明M B Z和华法林在S i t eⅠ发生了竞争,即M B Z结合在B S A亚结构域ⅡA处的S i t eⅠ㊂3结论本文通过多种光谱法研究了M B Z与B S A的相互作用机制㊂实验结果表明,M B Z会与B S A通过范德华力和氢键形成复合物,从而导致B S A荧光猝灭㊂U V-V i s光谱㊁同步荧光光谱㊁F T I R光谱和C D光谱实验结果表明,M B Z诱导B S A二级结构改变,并且影响色氨酸周围微环境㊂位点竞争实验表明,M B Z结合在B S A亚结构域ⅡA处的S i t eⅠ㊂实验结果以期为从分子水平上了解苯并咪唑类药物与蛋白质的作用机制提供参考依据㊂参考文献:[1] L IR,Y A N GLQ,L U OYD,e t a l.J o u r n a l o f I n s t r u m e n t a l A n a l y s i s(李蓉,杨璐齐,罗阳丹等.分析测试学报),2018,37(5):547.[2] L IT,HU A N G YZ,J I A N G YF,e t a l.T h eF o o d I n d u s t r y(李唐,黄永震,姜艳芬等.食品工业),2019,40(7):260.[3] Z HA OCQ,L I UZ,X U X Y,e t a l.P h y s i c a lT e s t i n g a n dC h e m i c a lA n a l y s i s(C h e m i c a lA n a l y s i s)(赵超群,刘柱,徐潇颖等.理化检验-化学分册),2017,53(7):765.[4] X I A OLZ,Z O U Y,C H E NSM.J o u r n a l o f I n s t r u m e n t a lA n a l y s i s(邵琳智,邹游,陈思敏.分析测试学报),2019,38(8):990.[5] L I N H D,L I NF,Z HA N G MJ,e t a l.F o o dS c i e n c e(林海丹,林峰,张美金等.食品科学),2011,32(2):231.[6] K o r k m a zF,E r d o g a nD A,Öz a l p-Y a m a nS.N e wJ o u r n a l o fC h e m i s t r y2015,39(7):5676.[7] X I O N GSP,C H E NJB.S p e c t r o c s o p y a n dS p e c t r a lA n a l y s i s(熊时鹏,陈建波.光谱学与光谱分析),2018,38(11):175.[8] L iX,C h e nD,W a n g G.J o u r n a l o fL u m i n e s c e n c e,2014,156:255.[9] T o p r a k M,A rık M.L u m i n e s c e n c e t h e J o u r n a l o fB i o l o g i c a l a n dC h e m i c a l L u m i n e s c e n c e,2015,29(7):805.[10]L IH,X U Q,Z H E N G X L,e t a l.S p e c t r o c s o p y a n dS p e c t r a lA n a l y s i s(李红,许茜,郑晓丽等.光谱学与光谱分析),2018,38(12):3839.[11]G O N G A Q,J I N D Q,Z HU XS.S p e c t r o c s o p y a n dS p e c t r a lA n a l y s i s(龚爱琴,金党琴,朱霞石.光谱学与光谱分析),2018,38(1):157.[12]G O N G H Q,C H E NJB.S p e c t r o c s o p y a n dS p e c t r a lA n a l y s i s(龚含情,陈建波.光谱学与光谱分析),2018,38(6):1869.[13]WA N G XX,N I EZ H,L I SB,e t a l.S p e c t r o c s o p y a n dS p e c t r a lA n a l y s i s(王晓霞,聂智华,李松波等.光谱学与光谱分析),2018,38(8):2468.168第6期顾佳丽等:光谱法研究甲苯达唑与牛血清白蛋白的相互作用第36卷[14]X i eX Y,LüWJ,C h e nX G.J o u r n a l o fH a z a r d o u sM a t e r i a l s,2013,347:248.[15]D u a nST,L i uBS,L iT T,C u iM M.J o u r n a l o fA p p l i e dS p e c t r o s c o p y,2017,84(3):431.[16]Y uX,L i a oZ,J i a n g B,H uX,L iX.S p e c t r o c h i m i c aA c t aP a r tA:M o l e c u l a r a n dB i o m o l e c u l a rS p e c t r o s c o p y,2015,137:129.[17]X I O N GSP,C H E NJB.S p e c t r o c s o p y a n dS p e c t r a lA n a l y s i s(熊时鹏,陈建波.光谱学与光谱分析),2018,38(11):3489.[18]M aR,L i ZY,D iXX,G u oDX,J i JB,W a n g SQ.B i o S c i e n c eT r e n d s,2018,12(4):369.[19]K h o d a r a h m iR,K a r i m i SA,K o o s h kM RA,G h a d a m i SA,G h o b a d i S,A m a n iM.S p e c t r o c h i m i c aA c t a.P a r tA:M o l e c u-l a r a n dB i o m o l e c u l a r S p e c t r o s c o p y,2012,89(4):177.[20]S i d d i q u i S,A m e e nF,J a h a n I,N a y e e mS M,T a b i s h M.N e wJ o u r n a l o fC h e m i s t r y,2019,43(10):4137.[21]X i o n g X,H e J,Y a n g H,T a n g P,T a n g B,S u nQ.R S C A d v a n c e s,2017,7(77):48942.I n v e s t i g a t i o no fB i n d i n g I n t e r a c t i o n sB e t w e e n M e b e n d a z o l ew i t hB o v i n e S e r u m A l b u m i nb y M u l t i s p e c t r o s c o p yG UJ i a l i,WA N GS i y u,Y A N G D a n,HU A N G X i y a o,H E Q i a n,Q I N H o n g w e i(C o l l e g e o f C h e m i s t r y a n dC h e m i c a lE n g i n e e r i n g,B o h a i U n i v e r s i t y,J i n z h o u121013)A b s t r a c t:M e b e n d a z o l e(MB Z)i sv e t e r i n a r y d r u g c o m m o n l y u s e df o ra n t i p a r a s i t i cc o n t r o l i nd o m e s t i c a n i m a l,b u t i t s r e s i d u e s i n e d i b l e a n i m a l s p r o d u c t sm a y p o s e p o t e n t i a l t o x i c t o h u m a nh e a l t h.T h e b i n d i n g m e c h a n i s mb e t w e e n M B Za n db o v i n e s e r u ma l b u m i n(B S A)w a s i n v e s t i g a t e db y m u l t i s p e c t r o s c o p y.T h e r e s u l t so f f l u o r e s c e n c e q u e n c h i n g a n d t i m e-r e s o l v e d f l u o r e s c e n c em e a s u r e m e n t s s h o w e d t h a t q u e n c h i n g o f B S Ab y M B Zw a sm a i n l y s t a t i c q u e n c h i n g.T h e b i n d i n g c o n s t a n t s a n dn u m b e r o f b i n d i n g s i t e sw e r e6.52ˑ104L㊃m o l-1a n d1.08a t298K,r e s p e c t i v e l y.T h et h e r m o d y n a m i c p a r a m e t e r se n t h a l p y a n de n t r o p y w e r e-117.49k J㊃m o l-1a n d-229.24J㊃m o l-1㊃K-1,i n d i c a t i n g t h a t t h e i n t e r a c t i o nb e t w e e nB S Aa n d M B Zw e r e v a nd e rw a a l s f o r c e s a n dh y d r o g e nb o n d.T h e r e s u l t so f s i t em a r k e r c o m p e t i t i v e e x p e r i m e n t s s u g g e s t e d t h a tM B Zc o u l db o u n dB S Ai n t os i t eⅠi ns u b d o m a i nⅡA.T h ec o n f o r m a t i o no fB S A w a s c h a n g e d a f t e r t h e i n t e r a c t i o n w i t h M B Z,w h i c h w e r ev e r i f i e db y t h er e s u l t so fU V-V i ss p e c t r o s c o p y, s y n c h r o n o u sf l u o r e s c e n c es p e c t r o s c o p y,f o u r i e rt r a n s f o r mi n f r a r e ds p e c t r o s c o p y a n dc i r c u l a rd i c h r o i s m s p e c t r o s c o p y.K e y w o r d s:M e b e n d a z o l e;B o v i n e s e r u ma l b u m i n;I n t e r a c t i o n268。

光谱法研究杀螟丹与牛血清白蛋白相互作用张颖;陈宁生;张红颖【摘要】在模拟人体生理条件下,应用荧光光谱法及紫外可见光谱法研究农药杀螟丹与牛血清白蛋白(BSA)间相互作用的荧光行为,用同步荧光技术和圆二色谱考察杀螟丹对BSA结构影响.实验发现,杀螟丹对BSA有较强荧光猝灭作用,猝灭机制属于静态猝灭.用Stern-Volmer方程处理实验数据,得到298 K、303 K、308 K和310 K时的结合常数分别为1.099×104 L/mol、0.805×104 L/mol、0.324×104L/mol和0.200×104 L/mol,能量转移理论求得二者之间的结合距离是2.5nm;其结合作用力以氢键和范德华作用力为主;一些金属离子的存在会影响杀螟丹对BSA的作用;相互作用使BSA的结构发生改变.【期刊名称】《安徽工程大学学报》【年(卷),期】2013(028)002【总页数】4页(P42-45)【关键词】杀螟丹;牛血清白蛋白;荧光光谱;紫外可见光谱;圆二色谱【作者】张颖;陈宁生;张红颖【作者单位】安徽工程大学生物与化学工程学院,安徽芜湖241000;安徽工程大学生物与化学工程学院,安徽芜湖241000;安徽工程大学生物与化学工程学院,安徽芜湖241000【正文语种】中文【中图分类】O657.39随着农药的大量使用,农药残留污染物对自然生态环境的影响日趋严重,引起社会各界的高度重视.研究农药与蛋白质的相互作用,不仅为从分子水平上研究农药在体内的储存、转运和代谢提供了理论依据,也为医学上治疗农药中毒提供了帮助,这方面的研究逐渐增多并成为研究热点[1].杀螟丹(Cartap,C7 H 15 N3 O2 S2·HCl)俗称巴丹,属于沙蚕毒素类广谱、中毒杀虫剂,对菜青虫、小菜蛾幼虫、马铃薯瓢虫、等蔬菜、水稻、旱粮作物及棉花害虫都有很好的灭杀效果[2].目前,对杀螟丹大多是提取、分离及施用等方面的研究,其与蛋白质作用的研究未见报道.本文应用牛血清白蛋白(BSA)代替人血清白蛋白,联合多种光谱技术研究了杀螟丹与BSA相互作用机理,推测了作用的结合力类型,探讨一些共存金属离子对作用的影响,以及杀螟丹的加入对BSA的结构变化.1 实验部分1.1 仪器和试剂Jasco-20c圆二色谱仪(日本,岛津公司);UV-757CRT紫外可见分光光度计(北京普析通用仪器有限公司);HH-601A超级恒温水浴(金坛市晶玻实验仪器厂);F-4500型荧光分光光度计(日本,日立公司);BSA(Sigma公司,1.0×10-5 mol/L),低温保存;杀螟丹(安徽华星化工有限公司,纯度 98%,1.0×10-3 mol/L);NaCl(0.1 mol/L);Tris-HCl溶液(p H=7.4);一定浓度的几种金属离子溶液;其他试剂均为分析纯,实验用水均为重蒸水.1.2 实验方法在10 m L的比色管中加入2.0 m L BSA溶液、2.0 m L Tris-HCl、2.0 m L NaCl 溶液溶液,稀释至刻度,摇匀、静置5 min.准确移取3.0 m L该溶液于1 m L石英比色皿中,用微量进样器逐次加入一定量的杀螟丹溶液于该比色皿中,混合均匀并静置8min,在荧光光度计上记录光谱.荧光光谱:将待测液置于1 cm比色皿中,调狭缝宽度都为10 nm,扫描速度1 200 nm/min,响应速度2.0 s,在280 nm激发波长下,光电管负高压为400 V,扫描发射波长300~500 nm范围内的荧光光谱.调节发射波长与激发波长的为Δλ=60 nm和Δλ=15 nm,记录250~450 nm同步荧光光谱.紫外可见光谱:以二次蒸馏水为参比溶液,将待测液加入1 cm比色皿中,扫描200~500 nm杀螟丹溶液紫外吸收光谱.圆二光谱:室温下,用Jasco-20c圆二色谱仪扫描250~350 nm范围内BSA与杀螟丹作用前后的CD光谱(1 mm石英池).2 结果与讨论2.1 杀螟丹对BSA的荧光猝灭光谱色氨酸、酪氨酸等氨基酸残基都是蛋白质中具有荧光的,所以蛋白质具有内源性荧光.由图1可见,随着杀螟丹的加入,BSA荧光强度明显减弱,并且最高峰的波长从352 nm变到248 nm,发生了蓝移,杀螟丹使BSA内部氨基酸微环境疏水性增强,说明两者发生了相互作用,杀螟丹对BSA有荧光猝灭效果.2.2 荧光猝灭机理杀螟丹作为猝灭剂,对BSA的荧光猝灭可能是静态猝灭或动态猝灭.若为静态猝灭,则杀螟丹与BSA的结合常数随温度的升高不断减小,这是由于两者相互作用生成不发光的复合物,使BSA的荧光强度降低,影响BSA的结构.若为动态猝灭,则杀螟丹和BSA激发态分子之间发生电子或能量转移,对BSA的二级结构没有影响[3].假设杀螟丹对BSA的荧光猝灭是动态猝灭,根据Stern-Volmer方程:式中,F 0与F分别为杀螟丹加入前后BSA荧光的相对强度,[Q]指杀螟丹浓度,K sv为动态(或stern-volmer)猝灭常数,K q为双分子猝灭过程的速率常数,τ0为未加农药时BSA的荧光平均寿命(一般约为10~8 s).作F0/F~[Q]图(见图2),得到不同温度下K sv和K q的值列于表1.由表1可知,K q大于各类猝灭剂对蛋白质最大扩散控制的碰撞猝灭常数2.0×1010 L·mol-1·s-1,且Ksv 随着温度升高而下降,与动态猝灭特征不符,故杀螟丹对BSA的荧光猝灭不是动态猝灭过程,属于静态猝灭过程.若杀螟丹与BSA有n个结合位点,根据方程:通过实验数据可以求出n和K A.通过表1和图3可看出,不同温度下,杀螟丹与BSA的结合位点数都接近于1,所以杀螟丹与BSA之间的结合位点数只有一个,可以形成1∶1的配合物.图1 杀螟丹对BSA的荧光猝灭图图2 杀螟丹 -BSA的荧光猝灭Stern-Volmer图和log[(F 0-F)/F]~log[Q]图表1 不同温度下杀螟丹 -BSA体系的Ksv、K A、nT/K Ksv×104(L·mol-1)Kq×1012(L·mol-1·s-1)K A×104(L·m ol-1)n 298 2.490 2.490 1.0990.92 303 1.943 1.943 0.805 0.92 308 1.454 1.454 0.324 0.86 3101.184 1.184 0.200 0.832.3 金属离子对相互作用的影响生物体中含有多种微量金属元素,一般会影响农药与蛋白质的相互作用.常温下,测定几种必需的金属离子共存时,杀螟丹与BSA的结合常数,说明金属离子对作用的影响,结果如表2所示.由表2可知,K+的存在,使杀螟丹和BSA体系的结合常数减小,但在Fe3+、Ca2+、Cu2+、Mg2+的存在下,使原来的杀螟丹和BSA体系的结合常数增大,有可能是这些离子先和杀螟丹反应,后和BSA作用,生成更稳定的复合物.结合常数的增大延长了杀螟丹在血浆中的储留时间,缓冲了农药在血液中的浓度,降低急性中毒的可能.表2 金属离子对杀螟丹 -BSA的结合常数的影响金属离子KA KA′×104(L·mol-1)KA′/KA无1.099 1 Fe3 +9.277 8.44 Ca2 6.669 6.07 K+ 0.17010.16 Cu2+ 4.213 3.83 Mg2+ 4.639 4.222.4 杀螟丹与BSA结合距离根据Forster偶极 -偶极非辐射能量转移原理[4],BSA的荧光光谱与杀螟丹的吸收光谱重叠(见图3).根据非辐射能量转移原理,能量转移效率E与给体-受体间距离r及临界能量转移距离R 0的关系式:图3 BSA的荧光光谱和杀螟丹的的UV光谱重叠图R 0为转移效率为50%时的临界距离,F 0和F分别为不存在和存在杀螟丹(Ccartap=2.0×10-6 mol/L)时BSA的荧光强度.介质的折射指数N=1.336;偶极空间取向因子K 2=2/3;BSA的荧光量子产率Φ=0.118.F(λ)为BSA在波长为λ时的荧光强度,εA(λ)为杀螟丹在波长λ时的摩尔消光系数.BSA的荧光发射光谱与杀螟丹的吸收光谱之间的光谱重叠积分为J,公式如下:结合图3可求出J=1.031×10-15 cm 3 L/mol,E=0.124,R 0=1.2 nm,r=2.5 nm<7 nm.即BSA上的氨基酸与杀螟丹的结合距离小于7 nm,说明这个过程是个非辐射能量转移过程.2.5 杀螟丹与BSA作用的热力学参数及作用力类型不同分子与蛋白质结合力的类型一般是不同的,具体可分为氢键作用力、范德华力、疏水作用力和静电引力等.在实验的温度范围内,ΔSθ和ΔHθ随温度的变化不大,一般可近似为常数.求得ΔHθ、ΔSθ和ΔGθ.根据ROSS理论可判断出此相互结合是以范德华力或氢键作用力为主.2.6 同步荧光由于Δλ的变化,BSA的荧光也会发生变化的.当Δλ=60 nm时,所得同步荧光光谱只显示色氨酸残基的特征荧光;当Δλ=15 nm时,所得同步荧光光谱只显示酪氨酸残基的特征荧光[5].如图4所示,1、2分别表示只有色氨酸残基和酪氨酸残基的荧光特征.随着杀螟丹浓度的增大,杀螟丹对色氨酸残基猝灭作用非常明显,并且荧光峰发生了蓝移,最高峰的波长从289 nm移到285 nm.但对酪氨酸残基的影响不是很大,这表明杀螟丹的加入使BSA中色氨酸残基附近的微环境发生了变化,从而使BSA得构象发生了变化.2.7 圆二色谱为了进一步研究杀螟丹和BSA结合过程中BSA的结构变化,我们扫描了BSA、BSA与杀螟丹混合溶液的圆二色谱,如图5所示.BSA的圆二色谱在208 nm和220 nm的远紫外区有2个负的吸收带,为α螺旋结构的特征吸收.加入杀螟丹后,峰带强度变化.由仪器附带软件计算出α螺旋结构的含量,BSA分子中α螺旋结构的含量由35.7%下降到26.4%,即BSA的分子构象发生了变化.图4 杀螟丹-BSA的同步荧光光谱图5 杀螟丹-BSA的圆二色谱3 结论杀螟丹与BSA的相互作用属于静态猝灭作用,主要的结合作用力是范德华力或氢键作用力,且发生了分子内的非辐射能量转移;结合位置距离为2.5 nm.杀螟丹使BSA分子中的色氨酸残基微环境改变,对酪氨酸影响较小.通过圆二光谱进一步证明了BSA的分子结构发生了变化.参考文献:[1]王俊杰.有机农药分子与牛血清白蛋白相互作用研究[D].南昌:南昌大学.2008.[2]李本昌.农药残留量实用检测方法手册[M].北京:中国农业出版,1995:106-108.[3]杨曼曼,席小莉,杨频.变温下荧光猝灭和加强理论公式合理性的比较[J].化学学报,2006,64(14):11437-1 445.[4]杨频,高飞,马贵斌.生物无机化学导论[M].西安:西安交通大学出版社,1991.[5]张国文,阙青民,潘军辉.葛根素与牛血清白蛋白相互作用的研究[J].光谱学与光谱分析,2007,27(9):1 784-1 788.。

荧光光谱研究吡虫啉与牛血清白蛋白的相互作用张根成;王彦卿;张红梅;陶为华;唐树和【期刊名称】《化学世界》【年(卷),期】2006(47)12【摘要】运用荧光光谱、紫外光谱法研究了农药吡虫啉与牛血清白蛋白(BSA)的相互作用。
实验结果表明,农药分子与BSA形成基态复合物导致BSA内源荧光猝灭,猝灭机理主要为静态猝灭和非辐射能量转移。
测定了不同温度下该反应的表观结合常数KA、结合位点数n及结合热力学参数,热力学参数的变化表明上述作用过程是自由能降低的自发分子间作用过程,农药分子与BSA之间以氢键和范德华作用力为主;根据F rster能量转移理论,测得供体与受体间结合距离r与能量转移效率E;并用同步荧光技术考察了农药分子对BSA构象的影响。
【总页数】5页(P730-733)【关键词】吡虫啉;牛血清白蛋白;荧光猝灭;热力学参数;能量转移【作者】张根成;王彦卿;张红梅;陶为华;唐树和【作者单位】江苏省滩涂生物资源与环境保护重点建设实验室;盐城师范学院应用化学与环境工程研究所【正文语种】中文【中图分类】O614.61;O613.72【相关文献】1.荧光光谱法研究2-乙氧基-3-苯基喹唑啉-4-酮与牛血清白蛋白的相互作用机理[J], 孙绍发;陈才旺2.含喹唑啉酮的4-(4-氟苯基)哌嗪二硫代甲酸酯与牛血清白蛋白相互作用的荧光光谱研究 [J], 冯玉萍;曹胜利;谢文俊;李艳梅;赵玉芬3.吡虫啉与牛血红蛋白相互作用的光谱研究 [J], 周秋华;王彦卿;张红梅;张根成;费正皓;刘总堂4.荧光光谱法研究3-唑啉基叶绿素-a衍生物和牛血清白蛋白的相互作用 [J], 刘淑燕;刘春林;刘永明;王进军;刘振波5.吡罗昔康-Cu(Ⅱ)-牛血清白蛋白相互作用的荧光光谱法研究 [J], 阿娟;赵智宏;安娜;刘慧民因版权原因,仅展示原文概要,查看原文内容请购买。

光谱法研究两种抗菌类药物对牛血清白蛋白结构变化的影响王芹;张晟瑞;聂峰【期刊名称】《化学研究与应用》【年(卷),期】2014(000)008【摘要】利用荧光猝灭光谱、同步荧光光谱、三维荧光光谱、紫外-可见吸收光谱及圆二色谱法研究了磺胺甲恶唑(Sulfamethoxazole,SMX)、磺胺二甲嘧啶(Sulfamethazine,SMZ)对牛血清白蛋白(Bovine serum albumin,BSA)结构的影响。
荧光猝灭实验结果表明SMX和SMZ可以使BSA发生荧光猝灭;通过同步荧光光谱、三维荧光光谱和紫外-可见光谱实验数据定性的证实了SMX和SMZ的加入会使BSA的构象发生变化,并且通过紫外-可见光谱的实验结果可知SMX和SMZ与BSA之间的作用机理为静态猝灭。
此外,由圆二色谱法得到的定量结果可知:当SMX或SMZ与BSA之间的摩尔浓度比为4∶1时,SMX可使BSA的α-螺旋结构含量由53.77%降低到51.82%;SMZ可使BSA的α-螺旋结构含量由53.77%降低到47.59%。
%Structural changes of bovine serumalbumin(BSA)caused by sulfamethoxazole(SMX)andsulfamethazine(SMZ)were studied using fluorescence quenching spectroscopy,Synchronous fluorescence spectroscopy,three-dimensional fluorescence spectros-copy,UV-vis absorption spectroscopy and circular dichroism spectroscopy(CD). The experiment results obtained from fluorescence quenching spectra data indicated that the fluorescence intensity of BSA was quenched by the gradual addition ofSMX/SMZ;Experi-mental results obtained from the Synchronousfluorescence spectroscopy, three-dimensional fluorescence spectroscopy and UV-vis absorption spectroscopy qualitatively confirmed that the secondary structure of BSA was altered in the presence of SMX/SMZ in a-queous solution,and the quenching mechanisms of SMX/SMZ and BSA were both static quenching process confirmed by UV-vis ab-sorption spectroscopy. Furthermore,the bindings of SMX/SMZ to BSA caused the changes of protein secondary structures,with the loss of α-helical stabilities. The calculating results exhibited reductions ofα-helix structures from 53. 77%to 51. 82%and 53. 77%to 47. 59%at molar ratios SMX/SMZ to BSA of 4∶1,respectively.【总页数】7页(P1188-1194)【作者】王芹;张晟瑞;聂峰【作者单位】陕西理工学院化学与环境科学学院,陕西汉中 723000;陕西理工学院化学与环境科学学院,陕西汉中 723000;陕西理工学院化学与环境科学学院,陕西汉中 723000【正文语种】中文【中图分类】O641.3【相关文献】1.光谱法研究酒石酸乙酰异戊酰泰乐菌素与牛血清白蛋白的相互作用及Zn2+,Cu2+的影响 [J], 邓凤玉;胡涛英;周珊珊;刘颖2.光谱法研究头孢西丁钠与牛血清白蛋白的相互作用及共存金属离子的影响 [J], 刘里3.光谱法与分子对接法研究山柰酚对牛血清白蛋白二级结构的影响 [J], 林锐;李悦;裘兰兰;何华;李丽丽;何佳4.光谱法研究盐酸利多卡因与牛血清白蛋白的相互作用及共存金属离子的影响 [J], 刘里;成飞翔5.光谱法研究Fe^(3+)/Fe^(2+)离子对CS-Fe_3O_4@ZnS:Mn/ZnS磁性荧光复合纳米粒子与牛血清白蛋白相互作用的影响(英文) [J], 彭茂民;夏虹;刘丽因版权原因,仅展示原文概要,查看原文内容请购买。

第26卷第2期 吕梁高等专科学校学报2010年6月V o.l26N o.2 Journa l o f L v liang H i gher Co llege Jun.2010荧光染料探针与牛血清白蛋白作用机理的研究张改清1,2,席小莉2(1.吕梁学院化学化工系,山西离石033000;2.山西大学分子科学研究所,山西太原030006)摘 要:用荧光光谱法和UV光谱法,研究染料荧光素、铬黑T、结晶紫(C rysta lV io l e t)与牛血清白蛋白(BSA)的作用,可以给出它们在不同结合数下的生成常数,求出它们的能量转移效率、给体-受体之间的距离,进而得知一些小分子染料与蛋白质结合后所引起染料或蛋白质光谱特性的变化.因此,这些小分子染料可作为蛋白质的探针,从分子水平的角度研究蛋白质与小分子相互作用的机理,从而为生命科学研究以及药物研究提供有价值的信息.关键词:荧光染料;牛血清白蛋白;给体与受体中图分类号:O611.3 文献标识码:A 文章编号:1008-7834(2010)02-0030-06配体同生物大分子的作用是研究生命现象和药物作用机理的一个基本问题.荧光探针法是研究上述问题简单易行的方法.一些染料小分子可与蛋白质结合,引起其光谱呈现出能量转移特征,即发生荧光的加强或淬灭,而测定生物分子与某些基团(如蛋白质的芳香氨基酸到配体)之间的距离,因此常被称为 光谱尺[1].杨频等曾用此法研究了染料与多种蛋白质的作用机理[2];本文则采用UV光谱法、荧光光谱法,研究了染料荧光素、铬黑T、结晶紫(C rysta lV io let)等与牛血清白蛋白(BSA)的作用.研究结果表明,在p H=7.4的Tris-H C l缓冲溶液中它们与牛血清白蛋白(BSA)生成不同的缔合物.且应用杨频等曾导出的荧光加强效应应用于给体-受体作用的理论公式[3],求出它们在不同结合数下的生成常数,进而又研究了它们的能量转移效应、给体-受体之间的距离.1 实验部分1.1 主要仪器和试剂LS-50B(PE公司)荧光光谱仪,H P8453UV-V is紫外吸收光谱仪(H P公司),F i n npipette微量可调取液器(上海金林生化仪器厂),Beckm an -50酸度计(美国贝克曼公司),实验中所有的玻璃仪器以及吸收池、荧光池均使用1m o l/L的HNO3浸泡后用蒸馏水冲洗干净.牛血清白蛋白(Bovine Ser um A l b um in,BSA)(A.R.,S i g m a公司);Tris(三羟基氨基甲烷),盐酸,氯化钠等均为分析纯试剂,荧光素(A.R.,北京经科宏达生物技术有限公司),铬黑T(A.R.,北京经科宏达生物技术有限公司),结晶紫(A.R.,天津市方得科技有限公司),实验用水均为三次蒸馏水.1.2 溶液的配制Tris-H C l缓冲液的配制:在分析天平上准确称取0.6057g T ris,0.1755gNaC l于小烧杯中,用约80m l 三蒸水溶解,再用盐酸调溶液pH值(用B eckm an -50酸度计测量)至7.38(约7.4左右),再定容到100m l 容量瓶中,放冰箱中备用.牛血清白蛋白(BSA)的配制:在分析天平上准确称取0.067g牛血清白蛋白,用p H=7.4的T ris-HC l 缓冲液容于小烧杯中,待完全溶解后,定容到10m l容量瓶中,其浓度为1.0!10-4m ol/L的溶液(相对分子质量以66700计),4∀冰箱保存.收稿日期:2010 01 07基金项目:国家自然科学基金(N o.20971081)资助项目.作者简介:张改清(1976-),女,山西柳林人,硕士研究生,讲师,研究方向为生物无机化学.染料荧光素,铬黑T ,结晶紫(C r ystalV i o let)用三蒸水配制为1!10-4m o l/L 的溶液,配置后放冰箱中备用.1.3 实验方法1.3.1 紫外光谱测定紫外光谱使用H P8453UV -V is(H P 公司)紫外吸收光谱仪,在室温条件下,以Tris-HC l 溶剂为参比,分别取浓度为1!10-4m ol/L 的染料荧光素,铬黑T ,结晶紫(CrystalV i o let)各500 L 及1.5m l T ris-HC l 于1c m 干燥的吸收池中,用微量可调取液器,逐次滴加10 L1.0!10-4m o l/L 的BSA (最后加入滴定剂的累加体积以吸收强度不再变化为止),每次滴定中保持反应时间间隔3m i n ,测吸收光谱.记录各自的最大吸收峰变化情况.1.3.2 荧光光谱测定(1)使用LS -50B (PE 公司)荧光光谱仪测定荧光光谱,确定它们的扫描参数分别为:选荧光素的激发波长为440n m,激发狭缝为2.5n m,发射狭缝为2.5n m.选铬黑T 的激发波长为339nm ,激发狭缝为8nm,发射狭缝为6nm.选结晶紫的激发波长为303n m,激发狭缝为10n m,发射狭缝为5nm .光谱滴定在室温条件下,分别移取20 L1.0!10-4m o l/L 的染料荧光素,铬黑T ,结晶紫(CrystalV iolet)及2m l T ris-H C l1m l 于干燥的荧光池中,用微量可调取液器,逐次滴加10 L1.0!10-4m o l/LBSA (最后加入滴定剂的累加体积以荧光强度不再变化为止而定),每次滴定中保持反应时间间隔3m i n ,扫描其荧光发射谱,观察BSA 对染料发生的荧光加强或猝灭.记录每次向染料溶液中加入BSA 后得到荧光强度Fn 值(第一个点为F A ;最高点为F b ).(2)再分别移取空白Tris-H C l 缓冲液2mL 于干燥的荧光池中,用微量可调取液器,逐次滴加10 L1.0!10-4mo l/LBSA (最后加入滴定剂的累加体积与(1)中一样),每次滴定中保持时间间隔3m i n ,其它参数和(1)中一样,扫描其荧光发射谱,记录每次向空白Tris-HC l 溶液中加入BSA 后得到的荧光强度FDn 值.(3)测定牛血清白蛋白与3种染料分别为1#1(摩尔比)时缔合物的荧光发射光谱和染料的吸收光谱.图1(a) BS A 滴加荧光素的可见光谱C 荧光素=2.5!10-5m o l/L;从1至6依序为C BSA (10-6m ol/L )=0、0.498、0.990、1.478、1.961的曲线;p H =7.42 结果和讨论2.1 紫外可见吸收光谱测定结果如图1(a)、1(b)、1(c)所示:由1(a)图可见:当向荧光素溶液中加入牛血清白蛋白(BSA)时,随BSA 溶液浓度的增加,BSA 使荧光素产生了明显的减色效应[4],且随BSA 溶液浓度的增加,减色效应减弱.由1(b)图可见:当向铬黑T 溶液中加入牛血清白蛋白(BSA )时,随BSA 溶液浓度的增加,BSA 使铬黑T 产生了明显的增色效应,最大吸收峰位未见明显移动,仍在278nm 处.由1(c)图可见:当向结晶紫(C rysta lV io l e t)溶液中加入牛血清白蛋白(BSA )时,随BSA 溶液浓度的增加,BSA 使结晶紫产生了明显减色效应[4],最大吸收峰位未见明显移动,仍在303nm 处.图1(b) BSA 滴加铬黑T 的紫外光谱C 铬黑T =2.5!10-5m ol/L ;从1至7依序为C BSA (10-6m ol/L)=0、0.498、0.990、1.478、1.961、2.439、2.913的曲线;p H =7.4图1(c) BSA 滴加结晶紫的紫外光谱C 结晶紫=2.5!10-5mo l/L ;从1至7依序为C BS A (10-6mol/L)=0、0.498、0.990、1.478、1.961、2.439、2.913的曲线;p H =7.42.2 牛血清白蛋白(BSA )与染料在不同结合数下的生成常数测定荧光光谱如图2(a)、2(b)、2(c)所示,当BSA 中加入染料时出现荧光加强效应.说明传能过程是主要过程.按杨频等推导荧光加强效应应用于给体-受体作用的理论公式[5]:F=F-F D(1)M b =M t ( F-F A )/(F b -F A )(2)( F-F A )-1=(F b -F A )-1(1+1/K A (nP t -M b ))(3)图2(a) BSA 滴加铬黑T 的荧光光谱!ex =339nm,C 铬黑T =1.0!10-6m ol/L ;从1至5为C BSA (10-6mo l/L )=0、0.98、1.94、2.88、3.81的曲线图2(b) BS A 滴加结晶紫的荧光光谱!ex =303nm,C 结晶紫=1.0!10-6mol/L ;从1至5为C B SA (10-6mo l/L )=0、0.98、1.94、2.88、3.81的曲线图2(c) BS A 滴加荧光素的荧光光谱!ex =440n m,C 荧光素=1.0!10-6mo l/L ;从1至5为C BSA (10-6m ol/L)=0、0.98、1.94、2.88、3.81的曲线其中F 是在牛血清白蛋白(BSA )溶液中加入染料后体系的荧光强度;F D 是自由牛血清的荧光强度;F A 是自由染料的荧光强度;F b 是键合到牛血清白蛋白(BSA )上的染料对荧光的贡献.M b 为键合到牛血清上的染料浓度,M t 为染料总浓度,P t 为牛血清白蛋白(BSA)的总浓度,K A 为生成常数,n 为牛血清白蛋白(BSA)(P)与染料(M )成键时的相互独立且等同的键合位置数.根据向染料溶液中逐次加入BSA 后得到荧光强度F n 值(第一个点为F A ;最高点为F b ),然后逐点减去向空白T ris-H C l 溶液中加入BSA 得到的荧光强度F D n ,由式∃及染料浓度M t ,可求得不同F n 值下的M b ,求出加入不同量BSA 溶液后的P t 值.按式%,以(nP t -M b )-1作横轴变量、( F -F A )-1作纵轴变量、并设n =2和4作图,如图3(a)、3(b)、3(c)所示,得到良好的直线,线性相关系数C 列于表1.由直线斜率为(F b -F A )-1!K A -1,可算得染料与BSA 的生成常数K A 列于表1.图3(a) 结晶紫与BS A &n=2,∋n=4的双倒数图2.3 能量给体-受体间距离的测定最大激发波长荧光素选440nm ,铬黑T 选339nm,结晶紫选303nm 测定它们的荧光发射光谱,观察了染料在加入BSA 时荧光强度变化,结果表明加入BSA 后出现荧光加强效应[6].为了论证给体-受体间是否发生了能量转移,我们固定激发波长,测定了BSA 与三种染料分别为1#1(摩尔比)时缔合物的荧光发射光谱和染料的吸收光谱,将测得的缔合物的荧光发射光谱和染料的吸收光谱绘在同一图中如图4(a)、4(b)、4(c)所示两者间发生了重叠,说明给体-受体间发生了能量转移[3].图3(b) 铬黑T 与BS A &n=2,∋n=4的双倒数图图3(c) 荧光素与BSA &n=2,∋n=4的双倒数图图4(a) (&)BSA 的荧光发射谱与(∋)荧光素的吸收谱之间的光谱重叠图4(b) (&)BS A 的荧光发射谱与(∋)结晶紫的吸收谱之间的光谱重叠图4(c) (&)BS A 的荧光发射谱与(∋)铬黑T的吸收谱之间的光谱重叠根据Forster 型偶极-偶极无辐射能量转移机理[5],转移效率E 与给体-受体间距离r 及临界能量转移距离R 0有关:E =R 06/(R 06+r 6)(4) 其中R 0是能量转移效率为50%时的临界距离:R 06=8.8!10-25(K 2n -4J D )(5)式中:K 2为偶极空间的取向因子,n 为介质的折射指数, D 为给体的光量子产率,J 为给体(牛血清白蛋白(BSA ))的荧光发射光谱与受体(染料)的吸收光谱间的光谱重叠积分,可表示为J =(F D (∀)#A (∀)∀-4∀/(F D (∀) ∀(6) 其中:FD (∀)为荧光给体(牛血清白蛋白(BSA ))在波数为∀的荧光强度,#(∀)为受体(染料)在波数为∀的摩尔消光系数,能量转移效率亦可由下式测定:E =1-F /F 0(7)其中:F和F0分别为能量接受体存在和不存在时能量给予体的荧光发射强度,显然,只要得知E,K2, D,和n并通过实测光谱求出积分J,就可算出R0和r.由图4,结合式(6),把光谱重叠部分分割成极小的矩形面积求积分,分别算得BSA与3种染料相互对应的重叠积分J值如表1.以色氨酸为标准物( D=0.14[7])、用相同的激发波长和仪器参数,用相对法测定牛血清白蛋白(BSA)中色氨酸的量子产率 D=0.118,折射参数n取水和有机物的平均值1.336,取向因子取给体-受体各向随机分步的平均值K2=2/3.以上各量代入式),分别得到牛血清白蛋白(BSA)和3种染料相互间的能量转移距离R0如表1.能量转移效率的测定,利用前面测定的牛血清白蛋白(BSA)与染料摩尔比为1#1的缔合物的荧光强度,按式∗算得能量转移效率E值如表1.于是,由R0和E、按式+分别得到BSA与染料分子的距离r如表1.表1 三种染料与BS A的生成常数、结合位置数、作用距离、能量转移效率和线性相关系数染料K A(n=2)C K A(n=4)C KA (2)/KA(4)J(10-14)R(A)E r(A)结晶紫3.372!1060.99844.139!1060.99870.811.6326.60.1236.8荧光素1.052!1060.99941.049!1060.99951.008.9135.30.2734.9铬黑T0.255!1050.99800.187!1050.99821.360.6022.50.1331.1 3 结论牛血清白蛋白有两个色氨酸残基,它们都可能与染料分子发生结合能量转移[7].从三种染料对牛血清的荧光光谱来看,它们有着类似的作用,它们的生成常数均在105以上,据此可说明它们的结合较牢固.同时得到线性相关系数C,由表1可看出n=2时C在0.9980-0.9994之间;n=4时C在0.9982-0.9987之间.从生成常数大小来看:结晶紫的K A(2)和K A(4)大于荧光素的K A(2)和K A(4)大于铬黑T的K A(2)和K A(4);但能量转移效率却是E荧光素>E铬黑T>E结晶紫.可见结合的稳定程度与能量转移并不成正比关系.从表1数据可见结晶紫与牛血清白蛋白(BSA)的给体-受体作用距离r(A)明显大于荧光素和铬黑T 与牛血清白蛋白(BSA)的相应距离;而能量转移效率E前者明显小于后者,表明给体-受体作用距离的增加,会大大降低能量转移效率.说明能量转移效率是和相互之间的距离成正比.通过以上几个方面的分析得知:一些小分子染料与蛋白质结合[8],可引起染料或蛋白质光谱特性的变化,因此可作为蛋白质的探针[9,10],从而可以从分子水平认识蛋白质与小分子相互作用的机理,为生命科学研究以及药物研究提供有用的信息.参考文献:[1]Stryer L,H au land R.P.Enger transfe r:A spectroscopic ru l e r[J].P ro.l N at.l A cad.Sc,i1967,58:719.[2]YANG M an m an,YANG P in,X I X iao l.i Bond i ng bet ween fl uo rescence dyes and pro tein[J].K exue T ongbao(Chi nese Science Bulleti n),1997,42:1276.[3]Y ang P in,Y ang M an m an,Y ang B i nsheng.T he F luorescence enhancem ent and the acti on be t w een donor and acceptor[J].Chi neseJou rna l of Chem istry,1996,14(2):109-113.[4]H assel barth A,Eych m ull e r A,E ichbe rger R,et al.Che m i stry and photophysics o f m i xde CdS/H gS co ll o ids[J].Phys Chem,1993,(97):5333-5340.[5]杨 频.生物无机化学导论[M].西安:西安交通大学出版社,1991:163-164.[6]李 军,袁 航,赵 奎,等.Cd T e纳米晶与蛋白相互作用研究[J].高等学校化学学报,2003,24(7):1293-1295.[7]杨曼曼,杨 频,张立伟.荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31-35.[8]高 峰,朱昌青,汪乐余,王 伦.灿烂甲酚蓝与表面活性剂的作用及其在蛋白质测定中的应用[J].分析化学,2002,30(3):324-326.[9]冯喜增,金瑞祥,曲 芸,何锡文.各种离子对血卟啉与牛血清白蛋白相互结合反应的影响研究[J].高等学校化学学报,1996,17(6):866-869.[10]俞 英,廖 尖,黄发德.牛血清白蛋白与酸性铬兰K结合反应的研究[J].光谱学与光谱分析,2002,22(6):1067-1069.St udy on the M echanis m of Interaction of F luorescence Dye wit h Bovine Seru m Albu m inZ HANG G ai-q i n g1,2,X I X i a o-li2(1.D epart m ent of Che m istry and Che m ical Eng i n eering,Lvliang C ollege,L is h i Shanx i033000China;2.Instit u te of M o lecular Science,Shanx i Universit y,Taiyuan Shanx i030006,China)Abst ract:In t h is article,the i n teracti o ns m echan is m o f dye Fluoresce i n,E riochro m e B lack T andM e t h ylV i o letw ith Bovine Ser um A l b um i n have been stud ied by m eans of fl u orescence spectrum and UV spectru m,and the assoc iation constant w ith different bi n ding num bers has a lso been obta i n ed;Further m ore,we have also got the energy transfer ring efficiency and t h e d i s tance o f dono r and acceptor.Thus w e can understand the i n teracti o ns m echanis m o f pro tein and s m allm o lecu le fro m the perspective ofm o lecular level and then provide useful i n for m ation for life science research and m ed i c i n e researchK ey w ords:fluorescence dyes;BSA;donor and accepto r(上接第23页)电位差计法测电动势和内电阻的实验优点是可以不从被测对象中取用电流而消耗其能量,测量结果稳定可靠,结果相当精确.但电位差计法测内电阻需要一个校准的过程,步骤繁琐,且数据处理比较麻烦.参考文献:[1]冯国进.测量电源电动势的一种简易方法[J].大学物理实验,2003,16(4).[2]杨述武.普通物理实验(直流电路部分)[M].北京:高等教育出版社,2000.[3]周 清.关于运用探究式方法进行物理实验教学的探索[J].大学物理实验,2002,15(1).[4]拾景忠.精确测量电压电动势和内电阻[J].物理实验,2003,(5).[5]程川吉.物理实验电源电动势和内阻的测量[M].北京:高等教育出版社,1995.[6]蔡颂仪.伏特计-安培计测电阻与补偿测电压[J].物理实验,1993,13(5):210-213.[7]黄绍书. 电桥伏安法测电池电动势和内阻[J].物理实验,1997,18(1):15.Co m parison and Analysis on severalM ethodsU sed inM easuri n gthe Power E lectro m otive Force and t he Internal ResistanceZHANG Jin-ai(D epart m ent of Phy sics,Lvliang C ollege,L is h i Shanx i033000,China)Abst ract:By co m pari n g and ana l y sing severalm ethods uesd in m easuring E lectro m oti v e Force and I n ter nal resist ance Vo lta mm etry such as Vo lta mm etr y,E lectric B ri d ge Vo lta mm etry,Oscill o graphy and Potenti o m eter m ethod etc. fro m the aspects of experi m enta l pri n ciple and experi m enta l data,t h e paper conc l u des their respecti v e advantages and d isadvantages thus expects to instruct practicalw ork.K ey w ords:electro m oti v e force;i n ternal resistance;co m parisi o n;analysis。
以草甘膦,马拉毒死蜱为模型研究有机磷农药与牛血清白蛋白的相互作用王珊;高奕红【摘要】利用了荧光发射光谱,同步荧光光谱,紫外吸收光谱进行了检测,研究有机磷农药(草甘膦和马拉硫磷)与牛血清白蛋白的相互作用,实验结果表明了有机磷农药对牛血清白蛋白有着明显的荧光猝灭作用,且方式为静态猝灭(BSA荧光分子与猝灭剂有机磷农药之间通过弱的结合生成复合物,该复合物会使得荧光完全猝灭的现象)为主.通过实验得出有机磷与牛血清白蛋白的结合位点数(n),与结合常数(K0).【期刊名称】《化工科技》【年(卷),期】2015(023)002【总页数】5页(P27-31)【关键词】荧光光谱;紫外光谱;相互作用;牛血清白蛋白【作者】王珊;高奕红【作者单位】咸阳师范学院化学与化工学院,陕西咸阳712000;咸阳师范学院化学与化工学院,陕西咸阳712000【正文语种】中文【中图分类】O657.3血清白蛋白是血浆中丰富的载体蛋白,可与许多内源、外源性化合物相结合[1],而结构剖析比较成熟的蛋白质是牛血清白蛋白(bovine serum alhumin,BSA),是研究蛋白质与小分子的相互作用的对象;研究农药与牛血清白蛋白之间的结合作用,有利于深入了解农药对人、畜的中毒机制,对科学使用农药具有重要意义,也为药物残留检测过程中提取液的选择提供理论依据。
有机磷农药是一类施用的非常广泛的农药,使用后会严重影响植物和水生生物的生长,从而对人类的健康构成威胁[2]。
但是关于有机磷-蛋白质相互作用的报道还非常少[3-6]。
作者以有机磷药物草甘膦,马拉·毒死蜱为例,研究有机磷与BSA相互作用。
1 实验部分1.1 试剂与仪器牛血清白蛋白:分析纯,百灵威试剂公司;草甘膦铵盐(质量分数30%):分析纯,镇江江南化工有限公司;马拉·毒死蜱(质量分数25%):分析纯,浙江新安化工集团股份有限公司。
SPECORD 50型紫外可见吸收光谱:德国耶拿公司;RF-5301型荧光分光光度计:日本岛津公司。
光谱法研究几种中药小分子与牛血清蛋白相互作用的开题报告一、研究背景随着中药学的发展,越来越多的中药被用于治疗不同种类的疾病。
中草药中的小分子化合物是其起作用的重要成分,这些化合物能够与蛋白质相互作用,从而影响生物体内相关的生物过程。
因此,研究小分子与蛋白质之间的相互作用对于深入了解中草药的作用机理具有重要意义。
牛血清蛋白是一种具有免疫调节和免疫调控功能的重要蛋白质,其在免疫学、药学等领域得到广泛应用。
研究小分子与牛血清蛋白的相互作用可以为新药物的研发提供有价值的信息。
光谱法是一种常用的研究小分子与蛋白质相互作用的方法。
光谱法既包括吸收光谱、荧光光谱,还包括紫外光谱、红外光谱等。
因此,通过光谱法研究几种中药小分子与牛血清蛋白相互作用,可以为深入研究中草药的作用机理和新药物的研发提供有价值的信息。
二、研究目的本研究旨在通过光谱法研究几种中药小分子与牛血清蛋白相互作用,探究其相互作用机理。
三、研究内容及方法1. 研究内容本研究将选择几种中药中的小分子化合物,通过光谱法研究其与牛血清蛋白的相互作用,包括吸收光谱、荧光光谱、紫外光谱、红外光谱等。
2. 研究方法(1)实验药物的制备和检测:选择几种中药中的小分子化合物作为实验药物,制备不同浓度的药物溶液,并经过不同的检测方法鉴定纯度。
(2)蛋白质的制备和检测:采用牛血清蛋白作为研究对象,制备不同浓度的蛋白质溶液,并经过不同的检测方法鉴定纯度。
(3)光谱法研究:将实验药物和蛋白质混合后进行光谱法研究,包括吸收光谱、荧光光谱、紫外光谱、红外光谱等。
通过比较药物与蛋白质混合后的光谱和单独的药物和蛋白质的光谱,探究其相互作用机理。
四、研究意义本研究可以从光谱学的角度,对几种中草药中的小分子化合物与牛血清蛋白的相互作用进行研究,为深入了解中草药作用机理及新药物的研发提供有益的参考。
此外,本研究的结果也有助于推动中草药的现代化、产业化及国际化发展。
收稿日期:2008210222 修回日期:2009203213基金项目:江西省教育厅基金(JJ2007218)3通讯联系人:李来生,男,博士,教授,研究方向为色谱及生物化学分析.第25卷第6期Vol.25 No.6分析科学学报J OU RNAL OF ANAL YTICAL SCIENCE 2009年12月Dec.2009文章编号:100626144(2009)0620652205荧光光谱法研究除草醚与牛血清白蛋白的相互作用金艳红,李来生3,黄丽芳,陈会明(南昌大学分析测试中心,江西南昌330047)摘 要:运用荧光光谱和紫外吸收光谱研究水溶液中除草醚(N P )与牛血清白蛋白(BSA )的相互作用。
结果表明,N P 与BSA 形成基态复合物导致BSA 内源荧光猝灭,猝灭机理主要为静态猝灭和非辐射能量转移。
运用位点模型计算298K 、308K 、318K时结合常数K A 分别为6.97×104、5.25×104、4.96×104L ・mol -1,结合位点数n 分别为0.98、0.92、0.96。
根据热力学参数确定其作用力以疏水作用和静电作用为主;运用F rster 偶极2偶极非辐射能量转移原理,测定了N P 与BSA 的结合距离r 为2.19nm ;用同步荧光技术初步考察了N P 对BSA 构象的影响。
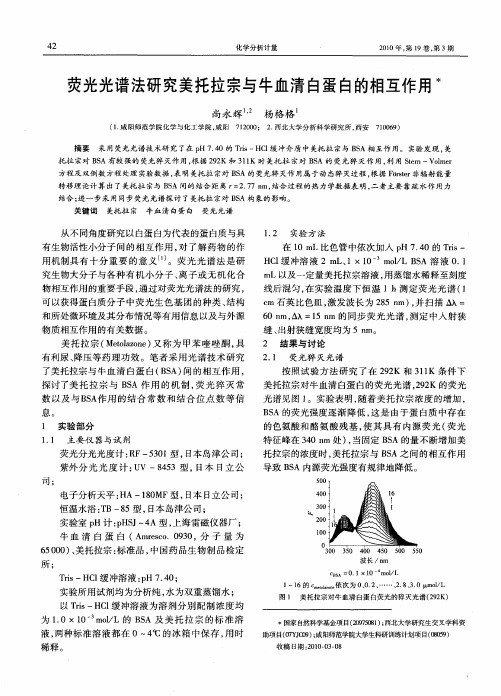
关键词:荧光光谱法;紫外光谱法;除草醚;牛血清白蛋白;相互作用中图分类号:O657.39 文献标识码:A除草醚(Nit hop hen ,N P )是一种选择触杀型除草剂,可有效防除水稻、高粱、玉米及大豆等作物田中一年生阔叶及禾本科杂草。
该药可用于播前土壤处理或芽前苗后直接使用,选择性高、药效好、持效期久[1]。
除草醚被人体吸入、摄入或经皮肤吸收后可引起中毒,患者可出现高铁血红蛋白血症、溶血性贫血和黄疸等。
且对眼睛和皮肤有刺激作用,对皮肤有一定的致敏作用。
该除草剂对环境的污染越来越严重,已对人体健康构成威协。
牛血清白蛋白为球形蛋白,等电点是4.7,它为一个氨基酸链,通过17个二硫键形成9个双环。
研究除草醚与血清蛋白的作用,有助于阐明这类农药的作用机制,了解其对人类健康的危害性。
有关除草醚与BSA 的相互作用研究尚未见报道。
本文运用荧光光谱(FS )、紫外可见光谱(UV/Vis )研究了除草醚与BSA 的相互作用,计算了除草醚与BSA 结合时的作用距离r ,表观结合常数K A 和结合位点数n ,从热力学参数推得农药除草醚与BSA 分子间作用力类型等分子作用信息,探讨了除草醚对BSA 构象的影响,试图从分子水平了解蛋白质分子与小分子间相互作用机制,了解其在体内的运输和分布情况,为生命科学研究提供有用的信息和数据。
1 实验部分1.1 主要仪器与试剂F 23010型荧光分光光度计(日本,日立公司);UV 22501PC 型紫外2可见光谱仪(日本,岛津公司);Y J 501型超级恒温器(上海跃进医疗仪器厂)。
BSA 溶液:准确称取0.066g BSA (上海长阳技术公司)于100mL 容量瓶中,以Tris 2HCl 溶液定容到100mL ,浓度为1.0×10-5mol ・L -1,4℃以下保存;除草醚(天津东方绿色技术发展公司):用Tris 2HCl 缓冲溶液配成浓度为3.52×10-5mol ・L -1的储备液,避光保存备用;0.05mol ・L -1(p H =7.4)的Tris 2HCl 缓冲溶液;0.1mol ・L -1的NaCl 溶液。
三羟甲基氨基甲烷(Tris )、HCl 、NaCl 等均为分析纯试剂。
实验用水为二次重蒸水,经检测无荧光杂质。
256第6期分析科学学报第25卷1.2 实验方法在5mL 比色管中,依次加入1mL 的NaCl 和1mL 的BSA ,然后加入一定量的除草醚,用缓冲溶液定容至5.0mL ,设激发波长为285nm ,狭缝宽度为5nm ,在295~450nm 范围内扫描BSA 在除草醚作用下的荧光猝灭光谱,及25℃、35℃和45℃下BSA 的荧光光谱,同时扫描同步荧光光谱和除草醚的紫外吸收光谱。
2 结果与讨论2.1 除草醚对BSA 的荧光猝灭光谱与猝灭机制BSA 分子中因含有色氨酸、酪氨酸等氨基酸残基而能发射较强的内源荧光。
在本实验条件下,测得BAS 的最大激发波长λex 为285nm ,最大发射波长λem 为336nm 。
除草醚分子中的芳环间含可旋转的单图1 除草醚对BSA 的荧光光谱Fig.1 Fluorescence spectra of BSA with differ 2ent concentration of nithophenc NP :a →g :0,1.408,2.816,4.224,5.632,7.04,8.448×10-6mol ・L -1;T =308K;p H =7.4.键,在实验条件下,它本身无荧光,但与BSA 结合后能猝灭BSA 的内源荧光。
2.1.1 荧光猝灭光谱 25℃、35℃和45℃选择不同温度条件,分别测定除草醚对BSA 的荧光猝灭光谱。
实验时固定BSA 的浓度,逐渐增大除草醚的浓度,测体系的荧光强度。
在25℃下,除草醚对BSA 的荧光猝灭光谱图见图1。
2.1.2 荧光猝灭机理探讨 激发态反应、分子重组、能量转移、形成基态复合物以及碰撞等过程可产生荧光猝灭现象。
荧光猝灭过程一般可分为动态猝灭和静态猝灭两种。
动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用过程,主要依赖于分子扩散;静态猝灭是猝灭剂和荧光物质分子在基态时生成不发荧光的配合物,从而导致荧光物质荧光强度降低的过程。
动态猝灭作用过程遵循Stern 2Volmer 方程[2]:F 0/F =1+K q τ0c =1+K SV c(1)式中,F 0为未加入猝灭剂时荧光物质的荧光强度;F 为猝灭剂浓度等于c 时荧光物质的荧光强度;K q 为动态荧光猝灭速率常数,L ・(mol ・s )-1;τ0为没有猝灭剂存在下荧光分子的平均寿命(生物大分子的τ0约为10-8s )。
若猝灭过程为静态猝灭,则应符合Lineweaver 2Burk 方程[2]:(F 0-F )-1=F -10+K -1LB F -10c -1(2)式中:K LB 为静态荧光猝灭结合常数,mol ・L -1。
将除草醚对BSA 的猝灭数据按式1处理作图(图2),并根据方程2绘制相互作用曲线图。
对实验数据进行线性拟合得到直线方程、相关系数等见表1。
其线性相关系数均达0.9951以上;由表1得到相应的猝灭常数值(K SV 值)见表2,再由K sv =K q τ0式得到相应的猝灭速率常数值均远大于2.0×1010L/(mol ・s )。
这初步说明NP 对BSA 的荧光猝灭不是由于动态碰撞引起的,而是与BSA 之间形成了基态复合物所产生的静态猝灭。
而且一般情况下动态与静态猝灭可以依据不同温度下的结果来区别,若是静态猝灭则温度升高将降低复合物的稳定性,使猝灭常数减小。
根据表1可求出298K 、308K 时的静态荧光猝灭结合常数K LB 分别为8.26×104、8.12×104mol ・L -1。
再由图2可看出,在选定的浓度范围内,随着温度升高,猝灭曲线的斜率降低,即温度升高猝灭常数呈降低趋势,表明除草醚对BSA 的荧光猝灭机理为静态猝灭。
表1 回归方程和相关系数T able 1 R egression equ ations and correlation coeff icientT (K )Regression equations R 298F 0/F =1.016+7.962×104c 0.9990308F 0/F =1.023+4.802×104c 0.9951318F 0/F =1.018+3.992×104c 0.9966298(F 0-F )-1=1.292×10-3+1.565×10-8c -10.9997308(F 0-F )-1=1.170×10-3+1.442×10-8c -10.9956356第6期金艳红等:荧光光谱法研究除草醚与牛血清白蛋白的相互作用第25卷2.2 结合常数与热力学参数对于静态猝灭过程而言,假设蛋白质上存在n个等同的独立的结合位点,可以用以下方程来计算结合常数K A和结合位点数n[3]。
log[(F0-F)/F]=log K A+n log[Q](3) 以log[(F0-F)/F]对log[Q]作图(图3),可得到不同温度下的结合位点数。
在298K、308K、318K 三个温度下,固定蛋白质的浓度而改变N P浓度进行荧光滴定,根据方程式3线性拟合计算结合常数与结合位点数(见表2)。
由图3可以看出其有着良好的线性关系(所有曲线的线性相关系数都在0.996~0.999之间),表明只有一个结合位点,这与所假设的结合位点数一致。
当温度变化不太大时,反应的焓变可看作一个常数,根据Van’t Hoff定律ln K=-△HθR T+△Sθ/R(4)△Gθ=△Hθ-T△Sθ(5)式中,K为对应温度下的结合常数,R为气体常数。
由ln K对1/T[4-6]作图,由斜率与截距分别可以计算出焓变,熵变,再由式(5)可以计算出反应的自由能变化。
将不同温度的ln K对1/T作图(未列出),求得除草醚与蛋白质相互作用的热力学常数,结果列于表2。
表2 NP2BSA体系的键合参数及热力学参数T able2 The binding parameters and thermodynamic parameters of NP2BSAT(K)K SV(L・mol-1)K A(L・mol-1)n△Gθ(kJ・mol-1)△Hθ(kJ・mol-1)△Sθ(J・mol-1・K-1)2987.96×104 6.97×1040.98-27.54308 4.80×104 5.25×1040.92-28.02-13.4647.26 318 3.99×104 4.96×1040.96-28.49图2 NP与BSA作用的Stern2V olmer曲线Fig.2 Stern2V olmer curves of the interaction be2 tw een nithophen and BSA 图3 BSA2NP体系log[(F02F)/F]和log[NP]关系图Fig.3 Logarithmic plots of fluorescence quenching of BSA in the presence of NP2.3 除草醚与BSA之间作用力类型蛋白质与小分子之间主要通过氢键、疏水作用力、范德华力、静电力等相互作用。