实际气体状态方程
- 格式:doc
- 大小:354.00 KB
- 文档页数:21

实际气体的范德华方程
范德华方程是描述气体状态的重要方程之一,它是由荷兰物理学家范德华于1873年提出的。
范德华方程是一种理想气体状态方程的修正,它考虑了气体分子之间的相互作用力,因此适用于实际气体的状态描述。
范德华方程的形式为:
(P + a(n/V)²)(V - nb) = nRT
其中,P是气体的压强,V是气体的体积,n是气体的摩尔数,R 是气体常数,T是气体的温度,a和b是范德华常数,它们是气体分子之间的相互作用力的参数。
范德华方程中的第一项(P + a(n/V)²)是修正因子,它考虑了气体分子之间的吸引力,这种吸引力会使气体分子之间的距离变小,从而导致气体的压强增加。
第二项(V - nb)是修正因子,它考虑了气体分子之间的斥力,这种斥力会使气体分子之间的距离变大,从而导致气体的体积减小。
范德华方程的应用范围很广,它可以用来描述各种气体的状态,包括液态和固态下的气体。
范德华方程的优点是可以考虑气体分子之间的相互作用力,因此可以更准确地描述实际气体的状态。
但是,范德华方程的缺点是计算比较复杂,需要知道气体的范德华常数,
这些常数通常需要通过实验测量得到。
范德华方程是一种重要的气体状态方程,它可以更准确地描述实际气体的状态。
在实际应用中,我们需要根据具体情况选择合适的气体状态方程,以便更好地描述气体的状态。

实际气体状态方程随着实验精度的提高,人们发现实际气体有着与理想气体不同的性质,如体积变化时内能也发生变化、有相变的临界温度等(见相和相变)。
实际气体的分子具有分子力,即使在没有碰撞的时刻,分子之间也有相互作用,因而其状态的变化关系偏离理想气体状态方程。
只是在低压强下,理想气体状态方程才较好地反映了实际气体的性质,随着气体密度的增加,两者的偏离越来越大。
常为人们引用的实际气体状态方程为范德瓦耳斯方程和H.开默林-昂内斯所提出的级数形式的方程。
18世纪,D.伯努利提出了气体分子的刚球模型,考虑到分子自身体积的影响,把气体状态方程改为p(V-b)=RT的形式。
1873年.范德瓦耳斯假设气体分子是有相互吸引力的刚球,作用力范围的半径大于分子的半径。
气体分子在容器内部与在容器壁处受到的力不同,相当于气体的压强p┡比容器对气体所施加的外压强 p要大一些,为p┡=p+p',p'叫气体的内压强。
这个附加的压强与体积V 的二次方成反比,a是一个常量。
再考虑分子自身的体积及平均自由程在分子运动中的作用把状态方程修改成:[P+a(n/v)2](V-nb)=nRT实式中b也是一常数。
a、b都要由实验确定。
实验上测定a和b的方法很多,例如在一定温度下,测定两个已知压强对应的体积值,便可由范德瓦耳斯方程定出a和b的值。
表中列出了一些常见气体的a、b的实测值。
范德瓦耳斯方程能较好地给出高压强下实际气体状态变化的关系,而且推广后可以近似地应用到液体状态。
它是许多近似方程中最简单和使用最方便的一个。
开默林-昂内斯提出了一个按体积V的负幂次展开的级数形式的气体方程:式中A、B、C…都是温度的函数,并与气体的性质有关。
他把这些系数分别叫做第一、第二、第三、……维里系数。
这是实际气体状态方程最完全的形式。
1937年,.迈尔用集团展开的办法求得了各级维里系数的表达式,从而完全解决了实际气体状态方程问题(见维里定理[1] )。

真实气体状态方程公式咱们来聊聊真实气体状态方程公式哈。
先得搞清楚,啥是真实气体状态方程公式呢?简单说,就是用来描述真实气体行为的一个数学表达式。
不像理想气体那么简单,真实气体可复杂多啦!咱就拿日常生活中的事儿来说吧。
有一次我去给车胎打气,就想到了这真实气体状态方程公式。
车胎里的气体可不是理想的,它会受到各种因素影响。
就像温度、压力,还有气体分子之间的相互作用,这些都得考虑进去。
咱们平时学的理想气体状态方程 PV=nRT,在处理真实气体的时候就不太准啦。
真实气体状态方程得修正一下,常见的有范德瓦尔斯方程、维里方程等等。
范德瓦尔斯方程(P + a(n/V)^2)(V - nb) = nRT 这里面的 a 和 b 就是修正参数,可别小看这俩参数,它们能让方程更贴近真实气体的情况。
比如说,a 反映了分子间的吸引力。
想象一下,气体分子就像一群调皮的孩子,有时候它们会互相拉一把,这就影响了气体的行为。
b 呢,则考虑了分子本身的体积。
分子可不是没有大小的点,它们也占地方,这就得在方程里体现出来。
再说说维里方程,它展开来是 P = RT(1 + B/V + C/V^2 +...) 这里的B、C 等等也是修正系数。
那这些方程在实际中有啥用呢?比如说在化工生产中,要控制反应条件,就得准确知道气体的状态。
还有在能源领域,研究燃气轮机的工作效率,也离不开对真实气体状态的精确描述。
回到开头我给车胎打气的事儿。
要是不了解真实气体状态方程,盲目打气,可能车胎就承受不住压力出问题啦。
总之,真实气体状态方程公式虽然有点复杂,但它在我们生活和各种科学技术领域中都有着非常重要的作用。
咱得好好琢磨琢磨,才能更好地理解这个世界里气体的奥秘!。


实际气体状态方程式1.范德瓦尔方程式2.R-K方程(*)3.维里方程(*)…范德瓦尔方程式按照理想气体状态方程式,定质量气体等温变化时p V=常数(或pv=常数),但实际气体仅在压力较低,温度较高的情况下近似满足此关系。
试验证明,气体的压力愈高、温度愈低,这一偏差愈大。
因此需要适用于实际气体的状态方程式来描述气体p-v-T之间的关系。
最早的实际气体状态方程式是1873年范德瓦尔(Van der Wals)提出的方程式。
他针对理想气体的两个基本假设,对理想气体状态方程式进行了修正,提出了实际气体的范德瓦尔方程式:(2-17)式中的常数a和b叫做范德瓦尔常数,与分子的大小和相互作用力有关,随物质不同而异,可由实验方法确定。
是考虑到分子之间吸引力的修正值,b是考虑到分子本身所占有体积的修正值, V m为比摩尔体积,即1mol气体的体积。
范德瓦尔方程式是从理论分析得出的。
如果把式(2-17)与理想气体状态方程式作一比较即可看出,比摩尔体积V m愈大,则两者之间的差别就愈小。
随着压力的降低与温度的升高,气体比体积增大。
因此,当压力愈低,温度愈高时,实际气体的性质愈接近于理想气体。
范德瓦尔方程式比理想气体状态方程式有了显著的进步,对于离液态颇远的气体,即使压力很高,也能得到较准确的结果,但对于较易液化的气体就显得不很准确,对于接近液态的气体,例如水蒸汽,即使在不怎么高的压力下已可见到很显著的误差。
范德瓦尔方程式仍不能在量上正确反映实际气体状态参数间的关系,不宜作为工程计算的依据。
范德瓦尔方程式的价值在于能近似地反映实际气体性质方面的特征,并为实际气体状态方程式的研究开拓了道路。
百多年来,有不少的学者,通过长期的理论分析和实验研究,提出了多种不同的状态方程式。
如R-K方程、BWR方程、M-H方程、维里型方程,等等。
这些状态方程式可归结为理论型、半经验型和通用型三类,但由于各种不同气体存在着不同的分子间聚集态,分子间力的变化又是错综复杂的,故很难用既合理又简单的方程适合所有物质和不同聚集态。

实际气体状态方程式1.范德瓦尔方程式2.R-K方程(*)3.维里方程(*)…范德瓦尔方程式按照理想气体状态方程式,定质量气体等温变化时p V=常数(或pv=常数),但实际气体仅在压力较低,温度较高的情况下近似满足此关系。
试验证明,气体的压力愈高、温度愈低,这一偏差愈大。
因此需要适用于实际气体的状态方程式来描述气体p-v-T之间的关系。
最早的实际气体状态方程式是1873年范德瓦尔(Van der Wals)提出的方程式。
他针对理想气体的两个基本假设,对理想气体状态方程式进行了修正,提出了实际气体的范德瓦尔方程式:(2-17)式中的常数a和b叫做范德瓦尔常数,与分子的大小和相互作用力有关,随物质不同而异,可由实验方法确定。
是考虑到分子之间吸引力的修正值,b是考虑到分子本身所占有体积的修正值。
范德瓦尔方程式是从理论分析得出的。
如果把式(2-17)与理想气体状态方程式作一比较即可看出,比摩尔体积V m愈大,则两者之间的差别就愈小。
随着压力的降低与温度的升高,气体比体积增大。
因此,当压力愈低,温度愈高时,实际气体的性质愈接近于理想气体。
范德瓦尔方程式比理想气体状态方程式有了显著的进步,对于离液态颇远的气体,即使压力很高,也能得到较准确的结果,但对于较易液化的气体就显得不很准确,对于接近液态的气体,例如水蒸汽,即使在不怎么高的压力下已可见到很显著的误差。
范德瓦尔方程式仍不能在量上正确反映实际气体状态参数间的关系,不宜作为工程计算的依据。
范德瓦尔方程式的价值在于能近似地反映实际气体性质方面的特征,并为实际气体状态方程式的研究开拓了道路。
百多年来,有不少的学者,通过长期的理论分析和实验研究,提出了多种不同的状态方程式。
如R-K方程、BWR方程、M-H方程、维里型方程,等等。
这些状态方程式可归结为理论型、半经验型和通用型三类,但由于各种不同气体存在着不同的分子间聚集态,分子间力的变化又是错综复杂的,故很难用既合理又简单的方程适合所有物质和不同聚集态。

实际气体状态方程
实际气体状态方程(actua1gasequationofstate)是指一定量实际气体达到平衡态时其状态参量之间函数关系的数学表示。
理想气体完全忽略气体分子间的相互作用,不能解释分子力起重要作用的气液相变和节流等现象。
理想气体状态方程只对高温低密度的气体才近似成立,对物质状态的大部分区域都不适用。
物质的量为1时,(p+a/-2)(V-b)=RT
物质的量为n时,[p+a(n∕V)2](V-nb)=nRT
压力修正项:真是气体分子之间是有引力的,当分子处于系统内部时,分子与周围分子的作用力对称,可以相互抵消,其合力为零。
但当分子靠近器壁时,周围分子分布不对称,撞向器壁分子的后面会受其他分子的一种拉力,使分子的动量减少,从而使器壁承受的压力也减小。
这种作用力称为内压力,内压力的大小与单位体积中的分子数成正比,用a∕V-2表示内压力,因而压力项被校正为
(p+a∕V*2)0
体积修正项:真实气体分子自身是有体积的,所以将气体的体积修正为(V-b)。
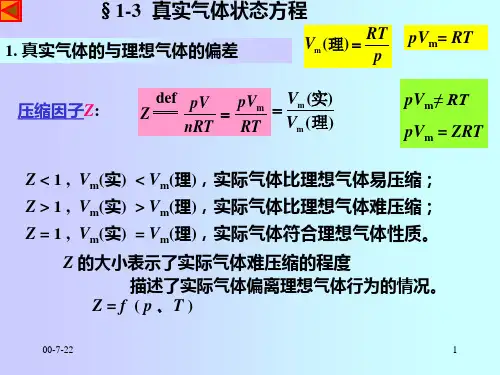

真实气体状态方程
其方程为pV=nRT。
这个方程有4个变量:p是指理想气体的压强,V为理想气体的体积,n表示气体物质的量,而T则表示理想气体的热力学温度;还有一个常量:R为理想气体常数。
可以看出,此方程的变量很多。
因此此方程以其变量多、适用范围广而著称,对常温常压下的空气也近似地适用。
理想气体状态方程,又称理想气体定律、普适气体定律,是描述理想气体在处于平衡态时,压强、体积、物质的量、温度间关系的状态方程。
它建立在玻义耳-马略特定律、查理定律、盖-吕萨克定律等经验定律上。
扩展资料:
适用情况
1、完全气体满足理想气体状态方程,从微观角度来看,它是分子本身体积与分子间作用力都可以忽略不计的气体。
在常温常压下,实际气体分子的体积和分子间的相互作用也可忽略不计,状态参数基本能够满足理想气体状态方程,所以空气动力学常把实际气体简化为完全气体来处理。
2、在低速空气动力学中,空气就可以被视为比热比为常数的完全气体;在高速空气动力学中,气流的温度较高,空气中气体分子的转动能和振动能随着温度的升高而相继受到激发,比热比不再是常数,在1500~2000K的温度范围内,空气可视为变比热比的完全气体。

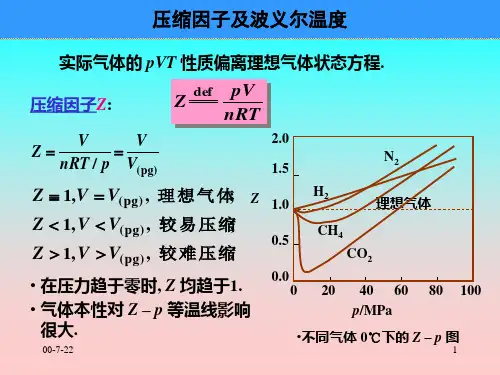
实际气体的状态方程
一、实际气体的压强 P 实
理想气体的 P 是忽略了分子间的吸力, 由分子自由碰撞器壁的
结果。
实际气体的压强是碰壁分子受内层分子引力, 不能自由碰撞器壁
的结果, 所以: P 实< P ,用P 内表示P 实与P 的差, 称为内压强, 则有:
P = P 实 + P 内
我们来讨论 P 内的大小, P 内是两部分分子吸引的结果, 它与两部分分子在单位体积内的个数成正比, 即与两部分分子的密度成正比:
⎪⎪⎭
⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛∝V n V n P 内外内 两部分分子共处一体, 密度一致, 故有:2
⎪⎭⎫ ⎝⎛∝V n P 内令比例系数为a, 则有: 2
⎪⎭⎫ ⎝⎛+=V n a P P 实 (1)
二、 实际气体的体积 V 实 理想气体的体积是指可以任凭气体分子运动
, 且可以无限压缩的理想空间, 原因是气体分子自
身无体积。
但实际气体的分子体积则因分子的体
积不能忽略而不同。
5dm 3
的容器中, 充满实际气
体, 由于分子自身体积的存在, 分子不能随意运
动, 且不可无限压缩. 若分子体积
为,3 dm B V =分 则分实实而,V V V dm V - 53==
3-5dm B V )(= 设每摩尔气体分子的体积为 b dm 3·mol -1
, 则有: V = V 实 - nb (2)。
实际气体状态方程公式在我们学习物理的过程中,有一个挺重要的概念,那就是实际气体状态方程公式。
咱们先来说说啥是气体状态方程。
简单来讲,气体状态方程就是描述气体状态的数学公式。
就像我们要知道一个人的身高体重一样,通过这个方程能清楚了解气体的各种情况。
对于理想气体,咱都知道有个特别经典的方程叫理想气体状态方程,就是 PV = nRT 。
这里的 P 是压强,V 是体积,n 是物质的量,R 是个常数,叫气体常数,T 是温度。
这个方程在很多情况下用起来挺方便的。
但是啊,实际中的气体可没那么“听话”,不是完全按照理想气体的规律来的。
这就引出了实际气体状态方程公式。
实际气体的行为比较复杂,因为分子之间有相互作用,而且分子本身还有大小。
我记得有一次,我在实验室里和学生们一起做实验。
当时我们要测量一种气体在不同条件下的状态。
按照理想气体状态方程计算出来的结果,和实际测量的数据总是有那么点儿偏差。
学生们都很困惑,一个个皱着眉头。
我就跟他们说:“别着急,这就是实际气体和理想气体的差别呀。
” 然后我们就一起探讨,怎么去修正这个偏差,怎么找到更能准确描述实际情况的公式。
实际气体状态方程有好几种形式,比如范德瓦尔斯方程。
这个方程在理想气体状态方程的基础上,增加了两个修正项,一个考虑分子间的相互吸引力,另一个考虑分子本身的体积。
在实际应用中,比如说在工业生产中,要准确控制气体的状态和行为,就得用实际气体状态方程。
比如在压缩气体储存的时候,如果只按照理想气体来计算,可能就会出问题,导致储存设备的设计不合理或者不安全。
还有在研究气候变化的时候,大气中的气体可不是理想气体,得用实际气体状态方程来更准确地模拟大气的行为。
总之,实际气体状态方程公式虽然看起来有点复杂,但在很多实际情况中,它可是非常重要的。
它能让我们更准确地理解和预测气体的行为,解决各种各样的实际问题。
所以啊,同学们在学习物理的时候,可别小瞧了这个实际气体状态方程公式,多琢磨琢磨,多做做实验,就能更好地掌握它啦!。
内容简介:研究实际气体的目的在于建立实际气体状态方程式。
因为有了状态方程,如前所述,利用热力学一般关系式,就可导出 u 、 h 、 s 及比热容的 计算式,以便进行过程和循环的热力计算。
1、 1、 纯物质的p-v-T 热力学面纯物质是指化学成分均匀不变的物质,它可以是固态、液态、气态或任意2种或3种物态的混合物。
简单可压缩系统纯物质的状态方程为F (p ,v ,T )=0,在p 、v 、T 三维坐标系中,全部热力学状态构成一曲面,这就是p-v-T 热力学面。
在p-v-T 热力学面上,熔解线、凝固线、沸腾线(饱和液体线)、凝结线(饱和蒸汽线)、升华线、三相线及凝化线,这7条曲线将物质的聚集态分为固相区、液相区、湿蒸汽区、气相区(过热蒸汽区)、熔解区及升华区6个区域。
湿蒸汽区(气液相变区)、熔解区(固液相变区)和升化区(气固相变区)内发生的相变过程,工质的压力和温度维持不变。
三相线表征固、液、气三相共存的特殊状态。
三相态具有特定的压力和温度,但因共处的三相物质的多少不同,可以有不同的比体积。
沸腾曲线(饱和液体线)和凝结曲线(饱和蒸汽线)的交点成为临界点,临界点的压力c p 、温度c T 分别称为临界压力和临界温度,这是液相与气相能够平衡共存时的最高值。
当p>c p 且T>c T 时,很难区分液相与气相,因而将这个区域的工质称为朝超临界流体。
将p-v-T 曲面投影到p-T 平面和p-v 平面上,就分别得到p-T 图和p-v 图。
在p-T 图上,湿蒸汽区、熔解区和升华区收缩为汽化、熔解和升华三条曲线,而三相线收缩为三相点。
一般纯物质的熔解曲线斜率为正,熔点岁压力升高而升高,凝固时体积收缩。
而水凝固时体积膨胀,熔解曲线斜率为负。
2、 2、 实际气体的状态方程(1) (1) 维里(Virial )方程维里方程是由统计力学方法导出的理论方程,最常用的形式为231...m m m m pV B C D RT V V V =++++ (5-30a )或以压力的幂级数表示为231...m pV B p C p D p RT '''=++++(5-30b )式中:B 、'B 称为第2维里系数;C ,'C 称为第3维里系数:依次类推。
理想气体模型: 微观上不考虑分子本身体积和分子间相互作用力,宏观上始终遵循恒量=TPV 的气体; 气体分子之间平均距离相当大,分子体积与气体的总体积相比可忽略不计;分子之间无作用力;分子之间相互碰撞及分子与容器壁的碰撞都是弹性碰撞;当气体压力不太高,温度不太低时,气体分子间的作用力及分子本身体积可忽略,气体可作为理想气体;实际气体范德瓦尔方程:RT b V V a p m m =-+))((2 或 nRT nb V Va n p =-+))((22 式中a 和b 为范德瓦尔常数,与分子大小和相互作用力有关,随物质不同而异,可由实验方法确定;2m V a 考虑到分子之间吸引力的修正值,b 考虑到分子本身所占体积的修正值;把在任何温度压力下均服从范德瓦尔方程的气体称为范德瓦尔气体;适用范围:中低压范围,高压下有一定误差;范德瓦尔方程式近似地反映了实际气体性质方面的特征,为实际气体状态方程的研究开拓了道路;不同气体存在着不同的分子间聚集态,分子间力的变化错综复杂,因此R-K 方程、BWR 方程、M-H 方程、维里方程等等都有一定的应用范围;R-K 方程:a 和b 是各种物质的固有常数,可以从p 、v 、T 实验数据拟合求得;缺乏这些数据时可用临界参数求取近似值:特点:应用简便,对气液相平衡和混合物的计算十分成功;适用范围:适用于烃类、N 2、H 2等非极性气体,且精度很高,即使在高压下误差仍很小,对NH 3、H 2O (g )等极性分子气体误差较大;维里方程,以幂级数形式表达:...132++++==vD v C v B T R pv Z g (体积幂级数) 式中B 、C 、D …是温度的函数,分别称为第二、第三、第四等维里系数;...13'2''++++==p D p C p B TR pv Z g (压力幂级数) 用统计力学方法导出维里系数,并赋予维里系数物理意义:第二维里系数表示两个分子相互作用,第三维里系数表示三个分子相互作用,以此类推;适用范围:一般略去第三维里系数及以后的高次项,不适用于高压情况;维里方程的另一个特点:截取不同项数可满足不同精度要求;例如在低压下,只要截取方程的前两项,就能得到较满意的精度;在高密度区的精度不高;压缩因子:临界温度:临界温度以上,无论压力有多高,气体都不能被液化;临界温度是判断气体能否液化的依据;临界参数:临界点时的参数为临界参数;如临界压力c p 、临界温度c T 、临界比容c v 等;1.对比参数:状态参数与临界状态同名参数的比值;2.对比态方程:由范德瓦尔方程和对比参数可得:3.对比态定律:由对比态方程知,同类物质(r Z 相近或相同)的各种气体,对比参数中若有两个相等,则第三个对比参数也相等,物质也处于对应状态中;Z 为压缩因子;压缩因子求法:1.临界压缩因子:2.压缩因子:由此式可知,压缩因子、压缩因子图与气体种类有关;压缩因子图:工程上常用多种c Z 相近的气体做实验,将所得结果的平均值作出Z 随r p 、r T 而变化的线图;通用压缩因子图:取27.0=Z c 时获得的压缩因子图即为通用压缩因子图;可由r p 、r T 在通用压缩因子图中获得任意气体的z 值,这是因为实际气体33.0~23.0≈Z c ;Z 表示实际气体难压缩的程度:在压力、温度、摩尔气体常数相同的条件下,有1<Z ,(理)实mm V V <)(,实际气体比理想气体易压缩; 1>Z ,(理)实mm V V >)(,实际气体比理想气体难压缩; 1=Z ,(理)实mm V V =)(,实际气体符合理想气体性质;。
5.3 实际气体状态方程研究实际气体性质首先要求得出精确的状态方程式。
对实际气体状态方程己作了百余年的研究,导得了许多不同形式的方程,至今仍在不断地发展和改进。
得出状态方程有两种方法。
一是直接利用由实验得到的各种热系数数据,按热力学关系组成状态方程。
这种方法己在4-4节作过简单的介绍;二是从理论分析出发,考虑气体分子运动的行为而对理想气体状态方程引入一些常数加以修正,得出方程的形式,引入常数的值则根据实验数据确定。
这一节着重介绍这一种方法。
5.3.1 范德瓦尔斯状态方程1873年范德瓦尔斯针对理想气体模型的两个假定(分子自身不占有体积;分子之间不存在相互作用力),考虑了分子自身占有的体积和分子间的相互作用力,对理想气体状态方程进行了修正。
分子自身占有的体积使其自由活动空间减小,在相同温度下分子撞击容器壁的频率增加,因而压力相应增大。
如果用表示每摩尔气体分子自由活动的空间,参照理想气体状态方程,气体压力应为。
另一方面,分子间的相互吸引力使分子撞击容器壁面的力量减弱,从而使气体压力减小。
压力减小量与一定体积内撞击器壁的分子数成正比,又与吸引它们的分子数成正比,这两个分子数都与气体的密度成正比。
因此,压力减小量应与密度的平方成正比,也就是与摩尔体积的平方成反比,用表示。
这样考虑上述两种作用后,气体的压力为或写成(5-24)这就是范德瓦尔斯导出的状态方程式,称为范德瓦尔斯状态方程式。
它在理想气体状态方程的基础上又引入两个常数:;做范德瓦尔斯常数,其值可由实验测定的数据确定。
范德瓦尔斯方程的引出,是从理论分析出发导出气体状态方程的一个典型例子。
范德瓦尔斯方程只不过是用两个常数很粗略地考虑了气体内分子运动的行为,所以还不能精确地表述气体的关系。
但是,它为用理论方法研究状态方程开拓了道路。
特别是它在定性上能反映出物质气—液相变的性质。
按照范德瓦尔斯状态方程在图上作出的定温线称为范德瓦尔斯定温线。
因为该方程可以展开成摩尔体积的三次方程。
所以范德瓦尔斯定温线在不同的温度范围内有图5-2所示的三种类型。
第一种是在温度较低的范围内,定温线如曲线所示。
它有一个极小值点和一个极大值点。
直线与曲线的转折部分围成两块相等的面积与。
这样,段对应于液体状态;段对应于气体状态;而、两点分别对应于饱和液及饱和气状态。
一般实验测定的液—气相变是沿直线进行的。
虽然范德瓦尔斯方程给出的相转变过程与实验测定的存在偏差,但在精确的实验中仍可观测到中邻近点的一段,和中邻近点的一段,即所谓过热液及过冷气阶段。
第二种类型如图中曲线所示。
它是由第一种曲线随着温度的升高,其中极小值点与极大值点逐渐接近,当温度升至某一定值时两极值点重合而形成的曲线。
这条曲线对应的温度称为临界温度,极值点重合点称为临界点,它是临界定温线上的拐点。
在临界点有:(5-25)及 (5-26)临界定温线的段对应于液体状态,段对应于气体状态。
第三种类型的曲线如图中曲线所示,它对应的温度高于临界温度。
曲线上不存在极值点及拐点,这表明,在温度高于临界温度的范围内物质总是呈现为气态。
将范德瓦尔斯代入式(5-25)及(5-26)然后联立求解,可得(5-27)(5-28)式中、是临界点的温度和压力值,称为物质的临界温度和临界历力。
在临界点物质骤然全部地发生气—液相转变,在实验中可以观察到临界乳光现象发生,由此可测定出临界点参数。
在测定出临界温度和压力以后,可按上式计算出范德瓦尔斯常数。
表5-1列出的常用气体的范德瓦尔斯常数即是按临界点参数计算得出的。
5.3.2 其它状态方程范德瓦尔斯方程的重要价值在于它开拓了一条研究状态方程的有效途径,在它以后,许多研究者对其作了进一步的修正,或引用更多的常数来表征分子运动行为,提出了许多状态方程。
这些方程具有更高的精度,有的可以较精确地表达气、液状态下工质的关系,用以制定工质的热力性质图、表。
作为举例,下面仅列出其中的两个方程。
1949年瑞里奇邝(O.Redlich-J.N.S.Kwong)对范德瓦尔斯方程进行改进,提出只有两个具体常数的方程(5-29)简称方程,其中常数、可按临界点特性式(5-25)、(5-26)导得:(5-30)(5-31)据报导,在临界温度以上,对于任何压力方程都给出令人满意的计算结果。
令人满意的精确度,再加上简单的形式,使这个方程在工程应用中引人注目。
贝蒂.布里奇曼(J.A.Beattie-O.C.Bridgeman)状态方程为一多常数方程。
(5-32)方程中,表达气体分子间的作用不是用两个常数,而是引入了两个密度的线性函数和,表示分子的作用与密度有关。
此外方程中还对气体常数进行了修正,即。
这是考虑到缓慢运动的分子相碰时,它们的运动会相互影响,分子就像联成聚集体一样。
这与气体分子数量改变具有相同的效应,因此可以认为气体常数是变化的。
实验资料表明,气体常数的变化与密度成正比,与热力学温度的立方成反比。
方程中,除气体常数之外还引入了五个常数( 、、、和),它们的数值可参阅有关书籍(如参考文献[11])。
在气体摩尔体积超过临界摩尔体积(见附录表7)两倍的气体状态范围内,这个方程是相当精确的。
己提出的气体状态方程数目繁多,有的引用了十个以上的常数。
它们在不同的范围内可以达到相当高的精确度。
例题5.4 体积的容器内盛有1 氧气,在下测得其压力。
试分别用理想气体状态方程、范德瓦尔斯方程及方程计算容器内氧气压力及它们的计算误差。
解:(1)按理想气体状态方程计算计算误差 %(2)按范德瓦尔斯方程计算由表5-1查得、0.03184计算误差%(3)按方程计算由附录表8查得,氧的临界参数、。
按式(5-30)及(5-31)可得= 19.82计算误差%5.3.3 维里(Virial) 状态方程1901年,卡末林·昂尼斯(Kammerlingh Onnes)提出以幂级数形式来表达状态方程,即(5-33)式中系数、、等只是温度的函数,称为第二、第三、第四等维里系数。
这种形式的状态方程称为维里状态方程。
维里状态方程的项数可以按照要求方程的精确程度来选定。
各维里系数可依据实验数据拟合确定。
维里系数的物理意义在统计物理学中有一定的解释,例如,第二维里系数反映一对分子间的相互作用造成的气体性质与理想气体的偏差,第三维里系数反映三个分子间的相互作用造成的偏差,等等。
因此,维里系数还可以用理论导出,目前用统计力学方法已能计算到第三维里系数。
许多研究者将他们提出的状态方程表达成维里形式,如1955年马丁(J.J.Madin)与我国学者侯虞均合作提出的马丁-侯( )方程(5-34)式中:其中包含、、、、、、、、,共9个常数,这些常数可依据临界点参数及饱和蒸气压数据确定。
方程提出后,马丁和候虞均又分别对方程进行过改进。
这个状态方程对于烃类物质及各种制冷剂都具有较高的精度。
各种状态方程也都可以展开成维里方程的形式。
例如范德瓦尔斯方程可以展开成如下维里形式:5.3.4 对比态状态方程研究表明,各种物质的热力性质存在一定的相似性,称为热力学相似。
这种相似性表现在用无量纲的对比参数来表达热力性质时,各种物质的热力性质可以用同一个方程式来表达,方程中不包含任何与物质种类有关的常数。
对比态状态方程就是用无量纲对比参数表达的、各种物质通用的状态方程式。
用以表达关系的对比参数有对比压力、对比温度、对比体积及压缩因子。
其中对比参数、、都是各点参数与临界点相同参数的比值;而压缩因子则是工质体积与按理想气体状态方程计算得的体积值的比值。
压缩因子表达了实际工质性质与理想气体性质的偏差,值偏离1愈远,工质的性质偏离理想气体愈远。
图5-3将在实验中对不同气体测得的、、、数据整理成对比参数、、的形式表示出来。
结果表明,在图上各种气体等值的定对比温度线相互重合(平均偏差在5%以内)。
这一实验结果可以表述为:具有相同对比压力和对比温度时,各种气体的压缩因子相等。
这个由实验得出的规律称为对应态定律,其数学表达为(5-35)式(5-35)即为对比态状态方程的一种表达形式。
附录图1给出以为纵坐标,为横坐标,为参变量的通用压缩因子图,它是对比态状态方程的图线表达,可供计算使用。
由通用压缩因子图可以看出:当、的低压范围内,,即按理想气体状态方程计算的误差小于5%;当时,在较大压力范围内值与1非常接近,即在较大压力范围内满足理想气体状态方程,这个温度被称为波义耳温度;在临界点附近值最小,远小于1,与理想气体状态方程偏差最大;在高压区值恒大于1。
对比态方程的通用性是它的优点,对各种工质只需知道它们的临界点参数就可应用它进行热力性质计算。
因为各种物质间的热力学相似性只是近似的,仅包含两个对比参数的对比态方程不能给出较精确的计算结果。
为此,一些研究者在方程中引入一些表征气体分子结构或运动特征的无量纲量,组成有较多参数的,精度较高的对比态方程式。
哈尔滨工业大学严家禄教授提出的气体通用状态方程就是一个应用范围广、精度高的对比态方程。
(5-36)式中是临界点压缩因子。
对于单原子气体,双原子气体,多原子气体。
为波义耳温度。
用严家禄方程对氢、氦、空气、、、,及烃类、氟里昂类气体进行计算,得到的精确度较方程更高,而且使用的参数范围也更广。
例题5.5 用理想气体状态方程计算在、时的比体积,并用通用压缩因子图进行修正。
解按理想气体状态方程计算由附录表8查得的临界参数为其对比参数为由通用压缩因子图(附录图1)查得故修正后比体积为由于状态方程在工质热力性质研究中的重要地位,众多研究者己提出的各种形式的状态方程数量极多,适用范围及精确程度各异,在应用中可查阅相关文献选用适当的状态方程。