2023届高三化学二轮复习题—元素或物质推断题及解析
- 格式:pdf
- 大小:1.48 MB
- 文档页数:25

2023届高三化学高考备考二轮复习专题训练有机化合物的结构与性质
选择题(共20小题)
1.(2022春•吉林期末)分子式为C8H8O2,且能与饱和NaHCO3溶液放出气体的芳香族化合物共有(不含立体异构)( )
A.3种 B.4种 C.5种 D.6种
2.(2022秋•青羊区校级月考)脱落酸(ABA)是一种抑制生长的植物激素,常用于植物组织分化、培养实验,其结构简式如图。下列关于ABA的说法正确的是( )
A.ABA含有三种官能团
B.ABA中所有碳原子均能共平面
C.ABA能发生氧化反应、加成反应、取代反应
D.1molABA最多消耗2molNaOH
3.(2022春•袁州区校级月考)某有机物A的结构简式如图所示,它是最早被禁用的兴奋剂之一,下列有关有机物A的叙述不正确的是( )
A.有机物A属于烃的衍生物
B.有机物A的分子式是C13H12O4Cl2
C.有机物A可看作卤代烃,也可看作芳香族化合物
D.有机物A分子中含有5种官能团
4.(2022春•梅江区校级月考)2021年诺贝尔化学奖授予本杰明•李斯特(BenjaminList)、大卫•麦克米兰(DavidW•C.MacMillan),以表彰在“不对称有机催化的发展”中的贡献,用脯氨酸催化合成酮醛反应如图,下列说法正确的是( )
A.该反应为取代反应
B.c的分子式为C10H9NO4 C.c发生消去反应后形成的产物存在顺反异构
D.b与足量H2加成后分子中含有2个手性碳原子
5.(2022秋•广西月考)奥昔布宁具有解痉和抗胆碱作用,其结构简式如图所示。下列有关奥昔布宁的说法正确的是( )
A.分子式为C22H30NO3
B.分子中的三个氧原子一定不在同一平面
C.可发生加成反应,不能发生取代反应
D.既不是乙醇的同系物,也不是乙酸乙酯的同系物
6.(2022秋•海淀区校级月考)中医药是中华民族的瑰宝,具有消炎、抑菌、抗病毒作用的大黄素是中药大黄的主要有效成分之一,其结构如图所示。下列关于该有机物的说法中不正确的是( )

试卷第1页,共11页 2023届高考化学一轮训练专题——元素或物质推断题
1.(2022·河南郑州·一模)Q、W、X、Y、Z 是位于不同主族的五种短周期元素,其原子序数依次增大。
①W 的氢化物与 W 最高价氧化物对应水化物反应生成化合物甲。
①X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
①常温下,Q 的最高价气态氧化物与化合物 X2O2 发生反应生成盐乙。
请回答下列各题:
(1)甲的水溶液呈酸性,用离子方程式表示其原因____________________________________________________________________________。
(2)①中反应的化学方程式为_________________________________________________________________________________________。
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测 Z 在周期表中位置为____________________________________________________________________________________。
(4)Y 形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成 NO。写出此反应的离子方秳式_____________________________。
2.(2022·上海杨浦·一模)科学家合成了一种新化合物(如图所示),其中X、Y是第三周期的非金属元素,各原子均满足8电子稳定结构。
完成下列填空:
(1)硅原子最外电子层有________种运动状态不同的电子,占据______个轨道。
(2)由题意可推知Y是Cl,推得此结论的依据是__________________。X和Si之间共用电子对偏离________。

2023届初三化学中考二轮复习题——元素或物质推断题
1.(2022·湖南湘潭·校考模拟预测)A~H是初中化学常见物质,它们之间的转化关系如下图所示(部分产物已略去)。
已知B是目前世界上年产量最高的金属,A、E、F均为氧化物,且A为红色固体。C为气体。H的水溶液呈蓝色,农业上常用来配制波尔多液,G、H中的阴离子相同。回答下列问题:
(1)写出物质的化学式:A_______,F______,G_______。
(2)列举D物质的一种用途_______。
(3)在反应I→反应IV中,属于置换反应的是_______。
(4)写出反应的化学方程式:
①反应①______ 。
①反应IV______ 。
(5)某溶液由G、H混合而成,若往该溶液中逐滴滴入足量NaOH溶液,并振荡,可观察到的现象是________。
2.(2022·山东聊城·统考一模)2022年北京成功举办冬奥会。如图彩色“奥运五环”中相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是NaOH、Fe、CuO、CuCl2中的一种,C溶液能使紫色石蕊溶液变蓝。
(1)C的化学式是___________。
(2)写出B与C反应的化学方程式:___________,A与B的反应属于___________(填基本反应类型)。
(3)C与H2SO4反应的微观实质是___________。
3.(2018·四川乐山·统考模拟预测)如图A、B、C、D是初中化学中常见的四种物质。其中A为黑色单质,D为红色单质,B、C是组成元素相同的两种气态化合物。“→”表示物质间的转化关系(部分反应物、生成物及反应条件已略)。请回答:
(1)B的化学式是____。
(2)C的一种用途____。
(3)A→D反应的化学方程式是____。
(4)将C转化成B的反应中,C表现出____(可燃性、还原性、氧化性、腐蚀性)。
4.(2022·陕西西安·校考模拟预测)如图是初中常见物质的反应关系,“→”表示某物质可一步反应生成另一种物质,“—”表示两端的物质能相互反应(部分生成物已略去)。回答下列问题。

试卷第1页,共9页 2023届高考化学备考一轮复习:元素或物质推断题
1.(2022·宁夏·贺兰县景博中学高三阶段练习)下表为元素周期表的一部分,请参照元素①~①在表中的位置,请回答下列问题:
①
① ① ①
① ① ① ① ①
①
(1)元素①在周期表中的位置是_______;①的原子结构示意图为_______;
(2)①①①的简单离子半径由小到大的顺序为_______(用离子符号和“<”表示);
(3)①①的简单气态氢化物中沸点高的是_______(用化学式表示);
(4)①的最高价氧化物对应的水化物与①的最高价氧化物对应的水化物发生反应的离子方程式_______;
(5)下列五种物质中,①2HO ①2CO ①22NaO ①NaOH ①NaBr,只存在共价键的是_______;只存在离子键的是_______;既存在离子键又存在共价键的是_______(填序号)。
2.(2023·河南·高三阶段练习)X、Y、Z、P、Q是原子序数依次增大的短周期主族元素,其中X的一种核素中没有中子,Y的单质和Z的单质是空气的主要成分,Z和Q同主族。做焰色试验时P元素的焰色为黄色。回答下列问题:
(1)X、Y、Z、P、Q五种元素的原子半径从大到小的顺序为_______(用元素符号表示)。
(2)M是由X、Y元素组成的含有10个电子的分子,M的空间构型为_______。
(3)3PY可用作医药原料、照相乳剂的防腐剂。3PY可由2YZ与2PYX反应制备,副产物为PZX和M。
①PZX中含有的化学键类型为_______,2PYX的电子式为_______。
①上述制备3PY的化学方程式为_______。
(4)Z和Q的简单气态氢化物中,热稳定性更好的是_______(填化学式),从化学键的角度解释Z的简单气态氢化物的分解反应为吸热反应的原因:_______。

2023届初三化学中考二轮复习题:元素或物质推断题
1.(2021·山东聊城·统考中考真题)A-G 是初中常见的物质,相互间反应及转化关系如下图所示(部分反应条件和生成物已省略)已知 A 是金属氧化物,B 是胃酸的主要成分,C 俗称烧碱,E是应用最广泛的金属。请回答下列问题:
(1)F 的化学式为______。
(2)化学反应①基本反应类型是______。
(3)反应①的反应方程式为_______________。
(4)若 B 和 C 能发生反应。这一反应的微观实质为____________。
2.(2020·湖北武汉·统考一模)有一包固体,可能由BaCl2、NH4NO3、Na2CO3、MgSO4、NaCl中的一种或几种组成,为了探究该固体组成,某化学小组取适量固体溶于水得到无色澄清溶液,并开展以下实验。步骤①中白色沉淀部分..溶解且无气泡...产生,请回答下列问题:
(1)步骤①产生的气体为______(填名称或化学式均可)。
(2)原固体中一定含有的物质是______,一定不存在的物质是_____。
(3)步骤①中发生反应的化学方程式为________。
(4)无色溶液C中所含阳离子的符号为________。
3.(2023·陕西西安·校考二模)A-E是初中化学常见的物质,其中B是光合作用的原料、C是相对分子质量最小的氧化物,A、E物质类别相同且都属于碱,D是大理石的主要成分,D、E中含有相同的金属元素。物质间的转化关系如图所示(“一”表示相邻两物质间能发生反应,“→”表示一种物质经一步反应转化为另一种物质,部分反应物、生成物及反应条件已略去)。
请回答下列问题。
(1)C的化学式是_______。
(2)写出E的一种用途:_______。
(3)D→B反应的化学方程式为_______。
4.(2023秋·广东汕头·九年级统考期末)A~E分别是初中化学常见物质,它们之间的转化关系如图所示(“→”表示物质间能转化,“——”表示两端的物质能够发生反应)。通常情况下B、C、E是无色气体,A、D是固体单质,且D是目前应用最广泛的金属。请回答:

1
2023届高考化学一轮专题训练——元素或物质推断题
1.(2022秋·河南郑州·高三巩义二中校考期末)有四种短周期元素,相关信息如下表。
元素 相关信息
A 气态氢化物极易溶于水,且其水溶液显碱性
B 单质在焰色试验中显黄色
C 单质是淡黄绿色气体,可用于自来水消毒
D -2价阴离子的电子层结构与Ar原子相同
请根据表中信息回答:
(1)A在周期表中位于第_______周期第_______族。
(2)用电子式表示B与C形成化合物的过程:_______。
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是_______(填化学式)。
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是_______。
a.其单质在常温下呈固态
b.2SeO既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为23HSeO
d.非金属性比Cl元素的强
2.(2022秋·辽宁沈阳·高三沈阳二中校考期末)请回答下列问题
I、
(1)请用下列10种物质的序号填空:
①2O②2H③43NHNO④22KO⑤2BaOH⑥4CH⑦2CO⑧NaF⑨3NH⑩2I
其中既含离子键又含非极性键的是___________(填序号,下同);既含离子键又含极性键的是___________。
(2)X、Y两种主族元素能形成2XY型化合物,已知2XY中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为___________;若2XY为共价化合物时且每个原子都满足最外层8电子稳定结构,其结构式为___________。 2
II、下表为元素周期表的一部分,请回答下列有关问题
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
(3)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为___________。

1
2023届高考化学一轮专题训练题—元素或物质推断题
1.(2022·浙江·模拟预测)化合物A(11200gmol300gmolM)由3种元素组成,某小组开展如图的探究实验:
已知:固体C由相对分子质量相差32的甲、乙(相对分子质量:甲>乙)两种物质组成,甲和乙所含元素完全相同。
请回答:
(1)组成化合物A的元素为O、___________,A的化学式为___________。
(2)溶液E的溶质为___________(用化学式表示)。
(3)由B生成F的离子方程式为___________。
(4)化合物A在KOH溶液中会发生歧化反应,生成两种盐(与C成分不完全相同,其中的氧化产物为固体C中的一种),且无沉淀生成,写出该反应的化学方程式:___________。
(5)请设计实验方案检验固体C中乙物质的阴离子:取适量纯净的乙物质于试管中,___________。
2.(2021秋·北京通州·高三统考期末)元素周期表揭示了化学元素间的内在联系。
族
周期 ⅠA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③
3 ④
4 ⑤
(1)芯片的主要成分为硅,硅在元素周期表中的位置是_______,其氧化物可作为光导纤维,该物质的化学式为_______; 2
(2)元素①分别与③和④形成的化合物中,稳定性由强到弱....顺序为:_______(用化学式表示),用原子结构解释原因:元素③和④在同一主族,原子最外层电子数相同,_______;
(3)元素②广泛存在于自然界中,②的最高价氧化物的水化物和⑤的最高价氧化物的水化物发生反应的产物是农业上常用化肥,其反应的离子方程式.....为_______;
3.(2022秋·广东深圳·高三统考期末)已知a~f是原子序数依次增大前四周期的六种元素,a元素原子核外电子只有一种自旋取向;b元素原子最高能级的不同轨道都有电子且自旋方向相同;c元素原子的价层电子排布为n2nnsnp,d元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;e与d的最高能层数相同,但其价电子层电子数等于其电子层数;f元素原子最外层只有1个电子,次外层内的所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号....表示):
2023年高考化学专题训练--常见的无机物及其应用
一、单选题
1.氯气是一种有毒气体,在运输与储存过程中必须防止泄漏.一旦储存液氯的钢瓶发生泄漏,必须立即采取措施.下列各种措施不合理的是( )
A.将人群向高处疏散
B.将人群逆风向疏散
C.用浸有烧碱溶液的毛巾捂住口鼻
D.向泄漏地点撒一些石灰
2.下列物质不能使酸性KMnO4溶液褪色的是( )
A.乙烯 B.二氧化硫 C.乙醇 D.甲烷
3.新冠病毒由蛋白质和核酸组成,直径大约在60~140nm,怕酒精,不耐高温。下列说法正确的是( )
A.医用酒精中乙醇的体积分数为95%
B.高温可使蛋白质发生变性
C.新冠病毒扩散到空气中不可能形成胶体
D.“84”消毒液(主要成分NaClO)中加入浓盐酸可以增强消毒效果
4.下列有关的化学知识,错误的是( )
A.胶体区别于溶液的本质是胶体中分散质大小介于1nm和100nm之间
B.进行焰色反应实验时,没有铂丝可用无锈铁丝代替进行实验
C.胶体都可以用来净水
D.实验室中取用后剩余的钠要放回原试剂瓶中
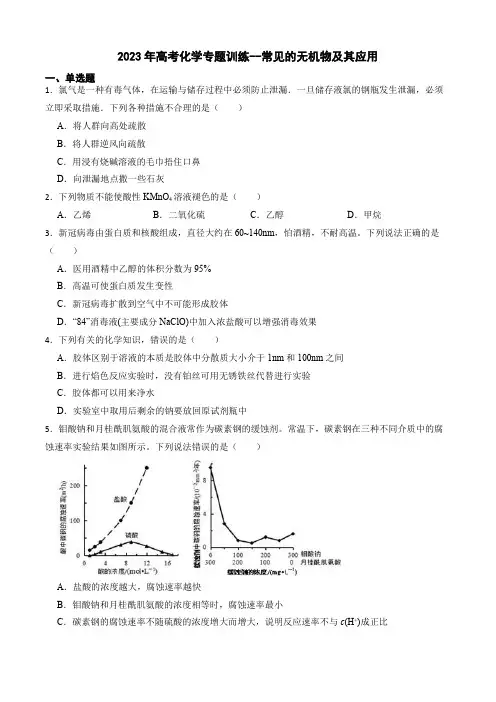
5.钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法错误的是( )
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比 D.对比盐酸和硫酸两条曲线,可知Cl-也会影响碳素钢的腐蚀速率
6.下列有关铁及其化合物的说法中,错误的是( )
A.如图所示操作可制取𝐹𝑒(𝑂𝐻)2
B.红热的铁与水蒸气发生反应,生成红棕色的固体
C.𝐹𝑒3𝑂4、𝐹𝑒(𝑂𝐻)3均可以由化合反应制得
D.𝐹𝑒(𝑂𝐻)3胶体可用饱和氯化铁溶液和沸水制备
7.有关硅元素的下列叙述中正确的是( )

1
2023届高考化学一轮专题训练—元素或物质推断题
1.(2022春·广东云浮·高三统考期末)已知X、Y、Z、M、N是原子序数依次增大的前四周期元素,其中Y是地壳中含量第二的元素,X、Y、Z是核外未成对电子数均为2的非金属元素,ZX3的空间结构为平面三角形,M的价层电子数为6,N与Z同族。请回答下列问题:
(1)X为____(填元素名称,下同),Y为____,Z为____。
(2)M在元素周期表的位置是____,基态N原子的价层电子排布式为____。
(3)X、Y、Z的第一电离能由大到小的顺序为____(填元素符号)。
(4)Z与N的最简单氢化物的稳定性比较:____ (写化学式),原因为____。
(5)YX2的晶体类型为____,其熔点____(填“高于”或“低于”)NX2。
2.(2022春·内蒙古赤峰·高三统考期末)回答下列问题:
(1)X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法不正确的是
A.若W是单质铁,则Z溶液可能是2FeCl溶液
B.若W是氢氧化钠,则X水溶液呈酸性
C.若W是氧气,则X、Z的相对分子质量可能相差48
D.若W是强氧化性的单质,则X可能是金属铝
(2)A是一种常见的铵盐,受热分解可得到碱性气体B,C、D是常见的两种氧化物,E溶液显酸性。A、B、C、D、E是含有一种相同元素的五种化合物,在一定条件下可发生如图所示的转化。
①B的化学式___________;D的颜色___________。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式___________。
(3)电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择___________(填字母标号)。
a.碳棒 b.锌板 c.铜板 2
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的___________(填“正”或“负”)极。F电极上的电极反应式为___________。
答案第23页,共34页 2023届高考化学一轮专题训练——元素或物质推断题
1.(2022·四川·盐亭中学一模)元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列,得到如图所示的“蜗牛元素周期表”,图中每个圆圈代表一种元素,其中①代表氢元素。请回答下列问题:
(1)①在元素周期表中的位置为_______。
(2)①①①的离子半径由大到小的顺序为_______。
(3)①①①的最高价氧化物对应水化物的酸性由强到弱的顺序是_______(填化学式)。
(4)用电子式表示由①和①组成的化合物的形成过程:_______。
(5)实验室制取①的简单氢化物的化学方程式为_______。
(6)可以验证①、①两元素金属性强弱的实验是_______(填字母)。
A.比较①、①两种元素的单质的硬度及熔点
B.将除去氧化物薄膜的①、①的单质分别和热水作用,并滴入酚酞溶液
C.将除去氧化物薄膜的①、①的单质分别和2mL1 mol∙L−1的盐酸反应
D.比较①、①两种元素的最高价氧化物对应水化物的溶解性
2.(2022·河南洛阳·模拟预测)A、B、C、D四种物质之间的转化关系如图所示(部分产物略去),根据所学知识回答下列问题:
(1)若A为NaAlO2溶液,写出A与过量B反应的离子方答案第24页,共34页 程式____。
(2)若A为Fe,B为稀HNO3,则反应①(还原产物为NO)中氧化剂与还原剂的物质的量之比为____,稀硝酸在反应过程中除了起氧化剂的作用外,还有____的作用。
(3)若A为Cl2,B为NH3,当NH3过量时,则二者相遇有白烟生成,写出反应①的化学方程式:_____。
(4)若A为1L0.1mol·L-1NaOH溶液,B为SO2,当向A中通入0.07molSO2气体时,溶液中的溶质为_____(填化学式,下同)、____,物质的量分别为____、___。
3.(2022·上海市南洋模范中学模拟预测)硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。

2023届高考化学一轮训练题:元素或物质推断题
1.(2022·吉林松原·高三阶段练习)元素周期表是学习化学的基础,下表列出了常见的十种短周期主族元素的分布位置。
族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
一
二 ① ② ③ ④
三 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
回答下列问题:
(1)画出元素⑤的原子结构示意图:_______。
(2)元素③④⑧形成的气态氢化物中,最稳定的是_______(填化合物的电子式)。
(3)元素⑤⑥⑦的最高价氧化物的水化物中,碱性最强的是_______(填化合物的电子式)。
(4)写出能说明②③元素非金属性强弱的化学方程式:_______。
(5)元素④⑤⑩形成的化合物中存在的化学键为_______。
(6)元素④⑤⑥⑩形成的简单离子半径由大到小的顺序为_______。
2.(2022·河南·官庄乡联合中学高三开学考试)已知500mL待测液中除含有0.3mol·L-1的Na+外,还可能含有下列离子中的一种成几种:K+、NH4、Mg2+、Ba2+、Al3+、Cl—、Br—、CO23、HCO3、SO24。现进行如下实验操作(每次实验所加试剂均过量):
(1)由白色沉淀B可确定待测液中含有的离子是____。
(2)检验气体B常用的简便方法是____,若在标准状态下,用一充满气体B的圆底烧瓶做喷泉实验,实验完毕后,圆底烧瓶中充入水的体积为其容积的45,则所得溶液的物质的量浓度是____mol·L-1(假设溶液不扩散,保留2位有效数字)。
(3)由沉淀D和沉淀E可以判断待测液中一定含有____离子,据此可以排除的离子是____。
(4)某同学分析白色沉淀C后,认为待测液一定不含____。
(5)综合分析,待测液中K+的最小浓度为____。
3.(2022·浙江·湖州中学高三阶段练习)为了探究化合物A(含三种元素)的组成和性质,设计并完成如下实验:
1
2023届高考化学一轮专题复习题——元素或物质推断题
1.(2022·河北正中实验中学高三阶段练习)现有A、B、C、D、E、F、G、H、I九种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为_______。
(2)B元素的原子核外共有_______种不同运动状态的电子。
(3)某同学推斯E元素基态原子的核外电子轨道表示式为。该同学所画的轨道表示式违背了_______,解释E元素原子的第一电高能大于F元素原子的第一电离能的原因:_______。
(4)用惰性电极电解EG2的水溶液的离子方程式为_______。
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______;已知T元素和Cl元素的电负性分别为1.5和3.0,则它们形成的化合物是_______(填“离子化合物”或“共价化合物”)。
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______种。
(7)I位于元素周期表中_______区(按电子排布分区),实验室用一种黄色溶液检验I2+时产生蓝色沉淀,该反应的离子方程式为_______。
2.(2022·河南·平顶山市蓝天高级中学高三期末)下表列出了A﹣R 9种元素在周期表中的位置
- 1 - 专题二十二 无机推断题作业纸
姓名: 学号: 班级: 优 良 中 差 成绩
1.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化:
则X为 ( )
A.Fe B.Cu C.S D.C
2.如图所示:,图中6个编号分别代表下列物质中的一物质:a.Al,b.Fe2O3,c.NaOH溶液,d.氢碘酸溶液,e.NH3,f.O2。凡是用直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁)。图中⑤表示的物质是 ( )
A.a或b B.c C.d D.e或f
3.A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素。它们间的反应关系如下图所示。
(1)若A为金属钠,B为饱和NaOH溶液,则白色沉淀D为 (写化学式)
(2)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B反应(加热)的化学方程式为 。
(3)若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为
;若C的燃烧热为1300kJ·mol—1,则C燃烧的热化学方程式为
(4)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同,向一定量的B溶液中逐渐加入固体粉末A,当A与B以物质的量之比3:1反应时,生成的D的量最多。推知A的化学式为 ,B的化学式为
4. 在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知A、B、C中A B C D D
第 39 讲-铁钴镍及其化合物
一、知识重构
“能依据物质类别和元素价态列举某种元素的典型代表物。能利用电离、离子反应、氧化还原反应等概念对常见的反应进行分类和分析说明。能举例说明胶体的典型特征。能列举、描述、辦识典型物质重要的物理和化学性质及实验现象。能用化学方程式、离子方程式正确表示典型物质的主要化学性质。”常见评价方式:辨析知识点对与误或者知识的逻辑关系,评定学生知识掌握水平。
“能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。”常见评价方式:利用已知知识内容结合题干信息可以类推未知物质的性质或者反应规律,是铁及其化合物一种常见考查方法,铁钴镍均为变价金属在氧化还原反应原理及部分复分解反应性质方面具有一定相似性所以通过类比方法进行命题是一种常见命题方式和方法。这类试题对学生的归纳与理解能力的评价也尤为突出。
能利用典型代表物的性质和反应,设计常见物质制备、分离、提纯、检验等简单任务的方案。能从物质类别和元素价态变化的视角说明物质的转化路径。常见评价方式:结合题干信息和已学类似物质性质设计制备某物质一般方法或者评价过程中涉及重要操作设计的目的以及改进方法等。
能根据物质的性质分析实验室、生产、生活及环境中的某些常见问题,说明妥善保存、合理使用化学品的常见方法。常见评价方式:创设实验情景评价实验操作设计的目的与意图。
能说明常见元素区其化合物的应用(如金属冶炼、合成氨等)。常见评价方式:结合学习内容辨析应用方式和方法是否正确。
对社会发展的价值、对环境的影响。能有意识运用所学的知识或寻求相关证据参与社会性议题的讨论(如酸雨和雾羅防治、水体保护、食品安全等)。常见评价方式:结合学习内容辨析物质对环境、食品安全等的影响。
2.知识清单
(1)铁的性质
结构特点 排布式: 1s22s22p63s23p63d64s2
第 1 页 共 30 页
高考化学(huàxué)无机推断题大汇总
高考化学无机(wújī)推断题大汇总
全国名校高三化学调研精选(jīnɡ xuǎn)汇编
1〔8分〕某、Y、Z为三种由短周期元素(yuán sù)构成的粒子,每mol粒子都有10mol电子,其结构特点如下:
原子核数粒子(lìzǐ)的电荷数
物质A由某、Z构成,B、C、D、K都是单质,反响①~⑤都是用于工业生产的反响,各有关物质之间的相互反响转化关系如以下图所示:
请答复以下问题:
(1)A的化学式为;D的结构式为。(2)完成以下反响的离子方程式:
反响①。反响④。
(3)假设J气体浓度过高可导致高铁血红蛋白血症,且污染大气等。但J也有不少的用途,如〔举出一例〕
2.物质之间的转化关系如以下图所示,A〔只含两种元素〕可作为工业生产J的原料,B、C、H、I为非金属单质,某的水溶液为一种常见的无色医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反响⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。
CAB高温①某单核1个单位正电荷Y四核0Z双核1个单位负电荷EFGH某③J高温④足量Ba(NO过滤32)溶液白色沉淀KLM高压⑦N
D高温②OD设备ⅠI⑤设备ⅡH+I⑥答复以下问题:
第 2 页 共 30 页
⑴某的化学式为_______________,C+D的反响方程式为___________________⑵考虑到综合经济效益,工业生产M时,可采取的措施有_______________(填字母序号)。
a.使用催化剂b.适当降低温度c.选择适宜的温度d.适度增大压强e.及时别离出产物f.对原料进行循环利用g.充分利用反响本身放出的热量h.工厂地址尽可能选择在交通兴旺的城市i.工厂地址可选择在盛产天然气的地区;
第1页/总20页【高考化学】2023届高考备考第一轮复习化学元素或物质推断题
提升练习3
1.物质X、Y、Z均含同种短周期元素,其转化关系如下图所示(反应条件未标出)。
WW
XYZ
(1)若X是无色极易溶于水的刺激性气味气体,Z是红棕色气体,由Y与W反应生成Z的化学
方程式是_______。
(2)若X含三种短周期元素,其中两种元素的原子的质子数之和等于另一种元素原子的质子数,
单质W是常见金属,则X的稀溶液转化为Y的离子方程式是_______
(3)若X是空气的主要成分之一,W原子的最外层电子数是内层电子数的二倍:则Y与W反
应生成时,反应中转移的电子数为_______。0.1molZ
2.A、B、C、D分别代表四种不同的短周期元素。A元素原子的最外层电子排布式为ns1
,B
元素的原子价电子排布式为ns2np2
,C元素原子的最外层电子数是其电子层数的3倍,D元素
原子的L电子层的p能级中有3个电子。
(1)C原子的电子排布式为_______,若A元素的原子最外层电子排布式为1s1
,则A与C形成
的阴离子的电子式为_______,若以A、C两元素的单质组成原电池(电解质为NaOH溶液),
电池工作时,通入C的单质的电极反应式为_______。
(2)当n=2时,B的原子结构示意图为_______。
(3)若A元素的原子最外层电子排布式为2s1
,B元素的原子价电子排布为3s23p2
,元素A在周
期表中的位置_______,A、B、C、D四种元素的第一电离能由大到小的顺序是
_______,A、B、C、D四种元素的电负性由大到小的顺序是_______。
3.表为元素周期表中的一部分。
族
周
期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0
2⑥⑦⑪试卷第2页,共8页
3①③⑤⑧⑩
4②④⑨
用化学式或元素符号回答下列问题:
(1)①③⑤元素的最高价氧化物的水化物,碱性最强的是_______。
(2)②③④元素形成的简单离子半径由大到小的顺序是_______。
试卷第1页,共10页 2023届高三化学二轮复习题—元素或物质推断题 1.(2022·云南德宏·统考一模)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数
之比为2:3.试回答下列问题:
(1)E元素在周期表中的位置是_______;
(2)已知101KPa时,A单质的燃烧热为285.8 kJ/mol,请写出A单质完全燃烧生成液态
水时的热化学方程式:_______;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是_______;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于_______化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为_______;
(5)化合物E
2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式
为:_______。
2.(2022·河南·河南省实验中学校考三模)Ⅰ. A、B、C、D、E均为中学化学常见的纯净
物,B为最常见的液体,它们之间有如下反应关系:
(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1C溶液的pH=13,则该反应的
离子方程式为____________。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该
反应的化学方程式为___________。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,
则该反应的离子方程式为 ___________。
Ⅱ.
(4)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO
3和
H
2SO
4存在下与Na
2SO
3反应制得。请写出该反应的离子反应方程式: ___________。
(5)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na
2CO
3∙3H
2O
2,
它具有Na
2CO
3和H
2O
2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其
中过碳酸钠只发生了还原反应的是_________。
A.MnO
2 B.KMnO
4溶液 C. 稀盐酸 D.Na
2SO
3溶液
3.(2022·广东茂名·校联考一模)A、B、C、D、E是核电荷数依次增大的五种短周期试卷第2页,共10页
主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价
氧化物对应的水化物的化学式为HBO
3;C原子最外层的电子数比次外层的多4;C的
简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D
2C;C、E同
主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离
子符号表示)。
(4)化合物D
2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物
的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D
2EC
3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸
盐,则此反应的化学方程式为______________________。
4.(2022·甘肃平凉·静宁县第一中学校考三模)A、X、W、D、E为短周期元素,且原
子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色
石蕊试纸变蓝, A、W能形成两种液态化合物A
2W和A
2W
2,E元素的周期序数与主
族序数相等。
(1)E元素在周期表中的位置为______________________。W的原子结构示意图为
________。
(2)A、X 两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。
用电子式表示化合物D
2W的形成过程______________________________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H
2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)实验室制备A和X形成的气态化合物的化学方程式为
____________________________。
(5)经测定A
2W
2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离
方程式
_________________________________________________________________________。
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫
酸溶解。现在改用A
2W
2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,
试卷第3页,共10页 试写出反应的离子方程式
________________________________________________________________。
5.(2022·天津河北·统考一模)A、B、C、D都是中学化学常见的物质,其中A、B、C
均含有同一种元素。在一定条件下相互转化的关系如下图所示。
请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)
的化学方程式:_______________________。
(2)若D为氯碱工业的重要产品,A、B、C 为均含有同一种金属元素的无机化合物,
反应(Ⅲ)的离子方程式为________________________。
(3)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值
为3: 5,则反应(Ⅲ)中氧化产物与还原产物的物质的量之比为______,0.1mol A与含
0.15molNaOH 的溶液充分反应后,溶液中所含离子浓度的大小关系为______。(已知: 常
温下H
2S 的电离平衡常数K
a1= 1.3×10-7 K
a2=7.1×10-15)
(4)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为________,D的电子式为_________
②25℃时,浓度均为0.1mol/L 的B、C 溶液,pH 较大的是______(填溶质的化学式)
溶液,写出B 溶液中显电中性的原因:__________________(用B 溶液中有关粒子的浓
度关系表示)
6.(2022·浙江·统考一模)由3种常见短周期元素组成的化合物A,相对分子质量为119,
能与水剧烈反应,生成2种酸性气体的混合气体B。现对化合物A进行下列实验,假设
各步反应均完全,反应中气体完全逸出。
请回答:
(1)D中溶质的化学式_____________________,H
2O
2的电子式_______________。
(2)A和水反应的化学方程式___________________________________________。
(3)B→E的离子方程式______________________________________________。 试卷第4页,共10页
7.(2022·浙江·校联考一模)化合物M 是某种具有优异磁学性质的新型电子材料的主
要成分,由两种元素组成。为了研究其组成,设计如下实验:
气体甲可使湿润红色石蕊试纸变蓝。请回答
: (1)M 的化学式______。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是______(用化学方程式表示) 。
(3)高温条件下,丁与甲反应生成两和单质和水,该反应的化学方程式为______。
8.(2022·江苏镇江·江苏省镇江第一中学校考模拟预测)为探究黑色固体 X(仅含两种
元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X 的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
9.(2022·天津·天津实验中学校考一模)物质M是一种日常生活中不可缺少的调味品.已
知C可在D中燃烧发出苍白色火焰,M与其他物质的转化关系如图所示(部分产物已
略去)
(1)写出用惰性电极电解M溶液的离子方程式_____。
(2)比较B中各元素原子半径由大到小_____(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入试卷第5页,共10页
E溶液,边加边振荡,所看到的实验现象是_____。
(5)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后
变成红褐色的E,则由A转化成E的离子方程式是_____。
(6)若A是一种溶液,只可能含有H+
、NH
4+
、Mg2+
、Fe3+
、Al3+
、CO
32﹣、SO
42﹣中的
某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生
变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为_____。
(7)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的
化学方程式为_____。
10.(2022·全国·统考一模)A、B、C、D、E五种化合物,均含有某种常见元素,它们
的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,
若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:
(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
11.(2022·河南·统考二模)下表是元素周期表的前三周期及其中的部分元素,请回答相
关问题
(1) a、f、g 元素最高价氧化物的水化物碱性由强到弱的顺序是__________(用化学式
表示)。表中所给元素中金属性最强的与非金属性最强的形成的化合物溶液显______(填