九年级化学下册第9单元实验活动5一定溶质质量分数的氯化钠溶液的配制教案2(新版)新人教版
- 格式:doc
- 大小:42.00 KB
- 文档页数:3


C\增强化学学习的兴趣。
实验活动二:配制50g质量分数为3%的氯化钠溶液
1.用什么办法能让刚得到的9%的溶液变成0.9%的呢?
2.需要通过哪几步完成?和以上有何不同?
3.学生分组活动,教师巡视、指导。
(1)回答:加水稀释
(2)进一步明确步骤:计算、量取、混匀、保存。
指出用液体配制时不需要天平。
(ppt展示)
误差分析
1.从溶质角度(用偏大、增多或偏小、减少填空)
①称量时采用左码右物,则溶质质量()质量分数()
②称量时左盘放纸,右盘不放纸,则溶质质量()质量分数
()
)质③将称好的食盐放入烧杯中的时候,有些盐洒到外面了,
溶质质量(.
量分数()
④使用的砝码生锈,则实际称量出溶质质量()质量分数()
⑤药品中有杂质,则实际称量出溶质质量()质量分数()
2.从溶剂角度(用偏大、增多或偏小、减少填空)
①使用量筒时俯视读数,则溶剂的质量()质量分数(),如果仰视读数,则溶剂的质量()质量分数()。
②将水倒入烧杯前,烧杯内用水润湿,溶剂()溶质质量分数会().
③将水倒入烧杯后,有少量水洒出,则溶剂的质量()质量分
数()。
课堂练习
作业:练习册布置作业。

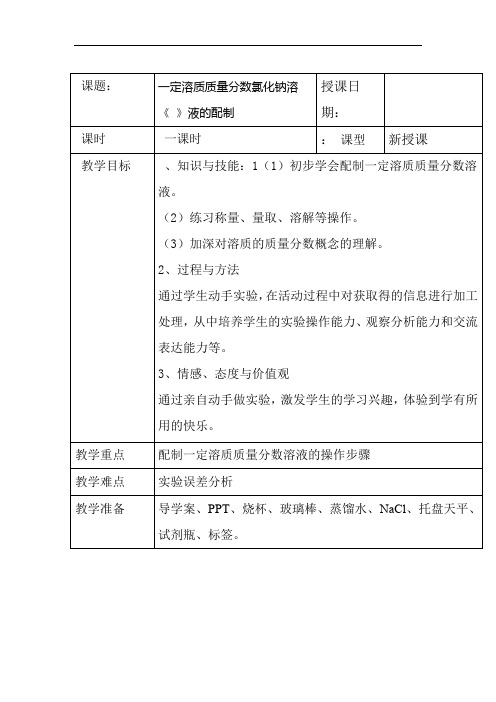
实验活动5 一定溶质质量分数的氯化钠溶液的配制【学习目标】1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
【学习重点】配制溶液的操作步骤与注意事项。
【学习难点】配制溶液时的误差分析。
【学习过程】一、自主学习1.溶液在稀释前后,溶质的质量不变。
2.溶液的配制(1)固体作溶质配制一定质量分数的溶液步骤为计算、称量、量取、溶解;(2)液体作溶质配制一定质量分数的溶液步骤为计算、量取、混匀。
二、新知导学实验目的1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
实验用品托盘天平、烧杯、药匙、量筒、玻璃棒、胶头滴管、氯化钠、蒸馏水。
实验步骤1.配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠3g;水47g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
【注意事项】①检查天平是否平衡,若不平衡则调节平衡螺母使天平平衡;②托盘上各放大小相同、质量相等的干净的纸;③用药匙取NaCl,用过的药匙立刻用干净的纸擦拭干净;④左物右码,正确放置砝码并调节游码至所需质量,然后添加氯化钠固体直至天平平衡;⑤称量完毕,把游码移回0处。
(3)量取:用50 mL量筒量取所需的水,倒入盛有氯化钠的烧杯中。
【注意事项】①倾倒液体时,瓶口紧挨着量筒口;②接近所需体积刻度时,量筒应放在水平面上,视线与凹液面最低处保持水平,用胶头滴管添加液体至所需刻度。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
【注意事项】①使用玻璃棒在烧杯内搅拌,不得用玻璃棒在烧杯中研磨固体。
2.配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/mL),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氧化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:氯化钠溶液25 g(体积24mL);水25 g;(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。


实验活动5 一定溶质质量分数的氯化钠溶液的配制
一、教学目标
【教学目标】
1.知识与技能
(1)初步学习配制一定溶质质量分数的溶液。
(2)通过亲手操作,达到独立完成实验的能力培养。
2.过程与方法
(1)按配制溶液的步骤配制一定溶质质量分数的溶液。
(2)提高学生动手操作能力和科学探究能力。
3.情感、态度与价值观
(1)加深学生对溶质质量分数概念的理解。
(2)培养学生具体问题具体分析的意识。
二、教学重点、难点
【教学重点】配制溶液的操作步骤与注意事项。
【教学难点】配制溶液时的误差分析。
三、教学用具
【教学准备】天平、烧杯、玻璃棒、药匙、量筒、胶头滴管、氯化钠、蒸馏水等。
四、教学过程
【导入新课】在生产生活中,人们如何配制农药呢?
【活动与探究】
请同学们按教材P47~P48“1.配制质量分数为6%的氯化钠溶液”进行实验,并归纳出实验步骤及注意事项。
仪器:托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。
步骤:①计算;②称量;③量取;④溶解;⑤装瓶贴标签。
注意:1.天平使用时注意要用称量纸;调平;左物右码。
2.用镊子取砝码;用镊子移动游码。
3.量筒量取液体时,不可俯视或仰视。
4.搅拌时,不可将溶液溅出。
5.注意贴标签。
【提出问题】
请同学们讨论分析:哪些因素造成配制溶液的质量分数偏低或偏高?
【归纳总结】
1.所配溶液中溶质的质量分数偏大
(1)溶质的质量偏大:称取固体溶质质量偏大或量取浓溶液时仰视读数。
实验活动五一定溶质质量分数的氯化钠溶液的配制教材设计意图:在实际生活中,很多时候必须使用溶质质量分数一定的溶液。
本节课立足溶质质量分数的计算方法,进一步延伸到具体的配制方法,让学生通过亲身的观察、操作和体验,去感受和领悟科学的理念,帮助学生进一步熟悉实验的基本操作,而且要让不同层次的学生都有收获,从而来增加他们学习化学的兴趣。
学生分析:本节课实验操作比较简单,学生多能独立完成,只是熟悉简单的实验操作,每一组的成员,依据学生各方面的能力,按层次ABBC分为一组,依据同学的特点,有组长对学生进行合理的分工,使每个学生都有收获,实验完后,能简单进行实验评价和分析。
同时在实验中进一步提升化学能力及实验的规范化。
A层知识与技能:1、巩固溶质的质量分数概念的理解。
2、知道称量技巧、能准确称量固体。
3、学会配制一定溶质质量分数溶液。
过程与方法:在活动过程中对获取得的信息进行深加工处理,从中提升学生的实验操作能力、观察分析能力和交流表达能力等。
情感·态度·价值观:1、亲自动手做实验,激发学生的学习兴趣,体验到学有所用的快乐。
2.初步养成勤于思考、敢于质疑、严谨求实、乐于实践、善于合作的科学精神。
教学重点:配制一定溶质质量分数溶液的操作步骤。
教学难点:实验误差分析。
教学方法:引导──探究式B层知识与技能:1、加深对溶质的质量分数概念的理解。
2、练习量取的方法、体会量液读数时三点一线。
3、初步学会配制一定溶质质量分数溶液。
过程与方法:活动过程中对获取得的信息进行加工处理,从中提升学生的实验操作能力、观察分析能力和交流表达能力等。
情感·态度·价值观:1、亲自动手做实验,激发学生的学习兴趣,体验到学有所用的快乐。
2.初步养成勤于思考、严谨求实、乐于实践、善于合作的科学精神。
教学重点:配制一定溶质质量分数溶液的操作步骤。
教学难点:简单的实验误差分析。
教学方法:引导、参与──探究式C层知识与技能:1、想一想溶质的质量分数的概念。
实验活动5 一定溶质质量分数的氯化钠溶液的配制
一、教学目标
【教学目标】
1.知识与技能
(1)初步学习配制一定溶质质量分数的溶液。
(2)通过亲手操作,达到独立完成实验的能力培养。
2.过程与方法
(1)按配制溶液的步骤配制一定溶质质量分数的溶液。
(2)提高学生动手操作能力和科学探究能力。
3.情感、态度与价值观
(1)加深学生对溶质质量分数概念的理解。
(2)培养学生具体问题具体分析的意识。
二、教学重点/难点
【教学重点】
配制溶液的操作步骤与注意事项。
【教学难点】
配制溶液时的误差分析。
三、教学用具
【教学准备】天平、烧杯、玻璃棒、药匙、量筒、胶头滴管、氯化钠、蒸馏水等
四、教学过程
【导入新课】
在生产生活中,人们如何配制农药呢?
【活动与探究】
请同学们按教材P47~P48“1.配制质量分数为6%的氯化钠溶液”进行实验,并归纳出实验步骤及注意事项。
仪器:托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。
步骤:①计算;②称量;③量取;④溶解;⑤装瓶贴标签。
注意:1.天平使用时注意要用称量纸;调平;左物右码。
2.用镊子取砝码;用镊子移动游码。
3.量筒量取液体时,不可俯视或仰视。
4.搅拌时,不可将溶液溅出。
5.注意贴标签。
【提出问题】
请同学们讨论分析:哪些因素造成配制溶液的质量分数偏低或偏高?
【归纳总结】
1.所配溶液中溶质的质量分数偏大
(1)溶质的质量偏大:称取固体溶质质量偏大或量取浓溶液时仰视读数。
(2)溶剂的质量偏小:用量筒量取水时,读数时俯视液面;水量好后,向烧杯中倾倒时有液体洒落。
2.所配溶液中溶质的质量分数偏小
(1)溶质的质量偏小:称量固体溶质的质量偏小;所用固体溶质不纯、不干燥或已潮解;称量时“左码右物”并使用了游码;量取浓溶液时俯视读数。
(2)溶剂的质量偏大:量取水时仰视读数;烧杯内有残留的水。
3.装瓶时将溶液洒落不影响溶液中溶质的质量分数,只是溶液质量减小。
【过渡】
上面我们学习了配制一定溶质质量分数的溶液的步骤和方法。
现在,我们将浓溶液配制成稀溶液,请学生们按教材P47“2.配制质量分数为3%的氯化钠溶液”进行实验。
【提出问题】
请同学们讨论分析:由浓溶液配制稀溶液时,计算的依据是什么?
【交流回答】
计算的依据是稀释前后溶液中溶质的质量不变。
【课堂小结】
本节课我们练习了配制一定溶质质量分数的溶液及怎样将浓溶液稀释,了解了配制溶液的步骤及所需仪器,进一步加深了对溶质质量分数的认识。
【布置作业】
完成本课时对应练习,并提醒学生预习下一节的内容。
板书
实验活动5 一定溶质质量分数的氯化钠溶液的配制
一、配制一定溶质质量分数的溶液
仪器:托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管。
步骤:①计算、②称量、③量取、④溶解、⑤装瓶贴标签。
二、浓溶液的稀释
浓溶液稀释的计算依据:稀释前后溶液中溶质的质量不变。