制剂申报临床资料21号
- 格式:doc
- 大小:204.50 KB
- 文档页数:14

申报新药临床需要的资料一、申报资料1、电子版资料(1、2、3、4、7、8、12、13、14、15、16、17、18、19、21、22、29、30、31号资料)2、2号、8号、12号、13号、14号、15号、18号资料附件(附件准备一式六份)二、原始记录1、工艺研究原始记录2、药材检验原始记录、药材检验报告3、质量研究原始记录4、稳定性检验报告(加温6个月、室温18个月)5、三批样品的检验报告6、检查项研究原始记录(重金属、砷盐检查、水分、装量等)7、微生物检验的方法学研究及样品检验报告8、微生物研究原始记录9、三批样品的批生产记录(按照GMP要求,尽量详细)三、电子图谱及照片1、液相电子图谱,时间安排一定合理(含药材检验、工艺验证、质量标准建立、中试样品检验、稳定性考察)2、薄层照片(所有薄层试验都要附彩色照片,含药材检验、质量标准考察、中试样品检验和稳定性考察)四、各种使用记录1、仪器使用记录(天平、崩解仪、液相、紫外等)2、对照品领用记录3、样品销毁记录(注意生产量、使用量、销毁量和现有剩余量的关系!)4、留样样品使用记录5、样品稳定性留样记录(注意留样样品的数量与销毁数量及总量对应)五、其他1、药品注册申请书(报盘资料),从国家局下载最新的报盘软件。
2、药品研制情况申请表六、关于生产现场核查1、生产设备(提取、浓缩、干燥、制剂)大小适应性2、原辅料来源、厂家资质(有发票及明细最好)。
3、包材的来源、厂家资质。
4、批生产记录的合理性。
申报流程1、准备全套资料一套(原件)及注册申请表的电子文档至省药监局受理办公室提交资料(有的省局将报国家局资料一起收);2、省药监局形式审查资料符合要求,出具受理通知书及缴费通知单,30日内组织研制现场核查(须抽样的出具抽样单及送检通知单,抽样单盖公司章后返1份给省局);3、缴费(一般省局2500元,国家局3500元),及时登录国家局网站查看缴费状态并填写缴费信息。

受理编号:换发《药品经营许可证》申请审批表企业名称:申请人:填报日期:年月日受理部门:受理日期:年月日填报说明一、申请前应当阅读《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品经营许可证管理办法》、《开办药品批发企业验收实施标准(试行)》、《新疆维吾尔自治区食品药品监督管理局贯彻〈药品经营许可证管理办法〉有关规定的实施细则》,并确知申请人享有的权利和应履行的义务。
二、申请企业应按照要求填表,内容应准确、完整,并使用钢笔(碳素笔)填写,也可打印,不得涂改。
三、换证企业应提交的材料主要包括:(一)企业换证申请及自查报告;(二)《换发〈药品经营许可证〉申请审批表》;(三)《药品经营许可证》正、副本原件及复印件、营业执照正、副本、《药品经营质量管理规范认证证书》复印件;(四)由地、州、市局出具的无“一般药品经营企业换证限制性条件”第3、4、5、7项、“麻醉药品和精神药品定点经营企业换证限制性条件”第1至8项以及企业、企业法定代表人、企业负责人、质量管理负责人无《药品管理法》第76条、第83条规定情形的证明;(五)由地、州、市局出具的已按规定实施《中国药品电子监管网》及食品药品监管部门搭建的药品电子监管平台情形的证明;(六)企业人员花名册(应包括姓名、性别、出生年月、岗位、学历、专业、职称、执业资格等内容);(七)企业法定代表人、企业负责人、质量管理负责人、质量管理机构负责人、质量管理员、验收员、养护员学历证明、职称证明、执业资格证明、培训或岗位合格证明原件、复印件、身份证复印件、个人简历及聘书;(八)企业组织机构情况;(九)营业场所、仓库地理方位图、平面布置图(标注面积、长、宽、高);(十)营业场所、仓库房屋产权或使用权证明原件和复印件;(十一)现代物流仓储系统情况说明,未要求现代物流设施设备的企业除外;(十二)仓储设施、设备目录;(十三)计算机管理信息系统情况说明;(十四)企业质量管理文件目录;(十五)申报材料时,申请人不是法定代表人或负责人本人的,应当提交由法定代表人签署的《授权委托书》;(十六)保证所申报材料真实性并承担法律责任的承诺书。

新药/仿制药注册申报资料形式审核要求申请注册新药:按照《申报资料项目表》的要求报送资料项目1~30(资料项目6除外)。
临床试验完成后报送的资料项目包括重新整理的综述资料1~6、资料项目12和14、临床试验资料28~32以及重新整理的与变更相关的资料和补充的资料,并按申报资料项目顺序排列。
对于注册分类1的品种,临床试验完成后应根据临床期间进行的各项研究的结果,重新整理报送资料项目1~30的全部资料同时申请注册属于注册分类3的原料药和属于注册分类6的制剂的,其原料药的注册申请应当符合申报生产的要求。
申请注册仿制药品:按照《申报资料项目表》的要求报送资料项目1~16和28~30。
需进行临床试验的,在临床试验完成后报送资料项目28~32以及其他变更和补充的资料,并按申报资料项目顺序排列。
注册申报分三类情况:▪A:申报临床▪B:申报生产▪C:仿制药的申报A、(申报临床)申报资料项目:(一)综述资料1、药品名称。
2、证明性文件。
3、立题目的与依据。
4、对主要研究结果的总结及评价。
5、药品说明书、起草说明及相关参考文献。
6、包装、标签设计样稿。
(可不附)(二)药学研究资料7、药学研究资料综述。
8、原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
9、确证化学结构或者组份的试验资料及文献资料。
10、质量研究工作的试验资料及文献资料。
11、药品标准及起草说明,并提供标准品或者对照品。
12、样品的检验报告书。
13、原料药、辅料的来源及质量标准、检验报告书。
14、药物稳定性研究的试验资料及文献资料。
15、直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料16、药理毒理研究资料综述。
17、主要药效学试验资料及文献资料。
18、一般药理学的试验资料及文献资料。
19、急性毒性试验资料及文献资料。
20、长期毒性试验资料及文献资料。
21、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。

新药Ⅰ期临床试验申报资料的内容及格式要求1995年11月美国FDA发布2009年6月药审中心组织翻译诺华制药有限公司翻译北核协会审核药审中心最终核准目录I. II. III. 引言 (1)现行要求与操作规范 (2)现行新药临床申请法规的解释 (2)A. 封面(FDA格式-1571)[21 CFR 312.23(a)(1)]: (2)B. 目录[21 CFR 312.23(a)(2)]: (2)C. 介绍性声明与整体研究方案[21 CFR 312.23(a)(3)]: (2)D. 研究者手册[21 CFR 312.23(a)(5)]: (2)E. 方案[21 CFR 312.23(a)(6)]: (2)F. 化学、生产和控制信息[21 CFR 312.23(a)(7)]: (3)G. 药理学和毒理学信息[21 CFR 312.23(a)(8)]: (6)H. 研究药物既往在人体中使用的经验[21 CFR 312.23(a)(9)]: (9)I. 21 CFR 312.23(a)(10)、(11)(b)、(c)、(d)(e): (10)新药Ⅰ期临床试验申报资料的内容及格式要求I. 引言随着近期FDA成功实现《1992年处方药付费法》(PDUFA)审评行动的目标,使得从递交上市注册申请至批准上市的平均时间和中位时间均显著缩短。
FDA已将注意力转移至如何提高药品开发过程中其它部分的效率,同时保证这种效率的提高不得以牺牲美国人所期望获得的、具备长期安全性和有效性药品的标准为代价。
其中有一个IND法规特别值得关注,即关于在人体中开始进行药物试验的法规(即Ⅰ期试验),自McMahon 行动会议以来,对此课题已经进行了两年多的积极讨论,并且吸纳了各方不同层次的意见。
本指导原则阐述了在美国将研究药品(包括已进行结构确证的治疗性生物工程类产品)开始用于人体研究时,所需要提供的数据和在21 CFR 312.22和312.23中需要报告的数据1。
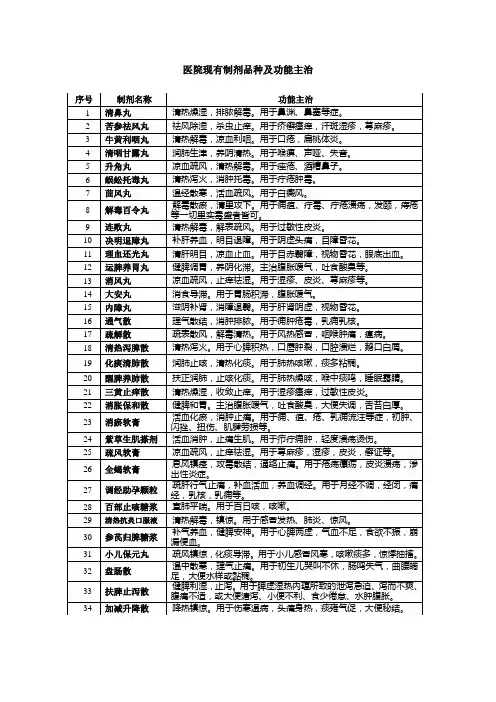
医院现有制剂品种及功能主治医疗机构制剂注册申报资料要求一、申报资料项目1.制剂名称及命名依据。
2.立题目的以及该品种的市场供应情况。
3.证明性文件。
4.标签及说明书设计样稿。
5.处方组成、来源、理论依据以及使用背景情况。
6.配制工艺的研究资料及文献资料。
7.质量研究的试验资料及文献资料。
8.制剂的质量标准草案及起草说明。
9.制剂的稳定性试验资料。
10.样品的自检报告书。
11.辅料的来源及质量标准。
12.直接接触制剂的包装材料和容器的选择依据及质量标准。
13.主要药效学试验资料及文献资料。
14.急性毒性试验资料及文献资料。
15.长期毒性试验资料及文献资料。
16.临床研究方案。
17.临床研究总结。
二、说明1.中药制剂的功能主治的表述必须使用中医术语、中医病名。
2.中药制剂应当与国家药品标准收载的品种进行比较,内容包括:(1)处方组成;(2)理法特色;(3)功能主治。
3.临床前申报资料项目为1-16项。
其中1.、2、3(医疗机构制剂或者使用的处方、工艺等的专利情况及其权属状态说明,以及对他人的专利不构成侵权的保证书)、5、6(临床提出剂型要求及建议以及标明文献,制剂配合)项需医院临床先提供。
见以下模版。
三、目前制剂室所能生产的剂型蜜丸、水丸、胶囊、口服液、糖浆、颗粒、散剂、软膏蓝色剂型为制剂室建议临床申报剂型,因剂型较现代而且利润附加值高。
以下为临床需准备的申报材料模板,供参考。
医疗机构中药制剂申报资料项目1******胶囊制剂名称及命名依据申报单位:黑龙江中医药大学附属第二医院制剂名称:******胶囊(Jiaonang)本品由枇杷叶薏苡仁****味中药组成,具有**********之功效,用于荨麻疹、药疹、多形红斑、玫瑰糠疹、湿疹。
依据主药加病症结合剂型的命名原则,本品命名为:*******胶囊。
医疗机构中药制剂申报资料项目2*******胶囊立题目的以及该品种的市场供应情况申报单位:黑龙江中医药大学附属第二医院********胶囊立题依据以及市场供应情况一、立题依据粉刺,多发于颜面、胸、背,因其生丘疹如刺,可挤出白色碎米样粉汁故名粉刺,又名酒刺、粉花疮,因多生于面部,故又称面疱、面皶疱、面粉渣等,相当于现代医学之寻常性痤疮。
![青岛市卫生局关于开展青岛市医疗机构知名中药制剂评选工作的通知-青卫中医字[2009]21号](https://uimg.taocdn.com/ac2a6a2b82c4bb4cf7ec4afe04a1b0717fd5b3cc.webp)
青岛市卫生局关于开展青岛市医疗机构知名中药制剂评选工作的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 青岛市卫生局关于开展青岛市医疗机构知名中药制剂评选工作的通知(青卫中医字〔2009〕21号)各区、市卫生局,有关医疗单位:为深入学习实践科学发展观,促进中医与中药协同发展,推进医疗机构中医内涵建设,提高医疗机构中药制剂研制水平和临床疗效,打造优势品牌,根据《青岛市中医事业四名工程第二周期实施方案(2007-2011)》和《2009年全市中医工作要点》的有关要求,市卫生局决定委托市中医药学会开展青岛市医疗机构知名中药制剂评选工作,现就有关事宜通知如下:一、申报的基本条件㈠参评中药制剂必须符合《中华人民共和国药品管理法》和《中华人民共和国中医药条例》的有关规定,取得医疗机构制剂批准文号,所在单位应取得《医疗机构制剂许可证》,近一年内在药检部门的历次抽检中均合格,未因质量问题受到投诉。
驻青部队医疗机构参评的中药制剂应符合军队医疗机构制剂管理的有关规定。
㈡参评中药制剂应当是本单位临床需要而市场上没有供应的纯中药制剂,且在临床使用一年以上,疗效确切、安全稳定。
年销售额在5万元以上,年处方量在600张以上。
二、申报程序凡符合基本条件的各类医疗机构应首先对照《青岛市医疗机构知名中药制剂评审标准》(见附件1)进行自评(自评在120分以上者方可推荐),并认真填写《青岛市医疗机构知名中药制剂申报表》(见附件2),加盖公章,并交此制剂成品一盒(瓶),附自评报告(需说明得分、扣分依据,学术论文及科技成果、科研课题应列出目录)、临床总结(说明处方来源、理论依据、疗效统计和有影响力的使用背景)、制剂制备详细说明(包括药材选择、炮制方法、制剂剂型、制备工艺、操作规程、所用设备等)、药效学、安全与毒性研究、稳定性研究材料及质控标准(说明基原)各一份,并与电子版一并经所属区市卫生局初审同意后于2009年5月31日前报市中医药学会办公室(市海慈医疗集团门诊三楼办公区,人民路4号)。

化学药物研究和评价药学问题(2005-2007)1、对已有国家标准的药品,如申请人对该标准进行了完善,并获得注册标准,请问上市后其它部门(如药检所不知道该注册标准),如何执行?答:对已有国家标准的药品,申请人可以根据实际情况对国家标准进行提高完善;上市后,其它部门(如药检所)可以根据品种的文号,查询该品种执行的是国家标准还是注册标准,如执行注册标准,药检部门可通过一定方式得到该质量标准。
当然企业也可主动告知相关部门该品种的执行标准情况。
2、药品生产中使用了较多的二类溶剂,经对大生产的数批产品证明,工艺中使用的有机溶剂已检不出,是否在申报生产的质量标准中保留对这些有机溶剂残留的检查?答:在药品生产中使用的二类溶剂,经过对大生产的数批产品证明,如工艺中使用的有机溶剂已检不出,在申报生产时,质量标准可不保留这些有机溶剂残留的检查,但应提供较为充分的数据积累的结果。
3、有关物质检查时,辅料在HPLC图谱中有峰,按不加校正因子的自身对照品法计算约为0.1%,有关物质的限度为1.0%,若用辅料空白进行扣除时,是扣辅料峰保留时间相同的峰?还是扣除空白辅料峰的面积?答:应该扣除空白辅料峰的面积。
此种方法适用性较差,最好进一步完善方法,避免辅料的干扰。
4、对于国外尚处于I期临床阶段的新药,其质量标准往往只对含量进行规定,而对有关物质等其它项目均无规定。
(1)对这类情况下的新药,在我国申请I 期和临床试验的批准,CDE如何评价其质量标准?(2)只有一批样品是否可以?答:国外尚处于I期临床阶段的新药,其质量标准并不只对含量进行规定,对有关物质则进行更加全面的研究。
国内对这类新药的质量标准,在批准I期和临床试验的时候,在保证质量可控、安全可控的前提下,有些问题是可以在临床期间完善的,但对于与安全性相关的指标(有关物质、有机残留、杂质检查等),在批准临床前必需做到安全、可控。
只进行含量研究是不可行的。
鉴于与国外研究相比,目前国内相关方面的研究明显不足,在进行质量研究时,应至少采用三批样品进行研究。

新药Ⅰ期临床试验申报资料的容及格式要求1995年11月美国FDA发布2009年6月药审中心组织翻译诺华制药有限公司翻译北核协会审核药审中心最终核准目 录I.II. III. 引言 .........................................................................................................................1 现行要求与操作规 ............................................................................. (2)现行新药临床申请法规的解释 (2)A. 封面(FDA 格式-1571)[21 CFR 312.23(a )(1)]: (2)B. 目录[21 CFR 312.23(a )(2)]: (2)C. 介绍性声明与整体研究方案 [21 CFR 312.23(a )(3)]: (2)D. 研究者手册 [21 CFR 312.23(a )(5)]: (2)E. 方案 [21 CFR 312.23(a )(6)]: (2)F. 化学、生产和控制信息 [21 CFR 312.23(a )(7)]: (3)G. 药理学和毒理学信息 [21 CFR 312.23(a )(8)]: (6)H. 研究药物既往在人体中使用的经验 [21 CFR 312.23(a )(9)]: (9)I. 21 CFR 312.23(a )(10)、(11)(b )、(c )、(d )(e ): (10)新药Ⅰ期临床试验申报资料的容及格式要求I. 引言随着近期FDA成功实现《1992年处方药付费法》(PDUFA)审评行动的目标,使得从递交上市注册申请至批准上市的平均时间和中位时间均显著缩短。
FDA已将注意力转移至如何提高药品开发过程中其它部分的效率,同时保证这种效率的提高不得以牺牲美国人所期望获得的、具备长期安全性和有效性药品的标准为代价。

*********CTD格式申报资料一、目录3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂研究3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性3.2.P.2.3 生产工艺的开发3.2P.2.3.1 小试工艺筛选3.2P.2.3.2 中试生产工艺筛选3.2P.2.3.3 生产工艺总结3.2P.2.3.4 关键工艺参数控制3.2P.2.3.5 生产工艺变化汇总3.2P.2.3.6 批分析汇总3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7稳定性3.2.P.7.1 稳定性总结3.2.P.7.2上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据二、申报资料正文3.2.P.1 剂型及产品组成(1)本品为淡黄色或类白色片,规格为50mg,单位剂量产品的处方组成,各成分在处方中的作用以及执行的标准见表3.2.P.1。
表3.2.P.1 产品组成成分用量百分重量作用执行标准微晶纤维素淀粉6026适量69.4030.080.52填充剂填充剂黏合剂中国药典2010年版中国药典2010年版中国药典2010年版(2)本品无专用溶剂。
(3)本品采用PVC 铝塑包装,外加聚酯/铝/聚乙烯复合膜袋。
3.2.P.2 产品开发*********是德国拜耳开发上市的首个口服苷酶抑制剂,1990年首先在德国上市。

附件三:生物制品注册分类及申报资料项目要求第一部分治疗用生物制品二、申报资料(一)申报资料第一部分:综述资料1.新制品名称(包括通用名、英文名、汉语拼音,说明命名依据),选题的目的和依据,国内外有关方面研究现状(包括专利情况)、生产和使用情况综述,附主要参考文献。
2.研制单位研究工作的综述。
第二部分:药学资料3.生产用原材料研究资料。
3.1生产用动物、生物组织或细胞、原料血浆的来源、收集及质量控制等研究资料。
3.2生产用细胞的来源、构建(或筛选)过程及检定等研究资料。
3.3主种子库和生产种子库的建立、检定、保存及传代稳定性资料。
4.原液或原料药生产工艺的研究资料,附生产用各种仪器、培养基质、试剂等的来源及标准。
5.制剂处方及工艺的研究资料,辅料的来源和质量标准,及有关文献资料。
6.中试产品质量研究工作的试验资料及文献资料。
包括理化性质分析、鉴别、纯度检查、有毒杂质检测、含量测定及生物活性测定等,还包括工作参考品或对照品的制备及检定资料。
7.供临床研究用连续三批中试产品的制造和检定原始记录,附中检所复检报告及对检定规程的审核意见。
8.中试产品制造和检定规程草案及起草说明。
9.初步稳定性研究资料。
10.产品内包装材料及其选择依据。
第三部分:临床前研究资料11.主要药效学研究资料及文献资料。
12.安全药理学研究资料及文献资料。
13.单次给药毒性研究资料及文献资料。
14.重复给药毒性研究资料及文献资料。
15.药代动力学研究资料及文献资料。
16.遗传毒性研究资料及文献资料。
17.生殖毒性研究资料及文献资料。
18.致癌研究资料及文献资料。
19.免疫毒性和/或免疫原性研究资料及文献资料。
20.局部耐受性研究资料及文献资料。
21.复方制剂中多种组分的动物药效、毒性、药代动力学相互影响的研究资料及文献资料。
22.药物依赖性研究资料及文献资料。
第四部分:临床资料23.供临床医师参阅的药理、毒理研究及文献的综述。
24.临床研究计划及研究方案。
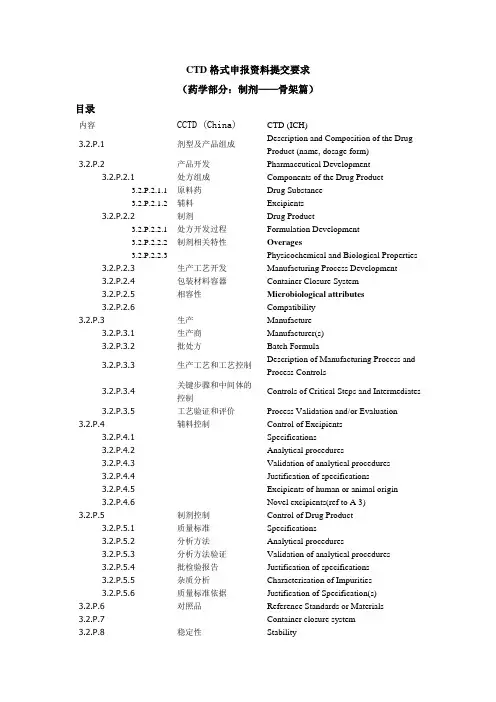
CTD格式申报资料提交要求(药学部分:制剂——骨架篇)目录内容CCTD (China) CTD (ICH)3.2.P.1 剂型及产品组成Description and Composition of the Drug Product (name, dosage form)3.2.P.2 产品开发Pharmaceutical Development3.2.P.2.1 处方组成Components of the Drug Product3.2.P.2.1.1 原料药Drug Substance3.2.P.2.1.2 辅料Excipients3.2.P.2.2 制剂Drug Product3.2.P.2.2.1 处方开发过程Formulation Development3.2.P.2.2.2 制剂相关特性Overages3.2.P.2.2.3 Physicochemical and Biological Properties3.2.P.2.3 生产工艺开发Manufacturing Process Development3.2.P.2.4 包装材料容器Container Closure System3.2.P.2.5 相容性Microbiological attributes3.2.P.2.6 Compatibility3.2.P.3 生产Manufacture3.2.P.3.1 生产商Manufacturer(s)3.2.P.3.2 批处方Batch Formula3.2.P.3.3 生产工艺和工艺控制Description of Manufacturing Process and Process Controls3.2.P.3.4 关键步骤和中间体的控制Controls of Critical Steps and Intermediates3.2.P.3.5 工艺验证和评价Process Validation and/or Evaluation 3.2.P.4 辅料控制Control of Excipients3.2.P.4.1 Specifications3.2.P.4.2 Analytical procedures3.2.P.4.3 Validation of analytical procedures3.2.P.4.4 Justification of specifications3.2.P.4.5 Excipients of human or animal origin3.2.P.4.6 Novel excipients(ref to A 3)3.2.P.5 制剂控制Control of Drug Product3.2.P.5.1 质量标准Specifications3.2.P.5.2 分析方法Analytical procedures3.2.P.5.3 分析方法验证Validation of analytical procedures3.2.P.5.4 批检验报告Justification of specifications3.2.P.5.5 杂质分析Characterisation of Impurities3.2.P.5.6 质量标准依据Justification of Specification(s)3.2.P.6 对照品Reference Standards or Materials 3.2.P.7 Container closure system3.2.P.8 稳定性Stability3.2.P.8.1 稳定性总结 Stability Summary and Conclusion 3.2.P.8.2 上市后稳定性研究方案和承诺 Post-approval Stability Protocol and Stability3.2.P.8.3稳定性数据Stability Data个人定义CTD :ICH 的要求,英文水平所限,仅罗列上,没有核对。
附件化学药品新注册分类申报资料要求(试行)第一部分注册分类1、2、3、5.1类申报资料要求(试行)一、申报资料项目(一)概要1.药品名称。
2.证明性文件。
2.1注册分类1、2、3类证明性文件2.2注册分类5.1类证明性文件3.立题目的与依据。
4.自评估报告。
5.上市许可人信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考文献。
8. 包装、标签设计样稿。
(二)主要研究信息汇总表9. 药学研究信息汇总表。
10. 非临床研究信息汇总表。
11. 临床研究信息汇总表。
(三)药学研究资料12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。
12.1(3.2.S.1)基本信息12.2(3.2.S.2 )生产信息12.3(3.2.S.3 )特性鉴定12.4(3.2.S.4)原料药的质量控制12.5(3.2.S.5)对照品12.6(3.2.S.6)包装材料和容器12.7(3.2.S.7)稳定性13. (3.2.P)制剂。
13.1(3.2.P.1)剂型及产品组成13.2(3.2.P.2)产品开发13.3(3.2.P.3)生产13.4(3.2.P.4)原辅料的控制13.5(3.2.P.5)制剂的质量控制13.6(3.2.P.6)对照品13.7(3.2.P.7)稳定性(四)非临床研究资料14.非临床研究资料综述。
15.主要药效学试验资料及文献资料。
16.安全药理学的试验资料及文献资料。
17.单次给药毒性试验资料及文献资料。
18.重复给药毒性试验资料及文献资料。
19.遗传毒性试验资料及文献资料。
20.生殖毒性试验资料及文献资料。
21.致癌试验资料及文献资料。
22.依赖性试验资料及文献资料。
23.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料及文献资料。
24.其他安全性试验资料及文献资料。
25.非临床药代动力学试验资料及文献资料。
26.复方制剂中多种成分药效、毒性、药代动力学相互影响的试验资料及文献资料。
新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求2003年5月 美国FDA发布2009年6月 药审中心组织翻译辉瑞制药有限公司翻译北核协会审核药审中心最终核准目录Ⅰ. 前言 (1)Ⅱ. 背景 (2)A. 现行法规要求 (2)B.一般原则 (2)Ⅲ. Ⅱ期临床研究 (5)A. 原料药 (6)B. 制剂 (9)Ⅳ. Ⅲ期临床研究 (11)A. 原料药 (12)B. 制剂 (15)Ⅴ. 安慰剂 (19)Ⅵ. 标签 (19)Ⅶ. 环境评估 (19)新药Ⅱ期和Ⅲ期临床试验药学申报资料的内容及格式要求Ⅰ. 前言本指导原则为进行新药临床研究申请(INDs)的申办者,提供新药临床研究申请Ⅱ、Ⅲ期临床研究2申报的药学(CMC)资料方面的建议。
本指导原则适用于人用药(定义见联邦食品、药品和化妆品法案),不适用于植物药3、天然物质衍生获得的药物或使用生物技术产生的蛋白质类药物或其它生物制品。
本指导原则的目的是:(1)确保充足的数据提交给监管机构,从CMC角度评价拟进行的临床研究的安全性和质量;(2)通过阐明Ⅱ、Ⅲ期临床CMC资料的类型、范围和报告,加快新药上市;(3)推动协调药物研发。
提交给监管机构的CMC资料的数量和深度很大程度上取决于临床研究的阶段、拟定的人体试验及资料是否与安全性有关。
本指导原则确定申报资料的补充修订(即CMC安全性信息)和年度报告(即确证资料)中提交的CMC资料。
本指导原则旨在为数据的收集和报告提供更大的灵活性和避免多余的提交,简化对申办者的监管。
简化监管的四个方面如下:z按照惯例提交的某些修正资料会被认定为确证资料(见Ⅱ.B.2部分),其可在年度报告中提交。
zⅢ部分中推荐限定的Ⅱ期相关资料,可在Ⅱ期药物研发中生成,在Ⅱ期试验启动前无需提交。
zⅣ部分中推荐的Ⅲ期相关资料,可在Ⅲ期药物研发中生成,在Ⅲ期试验启动前无需提交。
z年度报告应包含受试者报告期提交的确证资料和CMC安全性资料综述,因此,在Ⅰ期或Ⅱ期结束时无需常规的CMC更新资料。
附件3
医疗机构制剂再注册申报资料
一、《医疗机构制剂再注册申请表》;
二、证明性文件
(一)制剂批准证明文件及批准变更的文件;
(二)《医疗机构执业许可证》和《医疗机构制剂许可证》。
未取得《医疗机构制剂许可证》的医疗机构应当提供受托配制单位的《医疗机构制剂许可证》或《药品生产许可证》;
(三)直接接触制剂的包装材料和容器的注册证或核准编号。
直接接触制剂的包装材料和容器的注册证书在有效期内的应提供注册证,药包材注册证过期或未取得注册证的还应提供该品种在国家药品审评中心网站“原料药、药用辅料和药包材登记信息公示平台”获取登记号的查询打印页面,并加盖公章;
三、三年内制剂临床使用情况及不良反应情况总结;
四、提供制剂处方、工艺、标准,提供制剂处方、工艺、标准未发生改变的承诺书;
五、制剂所用原料药的来源;
六、制剂批准证明文件或者再注册批准文件中要求继续完成工作的,应当提供工作总结报告,并附相应资料。
CDE专家解答之二-化学药物研究与评价药理毒理问题二、化学药物研究与评价药理毒理问题(2005年-2007年)1、普通注射液改成注射用脂质体、脂肪乳等制剂时进行药理毒理研究方面的考虑?答:普通制剂改成脂质体或脂肪乳后,脂溶性或粒径等方面的变化可能导致药物的药代动力学行为和组织分布的变化,进而影响药物的有效性和安全性。
此时,应考虑进行改变前后的药效学比较试验,以及药代动力学和组织分布的组织试验。
如果药物的药代动力学行为和组织分布确实发生明显的改变,应考虑进行制剂的一般药理、急性毒性和长期毒性试验,必要时应进行生殖毒性试验。
2、国外已上市制剂引用的外文文献需翻译其摘要或主要内容吗?(国外已上市制剂引用的外文文献除提供原文外,文献是否应全部译成中文,或仅提供摘要译文;是否需对文献进行综述?)答:需要。
(当引用外文文献时,至少应将摘要译成中文。
)3、国外已上市制剂,无法查到其长毒文献资料,但有大量的临床应用的文献,能否用临床资料代替长期毒性研究资料?答:一般情况下,在能够确定产品与国外已上市制剂在药学方面基本一致的条件下,如果临床试验资料在研究目的、病例入选标准、病例数、用药剂量、频率和周期等方面能够达到要求,多中心临床试验资料或多篇临床试验资料的汇总可以代替长期毒性试验文献。
但应注意临床应用文献和临床试验文献是有区别的,描述性和观察性的临床应用文献对于药品注册价值很有限。
4、滴眼剂的非临床研究内容中三致毒理研究是否可以免做,药代动力学研究如何开展?答:考虑到三致毒性需通过全身吸收后产生,是否可免除三致试验要结合是否存在该药三致毒性担忧和是否已有相关信息两个角度来考虑,前者是指结合本品活性成分的化学本质和给药途径的特点角度考虑,是否有必要提供该方面信息(如体内已有天然物质,吸收量很少),后者是指在有必要提供的前提下检索是否已有该药(活性成分)口服和/或注射系统给药的相关毒理文献信息,如果能检索到符合要求的相关文献,应该是可以免做该研究的。
化学药品资料项目编号:3.1-21盐酸帕洛诺司琼注射液申报临床技术资料特殊安全性试验资料及文献资料研究机构:研究机构地址:研究机构电话:研究机构主要研究者姓名(签名):试验者姓名:试验起止日期:从年月至年月原始资料保存地点:联系人姓名、电话:×××制药股份有限公司目录21-1摘要21-2全身过敏性试验21-3血管刺激性试验21-4溶血试验21-5豚鼠皮肤过敏性试验21-6单次给药的血管刺激性试验21-7家兔皮肤刺激性试验21-8体外人血溶血性试验21-9光毒性试验21-10结论21-11参考文献21-1摘要豚鼠隔日每只腹腔注射盐酸帕洛诺司琼注射液(3μg/ml和15μg/ml,分别相当于30μg/kg和150μg/kg)1ml/100g,共5次。
分别于末次给药后第12天前肢静脉注射盐酸帕洛诺司琼注射液(15μg /ml、50μg/ml)2ml进行攻击,结果均未出现任何过敏反应症状,反应级数0级,表明盐酸帕洛诺司琼注射液全身过敏性试验合格。
浓度为50µg/ml的盐酸帕洛诺司琼注射液无溶血作用,检查结果符合注射用安全性要求。
家兔耳缘静脉缓慢注射浓度为50µg/ml的盐酸帕洛诺司琼注射液5ml,连续三天,耳部组织外观无异常,病理组织检查无组织变性或坏死等刺激反应。
皮肤过敏试验表明通过豚鼠皮肤给予10mg/kg RS-25258-007(帕洛诺司琼的自由基)的制剂不会引起豚鼠过敏。
家兔右耳静脉单次注射帕洛诺司琼 10mg/kg,在接触药物10、30和60分钟后处死动物作大体检查,帕洛诺司琼或溶剂在任何注射静脉均未引起大体或显微变化。
家兔经皮24小时接触含RS-25258-007(自由基)的制剂,结果给予5或10mg/ml RS-25258-007制剂后,给药部位未观察到任何变化。
3只家兔中的1只在接触20mg/ml RS-25258-007的24和48小时出现轻微的红斑。
因此,20mg/ml浓度的RS-25259-007对家兔皮肤有轻至中度刺激。
采用10mg/ml的帕洛诺司琼制剂进行体外人全血相容性和血浆相容性试验。
帕洛诺司琼对从全血中制备的悬浮物未引起明显的溶血或肉眼可见的变化,表明10mg/ml的帕洛诺司琼制剂在体外与人血是相容的。
体外光细胞毒性和光染色体畸变试验及包括一个预初的单剂量光刺激性试验的光敏性研究未显示出任何潜在的对光安全性方面的担忧。
21-2 盐酸帕洛诺司琼注射液全身过敏性试验[摘要]豚鼠隔日每只腹腔注射盐酸帕洛诺司琼注射液(3μg/ml和15μg/ml,分别相当于30μg/kg和150μg/kg)1ml/100g,共5次。
分别于末次给药后第12天前肢静脉注射盐酸帕洛诺司琼注射液(15μg /ml、50μg/ml)2ml进行攻击,结果均未出现任何过敏反应症状,反应级数0级,表明盐酸帕洛诺司琼注射液全身过敏性试验合格。
[试验目的]观察盐酸帕洛诺司琼注射液有无过敏反应。
21-2-1试验材料21-2-1-1药物及试剂盐酸帕洛诺司琼注射液:由×××制药股份有限公司研制,批号:20040403,规格:5ml:0.25mg(以盐酸帕洛诺司琼计)。
将盐酸帕洛诺司琼注射液制剂转移至洁净玻璃瓶内,再用生理盐水稀释至所需浓度使用。
卵白蛋白:华美生物工程公司分装,批号:BP0123。
注射用生理盐水:西南药业股份有限公司生产,批号:66040193。
21-2-1-2动物:普通级健康豚鼠,雌雄不拘,体重200-300g,共32只;由四川省医学科学研究实验动物研究所提供,许可证号:SCXK(川)2003-02。
饲养于普通级动物房,实验动物使用许可证号:SCXK(渝)20040003。
21-2-2试验方法21-2-2-1剂量设置阴性对照组:注射用生理盐水。
阳性对照组:卵白蛋白,致敏浓度为5%;激发浓度为5%。
盐酸帕洛诺司琼注射液低剂量组:致敏浓度为3μg/ml;激发浓度为15μg/ml。
盐酸帕洛诺司琼注射液高剂量组:致敏浓度为15μg/ml;激发浓度为50μg/ml。
21-2-2-2试验分组将豚鼠均分为4组,每组8只,雌雄不拘,1组为阴性对照组,2组为阳性对照组,3、4组为盐酸帕洛诺司琼注射液组。
21-2-2-3给药途径致敏:腹腔注射给药。
激发:前肢静脉注射给药。
21-2-2-4试验步骤致敏:腹腔注射给药,隔日一次,共5次(阳性对照组为末3次给药),受试物高低剂量组按体重给药:1ml/100g,最大不超过4ml,阳性/阴性对照组:1.0ml/只。
激发:末次致敏后第12日一次激发,前肢静脉内快速给药,给药容积1ml/只。
激发后按表1观察豚鼠的过敏反应症状,并按表2分级,判定其过敏试验是否合格。
表1过敏反应症状表2 全身致敏性评价标准反应级数达2级以上(包括2级)时,该供试品可认为过敏试验不合格。
21-2-3试验结果阴性对照组及盐酸帕洛诺司琼注射液组的豚鼠在末次致敏后12天攻击时未出现过敏反应症状,注射5%卵白蛋白阳性对照组8只豚鼠均出现竖毛、喷嚏、咳嗽、呼吸困难、颤抖、痉挛、休克死亡等明显过敏反应症状。
结果见表3。
表3 盐酸帕洛诺司琼注射液豚鼠过敏反应级数6续表3 盐酸帕洛诺司琼注射液豚鼠过敏反应级数721-2-4试验结论豚鼠隔日每只腹腔注射盐酸帕洛诺司琼注射液(3μg/ml和15μg/ml,分别相当于30μg/kg和150μg/kg)1ml/100g,共5次,末次致敏后第14天前肢静脉注射注射1ml盐酸帕洛诺司琼注射液(15μg/ml、50μg/ml),豚鼠过敏反应级数为0级,与注射用生理盐水的阴性对照组相同,注射卵蛋白的阳性对照组反应级数为4级。
表明盐酸帕洛诺司琼注射液过敏试验合格。
21-3 盐酸帕洛诺司琼注射液溶血性试验[摘要]浓度为50µg/ml的盐酸帕洛诺司琼注射液无溶血作用,检查结果符合注射用安全性要求。
[试验目的]检查浓度为50µg/ml的盐酸帕洛诺司琼注射液有无溶血和凝集等反应。
21-3-1试验材料21-3-1-1药物及试剂盐酸帕洛诺司琼注射液:由×××制药股份有限公司研制,批号:20040403,规格:5ml:0.25mg(以盐酸帕洛诺司琼计)。
生理盐水:西南药业股份有限公司生产,批号:66040193。
21-3-1-2动物普通级健康家兔,1只,体重2.2kg,雄性,由重庆中药研究院实验动物研究室提供,许可证号:SCXK(渝)20020004。
饲养于普通级动物房,实验动物使用许可证号:SCXK(渝)20040003。
21-3-1-3仪器电子恒温水浴箱:型号:DZKW-4,上海科析试验仪器厂;台式离心机:型号:LDZ4-0.8,北京医用离心机厂。
21-3-2试验方法21-3-2-1 2%兔血生理盐水混悬液的制备:取家兔心脏血10ml,置于装有玻璃珠的三角瓶中,摇动以去除纤维蛋白,加入生理盐水,移入离心管内,于离心机3000转/min离心10min。
丢弃上清液,再加生理盐水混匀离心,反复3-4次,直至上清液呈无色透明方可用于试验。
将所得兔红细胞按其体积用生理盐水稀释成2%的混悬液。
21-3-2-2取洁净试管7只,按1-7号进行编号,1-5号管为供试品管,6号管为阴性对照管,7号管为阳性对照管。
按表4所示依次加入2%红细胞悬液、0.9%氯化钠溶液或蒸馏水及受试药物,混匀后,立即置37℃±0.5℃的恒温箱中进行温育,开始每隔15分钟观察一次,1小时后,每隔1小时观察一次,一般观察3小时。
21-3-3 试验结果见表4。
表4 盐酸帕洛诺司琼注射液的溶血反应注:结果中“+”表示溶血; “-”表示不溶血.结果表明盐酸帕洛诺司琼注射液两组(浓度为50μg/ml)在0.1、0.2、0.3、0.4、0.5ml管中,经37℃保温1、30、45min、1、2、3hr,均未出现溶血和凝集反应,上层液无色澄明,红细胞全部下沉。
而第7管加蒸馏水后不到1min即出现溶血,上层液呈澄明红色。
21-3-4 试验结论50µg/ml的盐酸帕洛诺司琼注射液在观察期间均未见上层液澄明红色,红细胞全部下沉,振摇后能很好分散,即无溶血和凝集现象。
故浓度为50µg/ml的盐酸帕洛诺司琼注射液符合注射用安全性检查要求。
21-4 盐酸帕洛诺司琼注射液血管刺激性试验[摘要]家兔耳缘静脉缓慢注射盐酸帕洛诺司琼注射液(浓度为50µg/ml)5ml,耳部组织外观无异常,病理组织检查无组织变性或坏死等刺激反应。
[试验目的]观察家兔耳缘静脉滴注浓度为50µg/ml的盐酸帕洛诺司琼注射液对血管有否产生刺激反应。
21-4-1试验材料21-4-1-1药物及试剂盐酸帕洛诺司琼注射液:×××制药股份有限公司研制,批号:20040403,规格:5ml:0.25mg(以盐酸帕洛诺司琼计)。
注射用生理盐水:西南药业股份有限公司生产,批号:66040193。
21-4-1-2试验动物普通级健康家兔,5只,雌雄兼有,体重2kg左右,由重庆中药研究院实验动物研究室提供,许可证号:SCXK(渝)20020004。
饲养于普通级动物房,实验动物使用许可证号:SCXK(渝)20040003。
21-4-2试验方法将家兔固定好后,于左边耳缘静脉以无菌操作方法缓慢滴注入盐酸帕洛诺司琼溶液(浓度为50µg/ml)5ml,右边耳缘静脉相应部位同法注入5ml的灭菌生理盐水作为对照,连续给药3天。
末次给药48小时后,将3只家兔放血处死,于距注射部位近心端2cm左右处取耳缘组织(3×3cm2),用10%甲醛液(福尔马林)固定,然后进行组织病理学检查。
剩下的2只动物根据受试物刺激性反应情况,继续观察14天后处死,根据末次给药48小时后处死家兔的病理组织学检查结果决定是否进行病理样本取材,以了解刺激性反应的可逆程度。
21-4-3试验结果家兔耳缘静脉滴注浓度为50µg/ml的盐酸帕洛诺司琼注射液5ml后,注射部位外观未见淤血和肿胀现象。
末次给药后48小时处死部分家兔的病理检查显示:静注盐酸帕洛诺司琼注射液与0.9%氯化钠注射液,耳部组织结构完整,无变性坏死及出血现象发生。
14天后对剩下的2只家兔直接处死,不作病理取材。
21-4-4试验结论家兔耳缘静脉滴注盐酸帕洛诺司琼注射液(浓度为50µg/ml)5ml,每日1次,连续3日,耳部组织外观无异常,病理组织检查无炎症、无组织变性或坏死等显著刺激反应。
21-5豚鼠皮肤过敏性试验[1]21-5-1方法:使用10只雌性豚鼠检查RS-25258-007(帕洛诺司琼的自由基)制剂引起皮肤过敏反应的可能性。