第4章有机金属化合物-习题
- 格式:pdf
- 大小:218.31 KB
- 文档页数:4

第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近; (2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷; (4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷); (5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛; (6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰; (2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
C CH 3CH 3H 3CBrCH 2OHCH 3CH BrCH 3(1)(2)(3)(4)CH 2CH 2CHCH 3BrBr4-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。




有机化合物课后习题答案有机化合物课后习题答案第一章绪论习题答案1 •说明有机化合物的特点。
答案:有机化合物的特点是:数目繁多,结构复杂;稳定性差,容易燃烧;熔点•沸点较低;难溶于水;易溶于有机溶剂;反应速度慢;反应复杂,副产物多。
2•计算C7H702N的不饱和度并写出可能的结构式。
答案:有机化合物的不饱和度计算公式为,代入数字得不饱和度为5,所以可能的部分结构式分别是:3.搞清下列各概念并思考各组概念的区别。
①均裂•异裂;②离子型反应•游离基反应;③亲电反应•亲核反应;④键的极性和键的极化度;⑤键长•键角;⑥键能•键的离解能答案:①均裂共价键断裂后,两个成键原子共用的一对电子由两个原子各保留一个。
异裂共价键断裂后,共用电子对只归属原来生成共价键的两个原子中的一个。
②有离子参加的反应叫离子型反应。
有自由基(游离基)参加的反应叫游离基反应。
③由亲核试剂的进攻而发生的反应叫亲核反应。
由亲电试剂的进攻而发生的反应叫亲电反应。
④键的极性是由于成键原子的电负性不同而引起的。
当成键原子的电负性不同时,核间的电子云密集区域偏向电负性较大的原子一端,使之带部分负电荷,而电负性较小的原子一端则带部分正电荷,键的正电荷重心与负电荷重心不重合,这样的共价键称为极性共价键。
如HC1分子中的H-C1键就是极性共价键。
键的极化度是指在外界电场的影响下,共价键的电子云重新分布。
无论是非极性分子或极性分子的极化状态都将发生变化,使极性分子的极性增强,非极性分子变为极性分子。
⑤键长(Bond length):指分了中两成键原了核间的平衡距离。
键角(Bond angle):指分了中同一原了形成的两个化学键Z间的夹角。
键角是反映分子空间结构的重要因素。
⑥键能(Bond energy):在25。
(2和101. 325kPa压力下,以共价键结合的A. B两个原子在气态时使用键断裂,分解为A和B两个原子(气态)所消耗的能量叫做键能。
键离解能(Dissociation energy): 一个共价键断裂所消耗的能量叫做共价键的离解能。

第四章相平衡思考题1.什么叫自由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质称为系统的自由度。
相律就是在平衡系统中,系统内相数、组分数、自由度数及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。
相律是一个定性规律,可以指示相平衡体系中有几个相,可以指导如何去识别由实验绘制的相图。
2.水的三相点与冰点是否相同?答:不相同。
纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为610.62Pa,温度为273.16K。
热力学温标1K就是取水的三相点温度的1/273.16K。
5 水的冰点是在大气压力下,水的三相共存点的温度。
由于冰点受外界压力影响,在10Pa压力下,温度下降0.00747K,由于水中溶解了空气,温度又下降0.0024K,所以在大气压力为105Pa时,水的冰点为273.15K。
3.相点与物系点有什么区别?答:相点是相图中表示某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压力等。
相点位置可随压力、温度的改变而改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表示系统总组成的点,在单相区,物系点可与相点重合,而在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表示。
在T-x图上,物系点可沿着与温度坐标平行的直线上下移动;在水盐系统图上,随着水的含量不同,物系点可沿着与组成坐标平行的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是气-液-固三相共存,这时的自由度为零,它的压力、温度由系统自身性质决定,不受外界因素影响。
而二组分系统的低共熔点在等压的条件下自由度为零。
外压改变,低共熔点的温度和组成也会随之而改变。
5.米粉和面粉混合得十分均匀。
再也无法彼此分开,这时混合体系有几相?答:两相6.金粉和银粉混合后加热,使之熔融后冷却,得到的固体是一相还是两相?答:一相7.低共熔物能不能看作是化合物?答:不能。
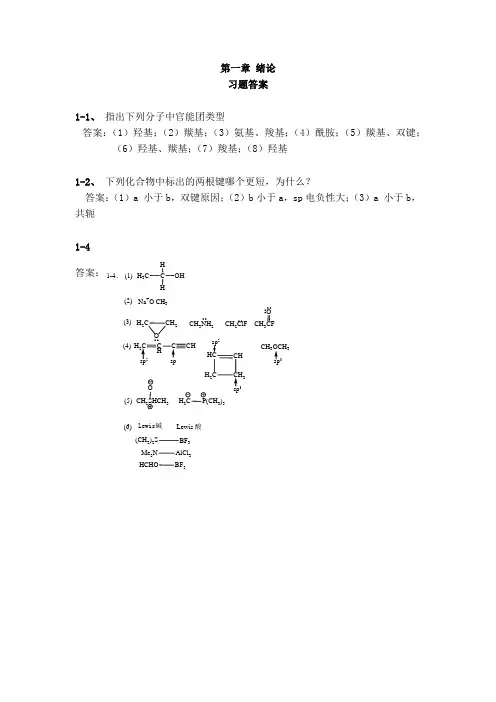
第一章 绪论 习题答案1-1、 指出下列分子中官能团类型答案:(1)羟基;(2)羰基;(3)氨基、羧基;(4)酰胺;(5)羰基、双键;(6)羟基、羰基;(7)羧基;(8)羟基1-2、 下列化合物中标出的两根键哪个更短,为什么?答案:(1)a 小于b ,双键原因;(2)b 小于a ,sp 电负性大;(3)a 小于b ,共轭 1-4 答案:(1)C HHH 3COH(2)Na +O -CH 3(3)H 2C CH 2O(4)CH 3NH 2CH 2ClF3HHC CH H 2CCH2sp 23CH 333(5)CH 2SHCH 3OH 2CP(CH 3)3(6)Lewis 酸Lewis 碱(CH 3)2S BF 3Me 3N AlCl 3HCHOBF 31-4、第2章 烷烃和环烷烃习题及答案2-1 用中文系统命名法命名或写出结构式。
答案: (1)2,6,6-三甲基-3-乙基辛烷 (2)2,6,7-三甲基壬烷(3)1-甲基-1-氯环己烷 (4) 顺-1,2-二溴环己烷 (5(6)(7)CCCC CH 3CH 3CH 3CH 3H 3H 3(8) (CH 3)2CHCH 2CH 2CH 32-2 用不同符号标出下列化合物中伯、仲、叔、季碳原子,并给以命名。
答案: (1) CH 3CH CH 2C C CH 3CH 3CH 2CH 3CH 3CH 3CH 2CH 31o 1o 1o1o1o1oo 2o2o 21o o 3o4o 43,3,4,4,6-五甲基辛烷 (2) CH3CH(CH 3)CH 2C(CH 3)2CH(CH 3)CH 2CH31o1o1o1o1oo2o2o 3o 3o 42,4,4,5-四甲基庚烷2-3 指出下列四个化合物的命名中不正确的地方并给以重新命名。
答案: (1)主链选错。
应为:2,4,6-三甲基-6-乙基辛烷 (2)主链、碳原子编号错。
应为:2-甲基-3乙基己烷 (3)碳原子编号错。

第四章 炔烃和二烯烃(习题和答案)一、给出下列化合物的名称1.H C CH 3H C CH 3C C HH 2. CH CH CH 2CH 2C(Z ,E)-2,4-己二烯 1-戊烯-4-炔3. CH CH 2CH 3C 2H 5CH 3C C C4. (CH 3)2CH C(CH 3)3C C4-乙基-4-庚烯-2-炔 2,2,,5-三甲基-3-己炔5. CH CH CH CH 2CH C6. CH CH CH CH 3CC C1,3-己二烯-5-炔 5-庚烯-1,3-二炔7. (CH 3)2CH H C C 2H 5C H C C 8.CH 2CH 2CH=CH 2CH 3CH 2CH 3CH C C(E)-2-甲基-3-辛烯-5-炔 3-乙基-1-辛烯-6-炔9. H H C C 2H 5C CH 3C C H H 10. CH H C CH CH 3C CH 3CH 3C(Z ,Z)-2,4-庚二烯 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构1. 丙烯基乙炔 2. 环戊基乙炔CH CH CH CH 3C CHC3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 CH 2CH 3HC CH 3C H C C CH CHCH 2CH 3CH CH 3CH C5.(Z)-3-甲基-4-乙基-1,3-己二烯-5-炔 6.1-己烯-5-炔CH CH 2CH3CHCH 2C CH 3C C CH CH CH 2CH 2CH 2C 7.(2E ,5Z)-6-甲基-2,5-辛二烯 8.3-甲基-3-戊烯-1-炔H H C C 2H 5CH 2CH 3C CH 3C C H CH3CH CH 3C C9.甲基异丙基乙炔 10.3-戊烯-1-炔CH (CH 3)2CH 3C C CHCH 3CH CH C 三、完成下列反应式 1.Cl 2CH 2CH 2CH CHC ClCH 2CH 2CH CHC2.稀H 2SO 4CH 3CH 2CHCHgSO 4OCH 3CH 3CH 23.+CH CH CH CH 3OCH=CH 2CC CH OOO CH 3C C O O4.NaCH 2CH NH 3O s O 4H 2O 2CH 3CC 液 HHC C 2H 5CH 3C HOC 2H 5(±)OHCH 3HH 5.CH CH 3Br 2CCl 4CH 3CC CH CH Br CH 3Br CH 3C C CH 6.H 2催化剂Lindlar CH 3CH CC H HC CH 3C CH 37.2CHCOCH 3C8.Na2CH 2CHCCH 2CHCCH 2CH 3C9.H 2OCH 24+CH CH 3CH CHgSO 4CH CH 3C OCH 3CH10.KMnO 4KOHCH 3CH 2CCOOK +CO CH 3CH 211.CH ClCH 2CH F +C CAg(NH 3) CH C CH 2FC CAg12.CHCH 3CH 2CCH 2CH 2CH 3CHO13.Na INH 3CH 3CHCH 3C液H 2Pt /PbCNa CH 3C CCH 3CH 3CH HC CH 3C CH 314.H 2OCOOHKMnO 4C 2H 5CH 3CH +B 2H C C 2H 5CH=CH 2CH 2OH C 2H 5CH 15.CH 2CH 2CH HBr CH +CCH 2CH Br CHCH 3C16.CH 2C 3+CH=CH 2 CH 2C CH 3Br +CH CH 3(主)CH 2C CH 3CH CH 3(次)17.CH C 6H 5+CH CH=CH 2 CH C 6H 5CH Cl CH CH 318.CH 3CH CC OCH 3CH 3CH 219.O 3C H 2OCH 3CH 2CH 3C COOH CH 3CH 2CH 3COOH +20.△ClNa NH 2CH 3ClCCHCCH 2CHO四、用化学方法鉴别下列化合物1.(A) 己烷 (B) 1-己炔 (C) 2-己炔答:加入溴水不褪色的为(A),余下两者加入Ag(NH 3)2+溶液有白色沉淀生成的为(B),另者为(C)。

第1章 绪论思考题1–1 典型有机物和典型无机物性质上有何不同?举例说明。
有机物易燃烧,不易溶于水,熔点和沸点都比较低。
如:有机物的熔点一般低于300℃,通常在40~300℃之间,而食盐的熔点为808℃。
思考题1–2 解释为何C=C 的键能比C –C 的键能的2倍要小。
σ键的键能比π键的键能大得多。
如C –C 键能为348 kJ·mol -1,而C=C 键能为610 kJ·mol -1,这表明π键的键能只有264 kJ·mol -1。
表1–1是一些常见共价键的键能。
思考题1–3 用δ+和δ-分别表示下列化合物的正负极(1)CH 3-NH 2 (2)CH 3-OHδ+ δ-δ+δ-思考题1–4 下列化合物哪些是极性化合物,哪些是非极性化合物? 极性化合物:CH 3Cl ,CH 3OH 非极性化合物:CCH 4, CCl 4, CH 3COCH 3思考题1–5 酸碱的质子理论中,下列化合物中哪些为酸?哪些为碱?哪些既为酸,又能为碱?酸:NH 4+, HI 碱:CN –既为酸,又能为碱:HS – ,H 2O思考题1–6 按酸碱的电子理论下列反应中,哪个反应物为酸,哪个反应物为碱? AlCl 3为酸,COCl 2为碱思考题1–7 下列化合物沸点由高到低的顺序为:CH 3(CH 2)4OHCH 3(CH 2)3CH 3(CH 3)4C abcd(CH 3)2CHCH 2CH 3c>a>d>b思考题1–8 矿物油(相对分子质量较大的烃的混合物)能溶于己烷,但不溶于乙醇和水,说明原因。
根据“相似相溶”原理,矿物油是非极性分子,而水和乙醇是极性分子,故不宜互溶。
习 题1.下列化合物各属于有机化合物还是无机化合物,分别属于哪一类别? 有机化合物:(1)(3)(4)(5)(6)(7)(8)(9)(10) 无机化合物:(2)2.写出甲烷CH 4分子的一个C –H 键均裂产生的自由基结构。
p941.解释下列名词。
共轭效应互变异构1,4-加成亲核加成乙烯基化反应氢化热离域能(共轭能)超共轭效应双烯合成亲双烯体红外活性键的伸缩振动键的弯曲振动解:共轭效应:由于结构的原因,双键π电子云不再只定域在双键上,也有部分离域到分子的其它部分,即发生了键的离域。
这种离域效应叫共轭效应。
互变异构:在一般条件下,两个构造异构体可以迅速地相互转变的异构现象。
1,4-加成:一分子试剂加在共轭双键两端的加成反应。
亲核加成:由亲核试剂进攻而引起的加成反应。
乙烯基化反应:反应物分子中的氢原子被乙烯基取代的反应。
氢化热:每一摩尔烯烃催化加氢时放出的能量叫氢化热。
离域能(共轭能):共轭分子中由于键的离域而导致分子的额外的稳定能,称为离域能。
超共轭效应:σ轨道与π轨道相互作用而引起的离域效应。
双烯合成:共轭二烯和某些具有碳碳双键的化合物发生1,4-加成,生成环状化合物的反应。
亲双烯体:在双烯合成中能和共轭二烯反应的重键化合物叫做亲双烯体。
红外活性:能吸收红外辐射的性质。
键的伸缩振动:只改变键长,而不改变键角的振动。
键的弯曲振动:只改变键角,而不改变键长的振动。
2.用系统命名法命名下列化合物:(1) (CH3)3CC≡CCH2CH3(2) HC≡CCH2Br (3) CH2=CHC≡CH (4)CH2=CHCH2CH2C≡CH (5) CH3CHClC≡CCH2CH3(6) CH3C≡CC(CH=CH2)=CHCH2CH3(7)解:(1) 2,2-二甲基-3-己炔(2) 3-溴丙炔(3) 1-丁烯-3-炔(4) 1-己烯-5-炔(5) 2-氯-3-己炔(6) 4 –乙烯基-4 –庚烯-2-炔(7) 1,3,5-己三烯3.写出下列化合物的构造式。
(1) 4 –甲基-1-戊炔(2) 3 –甲基-3-戊烯-1-炔(3) 二异丙基乙炔(4) 1,5 –己二炔(5) 异戊二烯(6) 丁苯橡胶(7) 乙基叔丁基乙炔解:(1) CH≡CCH2CH(CH3)CH3(2) CH≡CC(CH3)=CHCH3(3) (CH3)2CHC≡CCH(CH3)2(4) CH≡CCH2CH2C≡CH (5) CH2=C(CH3)CH=CH2(6) -[-CH2CH=CHCH2CH(C6H5)CH2-〕n- (7)CH3CH2C≡CC(CH3)34.写出1-丁炔与下列试剂作用的反应式。
第四章二烯烃和共轭体系思考题习题4.1 下列化合物有无顺反异构体?若有,写出其构型式并命名。
(P119)(1) 1,3-戊二烯解:有2个顺反异构体!(Z)- 1,3-戊二烯 (E)- 1,3-戊二烯(2) 2,4,6-辛三烯解:有6个顺反异构体!(Z,Z,Z)- 2,4,6-辛三烯(Z,Z,E)- 2,4,6-辛三烯(E,Z,E)- 2,4,6-辛三烯(E,E,E)- 2,4,6-辛三烯(E,E,Z)- 2,4,6-辛三烯 (Z,E,Z)- 2,4,6-辛三烯习题4.2 下列各组化合物或碳正离子或自由基哪个较稳定?为什么?(P126)(1) 3-甲基-2,5-庚二烯和 5-甲基-2,4-庚二烯√(2)(3)(4) (5)(6)习题4.3 解释下列事实:(P126)(1)(2)(3)习题4.4 什么是极限结构?什么是共振杂化体?一个化合物可以写出的极限结构式增多标志着什么?(P130)解:极限结构——对真实结构有贡献,但不能完全代表真实结构的经典结构式;共振杂化体——由若干个极限结构式表示的该化合物的真实结构。
一个化合物可以写出的极限结构式增多标志着该化合物稳定性增加。
习题4.5 写出下列化合物或离子可能的极限结构式,并指出哪个贡献最大。
(P130)(1)(2)(3)习题4.6 指出下列各对化合物或离子是否互为极限结构。
(P130)(1) (原子核有位移,不符合共振条件)(2) (原子核有位移,不符合共振条件)(3) (原子核有位移,不符合共振条件)(4)(原子核无位移,只是电子发生转移,符合共振条件)习题4.7 完成下列反应式,并说明理由。
(P132)(1)(低温下,动力学产物为主要产物,即以1,2-加成为主。
)(2)(较高温度下,以1,4-加成为主,形成更加稳定的热力学产物。
)(3)(较高温度下,形成更加稳定的热力学产物。
而1,6-加成的产物共轭程度更高,更加稳定。
)习题4.8 试判断下列反应的结果,并说明原因。
第4章-习题答案(科学出版社)第四章相平衡思考题1.什么叫⾃由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在⼀定范围内独⽴变动的强度性质称为系统的⾃由度。
相律就是在平衡系统中,系统内相数、组分数、⾃由度数及影响物质性质的外界因素(如温度、压⼒、重⼒场、磁场、表⾯能等)之间关系的规律。
相律是⼀个定性规律,可以指⽰相平衡体系中有⼏个相,可以指导如何去识别由实验绘制的相图。
2.⽔的三相点与冰点是否相同?答:不相同。
纯⽔的三相点是⽓-液-固三相共存,其温度和压⼒由⽔本⾝性质决定,这时的压⼒为610.62Pa,温度为273.16K。
热⼒学温标1K就是取⽔的三相点温度的1/273.16K。
⽔的冰点是在⼤⽓压⼒下,⽔的三相共存点的温度。
由于冰点受外界压⼒影响,在105Pa压⼒下,温度下降0.00747K,由于⽔中溶解了空⽓,温度⼜下降0.0024K,所以在⼤⽓压⼒为105Pa时,⽔的冰点为273.15K 。
3.相点与物系点有什么区别?答:相点是相图中表⽰某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压⼒等。
相点位置可随压⼒、温度的改变⽽改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表⽰系统总组成的点,在单相区,物系点可与相点重合,⽽在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表⽰。
在T-x图上,物系点可沿着与温度坐标平⾏的直线上下移动;在⽔盐系统图上,随着⽔的含量不同,物系点可沿着与组成坐标平⾏的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是⽓-液-固三相共存,这时的⾃由度为零,它的压⼒、温度由系统⾃⾝性质决定,不受外界因素影响。
⽽⼆组分系统的低共熔点在等压的条件下⾃由度为零。
外压改变,低共熔点的温度和组成也会随之⽽改变。
5.⽶粉和⾯粉混合得⼗分均匀。
4章思考题4.1付-克烷基化反应的特点是什么?4.2解释什么叫定位基,并说明有哪三类定位基。
4.3解释定位效应。
4.4共振论对于共振结构式有何规定?4.5试说明芳香亲电取代反应的机理。
4.6甲苯和对二甲苯相比哪个对游离基卤代反应更活泼?试说明理由。
4.7用KMnO 4或心6。
7+『使PhCH s氧化成PhCOOH的反应产率很差,而由P-O2N-C6H4CH3 氧化成P-O2NC6H4COOH,同样的氧化反应却有较好的产率。
如何解释。
4.8回答下列问题。
(1)(1)环丁二烯只在较低温度下才能存在,高于35K即(如分子间发生双烯合成)转变为二聚体,已知它的衍生物二苯基环丁二烯有三种异构体。
上述现象说明什么?写出二苯基环丁二烯三种异构体的构造式。
(2)(2) 1,3,5,7-环辛四烯能使冷的高锰酸钾水溶液迅速褪色,和溴的四氯化碳溶液作用得到C s H8Br8a、它应具有什么样的结构?+ 2-b、b、金属钾和环辛四烯作用即得到一个稳定的化合物2K C8H8 (环辛四烯二负离子)。
这种盐的形成说明了什么?预期环辛四烯二负离子将有怎样的结构?解答4.1答:(1)因烷基正离子容易重排,易形成烷基异构化产物;(2)烷基可活化苯环,易使烷基化反应产物为多元取代产物;(3)烷基化反应是可逆反应,使得产物可能复杂化。
4.2答:苯环上已有一个取代基后,再进行亲电取代反应时,新进入的基团进入苯环的位置由环上原有取代基的性质决定,这个原有的取代基叫定位基。
定位基可分为三类,即(1)邻、对位定位基,如一OH、一NH 2、一NHCOCH 3、一CH3等,这类基团使苯环活化,并且使新引入的取代基在定位基的邻位和对位。
(2)间位定位基,如一NO2、—CN、—COCH 3' —COOH、—SO3H等,这类基团使苯环钝化,并使新引入的取代基在它的间位。
(3)卤素是一类特殊的定位基,它使苯环钝化,但都是邻、对定位基。
4.3答:邻、对位定位基的推电子作用是苯环活化的原因,这又可分为两种情况:①在与苯环成键的原子上有一对未共享电子,这对电子可以通过大n键离域到苯环上;②虽无未共享电子对,但能通过诱导效应或超共轭效应起推电子作用的基团,如甲基或其他烷基。