设计实验 总黄酮的提取和测定
- 格式:doc
- 大小:50.00 KB
- 文档页数:3

山楂中总黄酮的提取及含量测定(吕培银)一、实验目的1.掌握黄酮类物质的提取方法。
2.掌握分光光度法测定黄酮含量的原理。
二、实验原理山楂富含黄酮类化合物,具有重要的生理活性和药效。
黄酮化合物的母核由C6-C3-C6即A-C-B三个环组成,A环和B环具有芳香化合物的性质,C环具有黄酮化合物的独特性质。
母核中某些位置如C3和C5上含有羟基或具有邻二酚羟基时能与铝、铅等金属离子形成稳定的络合物,这些络合物在光谱上产生明显变化。
黄酮与金属离子的这种作用不仅可以用于鉴别这类成分中羟基的位置,还可以作为进行定量分析的基础。
本实验利用碱性条件下,在亚硝酸盐存在时,硝酸铝与黄酮进行络合反应,生成红色络合物,且在500 nm左右有最大吸收,可利用分光光度法进行测定。
因此,本实验采用索氏提取法提取山楂中的总黄酮,并采用分光光度法对其含量进行测定。
三、实验用品1、仪器:索氏提取器、平底烧瓶、电热套、量筒、试管、容量瓶、移液管、玻璃比色皿、可见分光光度计等。
2、药品:山楂粉末、无水乙醇、芦丁标准品、硝酸铝、亚硝酸钠、氢氧化钠等。
四、实验内容1、山楂总黄酮的提取精密称取山楂粉末6 g,滤纸包好后置于250 mL索氏提取器中,加60%乙醇150 mL,连续回流提取1-1.5h, 冷却,将提取液转移至250 mL的容量瓶中,将圆底烧瓶润洗3次,60%乙醇定容至刻度线,摇匀,过滤。
取1 mL滤液稀释至10mL,摇匀,即为样品待测溶液。
2、芦丁标准溶液的配制精密称取芦丁20 mg,加入60 mL无水乙醇超声使其溶解后,以蒸馏水定容至100mL,摇匀,即得0.2 mg/mL的芦丁标准液。
3、芦丁标准曲线的制定分别精密吸取芦丁标准液5mL、6mL、7mL、8mL、9mL至10mL容量瓶中,60%乙醇定容后得到浓度为0.10 mg/mL、0.12 mg/mL、0.14 mg/mL、0.16mg/mL 和0.18mg/mL的芦丁系列浓度梯度溶液。


菊花中总黄酮的含量测定
菊花中总黄酮的含量可以通过以下步骤进行测定:
1. 菊花样品的制备:将干燥的菊花样品磨成粉末,并通过筛网得到均匀的颗粒状样品。
2. 提取黄酮化合物:将菊花样品加入适量的溶剂(如乙醇、乙酸乙酯等),在适当条件下进行浸提,如使用超声波浸提或加热浸提。
3. 滤液处理:将浸提得到的溶液通过滤纸过滤,去除固体颗粒。
4. 冷却与浓缩:将滤液置于冷环境中,待其冷却,然后使用旋转蒸发器将溶液浓缩。
5. 与试剂反应:将浓缩后的溶液与适当的试剂反应,如添加醋酸铝试剂(亚铁试剂)、硼酸试剂等,进行反应产生颜色。
6. 测定吸光度:使用紫外可见光谱仪测定反应产生的颜色的吸光度。
7. 与标准曲线对比:使用已知浓度的黄酮标准溶液制作标准曲线,通过吸光度值与标准曲线的对比,确定菊花样品中黄酮的含量。
需要注意的是,在测定过程中应注意控制条件,如浸提时间、浓缩程度、反应时间等,以保证测定结果的准确性和可靠性。
同时,为了获得更精确的测定结果,可以重复进行多次测定,并取平均值。

实验一植物材料中总黄酮分离提取--超声波提取植物总黄酮一、实验目的为充分利用天然植物资源,避免资源的浪费,探讨植物总黄酮的提取及鉴别方法。
二、实验原理采用超声波乙醇浸提法从植物材料(黄芩、银杏叶、枇杷叶)中提取黄酮类物质,并用分光光度法测定含量。
利用超声波产生的强烈振动、高的加速度、强烈的空化效应、搅拌作用等,可加速植物材料中的有效成分进入溶剂,从而增加有效成分的提取率,缩短提取时间,并且还可避免高温对提取成分的影响。
三、实验材料原料:黄芩、银杏叶、枇杷叶试剂:95%乙醇AR;无水乙醇AR;亚硝酸钠AR;硝酸铝AR;氢氧化钠AR;芦丁标准品、蒸馏水其它:滤纸、吸管、容量瓶、漏斗、试管四、实验仪器超声波清洗器(超声工作频率40kHz);紫外可见分光光度计;抽滤机电炉子水浴锅五、实验步骤(一)试剂配制a.硝酸铝(10%):称取20 g硝酸铝溶于蒸馏水中,定容至200 mL,混匀,贴标签备用。
b.亚硝酸钠(5%):称取10 g亚硝酸钠溶于蒸馏水中,定容至200 mL,混匀,贴标签备用。
c.芦丁标准溶液(2 mg/ml):称取芦丁2 g于1000 mL容量瓶中,加蒸馏水溶解并定容至刻度,混匀,贴标签备用。
d.乙醇溶液(60%):600ml无水乙醇,溶于蒸馏水,定容至1000 ml容量瓶中,混匀,贴标签备用。
e.氢氧化钠溶液(4%):40 g氢氧化钠溶于水,定容至1000 ml容量瓶中,混匀,贴标签备用。
(二)总黄酮成分提取取干燥植物材料(黄芩、银杏叶、香樟叶),粉碎。
称取约5 g,加80 ml 95%乙醇,浸泡20min,超声波提取30 min,抽滤。
滤渣再加80 ml 95 %乙醇,浸泡20min,再次超声波提取30 min,抽滤,合并两次滤液,减压回收(水浴加热)乙醇至滤液仅剩5~7 ml为止,放置100 ml容量瓶中,用60%乙醇稀释至刻度,得样品液。
(三)定量实验-总黄酮的含量测定1. 波长的选择取样品液适量,在0.30 ml 5%亚硝酸钠溶液存在的碱性条件下,经硝酸铝显色后,以试剂为空白参比液在420~700 nm波长范围测定络合物的吸光度,络合物于510 nm波长处有最大吸收,故测定时选用此波长。

总黄酮含量测定一样品溶液的制备70%乙醇溶液,料液比1﹕8 ,80度下回流2h。
取10g样品放入圆底烧瓶中加入80ml 70%乙醇溶液回流2h,抽滤定容至100ml备用。
使用时先离心再用70%乙醇稀释10倍做样品溶液。
二芦丁标准品的配置精密称取芦丁2mg,加无水乙醇定容至10ml。
制得浓度为0.2mg/ml芦丁标准品溶液。
三显色方法的确定1 扫描原液分别取芦丁溶液和样品溶液各1ml,加无水乙醇定容至25ml,空白对照,全波扫描。
2硝酸铝显色法分别取芦丁对照品溶液和样品溶液各5ml,加5%亚硝酸钠溶液(1.25g亚硝酸溶于无水乙醇中定容到25ml容量瓶中) 1ml, 摇匀,放置6min,加10%硝酸铝溶液(4,4014g硝酸铝.九水溶于无水乙醇中定容到25ml 容量瓶中) 1ml,摇匀,放置6min,加4%氢氧化钠试液(2g氢氧化钠溶于无水乙醇中定容到50ml容量瓶中)10ml, 再加无水乙醇定容至25ml,摇匀,放置15min,空白对照,全波扫描bb 。
3氯化铝显色法分别取芦丁对照溶液和样品溶液各5ml ,加1%的氯化铝溶液(1g氯化铝溶于无水乙醇中定容到100ml容量瓶中)10ml,摇匀放置10min,空白对照,全波扫描。
4 氢氧化钾显色法分别取芦丁对照品溶液和样品溶液各5ml,加3ml10%氢氧化钾溶液(2.5g氢氧化钾溶于无水乙醇中定容到25ml容量瓶中),充分摇匀显色5min后,用无水乙醇定容至25ml, 摇匀,空白对照,全波扫描。
四显色条件的确定五标准曲线的绘制分别取1ml,2ml,3ml,4ml,5ml,6ml芦丁对照品溶液,按所选的显色方法测定吸光度,绘制标准曲线。
六精密度实验按标准曲线绘制方法,分别准确量取1.0ml芦丁标准液5份,按所选显色剂和所确定的最优显色条件在所选波长下测定吸光度。
次数 1 2 3 4 5吸光度平均值相对标准偏差RSD(%)七重现性实验取火棘果样品5份各10g,按提取步骤制得样品液,按制备标准曲线方法显色后测定吸光度值并计算总黄酮含量。

中药总黄酮的含量测定方法
中药总黄酮的含量测定方法常用的有以下几种:
1. 酸碱比色法:先将中药样品提取,然后加入酸性试剂,使黄酮化合物转化为黄色络合物,再通过比色法测定黄色染色的强度,从而计算出黄酮的含量。
2. 高效液相色谱法(HPLC):中药样品经过适当溶剂提取后,利用高效液相色谱仪对黄酮进行分离和检测,通过峰面积或峰高与标准品进行比较计算黄酮的含量。
3. 紫外分光光度法:根据黄酮化合物在紫外可见光区域的吸收特性,在一定波长范围内测定样品的吸光度,通过比较吸光度与标准曲线计算黄酮的含量。
4. 荧光法:将黄酮溶液与适当溶剂混合后,在特定波长下激发,并测定荧光强度,通过标准曲线计算黄酮的含量。
以上方法可根据实际研究需求和条件选择适合的方案进行测定。
值得注意的是,不同的中药样品可能有不同的成分和浓度,因此在具体测定过程中需根据样品特点进行方法优化和验证。

试验植物总黄酮的提取与测定摘要本实验采用紫外分光光度法测定芹菜体内总黄酮含量,利用黄酮类化合物与铝盐反应生成红色络合物。
以芦丁为标准品在510nm处测定吸光度。
得出标准曲线,然后计算样品的黄酮量。
下面会就本实验出现的一些状况作出详尽想分析。
材料与方法材料新鲜芹菜叶方法试剂的配制标准品芦丁;甲醇;石油醚;磷酸;95%乙醇;硝酸铝;亚硝酸钠;氢氧化钠;去离子水步骤1 总黄酮提取称取新鲜芹菜叶子10.0g,研磨后于回流装置中用70ml 95%乙醇回流2h,过滤,然后用石油醚做溶剂萃取1~2次去脂溶物。
溶剂用量为提取液的1/2,除脂后浓缩并定容至50ml。
2 芹菜黄酮含量的测定吸取10ml置25ml容量瓶中,加30%乙醇2.5ml,再加入5%亚硝酸钠溶液0.75ml摇匀,放置5min,加10%硝酸铝液0.75ml,摇匀,放置5min,再加1mol/L NaOH溶液10ml,摇匀,加30%乙醇至刻度,放置10min,在510nm波长处测定吸光度。
同时,取上述稀释液10ml,置于25ml容量瓶中,加30%乙醇至刻度,作为对照溶液。
根据测得的吸光度得出标准曲线3 标准溶液配制精确称取与120℃真空干燥至恒重的芦丁标准品20mg,置100ml容量瓶中,加60%乙醇溶液,稀释至刻度,精确量取25ml,置于50ml容量瓶中,稀释至刻度,摇匀既得每1ml 含芦丁0.1mg的标准溶液。
4标准曲线制作精确量取标准溶液0。
0,2.5,5.0,7.5,10.0,12.5ml,分别置于25ml容量瓶中,加30%乙醇补足至12.5ml,加5%亚硝酸钠溶液0.75ml摇匀,放置5min,精确加入10%硝酸铝液0.75ml,摇匀,放置5min,再精确加入1mol/L氢氧化钠液10ml,用30%乙醇稀释至刻度,以第一管为空白,与510nm波长下测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准溶液。
结果标准:A1=0.000;A2=0.121;A3=0.266;A4=0.394;A5=0.530;A6=0.673样品:A(1)=0.000;A(2)=0.036由标准曲线图可得样品中黄酮的含量为0.042分析1 在实验之前,必须要仔细检查实验仪器的密封性,如萃取瓶,回流装置的密封性。

竹叶总黄酮的提取和测定实验目的:1.了解总黄酮类化合物的一般制备实验原理及方法2.掌握总黄酮类化合物的制备方法和测定方法3.培养验证和解决某一实际问题的能力和创新意识实验原理:1.竹叶中含有大量总黄酮化合物,竹叶中黄酮类物质的相对极性决定了竹叶中含有的大量黄酮类物质可用较大极性的溶剂(乙醇)提取。
材料和用品:1. 药品竹叶、芦丁标准品、75%乙醇﹑70%乙醇、60%乙醇、5%亚硝酸钠、10%的硝酸铝溶液、l mol/ L 氢氧化钠溶液2 仪器粉碎机、60目筛、恒温水浴锅、真空干燥箱、紫外—分光光度计、50ml容量瓶、10ml容量瓶、电子天平、滤纸、漏斗、烧杯、量筒、玻璃棒方法与步骤:1总黄酮提取⑴将竹叶干燥粉碎过60目筛。
⑵称取50g竹叶粉三份,分别加入体积分数75%的乙醇500ml、1000ml、1500ml.⑶ 70℃水浴提取1.5h后过滤取滤液。
⑷将三份滤液混合后水浴蒸发浓缩(温度不宜过高)待乙醇蒸发完后,将浓缩液置于真空干燥箱中干燥成疏松固体,粉碎得终产物。
⑸称量计算产率。
2总黄酮的测定⑴标准液的配制精确称取芦丁标准品10mg,置于50ml容量瓶中,加60%乙醇适量,水浴微热使溶,放冷,用60%乙醇稀释至刻度,摇匀即得0.2g/L的标准溶液。
⑵标准曲线制作精密吸取标准液0.0﹑1.0﹑2.0﹑3.0﹑4.0﹑5.0ml,分别置于10ml容量瓶中,各加60%乙醇溶液使成7ml,精密加入5%亚硝酸钠0.3ml,摇匀,放置6min,精密加入10%的硝酸铝溶液0.3ml,摇匀, 放置10 min, 加入l mol/ L 氢氧化钠溶液2 mL. 分别用60%乙醇稀释至刻度, 摇匀,放置10 min ,在510 nm 处测吸光度,⑶样品溶液配制称取1.5g样品,置于50ml容量瓶中,加60%乙醇适量,水浴微热使溶,放冷,用60%乙醇稀释至刻度。
⑷样品溶液测定精密吸取1.0ml样品液,置于10ml容量瓶中,各加60%乙醇溶液使成7ml,精密加入5%亚硝酸钠0.3ml,摇匀,放置6min,精密加入10%的硝酸铝溶液0.3ml,摇匀, 放置10 min, 加入l mol/ L 氢氧化钠溶液2 mL. 分别用60%乙醇稀释至刻度, 摇匀,放置10 min ,在510 nm 处测吸光度, 测三次取平均值。
⽢草中总黄酮的提取及含量测定⽢草中总黄酮的提取及含量测定前⾔⽢草是我国传统常⽤中草药之⼀,也是我国重要的植物资源?。
⽢草黄酮类成分是⽢草中最重要的活性成分之⼀,具有抗氧化、抗肿瘤、增强⼀t5⾎管功能、增强免疫⼒等作⽤。
因此,开展⽢草的深加⼯,使⽢草资源得以充分利⽤,增加资源的附加值,前景⼗分可观。
为此,笔者以⽢草为对象,研究了⽢草黄酮的⼄醇回流提取⼯艺,单因素试验确定各因素对提取⼯艺的影响,正交试验确定⽢草黄酮提取的最佳⼯艺条件。
1材料与⽅法1.1材料⽢草,市售;试剂:亚硝酸钠、碳酸钠、⽯油醚、蒸馏⽔、氢氧化钠、盐酸、⽆⽔⼄醇、芦丁;仪器:烧杯、容量瓶、移液管、玻璃棒、量筒、回流装置、滤纸、HH-4数显恒温⽔浴锅、分析天平、AB104.N电⼦天平、布⽒漏⽃、SHZ—C型循环⽔多⽤真空泵、分光光度计。
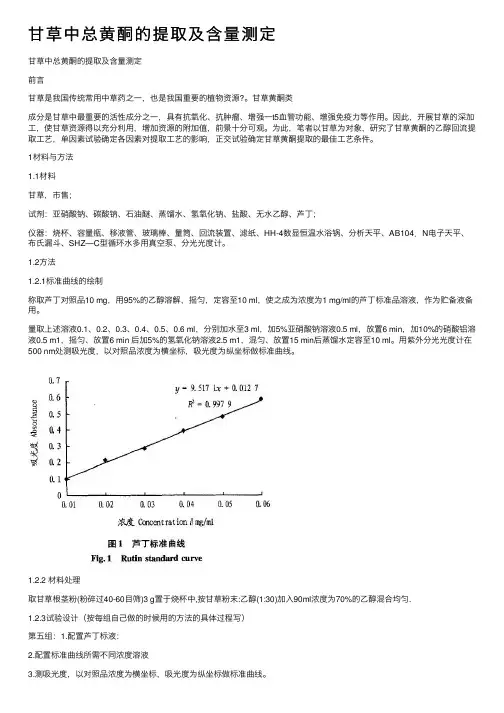
1.2⽅法1.2.1标准曲线的绘制称取芦丁对照品10 mg,⽤95%的⼄醇溶解,摇匀,定容⾄10 ml,使之成为浓度为1 mg/ml的芦丁标准品溶液,作为贮备液备⽤。
量取上述溶液0.1、0.2、0.3、0.4、0.5、0.6 ml,分别加⽔⾄3 ml,加5%亚硝酸钠溶液0.5 ml,放置6 min,加10%的硝酸铝溶液0.5 m1,摇匀、放置6 min 后加5%的氢氧化钠溶液2.5 m1,混匀、放置15 min后蒸馏⽔定容⾄10 ml。
⽤紫外分光光度计在500 nm处测吸光度,以对照品浓度为横坐标,吸光度为纵坐标做标准曲线。
1.2.2 材料处理取⽢草根茎粉(粉碎过40-60⽬筛)3 g置于烧杯中,按⽢草粉末:⼄醇(1:30)加⼊90ml浓度为70%的⼄醇混合均匀.1.2.3试验设计(按每组⾃⼰做的时候⽤的⽅法的具体过程写)第五组:1.配置芦丁标液:2.配置标准曲线所需不同浓度溶液3.测吸光度,以对照品浓度为横坐标,吸光度为纵坐标做标准曲线。
4.处理样品5.测出样品吸光度,按照标准曲线,得出样品总黄酮含量1.2.4⽢草黄酮含量测定收集滤液并测量滤液体积,取样按绘制标准曲线的⽅法测定其吸光度值,根据公式计算每克⽢草中黄酮的含量。

实验九食品中总黄酮的测定(-)目的意义黄酮类化合物(flavonoids)是广泛存在于植物界的一大类多酚化合物,多以苷类形式存在。
其分析方法有多种,对于黄酮类化合物的相互分离以及单一成分的定量分析,常采用高效液相色谱法(high performance liquid chromatography,HPLC);而对于总黄酮含量的测定,则主要采用分光光度法。
通过本方法的学习,可以掌握食物中总黄酮的测定方法。
(二)高效液相色谱法1. 原理植物类样品用石油醚脱脂后,经甲醇加热回流提取,以高效液相色谱法分离,在紫外检测器360nm条件下,以保留时间定性、峰面积定量。
2.仪器和试剂(1)高效液相色谱仪(2)紫外检测器(3)层析柱(4)超声波清洗仪(5)索氏提取器(6)微孔过滤器(滤膜0.45um)(7)甲醇(色谱纯)(8)芦丁标准品(9)石油醚,盐酸,磷酸(分析纯)。
(10)去离子水(11)芦丁标准溶液:精确称取经105℃干燥恒重的芦丁标谁品15.0mg,加甲醇溶解并定容至100ml,配成150ug/ml的芦丁标准溶液。
3. 操作步骤(1)样品处理1)固体样品:称取2.0g干燥的固体样品,研细,置于索氏提取器中,用石油醚(60~90℃)提取脂肪等脂溶性成分,弃去石油醚提取液,剩余物挥去石油醚,加人甲醇50ml和25%HC1 5ml,80℃水浴回流水解1h,取出后快速冷却至室温,转移至50ml容量瓶中,甲醇定容,经0.45um滤膜过滤,供分析用。
2)液体样品:准确吸取样品2.0ml,直接以石油醚萃取脱脂,挥去石油醚后,以甲醇溶解并定容,经微孔滤膜(0.45um)滤过后供测定用。
(2)色谱分离条件色谱柱:CLC-ODS,6mm×150mm,5um;流动相:0.3%磷酸水溶液:甲醇(V:V)=40:80,临用前用超声波脱气;流速:lml/min;柱温:40℃;检测波长:360nm;灵敏度:0.02AUFS;进样量:20ul。

总黄酮的提取和测定实验原理黄酮类化合物是植物的重要次生代谢产物,也是一些保健品和中药材的有效成分之一。
黄酮类化合物的定量方法常用的有 HPLC法和分光光度法,在实际生产和科研过程中,对于黄酮单体的定量常采用HPLC法,而对总黄酮的测定,考虑到方法的简便、快捷以及可行性,多采用在碱性介质中加铝盐显色的分光光度法。
在碱性条件下黄酮类化合物与铝盐形成络合物、在500nm波长处有最大吸收峰。
标准品选用芦丁。
试剂和器材一、试剂芦丁标准品。
5%NaNO2;10%A1(NO3)3;5%NaOH;70%乙醇。
二、材料新鲜银杏叶。
三、器材容量瓶10ml(×7),25ml(×1),100ml(×2);吸管 0.5ml(×2),1ml(×2),2ml(×1),5ml(×1);分光光度计。
操作方法一、制作标准曲线精密称取芦丁标准品5mg,用70%乙醇溶解,定容于25mL容量瓶中,摇匀,得0.2mg/mL的标准溶液。
精确吸取标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2mL,分别置于10mL容量瓶中,加入 5%NaNO2 0.4mL,摇匀,放置6min;加入10%A1 (NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH 4.0mL,再加水至刻度,摇匀,放置15min。
以试剂空白作为参比溶液。
用1cm比色皿,在500nm波长处测定吸光度,绘制标准曲线。
二、总黄酮的提取把新鲜的银杏叶低温烘干,使水分小于8%,制成干粉。
精确称取干粉1.0g,置于 100mL容量瓶中,加入70%乙醇30mL,浸泡24h。
超声波提取30min,过滤,滤液用70%乙醇定容于100mL容量瓶中,得到黄酮提取液,待用。
三、测定吸取黄酮提取液1.00mL, 置于10mL容量瓶中,加入5%NaNO3 0.4mL,摇匀,放置6min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH 4.0mL,再加水至刻度,摇匀,放置15min。
总黄酮的测定方法总黄酮是指一种天然的化合物,属于类黄酮类物质。
总黄酮是一类化合物的总和,包括黄酮,异黄酮和类黄酮等。
这些化合物广泛分布于植物中,并具有许多生理功能,如抗氧化性、抗癌性、降血脂、心脑血管保护等。
因此,对总黄酮的测定方法很重要,能够为药理研究和食品营养分析提供支持。
总黄酮的测定方法多种多样,根据不同的化学性质、测量目的和样品的性质,采用不同的测定方法。
下面介绍一些常见的总黄酮测定方法。
1. 酸碱比色法酸碱比色法是总黄酮测定的一种常用方法。
它是根据总黄酮具有酸碱变色性质,利用酸碱指示剂变色的原理进行测定。
具体实验流程如下:(1)取一定量的样品,加入稀盐酸,使样品酸化。
(2)加入稀氨水,使RH值在6.5~7.0之间。
(3)加入酚酞指示剂,观察样品溶液颜色变化,从而计算出总黄酮含量。
这种测定方法操作简便、快速,但由于酸碱条件的控制较为严格,且无法区分具体的黄酮类化合物,所以在某些情况下需要结合其他方法进行测定。
2. 溶解性法溶解性法是另一种常用的总黄酮测定方法。
它是通过将样品与有机溶剂混合,将总黄酮从样品中提取出来,然后用紫外光谱或比色法进行测定。
具体实验流程如下:(1)取一定量的样品,加入适量的有机溶剂(如甲醇、乙醇等),在恒温水浴中振荡提取一定时间。
(2)离心沉淀,取上清液用紫外光谱或比色法进行测定。
这种测定方法能够将总黄酮从样品中提取出来,并且可区分不同种类的黄酮化合物。
但由于实验中需用到有机溶剂,因此分析结果存在一定的误差。
3. 高效液相色谱法高效液相色谱法是对总黄酮测定的一种较为精确的方法。
该方法是利用高效液相色谱仪对总黄酮进行分离和定量。
具体实验流程如下:(1)取一定量的样品,经过萃取、分离和净化处理后,进行高效液相色谱分析。
(2)色谱分离后,对不同种类的黄酮进行检测和定量。
该方法具有分离效果好、灵敏度高、稳定可靠等优点,是总黄酮测定的可靠方法。
总的来说,总黄酮的测定方法有很多,根据实验条件、样品性质和分析目的不同,可以选择不同的方法。
实验一 槐米总黄酮提取和含量测定一 实验目的1 了解溶剂提取法的基本操作。
2 掌握黄酮化合物的检测方法。
3 掌握通过分光光度法以芦丁为对照品检测总黄酮含量。
二 实验仪器和药品1 药品:槐米(自制100目),无水乙醇,30%的乙醇溶液,5%亚硝酸钠溶液(自制),10%氯化铝溶液(自制),10%的硫酸-氯化铝显色剂(自制)。
2 仪器:水浴锅,100mL 圆底烧瓶,冷凝管,旋转蒸发仪,721型分光光度计,抽滤瓶和抽滤漏斗,50 mL 容量瓶、移液管(1 mL 、5 mL)。
三 实验操作1 提取分别取经石油醚脱脂脱色的槐米粉末3 g 和50mL60%的乙醇溶液(无水乙醇30mL ,水20mL)加入100 mL 圆底烧瓶中,在70℃水浴中提取2h ,完毕,抽滤,取1ml 于25ml 容量瓶中,用30%乙醇定容,按3所述方法测定吸光度,计算提取得率。
2 定性检测以CHCl 3 : CH 3OH : H 2O = 80 : 20 : 2 为展开剂,以10%的硫酸-氯化铝溶液显色,烘干后在UV254紫外检测仪下观察斑点颜色。
3 定量于25mL 容量瓶中精密吸取1mL 样品提取液置于10 m1试管中,加5%亚硝酸钠溶液0.3ml ,摇匀,放置6min 后,加入10%硝酸铝溶液0.3ml ,摇匀,放置6min ,加入4%的氢氧化钠溶液4.0ml ,摇匀,放置15min ,加30%乙醇定至10mL ,摇匀,用UV-721型紫外分光光度计在510 nm 处测定其吸光度。
依据芦丁对照品所得回归方程m=1.1159A + 0.036,R 2 =0.9986并通过下式计算槐米总黄酮含量。
)()(%100100025)036.01159.1mL V g M M V A :提取液体积;:槐米质量(槐米总黄酮提取得率=⨯⨯⨯⨯+四 要求1. 严格按实验要求规范操作。
2. 观察黄酮化合物在不同条件下斑点的显色情况。
3. 详实记录实验数据。
葛根粉中总黄酮的提取和测定一、实验目的:⒈熟悉超声波提取葛根粉中总黄酮的操作;⒉比较紫外吸收与可见分光光度法测定总黄酮方法的相关性。
二、实验原理:试样经超声波用无水甲醇提取其中的总黄酮,①紫外吸收法:经扫描其紫外吸收光谱后,在紫外最大吸收波长下测定吸光度,根据标准曲线法定量;②可见分光光度法:利用黄酮分子中的酚羟基在弱碱性条件下与铝离子发生铬合反应生成有色物质,在一定浓度范围内,其吸光度与总黄酮浓度成线性关系,标准曲线法定量。
三、主要仪器和试剂:1⒈紫外-可见分光光度计;⒉超声波发生器;⒊电子天平;⒋芦丁标准溶液:精确称取10mg于120℃烘干至恒重的芦丁标样,以无水甲醇溶液超声溶解并定容至50ml摇匀即得浓度为0.2mg/ml芦丁标准液。
⒌硝酸铝溶液(100g/L):称取10g硝酸铝加水溶解并稀释到100mL。
⒍乙酸钾溶液(98.1g/L):称取9.81g乙酸钾,加水溶解并稀释至100mL。
四、实验步骤:⒈样品中总黄酮提取:准确称取2.0g(精确到0.1mg)葛根粉于150mL锥形瓶中,加入无水甲醇40mL,在60℃超声提取1h,抽滤,收集滤液于100mL容量瓶中,滤渣重新置于原锥形瓶内再加入甲醇40mL,在60℃超声提取1h,抽滤,合并滤液,无水甲醇定容,摇匀。
2⒉ 紫外吸收测定:①准确吸取芦丁标准液0.00,0.50,1.00,1.50,2.00,3.00mL 于25mL 容量瓶内,分别用无水甲醇定容,摇匀。
②选取第四管溶液,以无水甲醇为参比液,扫描紫外吸收光谱,找出最大吸收波长λmax 。
③在λmax 处,分别测定标准系列和样品提取液的吸光度,计算样品测定液中总黄酮含量。
⒊ 可见分光光度法测定:①准确吸取芦丁标准液0.00,0.50,1.00,1.50,2.00,3.00mL 于25mL 容量瓶内,加无水甲醇至6mL ,分别加入硝酸铝溶液(100g/L )1 mL ,乙酸钾溶液(98.1g/L )1 mL ,用无水甲醇定容,摇匀,静置30min 。
总黄酮含量测定方法
总黄酮含量测定呀,有几种常见方法呢。
紫外- 可见分光光度法。
先得把样品处理好,就像给食材做前期准备一样。
把含有总黄酮的样品进行提取,提取液要纯净呀,不能有太多杂质干扰,杂质多了就像炒菜的时候锅没洗干净,那肯定做不出好菜。
然后在特定波长下测定吸光度,这个波长就像一把专门开总黄酮这把锁的钥匙,得找对喽。
这方法安全性挺高的,只要按照正常操作流程,不会有啥危险情况,稳定性也不错呢,只要仪器正常工作,数据偏差不会太大。
在食品、药品检测领域应用可广泛了,能快速知道产品里总黄酮的大概含量。
我知道一家小型制药厂,想检测新研发的药品里总黄酮含量,就用这个方法,快速得到结果,他们高兴得不得了,就像挖到宝藏一样。
还有高效液相色谱法。
这得把样品制成合适的溶液,溶液就像一支整齐有序的队伍,不能乱哄哄的。
然后注入色谱仪,色谱仪就像一个超级严格的裁判,把不同成分分得清清楚楚。
测定过程中要保证仪器的清洁和稳定,这可不能马虎呀,不然数据就乱套了。
这个方法安全性也还好,就是操作要细心些。
在科研中用得很多,能精确测定总黄酮含量,优势就是精准度高呀。
有个科研团队研究植物中的总黄酮含量,用这个方法得到准确数据,他们兴奋地说这简直是找到了解开谜团的密码。
我觉得这些总黄酮含量测定方法各有各的好,在合适的场景下都能发挥大作用,就像不同的工具在不同的工作里都能大显身手。
2.3、清除率测定:本实验中抗氧化活性以清除DPPH自由基能力大小表示。
当DPPH 溶液中加入自由基清除剂时,溶液颜色变浅,517nm 处的吸收光度变小。
吸收度变小的程度与自由基被清除的程度呈线形关系,可用于检测自由基的清除程度,从而评价天然产物中活性物质的抗氧化能力。
其能力用清除率来表示,按照下面公式计算清除率,清除率越大,抗氧化能力越强。
根据以下公式计算样品的清除率:清除率=〔1-(Ai -Aj)/Ac〕 100%(式中:Ai -----样品与DPPH溶液的吸收度;Aj-----样品与70%乙醇的吸收度;Ac------DPPH溶液与70%乙醇的吸收度)黄酮类化合物的提取及其抗氧化性测定实验原理黄酮类化合物是一种良好的活性氧自由基清除剂。
DPPH是一种稳定的自由基,其乙醇溶液呈紫色,在可见光区最大吸收峰为517nm。
当DPPH溶液中加入自由基清除剂时,溶液颜色变浅,517nm处的吸收光度变小。
吸收度变小的程度与自由基被清除的程度呈线形关系,可用于检测自由基的清除程度,从而评价天然产物中活性物质的抗氧化能力。
其能力用抑制率来表示,抑制率越大,抗氧化能力越强。
实验仪器和主要试剂1、组织捣碎机,分光光度计,电子分析天平,离心机,水浴振荡器2、0.1mg/mL芦丁标液;3、5%NaNO2;4、10%Al(NO3)3;5、1mol/LNaOH;无水乙醇;6、二苯代苦味肼基自由基(DPPH,浓度为2 10¯4);操作步骤1、芦丁标准曲线的绘制精确称取0.1mg/mL芦丁标液0.0,2.0,4.0,6.0,8.0,10.0mL于6个25mL 比色管中,用30%的乙醇补至10mL,加入1mL5%NaNO2,摇匀,放置6min,加入1mL10% Al(NO3)3,放置6min后,再加入10mL1moL/LNaOH,摇匀显色,定容,静置15min,以零管为空白,在510nm处测定系列吸光度。
用最小二乘法做线形回归,求得芦丁浓度(Y)与吸光度(A)的关系曲线。
总黄酮成分提取取苦菜和蒲公英地上部分,洗净烘干,粉碎成粉,过0.6 mm筛,置于棕色瓶内储藏备用。
分别称取苦菜和蒲公英粉1.000 g于三角瓶中溶解,共9份,放入超声波清洗器中(超声功率120 W,温度为50℃)提取,过滤定容至100 mL。
为快速提取苦菜和蒲公英中的总黄酮成分,采用正交试验确定提取的最佳条件。
选择乙醇浓度、料液比和提取时间3个水平进行试验(见表1) 。
表1 正交试验因素及水平Table 1 Factors and level of orthogonal test处理Treatment因素FactorsA 乙醇浓度/%EthanolconcentrationB 料液比/g·mL-1Solid-liquid ratioC 提取时间/hExtraction time1 50 1:10 0.52 60 1:20 1总黄酮含量测定(1)芦丁标准溶液的制备:将芦丁标准品于120℃下干燥30min,称取干燥后样品20 mg,用30%乙醇溶解,定容到100 mL,配制成浓度为0.2 mg·mL-1的芦丁标准溶液。
(2)标准曲线的制作:分别吸取0.0,1.0,2.0,3.0,4.0,5.0,6.0 mL芦丁标准溶液,置于50 mL比色管中,加入2.0 mL 5%的NaNO2溶液,混匀后放置5 min,再加入2.0 mL 10%的Al(NO3)3溶液,摇匀后放置5 min,加入10 mL 4%的NaOH溶液,最后用30%乙醇定容至50 mL,摇匀后放置10 min,在510 nm下用紫外分光光度计测定各样品吸光值。
以吸光度A值为纵坐标( Y),以标准样品浓度为横坐标( X) ,绘制标准曲线,计算线性回归方程。
得到的线性回归方程为: Y =0. 017X-0.0124,相关系数R2 = 0.994。
即在0~0.02 mg ·mL-1范围内,芦丁标准样品浓度与吸光度的线性关系良好。
设计性实验:
银杏叶中总黄酮的提取和测定
小组人员:袁国明郎启国赵永仓王蓉
一、目的要求
1、探究不同浓度的乙醇和在不同时间下对黄酮类化合物提取率的影响。
2、掌握从银杏叶中提取总黄酮的操作步骤和测定方法。
3、了解提取银杏叶中黄酮类化合物制备的基本原理和方法。
二、实验原理
根据超声波具有空化、粉碎、搅拌等特殊作用,对银杏叶的细胞有破坏现象,使乙醇溶液能渗透到银杏叶中,以便让总黄酮溶解在乙醇中,在通过分离提纯的方法,来获得总黄酮的含量。
黄酮类是含酚羟基的化合物,能够和铝离子产生黄色络合物,在碱性条件下溶液呈红色。
因此,本实验所采用的方法是在碱性溶液中加铝盐显色的分光光度法。
其具体操作是在所测定的溶液中加入5%NaNO2;10%A1(NO3)3;5%NaOH溶液,在500nm波长下,用紫外分光光度法测定所提溶液中总黄酮的含量。
三、试剂和器材
1、试剂
芦丁标准品;5%NaNO2;10%A1(NO3)3;5%NaOH;30%、40%、50%、60%、70%、80%的乙醇(用95%的酒精31.91ml、42.55ml、53.19ml、68.83ml、74.47ml、85.11ml );及蒸馏水等。
2、材料
新鲜的银杏叶
3、器材
容量瓶25ml(×1) 100ml(×6);吸管0.5ml(×2)1ml(×2),2ml(×1),5ml (×1)粉碎机;超声波清洗机;高速离心机;三角锥形瓶50ml(×6);滤纸;分光光度
计;烧杯;具塞刻度试管;分析天平;20ml量筒等
四、操作方法
1、银杏叶的处理
把新鲜的银杏叶低温烘干,使水分小于8%,制成干粉,待用。
2、制作标准曲线
准确称取芦丁标准品5mg,用80%乙醇溶解,定容于25mL容量瓶中,摇匀,得0.2mg /mL的标准溶液。
移液管精确吸取标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2ml,分别置于10mL容量瓶中,加入5%NaNO2 0.4mL,摇匀,放置5min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH 4.0mL,再加蒸馏水至刻度,摇匀,在80℃水浴中保温10min。
以试剂空白作为参比溶液。
用1cm比色皿,在510nm波长处测定吸光度,绘制标准曲线(标样浓度和吸光度的关系)。
表1-1 标准曲线制作
管号 1 2 3 4 5 6 7 芦丁标准液(mL)0.0 0.2 0.4 0.6 0.8 1.0 1.2 5%NaNO2(mL)0.4 0.4 0.4 0.4 0.4 0.4 0.4 放置时间(min) 5 5 5 5 5 5 5
0.4 0.4 0.4 0.4 0.4 0.4 0.4
10%Al(NO3)3
(mL)
放置时间(min) 6 6 6 6 6 6 6 5%NaOH(mL) 4.0 4.0 4.0 4.0 4.0 4.0 4.0 蒸馏水(mL) 5.2 5.0 4.8 4.6 4.4 4.2 4.0
3、探究不同时间对黄酮提取的影响
分别称取6分1g的银杏叶粉末,放在50mL的三角锥形瓶中,并作相应标记,分别加入70%的乙醇溶液各20mL,在超声波清洗机(500W)超声30 min、35 min 、40min、45 min、50min、 55min将溶液用高速离心机离心后除去滤渣,得到粗产品,用量筒量体积做记录,等待备用。
4、探究不同浓度的乙醇对总黄酮提取的影响
分别称取1g的银杏叶粉末6分,放在50 mL的三角锥形瓶中,分别加入30%、40%、50%、60%、70%、80%乙醇溶液各20毫升,并做标记,在超声波清洗机(500W)超声 45min,将溶液用高速离心机离心后除去滤渣,得到粗产品,用量筒量体积做记录,等待备用。
5、总黄酮的测定
分别吸取不同时间和不同浓度下提取的总黄酮粗产品溶液各1.00 mL稀释10倍,再分别各吸取1.00 mL溶液,加入到10 mL的试管中,各加5%亚硝酸钠0.4mL,放置5 min,再分别加入0.4mL10%硝酸铝,摇匀后放置6 min。
分别加5%NaOH 4.0mL摇匀后,用蒸馏水稀释至10mL刻度,在80℃水浴中保温10 min。
以试剂空白作为参比溶液,以调节分光光度计零点,用1cm比色皿,在510nm波长处样品的吸光度。
由标准曲线法计算总黄酮含量和提取率。
6、结果计算:
(1)总黄酮的含量计算
粗产品中总黄酮的含量= 总黄酮的浓度(mg/ mL)×10
原料重量(g)
(2)计算总黄酮的提取率
总黄酮的提取率= 提取液中总黄酮的含量(g)×100%
原料重量(g)
谢谢老师!。