偶电子离子裂解规律
- 格式:ppt
- 大小:7.58 MB
- 文档页数:23




质谱裂解机理中的特征裂解方式有机质谱中的裂解是极其复杂的,但是通过对其质谱裂解方式和机理的探讨研究,我们可以发现有一些特征结构裂解方式在有机质谱的裂解中是普遍存在的,是世界上的大量质谱学家通过对大量的有机质谱裂解方式进行观察、研究后的概括性总结。
所以其具有很重要的参考价值和应用价值,所以在有机质谱解析过程中,必须予以遵循,如此方能得到合理的质谱裂解方式和解析结果。
通过概括总结我们发现有机质谱中大部分化合物具有以下几种特征裂解方式:α裂解、苄基裂解、烯丙基裂解、麦氏重排裂解、DRA裂解(逆狄尔斯阿尔德反应),几种特征裂解方式的强弱顺序如下:苄基裂解>α裂解、i裂解>麦氏重排裂解、DRA裂解>烯丙基裂解当然这种顺序不是一成不变的,随着化合物的结构发生改变,这些特征裂解方式的顺序有可能会发生改变,有机化合物质谱裂解大致可以分为两类α裂解(均裂)、β裂解,我们上面所讲的苄基裂解、烯丙基裂解、麦氏重排裂解、DRA裂解都属于β裂解。
下面我们对几种特征裂解方式做以说明。
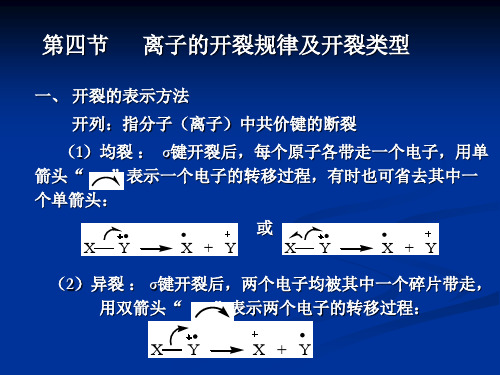
1、特征裂解方式1、α裂解α裂解是指凡具有C-X单键基团和C=X双键基团(其中X=C、O、S、Cl等)的有机分子,与该基团原子相连接的单键、称之为α键,在电子轰击条件下,该键很容易断裂因而称之为α断裂。
断键时成键的两个原子各自收回一个电子,这是由游离基中心引发的反应,原动力来自游离基的电子强烈配对倾向,所以α断裂属于均裂。
其裂解的机理及通式如下:I饱和中心II不饱和杂原子几类化合物的α裂解(1)(2)(3)(4)引发α断裂的倾向是由游离基中心给电子的能力决定的,一般来讲N>S、O、π、烷基>Cl、Br>H,同时α断裂遵循最大烷基游离基丢失的原则。
2、苄基裂解通常烷基苯、烷基吲哚、烷基萘、烷基喹啉等化合物具有苄基断裂的特征裂解方式,苄基裂解也属于α裂解。
以丙基苯为例对其裂解机理做以说明在电子的轰击下,苯环上的一对π电子被电离,游离基中心定域到苯环上,诱导α键发生断裂,形成α键的一对电子中的单电子与被电离后的π键的孤电子形成新键,失去烷基自由基,生成偶电子离子。

波谱学:波谱学是涉及电池辐射与物质量子化的能态间的相互作用,其理论基础是量子化的能量从辐射场向物质转移。
电池辐射区域:γ射线区,X射线区,远紫外,紫外,可见光区,近红外,红外,远红外区,微波区和射频区。
紫外光谱1.助色团:通常把那些本身在紫外或可见光区域吸收带不产生吸收带但与生色团相连后,能使生色团的吸收带向长波方向移动的基团称为助色团(将含有未公用电子对的杂原子基团称为助色团)发色团:有机化合物分子结构中有能吸收紫外光或可见光的基团,此类基团称为发色团。
2.红移:由于化学环境的变化而导致吸收峰长波方向移动的现象叫做红移。
3.蓝移:导致吸收峰向短波方向移动的现象叫做蓝移。
4.增色效应:使紫外吸收强度增加的作用。
5.减色效应:使紫外吸收强度降低的作用。
红外光谱红外吸收:一定波长的红外光照射被研究物质的分子,若辐射能等于振动基态的能级与第一振动激发态的能级之间的能量差时,则分子可吸收能量,由振动基态跃迁到第一振动激发态。
IR选律:在红外光的作用下,只有偶极矩(∆μ)发生变化的振动,即在振动过程中∆μ≠0时,才会产生红外吸收。
1.费米(Fermi)共振:由频率相近的倍频峰和基频峰相互作用产生,结果使倍频峰的强度增大或发生裂分。
2.伸缩振动:沿键轴方向发生周期性变化的振动称为伸缩振动。
3.弯曲振动:沿键角发生周期性变化的振动称为弯曲振动。
4.基频峰:从基态跃迁到第一激发态时将产生一个强的吸收峰,即基频峰。
5.倍频峰:从基态跃迁到第二激发态,第三激发时将产生相应弱的吸收峰,即倍频峰。
6.振动自由度:将多原子分子的复杂振动分解成若干个简单的基本振动,这些基本振动的数目称为分子的振动自由度。
7.指纹区:在红外光谱中,波数在1330~667cm-1 范围内称为指纹区。
8.振动偶合效应:当两个相同的基团在分子中靠得很近时,其相应的特征峰常发生分裂,形成两个峰,这种现象叫作振动偶合。
质谱:是化合物分子在真空条件下受电子流的“轰击”或强电场等其他方法的作用,电离成离子,同时发生某些化学键有规律的断裂,生成具有不同质量的带正电荷的离子,这些离子按质荷比的大小被收集记录的谱。

质谱技术中裂解机理的初步认识摘要质谱,即质量的谱图,物质的分子在高真空下,经物理作用或化学反应等途径形成带电粒子,某些带电粒了可进一步断裂。
每一离子的质量与所带电荷的比称为质荷比(m/z ,曾用m/e)。
不同质荷比的离子经质量分离器一一分离后,由检测器测定每一离子的质荷比及相对强度,由此得出的谱图称为质谱,本文从质谱的裂解机理,质谱的裂解方式和质朴中的离子类型三方面进行了介绍,对质谱有了更深的理解。
一、质谱裂解机理离子的裂解并不是随意裂解,它必须按“偶电子规则”进行裂解,当含有奇数个电子的离子裂解时,可以产生游离基与一个偶数个电子的离子,或含偶数个电子的中性分子与一个奇数个电子的离子;当含有偶数个电子的离子裂解时,只能产生偶数个电子的离子和中性分子,而不会产生游离基OE EF+R (断1个键)OE OE+Nee (断2个键)EE EE+ Nee (断2个键)EE OE+R (断1个键)(极少产生)注意:奇电子离子有两个活泼的反应中心,即电荷中心和游离基中心;偶电荷离子只有电荷中心。
分子离子的裂解和产物离子的进一步裂解都是由这些中心引发的。
二、质谱裂解的方式(一)简单裂解1.游离基中心引发的断裂反应(α断裂)分子失去电子,形成游离基离子,它的电子有强烈的成对倾向,电子转移与邻近原子形成一个新键,同时邻近原子的α键断裂。
因此,这种断裂通常称为“α”断裂反应,以下分别举例说明各种化合物α断裂过程。
R2R+CR2YR杂原子(Y)的孤对电子电离能较低,很容易去失,形成游离基离子,进而发生α断裂,如αR2O R'R+CH2O R'2. σ键的断裂化合物中某个单键失去电子,则在此处易进一步发生断裂反应,例如烷烃。
R +RCR 3CR 3CR 3σ 能够稳定正电荷的离子丰度较高,如CH 3CH 2CH 3-e CH 3 32CH 33C 33C CH 2CH 3σ+3、电荷中心引发的反应(诱导断裂,i )① 奇电子离子(OE) a. 饱合中心 R Y R'R +i YR上述反应由正电荷对一对电子的吸引所推动,反应发生的难易与该元素的诱导效应有关,一般为卤素>O 、S >> N 、C ;许多碘代烷烃,溴代仲和叔烷烃及氯代叔烷烃,较易产生这个反应。









有机化合物裂解规律1.偶电子规律偶电子离子裂解,一般只能生成偶电子离子(少数化合物例外)。
换言之,就是质谱中质荷比较小的奇电子离子往往是由质荷比较大的奇电子离子裂解产生的。
⋅+B +中性分子 +E +中性碎片⋅+A +D+C +自由基 ⋅+F +自由基2.烃类化合物的裂解烃类化合物的裂解是优先失去大基团,优先生成稳定的碳正离子。
碳正离子的稳定顺序是:322322256H C R H C HR C R C CH CH CH H C H C ++++++>>>>=>—,碳正离子的稳定性越高,其离子峰在质谱图中的相对强度越大。
CH 222C H 2CH CH 2R2CH 2CH CH 23.含杂原子化合物的裂解(羰基化合物除外)含杂原子的化合物,主要是自由基位置引发的βαC C —间的σ键断裂(称α裂解,正电荷在杂原子上)和正电荷诱导的碳—杂原子之间的σ键的异裂(称i 异裂),正电荷发生移位。
C H 2C H 2CH2RR4.羰基化合物的裂解羰基化合物的裂解为自由基引发的均裂(α裂解)及正电荷诱导的异裂。
CH OR'C OR'OC ORRC OHOC OR'HNC OCO5.逆Diels—Alder反应环己烯及其衍生物开环裂解反应。
OR6.氢的重排反应(1)Mclafferty重排(γ氢重排,含不饱和键的化合物经过六元环过渡态)OHR'HHR(2)自由基引发或正电荷诱导,含杂原子化合物经过四元、五元、六元环过渡态氢的重排H222H2C 2H 5C H 2CH 2C 2H 5C 2H 5H ClC 2ClC 2C 2C 22(3)长链酯基的双氢重排ROHROH OHR'CH(4)偶电子离子氢的重排偶电子离子经过四元环过渡态的β氢重排。
2CH3H222C2NH22CH3222CH22CH3H222CH2(5)芳环的邻位效应在邻位取代芳环中,取代基经过六元环过渡态氢的重排,失去中性分子,生成奇电子离子。