88cap卫生部临检中心的统计 发光总误差与允许误差
- 格式:doc
- 大小:63.00 KB
- 文档页数:2

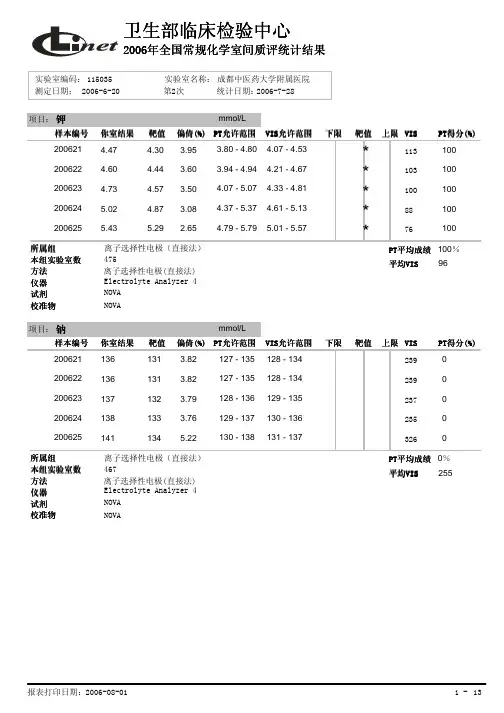
2017年卫生部临床检验中心室间质量评价标准临床化学(NCCL—C-01)2017年2016年钾靶值±6%靶值±0。
5mmol/L钠靶值±4%靶值±4mmol/L氯靶值±5%靶值±5%钙靶值±5%靶值±0.250mmol/L(1。
0mg/dL)磷靶值±10%靶值±0。
097mmol/L或靶值±10。
7%(取大者)葡萄糖靶值±7%靶值±0。
33mmol/L(6mg/dL)或±10%(取大者)尿素靶值±8%靶值±0。
71mmol/L或±9%(取大者)尿酸靶值±12%靶值±17%肌酐靶值±12%靶值±26。
5ummol/L(0.3mg/dL)或±15%(取大者)总蛋白靶值±5%靶值±10%白蛋白靶值±6%靶值±10%总胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%总胆红素靶值±15%靶值±6.84mmol/L(0。
4mg/dL)或±20%(取大者)丙氨酸氨基转移酶靶值±16%靶值±20%天门冬氨酸氨基转移酶靶值±15%靶值±20%碱性磷酸酶靶值±18%靶值±30%淀粉酶靶值±15%靶值±30%肌酸激酶靶值±15%靶值±30%乳酸脱氢酶靶值±11%靶值±20%直接胆红素靶值±2s靶值±2s铁靶值±15%靶值±20%总铁结合力靶值±2s镁靶值±15%靶值±25%锂靶值±0.3mmol/L 或±20%(取大者)铜靶值±2s锌靶值±2s酸性磷酸酶靶值±30%γ-谷氨酰基转移酶靶值±11%靶值±20%α—羟丁酸脱氢酶靶值±30%靶值±30%胆碱酯酶靶值±20%靶值±20%脂肪酶靶值±20%靶值±20%心肌标志物肌酸激酶—MB (ug/L)靶值±30%靶值±30%肌红蛋白靶值±30%靶值±30%肌钙蛋白-I靶值±30%靶值±30%肌钙蛋白—T靶值±30%靶值±30%肌酸激酶-MB(U/L)靶值±30%超敏CRP靶值±30%靶值±30%同型半胱氨酸靶值±2.5μmol/L 或±20%(取大者)脂类胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值±30%靶值±30%低密度脂蛋白胆固醇靶值±30%靶值±30%载脂蛋白A1靶值±30%靶值±30%载脂蛋白B靶值±30%靶值±30%脂蛋白(a)靶值±30%血气分析pH靶值±0。

美国CLIA’88临床检验各专业室内质量控制文件(一)美国CLIA'88质量控制要求美国临床实验室改进修正法案最终规则(CLIA final rule)于2003年1月24日通过,2003年4月24日实施.其中K-非豁免试验的质量体系,分析系统中493。
1256标准:控制程序(control procedures)对各专业质量控制提出具体要求。
1、控制程序根据美国CLIA’88最终规则Sec.493。
1256标准:控制程序(a)对于每一检测系统,实验室负责制定控制程序,监测整个分析过程的准确度和精密度。
(b)实验室必须建立检测控制物的数量、类型和频率,如果适合,实验室应按Sec.493.1256 (b)(3)规定验证或建立性能规范.(c)控制程序必须(1)立即检测出由于检测系统故障、不利的环境条件及操作者性能而产生的误差。
(2)长期监测由于检测系统性能和环境条件改变和操作者性能变化而可能影响到的准确度和精密度性能。
(d)除了CMS批准的程序,如国家操作手册附录C中规定(CMS Pub.7)的外,提供了等效质量检测,实验室必须(1)执行本节规定的质量控制程序,除非在493.1261到493。
1278部分其他专业和亚专业有其他的规定。
(2)对于每一检测系统,当他们满足或超出本节(d)(3)部分要求时,执行的质量控制程序使用厂家规定或实验室建立的个数和频率。
(3)每天检测患者标本时至少每天检测一次控制品,或执行如下的步骤(i)每一定量检测程序,包括两个不同浓度水平的控制品;(ii)对每一定性的检测程序,包括一个阴性和一个阳性控制品;(iii)对于产生分级或滴度结果的检测程序,分别包括阴性控制品和具有分级或滴度反应性的控制品;(iV)对于具有提取阶段的每一检测系统,包括两个控制品,其中一种能够检出提取阶段的误差;(v)对于每一种分子扩增程序,包括两个控制品,如果反应抑制性是假阴性结果的显著性来源,一个控制品能够检出抑制性作用。

血凝检测系统/方法的分析性能验证评估报告血液组依据CNAS-CL02:《医学实验室质量和能力认可准则》(ISO 15189:2007)对医学实验室检测系统性能评价的相关要求,STago-R-Evolution CA71013993全自动血凝分析、BECKMAN ADVANCE06111582全自动血凝分析系统和性能评价主要从以下几个方面进行:精密度、正确度、分析测量范围和临床可报告范围。
具体实施方案如下。
1 目的:对上述血液组的检测系统/方法的分析性能进行评价,结果与CLIA'88最大允许误差或生产厂家给出的性能指标进行比较,验证生产厂家声明的性能指标,判断检测系统的性能是否符合要求。
2 原理:2.1精密度评价2.1.1采用EP15-A《用户对精密度和准确性能的核实实验-批准指南》的性能要求,通过检测每个项目质控物值,计算项目的批内精密度(δ批内)和总的实验室内精密度(δ总)。
并与厂家声明的批内精密度及总精密度进行比较,核实是否与厂家声明的一致。
2.1.2 STago-R-Evolution CA71013993全自动血凝分析使用正常和异常两个水平的混合血浆,连续进行20次测定,计算CV值,即批内精密度。
测定两个水平的质控品,每天测定一次,共20天计算CV,即为批间精密度。
BECKMAN ADVANCE06111582全自动血凝分析使用正常一个水平的混合血浆,连续进行20次测定,计算CV值,即批内精密度。
测定正常水平的质控品,每天测定一次,共20天计算CV,即为批间精密度。
(参照厂家提供的精密度验证方案)2.2正确度验证评价仪器测量结果与真值的一致程度。
2.2.1 采用卫生部临检中心室间质评回报结果作为评价指标,分析最近一次室间质评回报成绩。
2.2.2 采用EP15-A《用户对精密度和准确性能的核实实验-批准指南》的性能要求,通过检测定值的参考物质来进行正确度验证,判断是否与厂家声明或与其他规定的性能要求一致。

两台生化分析仪同一检测项目结果比对和偏差评估发表时间:2012-07-23T15:55:33.323Z 来源:《中外健康文摘》2012年第13期供稿作者:张兴宗林云邹映东施雄飞[导读] 同一实验室不同仪器间所存在的差别,常被人们所忽略,从而导致检验结果的不确定性,给临床带来困扰。
张兴宗林云邹映东施雄飞(云南省中医医院检验科云南昆明 650021)【中图分类号】R445【文献标识码】A【文章编号】1672-5085(2012)13-0153-02【摘要】目的对罗氏MODULAR P800全自动生化分析仪和强生Vitros 950干式生化分析仪部分相同项目检测结果进行比对和偏差评估,探讨同一检测项目不同生化分析仪测定结果的可比性。
方法参照美国临床实验室标准化委员会(NCCLS)EP9-A2文件要求,分别在2台仪器上测定病人新鲜混合血清,以罗氏MODULAR P800全自动生化分析仪检测系统作为比对系统, 强生Vitros 950干式生化分析仪作为试验系统,用相关回归分析和配对t检验对相同项目的检测结果进行比对和偏差评估,应用医学决定水平处的系统误差作为方法学比对,以美国临床实验室修正法规(CLIA'88)规定的室间质量评价允许总误差范围的1/2为标准,判断不同检测系统的临床可接受性。
结果2台生化分析仪经过比对和校正,多数项目检测结果具有较好的可比性。
结论通过对同一检测项目不同生化分析仪测定结果进行比对和偏差评估,有助于验证不同检测系统相同检测项目结果间的相关性, 以保证检验结果的一致性,有助于仪器评价、校正, 满足临床需要。
【关键词】偏差生化分析仪检测系统允许总误差全自动生化分析仪的广泛应用大大提高了临床生化检测能力,在实验室使用不同的仪器测定同一项目之前,需明确其检验结果是否具有一致性[1]。
同一实验室不同仪器间所存在的差别,常被人们所忽略,从而导致检验结果的不确定性,给临床带来困扰。
使不同检测系统的检测结果具有可比性或一致性是临床医学实验室标准化和规范化必须解决的问题,是临床检验标准化对检验仪器的要求。

性能验证(仅供参考)1 生化生化室项目需要验证的参数包括批内精密度,批间精密度,正确度,线性范围、参考区间,可报告区间等。
适用时,还要考虑分析灵敏度(仅对那些在接近0的低值有临床意义的项目有必要进行确定,必要时,可引用说明书中给出的低值)和干扰试验。
1.1 精密度1.1.1 标本准备及要求质控品、已经检测过的病人标本或具有血清基质的定值材料。
每个项目均需选择至少正常和病理两个浓度水平的验证材料进行验证。
所用样本一定要稳定,其基体组成应尽可能相似于实际检测的病人标本,样本中的分析物含量应在该项目的医学决定水平附近。
1.1.2 方案1.1.2.1 方案1:对验证材料每天分析1批次,2个浓度,每个浓度重复测定4次,连续5天。
记录结果并计算均值、标准差和批内精密度(%)。
1.1.2.2 方案2:批内精密度:浓度分别处于正常和病理水平的混合新鲜临床标本,按照临床标本相同的检测方法,同批次内检测混合的新鲜临床标本20次。
记录结果并计算均值(X)、标准差(SD)和批内变异系数CV(%)。
批间精密度:浓度分别处于正常和病理水平的混合新鲜临床标本,按照临床标本相同的检测方法(或将室内质控品按照常规标本的方法一样测定,测定结果在遵照厂商参数不出控的前提下),同批次内检测混合的新鲜临床标本20次,同一批号室内质控品某一时间段(至少20天)的室内质控数据逐步累积最终得出均值、标准差。
1.1.3结果判断从美国临床实验室室间质量评估允许误差表中查阅评价项目的允许误差范围,由实验数据统计的批内不精密度和批间不精密度小于允许误差范围的1/4和1/3作为检测系统不精密度性能的的可接受标准(或用卫生部临检中心的允许总误差、卫生标准等),且又小于厂商提供的精密度性能指标,说明由实验室评价的检测系统的不精密度性能可接受,符合要求。
若大于判断限,检测系统的不精密度是否符合要示,应再进一步做统计学处理作出判断。
1.2 正确度1.2.1 卫生部临检中心室间质评含盖的项目,则以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。

![美国CLIA’88能力验证计划的分析质量要求(允许总误差)[1]](https://uimg.taocdn.com/b24b6bda680203d8cf2f2405.webp)
附表1 美国CLIA’88能力验证计划的分析质量要求(允许总误差)───────────────────────────────────────检验项目可接受范围常规临床化学谷丙转氨酶靶值±20%白蛋白靶值±10%碱性磷酸酶靶值±30%淀粉酶靶值±30%谷草转氨酶靶值±20%胆红素靶值±LdL)或±20%(取大者)血气PO2 靶值±3s血气PCO2 靶值±5mmHg 或±8%(取大者)血气PH 靶值±钙,总靶值±LdL)氯靶值±5%胆固醇靶值±10%高密度脂蛋白胆固醇靶值±30%肌酸激酶靶值±30%肌酸激酶同功酶 MB升高(存在或不存在)或靶值±3s肌酐靶值±LdL)或±15%(取大者)葡萄糖靶值±L(6mg/dL) 或±10%(取大者)铁靶值±20%乳酸脱氢酶靶值±20%LD同功酶 LD1/LD2(+或-)或靶值±30%镁靶值±25%钾靶值±L钠靶值±4mmol/L总蛋白靶值±10%甘油三酯靶值±25%尿素氮靶值±L尿素(2mg/dL尿素N)或±9%(取大者)尿酸靶值±17%内分泌皮质醇靶值±25%游离的甲状腺素靶值±3s人绒毛膜促性腺激素(HCG) 靶值±3s或(阳性或阴性)T3 uptake 靶值±3s(方法)三碘甲状腺素原氨酸靶值±3s促甲状腺激素靶值±3s甲状腺素靶值±20%或%dL)(取大者)毒理学血酒精靶值±25%血铅靶值±10%或±L(4ug/dL)(取大者)酰氨咪嗪(carbamazepine) 靶值±25%地高辛(digoxin) 靶值±20%或L(更大)乙琥胺(ethosuximide) 靶值±20%庆大霉素靶值±25%锂靶值±L或±20%(更大)苯巴比妥(phenobarbital) 靶值±20%苯妥英(phenytoin) 靶值±25%扑痫酮(primidone) 靶值±25%普鲁卡因酰氨(procainamid)(及代谢物) 靶值±25%奎尼丁(quinidine) 靶值±25%茶碱(theophylline) 靶值±25%妥布霉素(tobramycin) 靶值±25%Valproic acid 靶值±25%血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上的3s红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±25%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%一般免疫学a1-抗胰蛋白酶靶值±3s抗核抗体靶值±2个稀释或(阳或阴)抗-HIV 反应或不反应补体3 靶值±3s补体4 靶值±3sa-甲胎蛋白靶值±3s肝炎(HBsAg,anti-HBc,HBeAg) 反应(阳性)或不反应(阴性)IgA 靶值±3sIgE 靶值±3sIgG 靶值±25%IgM 靶值±3s传染性单核细胞增多(症) 靶值±2个稀释或(阳性或阴性)类风湿因子靶值±2个稀释或(阳性或阴性)风疹(Rubella) 靶值±2个稀释或(阳性或阴性)。
![美国CLIA’88能力验证计划的分析质量要求(允许总误差)[1]](https://uimg.taocdn.com/75b12b5733687e21ae45a90a.webp)
附表1 美国CLIA’88能力验证计划的分析质量要求(允许总误差)───────────────────────────────────────检验项目可接受范围常规临床化学谷丙转氨酶靶值±20%白蛋白靶值±10%碱性磷酸酶靶值±30%淀粉酶靶值±30%谷草转氨酶靶值±20%胆红素靶值±6.84mmol/L(0.4mg/dL)或±20%(取大者) 血气PO2 靶值±3s血气PCO2 靶值±5mmHg 或±8%(取大者)血气PH 靶值±0.04钙,总靶值±0.250mmol/L(1.0mg/dL)氯靶值±5%胆固醇靶值±10%高密度脂蛋白胆固醇靶值±30%肌酸激酶靶值±30%肌酸激酶同功酶MB升高(存在或不存在)或靶值±3s肌酐靶值±0.265umol/L(0.3mg/dL)或±15%(取大者) 葡萄糖靶值±0.33mmol/L(6mg/dL) 或±10%(取大者) 铁靶值±20%乳酸脱氢酶靶值±20%LD同功酶LD1/LD2(+或-)或靶值±30%镁靶值±25%钾靶值±0.5mmol/L钠靶值±4mmol/L总蛋白靶值±10%甘油三酯靶值±25%尿素氮靶值±0.71mmol/L尿素(2mg/dL尿素N)或±9%(取大者)尿酸靶值±17%内分泌皮质醇靶值±25%游离的甲状腺素靶值±3s人绒毛膜促性腺激素(HCG) 靶值±3s或(阳性或阴性)T3 uptake 靶值±3s(方法)三碘甲状腺素原氨酸靶值±3s促甲状腺激素靶值±3s甲状腺素靶值±20%或12.9%(1.0ug/dL)(取大者)毒理学血酒精靶值±25%血铅靶值±10%或±0.019ummol/L(4ug/dL)(取大者) 酰氨咪嗪(carbamazepine) 靶值±25%地高辛(digoxin) 靶值±20%或0.2ug/L(更大)乙琥胺(ethosuximide) 靶值±20%庆大霉素靶值±25%锂靶值±0.3mmol/L或±20%(更大)苯巴比妥(phenobarbital) 靶值±20%苯妥英(phenytoin) 靶值±25%扑痫酮(primidone) 靶值±25%普鲁卡因酰氨(procainamid)(及代谢物) 靶值±25%奎尼丁(quinidine) 靶值±25%茶碱(theophylline) 靶值±25%妥布霉素(tobramycin) 靶值±25%V alproic acid 靶值±25%血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上的3s 红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±25%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%一般免疫学a1-抗胰蛋白酶靶值±3s抗核抗体靶值±2个稀释或(阳或阴)抗-HIV 反应或不反应补体3 靶值±3s补体4 靶值±3sa-甲胎蛋白靶值±3s肝炎(HBsAg,anti-HBc,HBeAg) 反应(阳性)或不反应(阴性)IgA 靶值±3sIgE 靶值±3sIgG 靶值±25%IgM 靶值±3s传染性单核细胞增多(症) 靶值±2个稀释或(阳性或阴性) 类风湿因子靶值±2个稀释或(阳性或阴性)风疹(Rubella) 靶值±2个稀释或(阳性或阴性)。

检验科性能验证程序文件XXX人民医院检验科程序文件主题内容文件编号:JYK-02-CXWJ版本/修订号:A/0生效日期:性能验证性能验证1目的验证检测试剂在仪器上的性能指标。
2适用范围适用于检验科检验项目试剂的性能指标验证。
3职责3.1科主任:负责审批性能验证计划。
3.2技术负责人3.2.1负责制定性能验证方案和计划。
3.2.2负责组织性能验证的实施。
3.2.3负责定期对科室性能验证数据的统计、分析和总结。
3.2.4负责组织对上述活动的可行性和有效性评审。
3.3各专业组技术管理员3.3.1负责组织本组人员完成本组性能验证的验证工作。
3.3.2负责对本组性能验证数据的统计、分析和总结工作。
3.4检验人员3.4.1负责协助科室技术负责人和本组技术管理员完成本组的性能验证工作。
3.4.2负责完成本组性能验证工作中应承担的检验工作。
3.4.3卖力认真填写本组机能验证的检修记录。
4内容4.1生化生化室项目需要验证的参数包括批内精密度,批间精密度、正确度、线性范围、参考区间、可报告区间等,适用时,还要考虑分析灵敏度(仅对那些在接近的低值有临床意义的项目有必要进行确定,必要时,可引用说明书中给出的低值)和干扰试验。
4.1.1精密度4.1.1.1标本准备及要求可采用新鲜或冻存的样本。
当样本中待测物不稳定或样本不易得到时,也可考虑使用基质与实际待检样本相似的样本,如质控品。
应至少评估2个浓度水平样本的不精密度。
当2个浓度水平样本的不精密度有显著差异时,建议增加为3个浓度水平。
所选样本的被测物水平应在测量区间内,适宜时,至少有1个样本的被测物水平在医学决定水平左右。
注1:通常较高值样本的不精密度较小,较低值样本的不精密度偏大。
对低值有临床意义的检测项目,宜评判有判断代价的低程度样本的不精密度。
注2:如检测结果没有明确的医学决定水平,可在参考区间上限左右选1个浓度,再根据检验项目的特点在测量区间内选择另一个浓度。
XXX群众医院检修科程序文件主题内容文件编号:JYK-02-CXWJ版本/修订号:A/0见效日期:性能验证注3:如与厂商或文献报导的不精密度比较,所选样本水平宜与被比较的样本水平接近。

性能验证报告单位名称:AAA医院科室名称:检验科实验室:生化组仪器名称:全自动特定蛋白分析仪型号规格:BNⅡ仪器编号:SH008验证人员:审核人:批准人:验证日期:2012年6月1日—2012年8月23日目录抗链球菌溶血素(ASO)方法学验证 (1)补体C3方法学验证 (7)补体C4方法学验证 (12)C-反应蛋白(CRP)方法学验证 (17)免疫球蛋白A(IgA)方法学验证 (23)免疫球蛋白G(IgG)方法学验证 (29)免疫球蛋白M(IgM)方法学验证 (35)类风湿因子(RF)方法学验证 (41)抗链球菌溶血素(ASO)方法学验证一.检测系统信息:项目:血ASO仪器名称:西门子BN系列特种蛋白分析仪仪器型号:BNⅡ试剂及厂商:西门子公司标准试剂检测方法:免疫散射比浊法二. 厂商的相关参数:<1/4卫生部临检中心室间质评最大允许误差,批间精密度<1/3卫生部临检中心室间质评最大允许误差。
三.验证过程:1.精密度(Precision):1.1批内精密度:目的:考察方法的随机误差●标本来源:浓度分别处于正常和病理水平的混合新鲜临床标本,正常水平标本来源条码号:12072410582;12072410572;12072410588;12072410594。
病理水平标本来源条码号:12072110155;12072110355;12072410874.检测方法:按照临床标本相同的检测方法,同批次内检测混合的新鲜临床标本20次。
记录结果并计算均值(X)、标准差(SD)和批内变异系数CV(%)。
●测定时间及测定编号:正常水平:2012.07.27,测定编号101-120;病理水平:2012.07.30,测定编号121-140。
●试剂批号:110731●测定结果:●CV%值分别为1.84和1.32,小于1/4最大允许误差6.25,可判定该项目批内精密度验证结果为“通过”。
1.2批间精密度:●目的:考察方法的随机误差●评价方法:选择室内质控作为衡量批间精密度的依据。
附表1 美国CLIA’88能力验证计划的分析质量要求(允许总误差)───────────────────────────────────────检验项目可接受范围常规临床化学谷丙转氨酶靶值±20%白蛋白靶值±10%碱性磷酸酶靶值±30%淀粉酶靶值±30%谷草转氨酶靶值±20%胆红素靶值±6.84mmol/L(0.4mg/dL)或±20%(取大者) 血气PO2 靶值±3s血气PCO2 靶值±5mmHg 或±8%(取大者)血气PH 靶值±0.04钙,总靶值±0.250mmol/L(1.0mg/dL)氯靶值±5%胆固醇靶值±10%高密度脂蛋白胆固醇靶值±30%肌酸激酶靶值±30%肌酸激酶同功酶MB升高(存在或不存在)或靶值±3s肌酐靶值±0.265umol/L(0.3mg/dL)或±15%(取大者) 葡萄糖靶值±0.33mmol/L(6mg/dL) 或±10%(取大者) 铁靶值±20%乳酸脱氢酶靶值±20%LD同功酶LD1/LD2(+或-)或靶值±30%镁靶值±25%钾靶值±0.5mmol/L钠靶值±4mmol/L总蛋白靶值±10%甘油三酯靶值±25%尿素氮靶值±0.71mmol/L尿素(2mg/dL尿素N)或±9%(取大者)尿酸靶值±17%内分泌皮质醇靶值±25%游离的甲状腺素靶值±3s人绒毛膜促性腺激素(HCG) 靶值±3s或(阳性或阴性)T3 uptake 靶值±3s(方法)三碘甲状腺素原氨酸靶值±3s促甲状腺激素靶值±3s甲状腺素靶值±20%或12.9%(1.0ug/dL)(取大者)毒理学血酒精靶值±25%血铅靶值±10%或±0.019ummol/L(4ug/dL)(取大者) 酰氨咪嗪(carbamazepine) 靶值±25%地高辛(digoxin) 靶值±20%或0.2ug/L(更大)乙琥胺(ethosuximide) 靶值±20%庆大霉素靶值±25%锂靶值±0.3mmol/L或±20%(更大)苯巴比妥(phenobarbital) 靶值±20%苯妥英(phenytoin) 靶值±25%扑痫酮(primidone) 靶值±25%普鲁卡因酰氨(procainamid)(及代谢物) 靶值±25%奎尼丁(quinidine) 靶值±25%茶碱(theophylline) 靶值±25%妥布霉素(tobramycin) 靶值±25%V alproic acid 靶值±25%血液学细胞识别在分类上90%或更大的一致白细胞分类靶值±在不同类型白细胞百分数上的3s 红细胞计数靶值±6%血细胞容积靶值±6%血红蛋白靶值±7%白细胞计数靶值±15%血小板计数靶值±25%纤维蛋白原靶值±25%激活部分凝血酶时间靶值±15%凝血酶原时间靶值±15%一般免疫学a1-抗胰蛋白酶靶值±3s抗核抗体靶值±2个稀释或(阳或阴)抗-HIV 反应或不反应补体3 靶值±3s补体4 靶值±3sa-甲胎蛋白靶值±3s肝炎(HBsAg,anti-HBc,HBeAg) 反应(阳性)或不反应(阴性)IgA 靶值±3sIgE 靶值±3sIgG 靶值±25%IgM 靶值±3s传染性单核细胞增多(症) 靶值±2个稀释或(阳性或阴性) 类风湿因子靶值±2个稀释或(阳性或阴性)风疹(Rubella) 靶值±2个稀释或(阳性或阴性)仅供个人用于学习、研究;不得用于商业用途。