精馏的原理 (1)
- 格式:pptx
- 大小:655.26 KB
- 文档页数:5

精馏的基本原理(一)精馏的基本原理什么是精馏精馏是一种将液体混合物分离成各个组分的方法。
它基于不同组分的挥发性差异,通过加热液体混合物并利用组分的沸点差异分离组分。
精馏的基本原理精馏主要基于两个原理:沸点差异和液体汽化-冷凝循环。
沸点差异每个纯净物质都有其特定的沸点,即在一定的大气压下,物质从液体态转变为气体态所需的温度。
不同组分在混合物中的沸点有所差异,利用这一差异可以将混合物分离。
汽化-冷凝循环精馏通过加热液体混合物,使沸点较低的组分先转化为气体,随后通过冷凝将气体转化回液体态。
此过程中,将产生两种相,即汽相和液相。
通过收集、冷凝液相,可以得到更纯净的组分。
精馏的实际操作步骤1.准备装置:精馏仪由一组蒸馏烧瓶、加热器、冷凝管、接收瓶和温度控制器组成。
2.加热:将液体混合物放入蒸馏烧瓶中,在加热器的作用下,加热液体混合物使其开始汽化。
3.汽化:较低沸点的组分首先转化为气体,形成汽相。
4.冷凝:汽相通过冷凝管,被冷却为液体,并被收集在接收瓶中。
5.分离:重复加热、汽化、冷凝的过程,连续地将不同沸点的组分分离出来。
6.收集:将不同组分的收集瓶分别标注,存储纯净的组分。
实际应用精馏广泛应用于化学、石油、制药等领域。
以下是一些实际应用示例: - 石油精炼:将原油中的不同组分,如汽油、柴油和润滑油,通过精馏分离出来。
- 酒精制备:将发酵液中的酒精蒸发并冷凝,得到高纯度的酒精产品。
- 制药工艺:在制药过程中,精馏可用于纯化、分离药物的不同成分。
- 高纯度溶剂制备:通过精馏可以获得高纯度的有机溶剂,用于实验室研究和工业生产。
总结精馏是一种常用的物理分离技术,基于沸点差异和液体汽化-冷凝循环原理。
通过加热液体混合物并冷凝汽相,可以分离出混合物中的不同组分。
精馏在众多领域中有广泛的应用,可用于分离和纯化各类液体混合物。
精馏的类型根据不同的需求,精馏可以分为以下几种类型:1.简单精馏:适用于沸点差异明显的组分分离,只需一个蒸馏烧瓶和一个冷凝管。

精馏装置原理精馏是一种重要的化学分离技术,它在广泛的应用中起着重要的作用。
精馏的原理是利用不同成分在特定温度和压力下的升华和凝聚来分离混合物中的组分。
精馏通常通过特定的装置来实现。
一般而言,精馏可分为简单精馏和复杂精馏。
这两种方法主要的区别在于它们的原理和操作上的差异,以及其中复杂精馏具有更好的分离效果和应用范围。
以下是具体的原理及操作介绍。
1. 简单精馏原理简单精馏是最基础的精馏方法,它适用于分离具有较小沸点差异的混合物。
原理是将混合物加热并使其升华,然后在冷凝器中冷却并使其凝结。
这样就可以将混合物中的不同成分根据其沸点进行分离。
简单精馏要求混合物的沸点差异不能太大,一般应在25℃以下。
2. 简单精馏操作步骤简单精馏的操作步骤如下:(1)将混合物倒入精馏瓶中,并添加适量木炭或活性炭以减少杂质的影响。
(2)将精馏瓶连同冷凝器、配件和鼓风机装置等连接在一起。
(3)将精馏瓶内的混合物加热并使其升华,利用鼓风机将升华的气体引入冷凝器中。
(4)在冷凝器中通过冷却液使升华的气体冷却并凝固,分离出不同成分。
(5)将分离出的组分逐一收集,保存并进行后续检测。
3. 复杂精馏原理相比简单精馏,复杂精馏需要更加先进的设备和技术,可以分离不同沸点差异更大的混合物。
在现代工业及实验室中广泛使用的复杂精馏方法主要包括气相色谱法、液相色谱法、毛细管电泳法等。
这些方法都依赖于不同升华和凝聚速度的成分表现出不同的行为。
4. 复杂精馏操作步骤由于不同的精馏方法和设备有其固有的特征,因此复杂精馏方法的具体操作方法也略有不同。
以下是通用的几个步骤:(1)首先将混合物装入特定的精馏装置。
(2)启动加热器升温,并在适当的温度下保持一段时间。
(3)如果需要进行软件和硬件调整,则在采集过程中把控温度和压力等因素。
(4)根据需要,考虑使用特定的分离方法,例如液相色谱法、气相色谱法或毛细管电泳法,以获得更好的分离效果。
(5)根据原材料和需要目的,进行必要的分离收集。

精馏的原理及应用精馏是一种分离技术,通过控制液体在不同的沸点下蒸发和凝结,以实现对混合物的分离和纯化。
精馏技术的原理主要基于混合物中不同组分的沸点差异。
在一个精馏塔内,混合物被加热到沸腾。
此时,含有较低沸点的组分会首先蒸发,形成蒸汽,然后在塔内上升。
蒸汽中的组分在塔内上升过程中与冷却剂接触并冷凝为液体。
液体通过回流回到塔底,并被加热器再次加热。
这个循环使得混合物中低沸点的组分不断蒸发和冷凝,逐渐从混合物中分离出来。
高沸点的组分则会在混合物中停留,直至最后。
精馏广泛应用于化工工业中,主要包括以下几种应用:1. 各类石油产品的精炼:原油中含有不同沸点的烃类化合物,通过精馏可以将原油分离成汽油、柴油、煤油等不同的石油产品。
2. 酒精的提纯和精制:通过物质的蒸馏和重新凝结,可以提纯酒精,使其达到工业标准,用于制药、饮品等领域。
3. 各种有机化合物的制备和法药生产:许多有机化合物生产工艺中,需要对反应产物进行分离和提纯。
精馏是一种常用的技术,可以将目标化合物从反应混合物中分离出来,以提高纯度。
4. 水的脱盐和除气:海水淡化是一种利用精馏技术将海水转化为淡水的方法。
通过加热蒸发海水,然后将蒸汽冷凝,可以实现对盐分和杂质的除去。
同时,也可以利用精馏去除水中的溶解氧和其他气体。
5. 液态天然气(LNG)的制备:液态天然气是一种在极低温下制备的天然气。
利用精馏技术可以将天然气中的杂质、油和水分离出来,以获得纯净的液态天然气。
精馏技术虽然应用广泛,但也存在着一些限制和挑战。
首先,精馏设备的设计和操作要求较高,需要控制好温度和压力等参数,以实现有效的分离效果。
此外,对于沸点接近的组分,精馏效果较差,需要采用其他辅助技术来提高分离效率。
此外,精馏设备的能耗较高,需要消耗大量的热能。
总的来说,精馏技术是一种重要的分离和纯化技术,广泛应用于化工、制药、能源等领域。
通过控制不同组分的沸点差异,精馏可以实现对混合物的高效分离和纯化,达到所需的产品质量要求。
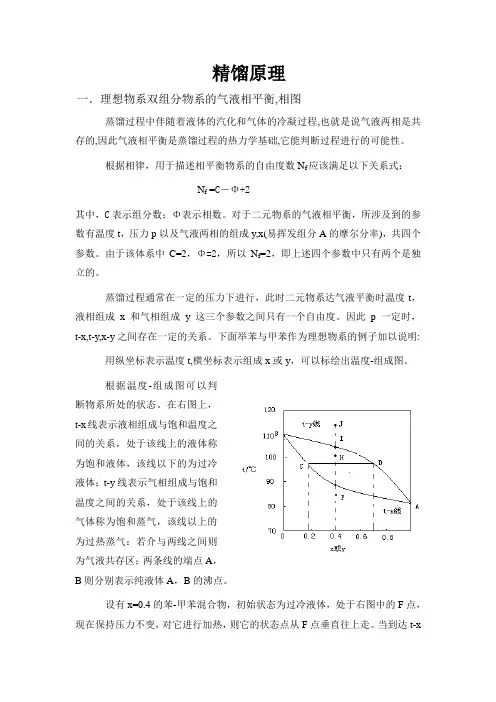
精馏原理一.理想物系双组分物系的气液相平衡,相图蒸馏过程中伴随着液体的汽化和气体的冷凝过程,也就是说气液两相是共存的,因此气液相平衡是蒸馏过程的热力学基础,它能判断过程进行的可能性。
根据相律,用于描述相平衡物系的自由度数N f应该满足以下关系式:N f =C-Φ+2其中,C表示组分数;Φ表示相数。
对于二元物系的气液相平衡,所涉及到的参数有温度t,压力p以及气液两相的组成y,x(易挥发组分A的摩尔分率),共四个参数。
由于该体系中C=2,Φ=2,所以N f=2,即上述四个参数中只有两个是独立的。
蒸馏过程通常在一定的压力下进行,此时二元物系达气液平衡时温度t,液相组成x和气相组成y这三个参数之间只有一个自由度。
因此p一定时,t-x,t-y,x-y之间存在一定的关系。
下面举苯与甲苯作为理想物系的例子加以说明: 用纵坐标表示温度t,横坐标表示组成x或y,可以标绘出温度-组成图。
根据温度-组成图可以判断物系所处的状态。
在右图上,t-x线表示液相组成与饱和温度之间的关系,处于该线上的液体称为饱和液体,该线以下的为过冷液体;t-y线表示气相组成与饱和温度之间的关系,处于该线上的气体称为饱和蒸气,该线以上的为过热蒸气:若介与两线之间则为气液共存区;两条线的端点A,B则分别表示纯液体A,B的沸点。
设有x=0.4的苯-甲苯混合物,初始状态为过冷液体,处于右图中的F点,现在保持压力不变,对它进行加热,则它的状态点从F点垂直往上走。
当到达t-x线上的G点时,液体达到饱和,并将开始沸腾产生第一个气泡,故常称t-x线为泡点线;继续生温气体量增多,在到达t-y线之前都处于气液共存区,其中的气液相平衡。
当到达t-y线上的I点,所有的液体恰好完全汽化,蒸气达到饱和,再继续升温就变成过热蒸气了,如在J点,若考虑采用从J点开始的冷却过程,当到达I点时,蒸气将开始冷凝并产生第一个液滴,故常称t-y线为露点线。
若以x,y为横,纵坐标,可得y-x图,如右图所示,其中y-x线称为相平衡曲线,通常还在相图中添加对角线作为参考线,以表示相平衡线偏离对角线的程度。




精馏的基本概念精馏的基本概念精馏是一种分离混合物中不同组分的方法,其原理是利用不同组分在液态和气态之间转化时的沸点差异。
在精馏过程中,混合物被加热至沸腾,然后通过冷凝器冷却,使得不同组分在液态和气态之间转化,并被收集。
一、精馏的原理1. 沸点差异原理精馏原理基于混合物中各组分沸点的差异。
当混合物被加热至其沸点时,其中具有较低沸点的组分首先蒸发,形成蒸汽。
这些蒸汽通过冷凝器冷却并变为液体,从而单独收集每个组分。
2. 热力学原理精馏还遵循热力学规律。
当两种或多种组分混合时,它们会自发地向着更稳定的状态转化。
因此,在混合物中存在着一种趋势,即使在相同温度下也会使其中某些组分具有更高的浓度。
二、精馏过程1. 简单批量蒸馏简单批量蒸馏是最基本的精馏方法。
在这种情况下,混合物在一个容器中被加热,然后通过一个冷凝器进行冷却,并收集不同组分。
这种方法通常用于分离液态混合物。
2. 稳态蒸馏稳态蒸馏是一种连续操作的精馏方法。
混合物被加热并注入塔中,然后沿着塔向上流动。
在塔的不同层次上,存在着不同的温度和压力条件,使得不同组分可以逐步分离。
3. 气相色谱法气相色谱法是一种高效、快速、准确的精馏技术。
它利用气体载体将混合物中的组分带到某个检测器中进行检测。
该技术广泛应用于化学、制药和食品工业等领域。
三、应用领域1. 化学工业在化学工业中,精馏广泛应用于提纯化学品和制备高纯度试剂。
2. 石油工业石油工业使用精馏来提取原油中的各种组分,并将其转化为成品油。
3. 食品工业食品工业中,精馏用于提取香料和调味品中的各种化合物,以及酿造酒类和饮料。
4. 制药工业制药工业使用精馏来提取药物中的活性成分,并将其纯化为高纯度药物。
四、总结精馏是一种分离混合物中不同组分的方法,其原理基于沸点差异和热力学规律。
精馏过程包括简单批量蒸馏、稳态蒸馏和气相色谱法等。
该技术广泛应用于化学、石油、食品和制药等领域。
精馏原理和流程1.掌握的内容:精馏分离过程原理及分析2.重点:精馏原理、精馏装置作用3.难点:精馏原理,部分气化和部分冷凝在实际精馏操作中有机结合的过程。
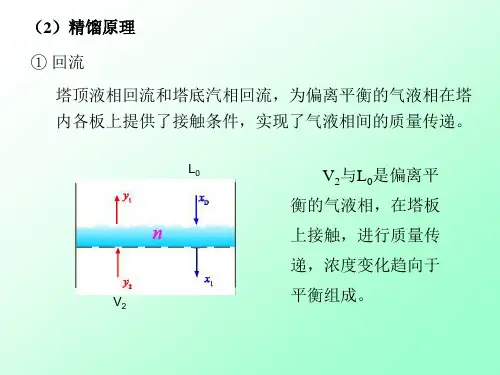
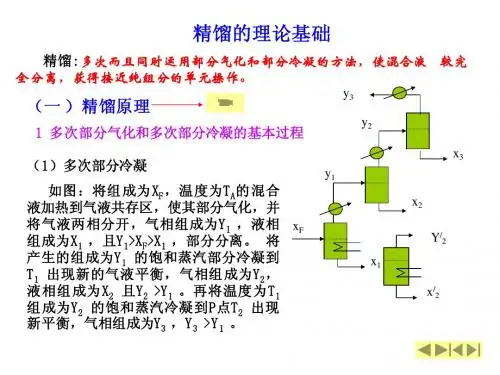
1.4.1 精馏原理精馏:多次而且同时运用部分气化和部分冷凝的方法,使混合液得到较完全分离,以分别获得接近纯组分的操作。
理论上多次部分气化在液相中可获得高纯度的难挥发组分,多次部分冷凝在气相中可获得高纯度的易挥发组分,但因产生大量中间组分而使产品量极少,且设备庞大。
工业生产中的精馏过程是在精馏塔中将部分气化过程和部分冷凝过程有机结合而实现操作的。
1.4.2 精馏装置流程一、精馏装置流程典型的精馏设备是连续精馏装置,包括精馏塔、冷凝器、再沸器等,如图1-8所示。
用于精馏的塔设备有两种,即板式塔和填料塔,但常采用的是板式塔。
连续精馏操作中,原料液连续送入精馏塔内,同时从塔顶和塔底连续得到产品(馏出液、釜残液),所以是一种定态操作过程。
二、精馏装置的作用精馏塔以加料板为界分为两段,精馏段和提馏段。
1、精馏段的作用加料板以上的塔段为精馏段,其作用是逐板增浓上升气相中易挥发组分的浓度。
2、提馏段的作用包括加料板在内的以下塔板为提馏段,其作用逐板提取下降的液相中易挥发组分。
3、塔板的作用塔板是供气液两相进行传质和传热的场所。
每一块塔板上气液两相进行双向传质,只要有足够的塔板数,就可以将混合液分离成两个较纯净的组分。
4、再沸器的作用其作用是提供一定流量的上升蒸气流。
5、冷凝器的作用其作用是提供塔顶液相产品并保证有适当的液相回流。
回流主要补充塔板上易挥发组分的浓度,是精馏连续定态进行的必要条件。
精馏是一种利用回流使混合液得到高纯度分离的蒸馏方法。
简述精馏原理精馏原理是一种利用物质的不同沸点来进行分离的方法,它在化工生产和实验室中都有着广泛的应用。
精馏原理的核心在于利用不同物质的沸点差异,通过加热液体混合物使其汽化,然后再通过冷凝使其重新凝结,从而实现不同成分的分离。
接下来我们将简要介绍精馏原理的基本概念和工作原理。
首先,让我们来了解一下精馏的基本概念。
精馏是一种通过控制沸点来实现液体混合物分离的方法。
在精馏过程中,液体混合物被加热至其中成分的沸点,使其部分汽化并形成蒸汽。
然后,这些蒸汽被冷却并凝结成液体,最终得到纯净的成分。
精馏的工作原理基于不同成分的沸点差异。
当液体混合物被加热时,其中沸点较低的成分首先汽化,形成蒸汽。
这些蒸汽经过冷却后凝结成液体,从而实现了不同成分的分离。
通过控制加热温度和冷却条件,可以实现对不同成分的有效分离。
精馏可以分为常压精馏和减压精馏两种。
常压精馏适用于液体混合物中成分之间的沸点差异较大的情况,而减压精馏则适用于沸点差异较小的情况。
在减压精馏中,通过降低系统压力,可以降低液体的沸点,从而实现对沸点差异较小的成分的分离。
精馏的应用非常广泛,它被广泛应用于石油化工、制药、食品加工等领域。
在石油化工中,精馏被用于原油的分馏,从而得到不同沸点范围内的燃料和化工原料。
在制药工业中,精馏被用于分离和纯化药物原料。
在食品加工中,精馏被用于酒精、香精等的提取和纯化。
总之,精馏原理是一种利用物质的不同沸点来进行分离的方法,其工作原理基于不同成分的沸点差异。
通过控制加热和冷却条件,可以实现对液体混合物中不同成分的有效分离。
精馏在化工生产和实验室中有着广泛的应用,对于提高产品纯度和提取纯净成分具有重要意义。
精馏的基本原理是什么,为什么回流液
精馏是一种重要的化工分离方法,其基本原理是根据组分在不同温度下的沸点
差异,利用加热和冷却来实现组分的分离。
在进行精馏过程中,液体混合物首先被加热至沸点,然后被引入精馏塔中,通过蒸馏柱中的填料或塔板,将蒸汽和液态组分进行传质传热的过程,使得液体混合物中的各个组分根据其沸点的不同被分离出来。
回流液在精馏过程中扮演着至关重要的角色。
回流液是指由精馏塔的顶部冷凝
器产生的液态物质,经过塔板或填料层返回到塔底的液体。
回流液的存在有助于提高分馏效率和提高纯度。
回流液的主要作用有以下几点:
1.提高传热效率:回流液通过蒸汽凝结释放出大量的热量,这有助于
保持塔板或填料的温度稳定,提高传热效率。
2.促进物质的混合和分配:回流液的再次引入可以促进物质在塔板或
填料中的混合和分配,帮助各组分更均匀地分离。
3.提高分馏效率:回流液的再沸腾可以提高精馏塔内各塔板或填料层
之间的传质传热效率,从而提高分馏效率,使得组分的分离更加彻底。
4.减少能源消耗:由于回流液释放出的热量可以提供一部分加热能量,
减少外部能源的消耗,达到节能的目的。
总的来说,回流液在精馏过程中扮演着积极的角色,有利于提高分馏效率、成
品质量和减少能源消耗,在工业生产中具有重要的应用价值。
因此,对精馏过程中回流液的合理利用和控制是非常重要的。
天然气精馏的原理及流程
原理:利用混合物中各组分挥发能力的差异,通过液相和气相的回流,使气、液两相逆向多级接触,在热能驱动和相平衡关系的约束下,使得易挥发组分(轻组分)不断从液相往气相中转移,而难挥发组分却由气相向液相中迁移,使混合物得到不断分离,称该过程为精馏。
流程:原料液连续地加入精馏塔内。
连续地从再沸器取出部分液体作为塔底产品(称为釜残液)。
塔顶蒸汽进入全(冷)凝器被全部冷凝,将部分冷凝液用泵(或借重力作用)送回塔顶作为回流液体,其余部分作为塔顶产品(称为馏出液)采出。
该过程中,传热、传质过程同时进行,属传质过程控制。
在精馏段,气相在上升的过程中,气相轻组分不断得到精制,在气相中不断地增浓,在塔顶获轻组分产品。
在塔内气液两相组分浓度沿塔高呈阶梯变化。
在提馏段,其液相在下降的过程中,其轻组分不断地提馏出来,使重组分在液相中不断地被浓缩,在塔底获得重组分的产品。
精馏的基本原理精馏是一种常用的分离和纯化混合物的方法,广泛应用于石油化工、化学工程、生物工程等领域。
其基本原理是利用不同组分的沸点差异,在恰当的条件下使混合物分离为不同组分。
精馏过程中主要涉及到两个关键概念:馏分和回流。
馏分是指通过精馏过程分离出来的纯净组分。
在精馏塔中,混合物被加热至沸点,开始蒸发。
蒸汽在塔内上升时,与冷凝的液体发生热量交换,部分蒸汽冷凝成液体。
这些冷凝液体就是馏分,其含有较高纯度的目标组分。
回流是指将部分冷凝液体重新引入精馏塔的过程。
回流液体通过塔内的填料层,与向上运动的蒸汽进行充分的接触,以实现组分的分离。
回流液体的引入使得塔内温度分布更加均匀,提高了分离效率。
精馏的基本原理可以通过以下几个步骤来描述:第一步是加热混合物。
混合物被加热至沸点,开始蒸发。
不同组分的沸点不同,因此各组分的蒸汽部分不同。
第二步是蒸汽上升。
蒸汽在精馏塔内上升,与填料层进行热量交换。
填料层提供了大量的表面积,增加了蒸汽和液体之间的接触,促进了组分的传递。
第三步是冷凝液体。
在塔顶部分,蒸汽进入冷凝器,冷凝成液体。
这些液体称为馏分,含有较高纯度的目标组分。
第四步是回流液体。
部分冷凝液体被引入塔底部,作为回流液体重新进入塔内。
回流液体与蒸汽在填料层进行接触,以实现更好的分离效果。
第五步是收集馏分。
通过控制回流液体的流量和塔顶的温度,可以控制馏分的纯度和产量。
纯度较高的馏分在塔顶收集,而纯度较低的馏分在塔底收集。
总的来说,精馏是利用不同组分的沸点差异,在适当的条件下通过蒸发和冷凝来实现混合物的分离和纯化。
通过控制回流液体的引入和馏分的收集,可以实现对目标组分的高效分离。
精馏作为一种常用的分离技术,在化工领域发挥着重要的作用。
它不仅可以用于提取纯净的化学品,还可以用于分离和回收有机溶剂、去除杂质等。
同时,精馏技术也在不断发展和改进中,以提高分离效率和降低能耗,为工业生产提供更可靠的解决方案。
一、工艺原理1 精馏原理●化工生产常需将液体混合物分离以达到提纯或回收有用组分的目的。
分离互溶液体混合物有许多种方法,蒸馏是广泛应用的一种方法。
●液体具有挥发而成为蒸汽的能力。
各种液体的挥发能力不同,因此,液体混合物汽化后所生成的蒸汽组成与原来液体的组成是有差别的,蒸馏就是藉液体混合物中各组分挥发性的差异而进行分离的一种操作。
一、工艺原理●蒸馏按操作方式可分为简单蒸馏、平衡蒸馏、精馏及特殊精馏等多种方法。
按操作压力可分为常压蒸馏、加压及减压(真空)蒸馏。
按操作是否连续可分为连续精馏和间歇精馏。
按原料中所含组分数目可分为双组分(二元)蒸馏及多组分(多元)蒸馏。
一、工艺原理●简单蒸馏:混合液加入蒸馏釜中,加热至沸腾,产生的蒸汽经冷凝后作为顶部产物,在蒸馏过程中釜内液体的易挥发组分浓度将不断下降,相应的蒸汽中的易挥发组分浓度亦随之降低。
因此,馏出液通常是按不同组成范围分罐收集的。
最终将釜液一次排出。
所以简单蒸馏是一个不稳定过程。
简单蒸馏只能使混合液部分地分离,故只适用于沸点相差较大而分离要求不高的场合,或者作为初步加工,粗略地分离多组分混合液,例如原油或煤油的初馏。
一、工艺原理一、工艺原理●平衡蒸馏:平衡蒸馏又称为闪蒸,是一连续稳定过程。
原料连续进入加热器中,加热至一定温度经节流阀骤然减压到规定压力,部分料液迅速汽化,汽液两相在分离器中分开,得到易挥发组分浓度较高的顶部产品与易挥发组分浓度甚低的底部产品。
一、工艺原理●精馏:若将混合液加热至沸腾但只令其部分汽化,则挥发性高的组分,即沸点低的组分(称为易挥发组分或轻组分)在汽相中的浓度比在液相中的浓度要高,而挥发性低的组分,即沸点较高的组分(称为难挥发组分或重组分)在液相中浓度比在汽相中的要高。
同理,混合物的蒸汽部分冷凝,则冷凝液中难挥发组分的浓度要比汽相中的高,反之亦然。
多次进行部分汽化或部分冷凝以后,最终可以在汽相中得到较纯的易挥发组分,而在液相中得到较纯的难挥发组分。