矿化水苏打石灰法处理计算
- 格式:docx
- 大小:25.00 KB
- 文档页数:4


管理及其他M anagement and other 矿山废水处理及其对水质改善效果的实验研究张 凯摘要:在矿山资源开采中会产生大量废水,其中含有多种污染物,包括重金属、有害化学物质、悬浮固体等,若未经处理直接排放将对环境造成严重影响,威胁水体生态和人类健康。
为改善矿山生态环境,必须加强矿山废水处理技术研究,选择适宜的废水处理技术工艺,去除矿山废水污染物,保障矿山企业安全环保生产。
对此,本文首先对矿山废水的主要成分进行介绍,然后对矿山废水处理中的常用技术类型进行分析,并结合实例开展实验研究,对矿山废水处理实验与效果进行详细探究。
关键词:矿山废水;处理;实验在我国能源构成中,煤炭占比超过70%,在促进国家经济发展方面发挥着关键作用。
在煤矿的开采过程,涉及复杂的地面及地下作业,不可避免地会对周围的水资源造成不良影响,导致矿区发生井泉干涸和地表岩溶塌陷等问题。
矿井水在排放过程中,需经历多种物理和化学反应,含有多种污染物,包括重金属、有害化学物质、悬浮固体等,如果未经处理而直接排放,则会对于生态环境与人类生存发展的危害性较大。
现如今,社会各界对于生态环保的关注度与要求均显著提升,基于此,必须强化矿山废水处理,将其作为环境工程和可持续发展的重要议题。
因此,对矿山废水处理技术展开深入研究迫在眉睫。
1 矿山废水的来源与危害性1.1 矿山废水的来源在矿山开采中,废水主要来源于多个环节大量水源。
首先,在矿山开采过程中,在抑尘、矿石运输和矿物处理环节,需使用大量水资源,在与矿石和矿物接触后转化为废水;其次,在矿石加工和洗选过程中,水在经过破碎、筛选、浮选等环节后可能含有有害化学物质和重金属;再次,地下水渗入矿井也是废水的一个重要来源,雨水经过露天矿区和废石堆流动时,溶解并携带有害物质,如重金属和酸性物质,形成废水;最后,尾矿库中的废矿石和加工剩余物与水的接触,也会造成水资源受到污染。
这些废水若未经妥善处理,将对环境造成严重影响,因此有效的矿山废水管理和处理是确保环境保护的关键环节。

石灰软化法使用石灰软化硬水的方法称为石灰软化法,又称石灰纯碱软化法,在硬水中加入消石灰,使水中的镁生成氢氧化镁沉淀,这样,加入碳酸钠使水中的钙生成碳酸钙而沉淀,硬水即变为软水,利用这种方法可使水中钙浓度降低到10~35ppm。
其化学反应式如下:CaSO4+Na2CO3→CaCO3↓+Na2SO4CaCl2+Na2CO3→CaCO3↓+2NaClMgSO4+Na2CO3→MgCO3+Na2CO3MgCO3+Ca(OH)2→CaCO3↓+Mg(OH)2↓采用石灰软化法处理高硬度含氟地下水,考察了药剂投量、反应时间对处理效果的影响。
结果表明,在CaO和Na2CO3的投量分别为187和106mg/L并反应25min的条件下,再投加10mg/L的聚合氯化铝铁和0.25mg/L的PAM可将出水浊度降至1NUT以下;若要将出水总硬度分别降至400、300、200mg/L,在略高于理论投药量的条件下,需控制搅拌反应时间分别为25、35、50min;水中氟化物可通过与软化过程中生成的Mg(OH)2形成共沉淀而得到有效去除,但由于出水pH值过高,需进行调节。
华东地区某市因地表水污染严重,计划适度开采高储量的地下水作为饮用水水源(开采量约为5.0×10 m /d)。
取样分析结果表明,该市地下水清澈透明,但水中硬度和氟化物含量不达标,为保证居民饮水安全,需对该地下水进行软化及除氟处理。
降低水中硬度的常用方法有离子交换法、电渗析法及药剂软化法等。
其中离子交换法和电渗析法均存在造价高、运行费用高等缺点;石灰是药剂软化法中最常用的药剂,其价格较低,但如果用量不当,则会造成出水水质稳定性欠佳,给实际操作管理带来麻烦,因此有必要进行试验确定药剂用量。
去除氟离子的常用方法有电化学法(电凝聚、电渗析)、· 49· 第23卷第13期中国给水排水www.watergasheat.corn 混凝沉淀法和离子交换法等。

苏打石灰法除硬度硬水是指含有较高浓度的钙、镁和其他离子的水。
它会导致许多问题,如水渍、水垢和皮肤干燥。
苏打石灰法是一种常用的方法来除去硬水,本文将介绍这种方法的步骤和注意事项。
步骤1.准备需要的材料和工具:-苏打粉-石灰-水桶-搅拌棒-滤纸2.先将一定量的苏打粉和石灰混合,并加入足够的水,搅拌均匀。
这时候会产生一种化学反应,生成二氧化碳气体并放热,需要注意安全。
3.将混合物倒入水桶中,轻轻搅拌,直到混合物均匀。
4.把饮用的水或需要处理的水倒入水桶中,然后轻轻搅拌,确保苏打石灰混合物彻底分散。
此时,你会看到水变为淡黄色。
5.急速搅拌,然后让水静置约3小时,这样可使水中的硬度沉淀。
为了加速沉淀的过程,你可以使用滤纸过滤掉混有泥沙的水。
6.缓慢地将水倒出桶,并把沉淀物留在底部,以保留所有的硬度。
7.让沉淀物在阳光下干燥,成为颜色较暗的石灰苏打粉。
可使用这种粉末来除去其他水体的硬度。
注意事项1.石灰和苏打粉的相对比例应为1:2。
2.如果将混合物加热后放置,则可以释放有助于化学反应的热量,并使反应更快。
3.搅拌和静置的时间可以根据需要调整。
4.对硬度的处理需要这种混合物,但是如果你想离开家一段时间,则可以直接使用苏打粉和水或石灰和水混合物。
5.这种方法可以去除硬度,但是会增加水的pH值。
确保不要让pH值过高。
6.根据硬度的浓度和混合物的比例,苏打石灰法可能需要多次重复。
苏打石灰法是一种流行的方法来处理硬度,它包括混合苏打粉和石灰,并在水中静置让硬度沉淀。
这种方法简单易行,能够快速解决硬度带来的问题,希望这篇文章能够帮助你理解苏打石灰法的使用方法。

石灰软化水的用量计算公式水是生活中不可或缺的重要物质,但有时候水中的硬度会对我们的生活造成一定的影响。
硬水中含有大量的钙和镁离子,这些离子会与肥皂和洗涤剂发生化学反应,导致肥皂不易起泡,同时还会在管道和设备上形成水垢,影响设备的正常运行。
因此,软化水是一种常见的水处理方式,而石灰软化水是其中的一种方法。
石灰软化水是通过向水中添加石灰来沉淀出水中的钙和镁离子,从而达到软化水的目的。
在进行石灰软化水处理时,需要根据水的硬度和处理量来计算石灰的用量,以确保软化水的效果。
下面我们将介绍石灰软化水的用量计算公式及其具体应用。
石灰软化水的用量计算公式如下:石灰用量 = (水的硬度×处理量)/ (石灰的纯度× 1000)。
其中,石灰用量的单位为克(g),水的硬度的单位为mg/L,处理量的单位为L,石灰的纯度为百分数。
首先,我们需要了解水的硬度。
水的硬度通常是以钙碳酸盐和镁碳酸盐的形式存在,硬度的单位通常为mg/L。
在进行石灰软化水处理前,需要对水进行化验,得到水的硬度值。
其次,我们需要确定处理量。
处理量是指需要进行软化水处理的水的总量,通常以升(L)为单位。
最后,我们需要知道石灰的纯度。
石灰的纯度是指石灰中有效成分的含量,通常以百分数表示。
在进行石灰软化水处理时,需要选择纯度较高的石灰,以确保软化水的效果。
通过以上三个参数,我们就可以根据石灰软化水的用量计算公式计算出所需的石灰用量。
以确保软化水的效果。
举个例子来说明石灰软化水的用量计算公式的具体应用。
假设我们需要软化一批水,其硬度为200mg/L,处理量为1000L,而我们选择的石灰纯度为90%。
那么我们可以按照以下步骤计算出所需的石灰用量:石灰用量 = (200mg/L × 1000L)/ (90% × 1000) = 222.22g。
通过以上计算,我们可以得出所需的石灰用量为222.22克。
这样,我们就可以根据计算出的石灰用量进行软化水处理,以达到软化水的效果。

1、什么是硬水?所谓"硬水"是指水中所溶的矿物质成分多,尤其是钙和镁。
硬水并不对健康造成直接危害,但是会给生活带来好多麻烦,比如用水器具上结水垢、肥皂和清洁剂的洗涤效率减低等。
水是一种很好的溶剂,能有效去除污物杂质。
纯水--无色、无味、无臭,被称作是"通用溶剂"。
当水和二氧化碳结合生成微量的碳酸时,水的溶解效果更好。
当水流过土地和岩石时,它会溶解少量的矿物质成分,钙和镁就是其中最常见的两种成分,也就是它们使水质变硬。
水中含钙、镁等矿物质成分越多,水的硬度越大。
2、水垢成因:即便是在硬水质地区,只要水中的饱和指数未被超过,水管中就不会结水垢。
若在饱和指数以下或正好在饱和的临界点上,都不会有水垢生成。
反之,软水质中也会生水垢,如果超出了饱和指数的话。
饱和指数由水的酸碱度决定。
众所周知,酸碱度是通过PH测试来测定的:PH值越低,水中的酸性越强,饱和指数越高,所能溶解的矿物质成分也就越多;PH值越高,水中的碱性越强,饱和指数越低,所能溶解的矿物质成分也就越少。
对水加热、水压降低(如打开水龙头等)、在水中添加化学品剂等都会导致PH值升高。
随着PH值升高,水能溶解矿物质成分的能力减低,这些矿物质成分(碳酸钙为主)也就沉淀出来,成了水垢。
循环系统(如冷却塔、蒸汽锅炉、循环水处理系统等)工作中,压力和温度长期处在变化中,造成水中PH值升高和过度饱和。
另外在工业用水中,由于经常要加石灰或一些腐蚀性品剂,也会造成水中PH值升高和过度饱和。
这些都是水垢成因。
3、硬水带来的困扰和麻烦洗衣:用硬水洗出来的衣服看上去暗黑、邋遢,摸上去感觉粗糙、僵硬。
硬性的矿物质和灰尘结合成了不溶解的盐,使得污渍较难去除。
而衣物上的灰土又向(洗衣用)水中引入了更多硬性的矿物质,使水质更硬。
经常用硬水洗衣会损坏衣服的纤维,使衣物的使用寿命缩短达40%。
洗浴:用硬水洗澡会在皮肤上留下一层肥皂凝结微粒粘膜,这层粘性的膜会使得皮肤上的脏东西和细菌等难以清除。

水的硬度水的硬度(也叫矿化度)是指溶解在水中的钙盐与镁盐含量的多少。
含量多的硬度大,反之则小。
1升水中含有10mmgCaO(或者相当于10mmgCaO)称为1度。
软水就是硬度小于8的水,如雨水,雪水,纯净水等;硬度大于8的水为硬水,如矿泉水,自来水,以及自然界中的地表水和地下水等。
硬水又分为暂时硬水和永久硬水。
暂时硬水的硬度是由碳酸氢钙与碳酸氢镁引起的,经煮沸后可被去掉,这种硬度又叫碳酸盐硬度。
永久硬水的硬度是由硫酸钙和硫酸镁等盐类物质引起的,经煮沸后不能去除。
以上两种硬度合称为总硬度。
当水滴在大气中凝聚时,会溶解空气中的二氧化碳形成碳酸。
碳酸最终随雨水落到地面上,然后渗过土壤到达岩石层,溶解石灰(碳酸钙和碳酸镁)产生暂时硬水。
一些地区的溶洞和溶洞附近的硬水就是这样形成的。
硬水有许多缺点:1.和肥皂反应时产生不溶性的沉淀,降低洗涤效果。
(利用这点也可以区分硬水和软水)2.工业上,钙盐镁盐的沉淀会造成锅垢,妨碍热传导,严重时还会导致锅炉爆炸。
由于硬水问题,工业上每年因设备、管线的维修和更换要耗资数千万元。
3.硬水的饮用还会对人体健康与日常生活造成一定的影响。
没有经常饮硬水的人偶尔饮硬水,会造成肠胃功能紊乱,即所谓的“水土不服”;用硬水烹调鱼肉、蔬菜,会因不易煮熟而破坏或降低食物的营养价值;用硬水泡茶会改变茶的色香味而降低其饮用价值;用硬水做豆腐不仅会使产量降低、而且影响豆腐的营养成分。
那么硬水毫无是处了吗?不对,否则怎么会有那么多的人买矿泉水喝呢。
原来钙和镁都是生命必需元素中的宏量金属元素。
科学家和医学家们调查发现,人的某些心血管疾病,如高血压和动脉硬化性心脏病的死亡率,与饮水的硬度成反比,水质硬度低,死亡率反而高。
其实,长期饮用过硬或者过软的水都不利与人体健康。
我国规定:饮用水的硬度不得超过25度。
硬水经过处理后可以转化为软水。
下面介绍硬水软化的三种主要方法:1. 煮沸法(只适用于暂时硬水)煮沸暂时硬水时的反应:Ca(HCO3)2 =CaCO3 ↓+H2O+CO2↑Mg(HCO3)2 =MgCO3↓ +H2O+CO2↑由于CaCO3不溶,MgCO3 微溶,所以碳酸镁在进一步加热的条件下还可以与水反应生成更难溶的氢氧化镁:MgCO3 +H2O = Mg(OH)2 ↓+CO2↑由此可见水垢的主要成分为CaCO3和Mg(OH)22. 石灰——纯碱法(工业用)在这种方法中,暂时硬度加入石灰就可以完全消除,HCO3-都被转化成CO32-。

软化水的方法将硬水软化,避免水垢的沉积有很多种方法,经常使用的方法有:1、离子交换法:采用特定的阳离子交换树脂,以钠离子将水中的钙镁离子置换出来,由于钠盐的溶解度很高,所以就避免了随温度的升高而造成水垢生成的情况。
这种方法是目前最常用的标准方式。
主要优点是:效果稳定准确,工艺成熟。
可以将硬度降至0。
采用这种方式的软化水设备一般也叫做"离子交换器"(由于采用的多为钠离子交换树脂,所以也多称为"钠离子交换器",即软化水设备,或者全自动软水器。
2、石灰法:向水中加入石灰,主要是用于处理大流量的高硬水,只能将硬度降到一定的范围。
3、加药法:向水中加入专用的阻垢剂,可以改变钙镁离子与碳酸根离子结合的特性,从而使水垢不能析出、沉积。
目前工业上可以使用的的阻垢剂很多。
这种方法的特点是:一次性投入较少,适应性广;但水量软大时运行成本偏高,由于加入了化学物质,所以水的应用受到很大限制,一般情况下不能应用于饮用、食品加工、工业生产等方面。
在民用领域中也很少应用。
4、电磁法:采用在水中加上一定的电场或磁场来改变离子的特性,从而改变碳酸钙(碳酸镁)沉积的速度及沉积时的物理特性来阻止硬水垢的形成。
其特点是:设备投资小,安装方便,运行费用低;但是效果不够稳定性,没有统一的衡量标准,而且由于主要功能仅是影响一定范围内的水垢的物理性能,所以处理后的水的使用时间、距离都有一定局限。
多用于商业(如中央空调等)循环冷却水的处理,不能应用于工业生产及锅炉补给水的处理(同时由于该种设备的机理并未得到真正的理论证实)。
5、膜分离法:纳滤膜(NF)及反渗透膜(RO)均可以拦截水中的钙镁离子,从而从根本上降低水的硬度。
这种方法的特点是,效果明显而稳定,处理后的水适用范围广;但是对进水压力有较高要求,设备投资、运行成本都较高。
一般较少用于专门的软化处理。

一、水质不好对锅炉的危害(一) 污染天然水的杂质污染天然水的杂质除氧、二氧化碳等气体和悬浮物外,还有溶解固形物。
溶解固形物最多见的有八种离子:氯离子(Cl--)、硫酸根离子(SO2-4)、重碳酸根离子(HCO--3)、碳酸根离子(CO2-3)、钠离子(Na+)、镁离子(Mg2+)、钙离子(Ca2+)、钾离子(K+)。
以上杂质的水溶液,若是直接用于锅炉给水,则对锅炉和蒸汽品质都会直接或间接地造成危害:产生水垢与沉渣;对锅炉侵蚀;恶化蒸汽品质。
(二) 天然水中杂质对锅炉水质的影响1. 钙、镁:天然水中的钙、镁均以不同化合物的形式存在。
水中所含钙、镁盐类的多少,决定水的硬度及水垢性质。
钙、镁含量越大,水的硬度越高,也就越不适宜作锅炉给水。
(风险世界网专业研究安全风险管理,安全员的门户网站!)2. 氯离子:氯离子的含量决定于水中所含氯化物的多少。
天然水中氯化物的来源,主如果水流经地层中含有氯盐的矿层所致。
一般天然水中平均含氯量为15~55mg/L。
炉水中含氯量在150~250mg/L或更高时,则不宜作锅炉给水。
3. 硫酸盐:水中硫酸盐主要来源于矿物地层及有机质,含水硫酸钙为水中硫酸盐的主要成份。
天然水中平均含硫酸盐30~75mg/L。
锅炉给水及炉水中含硫酸盐较高时,在受热面上易产生石膏质水垢。
4. 亚硝酸盐:天然水中存在亚硝酸盐,表明水的矿化进程尚在初期阶段,或常常进入有机质。
5. 硝酸盐:天然水中的硝酸盐一般来自矿物质与有机物,它是一切含氮物质氧化后的最后产物。
在干净的天然水中,硝酸盐与亚硝酸盐通常含量极少,乃至没有。
受到严峻污染的工业用水,作锅给水时,能在锅炉中放出大量的氨,使黄铜阀件蒙受侵蚀。
6. 氨:主要来源于水中有机物质,当河水中含氮物质反质分解时,会产生氨。
氨除对黄铜件造成严峻侵蚀外,还易引发炉水起泡,乃至产生汽水共腾现象。
7. 硫化氢:水中如含有L硫化氢就可以被发觉,若是硫化氢达1mg/L时,就会有显著的臭鸡蛋味。

软化水的方法一.水的硬度水的硬度通常用每升水中含的氧化钙数计算,含10mg/L氧化钙为一度,以此作为衡量水中钙盐和镁盐含量的一个指标。
水的硬度由于形成原因不同,可分为暂时性硬度和永久性硬度,这两种硬度总起来称为“总硬度”。
由于碳酸盐含量增高而形成的硬度叫做“暂时性硬度”,又称为“碳酸盐硬度”。
这种水经过煮沸以后,溶解的碳酸盐能沉淀下来,使水变软。
当水中含有钙、镁的硫酸盐、氯化物和硝酸盐时,水的硬度也增高,这种硬度不会因水的煮沸而降低,所以叫“永久性硬度”,又叫“非碳酸盐硬度”。
二.水的分类通常根据硬度的大小,把饮水分为硬水和软水两类。
当水的硬度低于8度时,叫做“软水”;高于8度时,则叫“硬水”。
我国各地区水质硬度相差悬殊。
东北、华北、西北地区地下水主要污染元素为总硬度、矿化度、硝酸盐和硫酸盐。
华南、华中、西南地区地下水主要污染元素为氨氮、铁和锰、亚硝酸盐。
总的来看我国西部和北部地区水的硬度明显高于东南方地区。
1.硬水我国《生活用水卫生标准》中规定,水的总硬度不能过大。
如果硬度过大,饮用后对人体健康与日常生活有一定影响。
如果没有经常饮硬水的人偶尔饮硬水,则会造成肠胃功能紊乱,即所谓“水土不服”。
近年来,还有些研究证明,饮用过硬的水与大骨节病的克山病的发生有密切关系。
当超过67度时能影响蛋白质和脂肪的吸收率。
一般认为,超过40度的硬水对机体有不良影响。
所以长期饮用硬水是不健康的。
鉴于上述情况,又鉴于我国大部分地区饮水的硬度不超过25度的实际情况,所以,我国饮水卫生标准规定,水的硬度不超过25度。
即以氧化钙计算,不超过250mg/L。
对于部分偏远山村在无其他水源可选择的情况下,硬度可放宽到40度。
2.软水由上可知市售饮用水是软水居多,可见软水较之硬水对人体更加有益。
另外在生活中由于软水中含有丰富的有机矿物质,具有较强的去污力,只需少量的卸妆膏,就可取得100%的卸妆效果。
软水用于经常性的饮用和沐浴,可解除皮肤干燥、皮癣、皮屑苦恼,恢复正常的弹性皮肤。
浅谈:高盐度及高矿化度地热水软化处理及综合运用地热水是指温度显著高于当地年平均气温,或者高于观测深度的围岩温度的地下水。
起源于地球的熔融岩浆和放射性物质的衰变,所以通常每1L地热水氧化钙(CaO)或氧化镁(MgO)含量均超过80mg,此种地热水就是我们俗称的硬水。
目前,我国非常重视地热水的勘探和综合利用,以地热发电、工业用水、地热采暖、温泉SPA、新型农业生产等为主要的利用形式.在中国,北方地区对地热水利用相对普遍,南方和西部城市对地热能的利用还存在较大空白;放眼国外,全球地热能发电总量约合8000兆瓦,其中美国就占2800兆瓦,日本占50兆瓦,位于北半球的冰岛,每5户家庭中就有4户享用着地热能源,可见利用率之高。
做为新型、绿色、可再生资源的地热能源在未来能源领域举足轻重,而发展历程却崎岖坎坷、荆棘丛生。
就目前国内、外地热能源利用的例子来看,原水的软化处理,尾水的排放问题当数首要问题了。
高温、高盐、高矿化度的硬水在外管网系统、辅热系统、内循环系统及闸阀、地漏等部分非常容易结垢,减缓地热水在管网系统中流速,造成阀门卡涩以致卡死,地漏堵塞,甚至在辅热系统中会造成爆炸的危险。
排放的尾水因具有较高温度会造成周边植物枯萎或者死亡,影响下游水质造成鱼虾死亡、土地盐碱化等。
如何最环保、最高效率、最大经济效益的综合利用宝贵的地热资源,成为一代地质地热人研究的新课题.要做到最环保,那么首当其冲的就是高盐、高矿化度极硬地热水的软化处理问题。
目前国内外软化硬水的方法主要有三种:石灰-——苏打法、药剂法、离子交换法、电渗析和超滤技术。
药剂法又称石灰—--苏打法、石灰—磷酸钠—纯碱法,此方法大规模用于生活水软化处理,利用石灰(CaO)和苏打(NaCO3)与硬水中的Mg2+和Ca2+离子发生反应,产生沉淀,达到软化硬水的目的。
其化学方程式如下:Ca2+ + CO32—=CaCO3↓Mg2+ + 2OH- = Mg(OH)2↓Ca2+ + 2HCO3—+ Ca2+ + 2OH—= 2CaCO3↓+ 2H2O Mg2++2HCO3-+2Ca2++4OH- =Mg(OH)2↓+2CaCO3↓+2H2O 因地热水具备相对较高的温度,且生石灰溶水会产生大量的热,加热过程可以省去.离子交换法是通过它是利用离子交换剂,把水中的离子与离子交换剂中可扩散的离子进行交换作用,使水得到软化的方法。
(10)申请公布号 CN 102108439 A(43)申请公布日 2011.06.29C N 102108439 A*CN102108439A*(21)申请号 200910312546.X(22)申请日 2009.12.29C22B 3/12(2006.01)(71)申请人厦门紫金矿冶技术有限公司地址361000 福建省厦门市火炬高新区(翔安)产业区舫山南路3号申请人紫金矿业集团股份有限公司(72)发明人黄怀国 谢洪珍 陈庆根 季常青马龙 张波 刘燕平 阮仁满邹来昌 罗映南 陈景河(74)专利代理机构厦门市首创君合专利事务所有限公司 35204代理人李雁翔(54)发明名称一种使用碳酸钠和生石灰对矿石进行氧化浸出的方法(57)摘要本发明涉及一种矿石浸出工艺,特别是指一种使用碳酸钠和生石灰对矿石进行氧化浸出的方法,包括如下步骤:步骤一,将碳酸钠和生石灰按照如下重量百分比进行配比:碳酸钠63~66%,生石灰34~37%;步骤二,将步骤一配比的碳酸钠和生石灰与矿石和适量的水进行混合、反应浸出目标元素;步骤三,将步骤二得到的浆液进行固液分离,得到含目标元素的溶液,继而得到目标元素产品。
对比使用苛化法将碳酸钠和生石灰制备成烧碱,再使用烧碱进行浸出反应的工艺流程,本发明的方法具有原料转化率较高,生产流程较短,设备要求较低等有益效果。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 1 页 说明书 2 页1.一种使用碳酸钠和生石灰对矿石进行氧化浸出的方法,其特征在于包括如下步骤:步骤一,将碳酸钠和生石灰按照如下重量百分比进行配比:碳酸钠63~66%,生石灰34~37%;步骤二,将步骤一配比的碳酸钠和生石灰与矿石和适量的水进行混合、反应浸出目标元素;步骤三,将步骤二得到的浆液进行固液分离,得到含目标元素的溶液,继而得到目标元素产品。
2.如权利要求1所述的方法,其特征在于:所述生石灰要求粒度小于0.075mm。
采用苏打石灰法,水中发生的反应主要为:Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓+ 2H2O ①Mg(HCO3)2 + Ca(OH)2 = Mg(OH)2↓+2CaCO3↓+ 2H2O ②CaSO4 + Na2CO3 = CaCO3↓+ Na2SO4 ③A 计算需要加入石灰的量首先把离子的质量浓度转换成摩尔浓度C HCO3-= 1343.5 mg·L-1 / 61 g·mol-1 = 0.022 mol·L-1C Mg2+ = 1398.5 mg·L-1 / 24 g·mol-1 = 0.058 mol·L-1根据反应式①、②:C OH- = C HCO3-+ 2 C Mg2+ = 0.022+0.058* 2 = 0.139 mol·L-1当PH= 11时C OH- = 10 -3 mol·L-1总C OH- = 0.139 + 0.001 = 0.140 mol·L-1C[Ca(OH)2] = 0.5 * 总C OH- = 0.070 mol·L-1m Ca(OH)2 = [摩尔浓度*分子质量]Ca(OH)2 = [CM]Ca(OH)2 = 5180 mg·L-1B计算需要加入Na2CO3的量C SO42- = 691.5 mg·L-1 / 96 g·mol-1 = 0.0072 mol·L-1根据反应式③:C[Na2CO3] = C SO42- = 0.0072 mol·L-1m Na2CO3 = [CM]Na2CO3 = 0.0072* 106 = 763 mg·L-1C 调回PH为6.5需加入的HCL量需要加入与OH-同等的H+的量,发生中和,即加入C H+ =10 -3 mol·L-1m HCL= [CM]HCL = 40 mg·L-1D 计算产生泥沙的量,泥沙主要为CaCO3和Mg(OH)2m CaCO3 = [CM]CaCO3 = (0.022+0.0072)*100=2920 mg·L-1m Mg(OH)2 = [CM]Mg(OH)2 = 0.058 *58= 3364 mg·L-1泥沙量:2920+3364= 6284 mg·L-1石灰加入量为5180 mg·L-1;碳酸钠加入量为763 mg·L-1;盐酸加入量为mg·L-1;泥沙加入量为6280 mg·L-1。
工艺总结:苏打石灰法处理250m3/h矿化水,需要加CaO 质量124.85kg/h,需加Na2CO3质量0.788t/h,产生沉淀物质CaCO3↓和Mg(OH)2↓共计0.884t/h,加入盐酸调节PH用量约98.71kg/h,浓缩至20.5m3/h并冷冻,产生Na2SO4约
0.894t/h,最后蒸发结晶,产生粗盐约2.57t/h,纯度小于90%,粗盐应该不合格。
若让粗盐产品合格,需要丢弃部分苦卤(最后结晶完全前的那部分水),约1-2m2/h。
最后丢弃的这部分水蒸发只能产生混合盐,成分比较丰富,也是重要的化工原料。
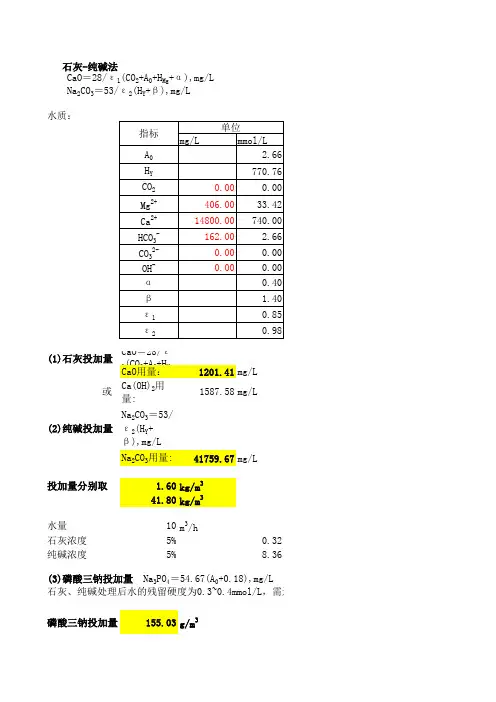
矿化水处理计算
现水质如下:
1.前处理或不处理
2.加入CaO
主要发生反应CaO+H2O→Ca(OH)2
Ca(OH)2+2 HCO3-+ Mg2+→2CaCO3↓+Mg(OH)2↓+2H2O
Ca(OH)2+ Mg2+→Mg(OH)2↓+Ca2+
该过程可去除HCO3-、Mg2+,其中镁离子去除率可达97-99%
经计算需要加入CaO理论质量为0.454kg/m3约113.5kg/h,
实际加入量为理论量的110%为0.4994 kg/m3约124.85kg/h
生成沉淀物质CaCO3↓质量为0.176 kg/m3约44kg/h
Mg(OH)2↓质量为0.470kg/m3约117.62kg/h
合计产生沉淀物质161.62 kg/h
3.加入Na2CO3
主要发生反应Na2CO3+Ca2+→CaCO3↓+2Na+
该过程可去除Ca2+,去除率可达98-99%
由于此前加入过量CaO致使此时钙离子含量增加至1155.1mg/L,
经计算需要加入Na2CO3的理论质量3.06 1kg/m3约
765.25kg/h
实际加入量为理论量的103%为3.1528kg/m3约788.21kg/h
生成沉淀物质CaCO3↓质量为2.888kg/m3约721.94kg/h
小结:石灰苏大法去除钙镁离子,需要加入CaO的质量为0.125t/h,Na2CO3+的质量为0.788t/h,生成沉淀物质CaCO3↓和Mg(OH)2↓共计0.884t/h
4.澄清、过滤,加入HCl调节PH至6.5,
主要发生反应Na2CO3+2HCl→2NaCl+H2O+CO2
NaOH+HCl→NaCl+H2O
加入HCl约为0.1221kg/m2约30.60kg/h,若用盐酸质量分数为31%,则盐酸用量为98.71kg/h
5.进多效蒸发
此时计算水质为
此时水质为
此时Na2SO4浓度约为52964.84mg/L即52.96g/L,接近100℃
饱和浓度54.8g/L
NaCl浓度约为113057.22 mg/L即113.06g/L,远低于100℃时饱和浓度309.5g/L
4.进冷冻机组
冷冻至-10℃
此时Na2SO4的溶解度为9.35g/L,故可以析出43.61g/L
Na2SO4约98.89g/L Na2SO4·10H2O即98.89kg/m3约2.027t/h,去除结晶水约0.894t/h
5.进单蒸发器,蒸发结晶
此时水质为
若Cl-全部为NaCl析出,此时的粗盐纯度约为90.23%,产量约为2.57t/h。