华东理工大学化工原理考研资料课后习题第08章蒸发
- 格式:pdf
- 大小:108.61 KB
- 文档页数:5

6.蒸发-概念题(题目)[一]单选择题(1) x06a02908为了提高蒸发器的生产强度A 应设法提高总传热系数或提高传热温度差, 或同时提高二者B 不应考虑传热系数问题, 而应设法提高传热温度差C 不应考虑传热温度差问题, 而应设法提高传热系数(2) x06a03037当加热蒸汽压力及冷凝器真空度相同,且每个蒸发器的传热面积、传热系数都相同,多效蒸发与单效蒸发操作相比较(1) 生产能力( ) (2) 经济性( ) (3) 生产强度( )(4) 有效温差( ) (5) 理论温差( )请选择以下答案之一填入A 多效蒸发大于单效蒸发B 多效蒸发小于单效蒸发C 多效蒸发与单效蒸发一样(3) x06a05009为了蒸发浓缩某种粘度随浓度和温度变化较大的溶液,应采用A 并流加料流程B 逆流加料流程C 平流加料流程(4) x06a05010下列几条措施中, 哪一条不能提高加热蒸汽的经济程度?A 采用多效蒸发流程B 引出额外蒸汽C 使用热泵蒸发器D 增大传热面积(5) x06a05037真空蒸发时, 冷凝器操作压强的最低极限取决于A 冷凝水的温度B 真空泵的能力C 当地大气压力D 蒸发器的蒸发水量(6) x06b02038为了工业化蒸发浓缩粘度偏高的稀磷酸水溶液,应采取的适宜蒸发方式是A 并流多效真空蒸发C 逆流多效真空蒸发D 单效真空蒸发(7) x06b03036设计蒸发器时,为减少蒸发所需的传热面积并降低设备费,应选择以下哪几种方案A 高的加料温度B 低的加料温度C 高的蒸发室压力D 低的蒸发室压力E 高的加热蒸汽压力F 低的加热蒸汽压力[二]填空题(1) t06a01103在Q=Wr式中,W表示______________________________________。
(2) t06a01104用135℃的饱和水蒸汽在蒸发室中加热某液体,使之沸腾,操作条件下,液体的沸点温度为95℃,蒸汽冷凝在饱和温度下排出,则传热的推动力为_________。


化工原理蒸馏题库及答案1. 下列说法错误的是( C )。
A、多效蒸发时,后一效的压力一定比前一效的低;B、多效冷却时效数越多,单位蒸气消耗量越太少;C、多效蒸发时效数越多越好;D、大规模已连续生产场合均使用多效冷却2. 多效蒸发流程中不宜处理黏度随浓度的增加而迅速增大的溶液是( A )。
A、顺流皮德盖;B、逆流皮德盖;C、平流皮德盖;D、错流皮德盖3. 多效蒸发流程中主要用在蒸发过程中有晶体析出场合的是( C )。
A、顺流皮德盖;B、逆流皮德盖;C、平流皮德盖;D、错流皮德盖4. 将加热室安在蒸发室外面的是( C )蒸发器。
A、中央循环管式;B、悬筐式;C、列文式;D、强制性循环式5. 膜式蒸发器中,适用于易结晶、结垢物料的是( A )。
A、升膜式;B、再降膜式;C、滑行膜式;D、回转式6. 下列结构最简单的是( A )蒸发器。
A、标准式;B、悬筐式;C、列文式;D、强制性循环式7. 下列说法中正确的是( D )。
A、单效冷却比多效冷却应用领域甚广;B、预热冷却可以增加设备费用;C、二次蒸气即第二效蒸发的蒸气;D、采用多效蒸发的目的是降低单位蒸气消耗量8. 在多效冷却的三种流程中( C )。
A、加热蒸气流向不相同;B、后一效的压力不一定比前一效低;C、逆流进料能够处置黏度随其浓度的减少而快速加强的溶液;D、同一效中加热蒸气的压力可能低于二次蒸气的压力9. 热敏性物料宜使用( C )蒸发器。
A、自然循环式;B、强制循环式;C、膜式;D、都可以10. 冷却操作方式中,以下措施中无法明显提升传热系数K的就是( C )。
A、及时排除加热蒸气中的不凝性气体;B、定期清洗除垢;C、提升冷却蒸气的湍流速度;D、提升溶液的.速度和湍流程度11. 下列溶液循环速度最快的是( D )蒸发器。
A、标准式;B、悬筐式;C、列文式;D、强制性循环式1. 多效蒸发的目的是为了提高产量。
(× )2. 冷却生产的目的,一就是铀溶液,二就是除去结晶盐。

习题相平衡1.已知甲醇和丙醇在80℃时的饱和蒸汽压分别为181.13kPa 和50.92kPa ,且该溶液为理想溶液。
试求:(1)80℃时甲醇与丙醇的相对挥发度;(2)若在80℃下汽液两相平衡时的液相组成为0.6,试求汽相组成; (3)此时的总压。
解:(1)甲醇与丙醇在80℃时的相对挥发度557.392.5013.181===o BoA p p α(2)当x=0.6时 ()842.06.0)1557.3(16.0557.311=⨯-+⨯=-+=x x y αα(3)总压kPa yxp p o A 07.129842.06.013.181=⨯==2.已知二元理想溶液上方易挥发组分A 的气相组成为0.45(摩尔分率),在平衡温度下,A 、B 组分的饱和蒸汽压分别为145kPa 和125kPa 。
求平衡时A 、B 组分的液相组成及总压。
解:对二元理想溶液的气液平衡关系可采用拉乌尔定律及道尔顿分压定律求解。
已知理想溶液 ,45.0y =A 则0.5545.0-1y 1y A B ==-= 根据拉乌尔定律 A oA A x p p = ,B oB B x p p = 道尔顿分压定律 A A p p y = ,B B p p y = 则有 o A A p p x A y =,op p x BBB y = 因为 1x x B =+A所以 1p y p y 0B BA =⎪⎪⎭⎫⎝⎛+o Ap即 11250.551450.45=⎪⎭⎫ ⎝⎛+p可解得 p =133.3 kPa 则液相组成 414.014545.03.133y A =⨯==oAA p p x586.0414.01x 1A B =-=-=x3.苯(A )和甲苯(B )的饱和蒸气压和温度的关系(安托因方程)为24.22035.1206032.6log +-=t p oA58.21994.1343078.6log +-=t p oB 式中oA p 单位为k a P ,t 的单位为℃。

习题相平衡1.已知甲醇和丙醇在80℃时的饱和蒸汽压分别为181.13kPa 和50.92kPa ,且该溶液为理想溶液。
试求:(1)80℃时甲醇与丙醇的相对挥发度;(2)若在80℃下汽液两相平衡时的液相组成为0.6,试求汽相组成; (3)此时的总压。
解:(1)甲醇与丙醇在80℃时的相对挥发度557.392.5013.181===o BoA p p α(2)当x=0.6时 ()842.06.0)1557.3(16.0557.311=⨯-+⨯=-+=x x y αα(3)总压kPa yxp p o A 07.129842.06.013.181=⨯==2.已知二元理想溶液上方易挥发组分A 的气相组成为0.45(摩尔分率),在平衡温度下,A 、B 组分的饱和蒸汽压分别为145kPa 和125kPa 。
求平衡时A 、B 组分的液相组成及总压。
解:对二元理想溶液的气液平衡关系可采用拉乌尔定律及道尔顿分压定律求解。
已知理想溶液 ,45.0y =A 则0.5545.0-1y 1y A B ==-= 根据拉乌尔定律 A oA A x p p = ,B oB B x p p = 道尔顿分压定律 A A p p y = ,B B p p y = 则有 o A A p p x A y =,op p x BBB y = 因为 1x x B =+A所以 1p y p y 0B BA =⎪⎪⎭⎫⎝⎛+o Ap即 11250.551450.45=⎪⎭⎫ ⎝⎛+p可解得 p =133.3 kPa 则液相组成 414.014545.03.133y A =⨯==oAA p p x586.0414.01x 1A B =-=-=x3.苯(A )和甲苯(B )的饱和蒸气压和温度的关系(安托因方程)为24.22035.1206032.6log +-=t p oA58.21994.1343078.6log +-=t p oB 式中oA p 单位为k a P ,t 的单位为℃。

化工原理(干燥部分)习题与解题指导第八章干燥【例题与解题指导】【例5-1】某常压空气的温度为30℃、湿度为0.0256kg/kg绝干气,试求:(1)相对湿度、水汽分压、比容、比热容及焓;(2)若将上述空气在常压下加热到50℃,再求上述各性质参数。
解:(1)30℃时的性质相对湿度由手册查得30℃时水的饱和蒸汽压p s=4.2464kPa。
用式5-5求相对湿度,即将数据带入解得水汽分压比容由式5-6求比容,即=0.8926 m3湿空气/kg绝干气比热容由式5-7a求比热容,即焓用式5-8b求湿空气的焓,即kJ/kg绝干气(2)50℃时的性质参数相对湿度查出50℃时水蒸汽的饱和蒸汽压为12.340kPa。
当空气被加热时,湿度并没有变化,若总压恒定,则水汽的分压也将不变,故水汽分压因空气湿度没变,故水汽分压仍为4.004kPa。
比容因常压下湿空气可视为理想气体,故50℃时的比容为m3湿空气/kg绝干气比热容由式5-7知湿空气的比热容只是湿度的函数,因此,湿空气被加热后,其比热容不变,为1.058kJ/(kg绝干气·℃)。
焓kJ/kg绝干气由上计算可看出,湿空气被加热后虽然湿度没有变化,但相对湿度降低了,所以在干燥操作中,总是先将空气加热后再送入干燥器内,目的是降低相对湿度以提高吸湿能力。
【例5-2】常压下湿空气的温度为30℃、湿度为0.0256kg/kg 绝干气,试求该湿空气的露点t d、绝热饱和温度tas和湿球温度t w。
解:露点t d将湿空气等湿冷却到饱和状态时的温度为露点,由式5-16可求出露点温度下的饱和蒸汽压解得=4.004kPa查出该饱和蒸汽所对应的温度为28.7 ℃,此温度即为露点。
绝热饱和温度由式5-14计算绝热饱和温度,即由于Has是的函数,故用上式计算时需试差。
其计算步骤为①设= 29.21℃②用式5-3求温度下的饱和湿度Has,即查出29.21℃时水的饱和蒸汽压为4054Pa,汽化潜热为2425.48kJ/kg,故kg/kg绝干气③用式5-7a求cH,即kJ/(kg.℃)④用式5-14核算。

化工原理《蒸发》习题及答案1、用一单效蒸发器将2500kg/h 的NaOH 水溶液由10%浓缩到25%(均为质量百分数),已知加热蒸气压力为450kPa ,蒸发室内压力为101.3kPa,溶液的沸点为115℃,比热容为3.9kJ/(kg ·℃),热损失为20kW 。
试计算以下两种情况下所需加热蒸汽消耗量和单位蒸汽消耗量。
(1)进料温度为25℃;(2)沸点进料。
解:(1) 求水蒸发量W应用式(4-1)kg/h 1500)25.01.01(2500)1(10=-=-=x x F W (2)求加热蒸汽消耗量应用式(4-4)rQ Wr t t FC D L 010')(++-= 由书附录查得450kPa 和115℃下饱和蒸汽的汽化潜热为2747.8和2701.3kJ/kg则进料温度为25℃时的蒸汽消耗量为:kg/h 18208.2747102.71005.41078.88.27473600203.27011500)25115(2500465=⨯+⨯+⨯=⨯+⨯+-⨯=D单位蒸汽消耗量由式(4-5a )计算,则21.1=W D原料液温度为115℃时kg/h 15008.27473600203.270115002=⨯+⨯=D 单位蒸汽消耗量0.12=WD 由以上计算结果可知,原料液的温度愈高,蒸发1 kg 水所消耗的加热蒸汽量愈少。
2、试计算30%(质量百分数)的NaOH 水溶液在60 kPa (绝)压力下的沸点。
解:''ΔT t A +=T ‘查 蒸汽在600kPa 下的饱和温度为85.6℃,汽化潜热为2652kJ/kg 'Δ由式(4-9) 常''f ΔΔ=可求其中 f 由式(4-10)求得,即785.01.2652)2736.85(0162.0')273'(0162.02=+=+=r T f 查附录 常'Δ为160℃则 常'Δ=160-100=60℃1.47785.060'=⨯=∴Δ℃即 7.1321.476.85=+=A t ℃3、在一常压单效蒸发器中浓缩CaCl 2水溶液,已知完成液浓度为35.7%(质分数),密度为1300kg/m 3,若液面平均深度为1.8m ,加热室用0.2MPa (表压)饱和蒸汽加热,求传热的有效温差。

化工原理考研题库5蒸发蒸发是一种常见的物质分离及浓缩技术,在化工工艺中应用广泛。
继续沿用考研化工原理试题这一主题,本文将通过分析蒸发原理、蒸发过程及蒸发器种类等内容,深入探讨蒸发技术在化工领域中的应用。
1. 蒸发原理蒸发是指液体在加热的作用下,通过表面变形,将液体分子从液相转变为气相,并将其中的杂质留在原容器中的一种过程。
蒸发原理主要基于液体和气体两相之间的相互作用力。
在蒸发过程中,液体分子受到加热后的能量激发,逐渐脱离液体界面进入气相,形成蒸汽。
蒸发原理的核心是热传导、传热与相变过程的结合。
2. 蒸发过程蒸发过程可以分为三个主要步骤:加热、传热与传质。
首先,液体在被加热后,因获得更多的热能,使得液体分子获得更大的动能。
然后,这些高速运动的分子将能量传递给液体表面,增加表面温度,逐渐转变为气态。
最后,这些蒸汽分子从液体表面进入气相,并通过传质使得液体中的溶质被分离并浓缩。
3. 蒸发器种类化工领域中常使用的蒸发器种类有多效蒸发器、蒸发冷凝器、旋转蒸发器等。
多效蒸发器以其高效的蒸发性能和节能的特点而得到广泛应用。
多效蒸发器由多个蒸发器组成,利用多级蒸发,每级蒸发器的蒸汽供给下级蒸发器,形成级联的蒸发系统。
蒸发冷凝器主要用于液体混合物分离,它能同时进行蒸发和冷凝过程,将蒸发产生的蒸汽冷凝回液相,实现分离和浓缩。
旋转蒸发器通过不断搅拌液体使之与蒸发器内的加热表面接触,以提高传热效率,广泛应用于药物和精细化工等领域。
4. 化工中蒸发的应用蒸发技术在化工领域中应用广泛。
一方面,蒸发是一种常见的物质分离方式,可用于分离液体混合物中的溶剂和溶质。
例如,化工生产中常用的盐水蒸发结晶法即是利用这一原理,通过蒸发将溶剂蒸发掉,使得溶质结晶。
另一方面,蒸发也可用于液体浓缩。
在化工工艺中,通常通过蒸发将溶液中的溶质浓缩至所需浓度,用于后续的加工或处置。
总结:本文从蒸发原理、蒸发过程以及蒸发器种类等方面详细介绍了蒸发技术在化工领域中的应用。

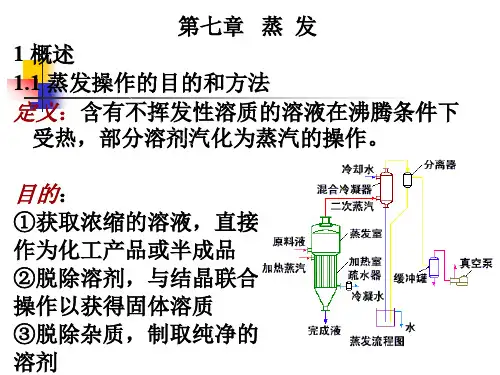
7.1 复习笔记一、概述1.蒸发操作的目的和方法含不挥发性溶质(如盐类)的溶液在沸腾条件下受热,使部分溶剂汽化为蒸气的操作称为蒸发。
化工生产中蒸发操作的目的是:(1)获得浓缩的溶液直接作为化工产品或半成品;(2)借蒸发以脱除溶剂,将溶液增浓至饱和状态,随后加以冷却,析出固体产物,即采用蒸发、结晶的联合操作以获得固体溶质;(3)脱除杂质,制取纯净的溶剂。
单效蒸发:用来自锅炉的蒸汽(加热蒸汽)作加热剂使溶液受热沸腾。
蒸发出的蒸汽(二次蒸汽)如不再利用,应将其在冷凝器中加以冷凝。
这种蒸发装置称为单效蒸发。
蒸发操作可连续或间歇地进行,工业上大量物料的蒸发通常是连续的定态过程。
2.蒸发操作的特点尽管蒸发操作的目的是物质的分离,但其过程的实质是热量传递而不是物质传递,溶剂汽化的速率取决于传热速率。
因此,蒸发操作应属于传热过程,但它具有某些不同于一般传热过程的特殊性。
(1)溶液在沸腾汽化过程中常在加热表面上析出溶质而形成垢层,使传热过程恶化。
因此,蒸发器结构的设计应设法延缓垢层的生成并易于清理。
(2)溶液的物性对蒸发器的设计和操作有重要影响。
(3)溶剂汽化需吸收大量汽化热蒸发操作是大量耗热的过程,节能是蒸发操作应予考虑的重要问题。
蒸汽温位降低的主要原因有两个:①传热需要有一定的温度差为推动力,所以汽化温度必低于加热蒸汽的温度;②在指定外压下,由于溶质的存在造成溶液的沸点升高。
由此可知,蒸发操作是高温位的蒸汽向低温位转化.较低温位的二次蒸汽的利用必在很大程度上决定了蒸发操作的经济性。
二、蒸发设备1.各种蒸发器针对各种物料不同的物性,研制了各种不同结构的蒸发器。
它们均由加热室、流动(或循环)通道、气液分离空间这三部分所组成。
(1)循环型蒸发器①垂直短管式;②外加热式;③强制循环蒸发器。
(2)单程型蒸发器单程型蒸发器中,物料单程通过加热室后蒸发达到指定浓度。
器内液体滞留量少,物料的受热时间大为缩短,所以对热敏物料特别适宜。

化工原理练习题(蒸发)化工原理练习题(蒸发)一.填空题1.(4分)中央循环管式蒸发器又称_______________。
由于中央循环管的截面积_______。
使其内单位容积的溶液所占有的传热面积比其它加热管内溶液占有的______________,因此,溶液在中央循环管和加热管内受热不同而引起密度差异,形成溶液的_______________循环。
2.(3分) 在蒸发操作中,降低单位蒸气消耗量的主要方法有:____________,__________________,________________。
3.(4分) 标准式蒸发器内溶液的循环路线是从中央循环管___________,而从其它加热管_________,其循环的原因主要是由于溶液的_____________不同,而引起的_______________所致。
4.(3分) 蒸发操作中,加热蒸气放出的热量主要用于:(1)__________________(2)______________________________(3)______________________。
二.选择题1.(2分)提高蒸发器生产强度的主要途径是增大()。
A. 传热温度差;B. 加热蒸汽压力;C. 传热系数;D. 传热面积;2.(2分)多效蒸发中,由于温度差损失的影响,效数越多,温度差损失越大,分配到每效的有效温度差就()。
A. 越小;B. 越大;C. 不变3.(2分)对粘度随浓度增加而明显增大的溶液蒸发,不宜采用()加料的多效蒸发流程。
A. 并流;B. 逆流;C. 平流三.判断题1.(2分)在蒸发计算中,由于加热蒸汽的压力高于二次蒸汽的压力,故加热蒸汽的汽化潜热也大于二次蒸汽的汽化的潜热。
()2.(2分) 在蒸发过程中,有结晶析出的或易结垢的溶液不宜采用升膜式蒸发器。
()3.(2分) 蒸发操作流程中的混合冷凝器,到了夏天其器内的真空度会降低(),因而蒸发器内的有效温度差也随着减小。
蒸发习题解1.试计算30%(质量分数)的NaOH 水溶液在60kPa 压力(绝压)下的沸点。
解:查附录9:在60kPa 压力(绝压)下水的沸点 T ′=85.6℃,r ′=2292kJ/kg查附录19:无机盐溶液在常压下的沸点,得30%NaOH 溶液的沸点为 t =118.1℃r )T (.f '+'=227301620=909.02292)2736.85(0162.02=+= △′=f 'a ∆=0.909×(118.1-100)=16.45℃故 相应沸点 t =T ′+ △′=85.6+16.45=102.1℃2.浓度为30%(质量分数)的NaOH 水溶液,在绝压为60kPa 的蒸发室内进行单效蒸发操作。
器内溶液的深度为2m ,溶液密度为3/1280m kg =ρ,加热室用表压为MPa 1.0的饱和蒸汽加热,求传热的有效温差t ∆。
解:在60kPa 压力(绝压)下水的沸点 t 0=85.6℃在MPa 1.0(表压)下水的沸点 T =120.2℃查图5-2,30% NaOH ,t 0=85.6℃下, t =103℃△′=103-85.6=17.4℃2'glp p m ρ+==60×103+21×1280×9.81×2=7.256×104 Pa 查P m 下水的沸点为90.8℃∴ △″=90.8-85.6=5.2℃△=△′+△″=17.4+5.2=22.6℃t =t 0+△=85.6+22.6=108.2℃∴t ∆=T -t =120.2-108.2=12℃3.已知单效常压蒸发器每小时处理2000kgNaOH 水溶液,溶液浓度由15 %(质量分数,下同)浓缩到25%,加热蒸汽压力为392kPa(绝压),冷凝温度下排出。
分别按20℃加料和沸点加料(溶液的沸点为113℃)。
求此两种情况下的加热蒸汽消耗量和单位蒸汽消耗量。
本文由tiger2100贡献doc文档可能在WAP端浏览体验不佳。
建议您优先选择TXT,或下载源文件到本机查看。
第八章传质过程导论第八章传质过程导论1.含有 CCl 4 蒸汽的空气,由 101.3kPa(绝)、293K 压缩到 l013kPa(绝)后,进行冷却冷凝,测出 313K 下开始有 CCl 4 冷凝,混合气出冷凝器时的温度为 300K 求: (l)压缩前、压缩后开始冷凝前与出冷凝器时,CCl 4 蒸汽的质量分率、质量比和摩尔浓度。
(2)出冷凝器时 CCl 4 蒸汽冷凝的百分率。
四氯化碳的饱和蒸汽压数据如下: 273 283 288 T /K 293 89.8 300 123 313 210p / mmHg 33.7 注:1mmHg = 133.3 p a55.671.1解:(1)l013kPa(绝),313K 下开始有 CCl 4 冷凝,则210 × 101.3 760 y= = 0.0276 1013 0.0276 × 154 压缩前: a = = 0.131 0.0276 ×154 + (1 0.0276) × 29 0.0276 × 154 a= = 0.15 (1 0.0276) × 29 yp 0.0276 × 101.3 C= = = 1.15 × 10 3 kmol / m 3 RT 8.314 × 293 压缩后开始冷凝前: a = 0.131 , a = 0.15 yp 0.0276 × 1013 C= = = 1.07 × 10 2 kmol / m 3 RT 8.314 × 313 123 × 101.3 760 出冷凝器时: y ' = = 0.0162 1013 0.0162 × 154 a' = = 0.080 0.0162 × 154 + (1 0.0162) × 29 0.0162 × 154 a'= = 0.087 (1 0.0162) × 29第 1 页第八章传质过程导论yp 0.0162 × 1013 = = 6.58 × 10 3 kmol / m 3 RT 8.314 × 300 a a' 0.15 0.087 × 100% = 42% (2) × 100% = a 0.15 C=2.二氧化硫与水在 30℃下的平衡关系为: a (kgSO2 / 100kgH 2 O) 0.1 0.2 0.3 0.5 0.7 52 1.0 79 1.5 1254.7 11.8 19.5 36 试求总压为 101.3kPa(绝)下的 x y 关系,并作图。
化工原理——蒸发习题及答案第五章蒸发一、选择或填空1. 为蒸发某种粘度随浓度和温度变化较大的溶液,应采用_____流程。
A 平流加料B 并流加料C 逆流加料D 双效三体并流加料2.蒸发器的生产强度是指_________。
欲提高蒸发器的生产强度,必须设法提高________。
3.蒸发过程中引起温度差损失的原因有(1)__________ ,(2)_________ ,(3)_________ 。
4.多效蒸发与单效蒸发相比,其优点是_______ 。
多效蒸发操作流程有______ 、_______ 和______ 。
5.循环型蒸发器的传热效果比单程型的效果要________ 。
6.要想提高生蒸汽的经济性,可以________ ,________, _________ ,_________。
7.计算温度差损失时以__________ 计算。
二、计算题1.用一单效蒸发器将1500kg/h的水溶液由5%浓缩至25%(均为质量%)。
加热蒸汽压力为190kpa,蒸发压力为30kpa(均为绝压)。
蒸发器内溶液沸点为78℃,蒸发器的总传热系数为1450W/(m2·℃)。
沸点进料,热损失不计。
(1)完成液量;(2)加热蒸汽消耗量;(3)传热面积;2. 浓度为2.0%(质量)的盐溶液,在28℃下连续进入一单效蒸发器中被浓缩至3.0%。
蒸发器的传热面积为69.7m2,加热蒸发为110℃饱和蒸汽。
加料量为4500Kg/h,料液的比热Cp=4100J/(Kg.℃)。
因为稀溶液,沸点升高可以忽略,操作在1atm下进行。
(1)计算蒸发的水量及蒸发器的传热系数;(2)在上述蒸发器中,将加料量提高至6800Kg/h,其他操作条件(加热蒸汽及进料温度、进料浓度、操作压强)不变时,可将溶液浓缩至多少浓度?3. 一并流操作的三效蒸发器用以浓缩水溶液,加热蒸汽为121℃饱和蒸汽,末效蒸发室的操作压强为26.1Kpa(绝压)。
原料预热至沸点加入第一效内,料液的浓度很低,沸点升高可以不计。
(完整版)华东理工大学化工原理简答题真题汇总第一章流体流动1.何谓轨线?何谓流线?为什么流线互不相交?99答:轨线是同一流体质点在不同时刻所占空间位置的连线;流线是采用欧拉法考察的结果,流线上各点的切线表示该点的速度方向;因为同一点只有一个速度,由此可知,流线互不相交。
2.动能校正系数α为什么总是大于、等于1的?试说明理由?003.简述数学模型法规划实验的主要步骤。
00、03、06、10答:数学模型实验研究方法立足于对所研究过程的深刻理解,按以下主要步骤进行工作:①将复杂的真实过程本身化简成易于用数学方程式描述的物理模型;②将所得到的物理模型进行数学描述即建立数学模型;③通过实验对数学模型的合理性进行检验并测定模型参数。
4.流体流动过程中,稳定性是指什么?定态性是指什么?015.简述因次论指导下的实验研究方法的主要步骤。
01、04答:因次分析法的具体步骤:①找出影响过程的独立变量;②确定独立变量所涉及的基本因次;③构造因变量和自变量的函数式,通常以指数方程的形式表示;④用基本因次表示所有独立变量的因次,并出各独立变量的因次式;⑤依据物理方程的因次一致性原则和π定理得到准数方程;⑥通过实验归纳总结准数方程的具体函数式。
6.层流与湍流的本质区别是什么?02答:湍流的最基本特征是出现了径向的速度脉动。
当流体在管内层流时,只有轴向速度而无径向速度,牛顿型流体服从牛顿粘性定律;然而在湍流时,流体质点沿管道流动的同时还出现了径向的随机脉动,这种脉动加速了径向的动量、热量和质量的传质,动量的传递不仅起因于分子运动,而来源于流体质点的横向脉动速度。
7.非牛顿流体中,塑性流体的特点是什么?02、05、06、10答:含固体量较多的悬浮体常表现出塑性的力学特征,即只有当施加的剪应力大于某一临界值(屈服应力)之后才开始流动,流动发生后,通常具有剪切稀化性质,也可能在某一剪切率范围内有剪切增稠现象。
8.什么是流体流动的边界层?边界层分离的条件是什么?03答:由于流体粘性的作用,靠近壁面的流体将相继受阻而降速,随着流体沿壁面前流动,流体受影响的区域逐渐扩大,而流速降为未受边壁影响流速的99%以内的区域即为边界层。
第八章习题气液相平衡1.在盛水的鼓泡吸收器中通入纯CO2气,经长期接触后测得水中CO2的平衡溶解度为2.857×10-2mol/L溶液。
鼓泡器中的总压为101.3kPa,水温30℃,溶液的密度ρm=996kg/m3。
求亨利系数,并将此实验值与文献值E=188.5MPa 作比较。
2.惰性气与CO2的混合气中含CO230% (体积百分数),在1MPa(表压)下用水吸收。
设吸收塔底水中溶解的CO2达到饱和,此吸收液在膨胀槽中减压至20kPa(表压),放出大部分CO2,然后再在解吸塔中吹气解吸。
设全部操作范围内水与CO2的平衡关系服从亨利定律,操作温度为25℃。
求1kg水在膨胀槽中最多能放出多少kgCO2气。
习题1 附图习题2附图3.20℃的水与N2气逆流接触以脱除水中溶解的O2气。
塔底入口的N2气中含氧0.1% (体积),设气液两相在塔底达到平衡,平衡关系服从亨利定律。
求下列两种情况下水离开塔底时的最低含氧量。
以mg/m3水表示。
(1)操作压强为101.3kPa(绝对)。
(2)操作压强为40kPa(绝对)。
4.气液逆流接触的吸收塔,在总压为101.3kPa下用水吸收Cl2气,进入塔底的气体混合物中含氯1%(体积),塔底出口的水中含氯浓度为x=0.8×10-5(摩尔分率)。
试求两种不同温度下塔底的吸收推动力,分别以(x e-x)及(y-y e)表示。
(1)塔底温度为20℃。
(2)塔底温度为40℃。
5.某逆流吸收塔塔底排出液中含溶质x=2×10-4(摩尔分率), 进口气体中含溶质2.5%(体积),操作压强为101kPa。
气液平衡关系为y=50x。
现将操作压强由101kPa增至202kPa,问塔底推动力(y-y e)及(x e-x)各增加至原有的多少倍。
扩散与相际传质速率6.柏油马路上积水2mm,水温20℃。
水面上方有一层0.2mm厚的静止空气层,水通过此气层扩散进入大气。
大气中的水汽分压为1.33kPa。
问多少时间后路面上的积水可被吹干。
*7. 某水杯中初始水面离杯上缘1cm, 水温30℃,水汽藉扩散进入大气。
杯上缘处的空气中水汽分压可设为零,总压101.3KPa。
求水面下降4cm需要多少天?习题7附图8.某填料塔用水吸收混合气中的丙酮蒸汽。
混合气流量为16kmol/(h ・m 2), 操作压强101.3kPa 。
已知容积传质分系数k y a=64.6kmol/(h ・m 3),k L a=16.6kmol/h.m 3.(kmol/m 3),相平衡关系为p A =4.62C A 。
式中气相分压p A 的单位是kPa ,平衡溶解度单位是(kmol/m 3)。
求(1)容积总传质系数及传质单元高度H OG 。
(2)液相阻力占总传质阻力的百分数。
9.在设计某降膜吸收器时,规定塔底气相中含溶质y=0.05,液相中含溶质的浓度x=0.01(均为mol 分率)。
两相的传质分系数分别为k x =8×10-4kmol/(s ・m 2),k y =5×10-4kmol/(s ・m 2)。
操作压强为101.3kPa 时相平衡关系为y=2x 。
试求:(1)该处的传质速率N A (kmol/(s ・m 2))(2)如果总压改为162kPa ,塔径及气、液两相的摩尔流率均不变,不计压强变化对流体粘度的影响,此时的传质速率有何变化?讨论总压对k y 、K y 及(y-y e )的影响。
吸收过程数学描述10.对低浓度气体吸收或解吸,由x y y k m k K +=11 出发,试证OG OL N AN 1=。
习题13 附图*11. 低浓度气体逆流吸收,试证:21ln 11y y L mG N OG ∆∆−=式中, Δy1= y1- y1e为塔底的吸收推动力,Δy2= y2- y2e为塔顶的吸收推动力。
*12. 用纯溶剂对低浓度气体作逆流吸收,可溶组分的回收率为η,采用的液气比是最小液气比的β倍。
物系平衡关系服从亨利定律。
试以η、β两个参数列出计算N OG的表达式。
13.下图为两种双塔吸收流程,试在y~x图上定性画出每种吸收流程中A、B两塔的操作线和平衡线,并标出两塔对应的进、出口浓度。
14.较浓的溶液进入图示解吸塔塔顶,塔底吹气解吸,塔中部某处抽出一半液体,另一半液体由塔底排出,试在y~x图上画出平衡线与操作线,并标出各股流体的浓度坐标。
吸收过程的设计型计算15.流率0.4 kmol/(s・m2)的空气混合气中含氨2%(体积),拟用逆流吸收以回收其中95%的氨。
塔顶淋入浓度为0.0004(mol分率)的稀氨水溶液,设计采用的液气比为最小液气比的1.5倍,操作范围内物系服从亨利定律,y=1.2x所用填料的总传质系数K y a=0.052kmol/(s・m3)。
试求:(1)液体在塔底的浓度x1。
(2)全塔的平均推动力Δy m。
(3)所需塔高。
16. 用纯溶剂对低浓度混合气作逆流吸收以回收其中的可溶组分,物系的相平衡关系服从亨利定律,吸收剂用量是最小用量的1.3倍,试求下列两种情况下所需的塔高,已知传质单元高度H OG=0.8m。
(1)回收率η=90%。
(2)回收率η=99%。
(3)两种情况下的吸收剂用量有何差别?习题14附图习题18附图17.含H2S 2.5×10-5 (摩尔分率,下同)的水与空气逆流接触以使水中的H2S脱除,操作在101.3kPa、25℃下进行,物系的平衡关系为y=545x,水的流率为5000kg/(m2・h)。
试求:(1)为使水中的H2S降至x=0.1×10-5 所需的最少空气用量。
(2)当空气用量为G=0.40kmol/(h・m2),设计时塔高不受限制,可以规定离解吸塔的水中含H2S最低浓度是多少?示意画出该种情况下的解吸操作线。
*18. 采用图示的双塔流程以清水吸收混合气中的SO2,气体经两塔后总的SO2回收率为0.91,两塔的用水量相等,且均为最小用水量的1.43倍,两塔的传质单元高度H OG均为1.2m。
在操作范围内物系的平衡关系服从亨利定律。
试求两塔的塔高。
吸收过程的操作型计算19.某吸收塔用25×25mm的瓷环作填料,充填高度5m,塔径1m,用清水逆流吸收每小时2250m3的混合气。
混合气中含有丙酮5%(体积),塔顶逸出废气含丙酮降为0.26%(体积),塔底液体中每kg水带有60g丙酮。
操作在101.3kPa、25℃下进行,物系的平衡关系为y=2x。
试求(1)该塔的传质单元高度H OG及容积传质系数K y a;(2)每小时回收的丙酮量。
20.某填料吸收塔高2.7m,在常压下用清水逆流吸收混合气中的氨。
混合气入塔的摩尔流率为0.03 kmol/m2.s。
清水的喷淋密度0.018 kmol/(m2.s)。
进口气体中含氨2%(体积),已知气相总传质系数K y a=0.1 kmol/(m2.s),操作条件下亨利系数为60kPa。
试求排出气体中氨的浓度。
*21. 某填料吸收塔用含溶质x2=0.0002的溶剂逆流吸收混合气中的可溶组分,采用液气比是3,气体入口浓度y1=0.01回收率可达η=0.90。
今因解吸不良使吸收剂入口浓度x2升至0.00035,试求:(1)可溶组分的回收率下降至多少?(2)液相出塔浓度升高至多少?已知物系的平衡关系为y=2x。
*22. 在15℃、101.3kPa下用大量的硫酸逆流吸收空气中的水汽。
入塔空气中含水汽0.0145(摩尔分率,下同)硫酸进出塔的浓度均为80%,硫酸溶液上方的水汽平衡浓度为y e=1.05×10-4, 且已知该塔的容积传质系数K y a∝G0.8。
空气经塔后被干燥至含水汽0.000322。
现将空气流率增加一倍,则出塔空气中的含水量为多少?思考题1. 吸收的目的和基本依据是什么? 吸收的主要操作费用花费在哪?2. 选择吸收溶剂的主要依据是什么? 什么是溶剂的选择性?3. E, m, H 三者各自与温度、总压有何关系?4. 工业吸收过程气液接触的方式有哪两种?5. 扩散流J A , 净物流N, 主体流动N M , 传递速率N A 相互之间有什么联系和区别?6. 漂流因子有什么含义? 等分子反向扩散时有无漂流因子? 为什么?7. 气体分子扩散系数与温度、压力有何关系? 液体分子扩散系数与温度、粘度有何关系?8. 修伍德数、施密特数的物理含义是什么?9. 传质理论中,有效膜理论与表面更新理论有何主要区别?10. 传质过程中,什么时侯气相阻力控制? 什么时侯液相阻力控制?11. 低浓度气体吸收有哪些特点? 数学描述中为什么没有总物料的衡算式?12. 吸收塔高度计算中,将N OG与H OG分开, 有什么优点?13. 建立操作线方程的依据是什么?14. 什么是返混?15. 何谓最小液气比? 操作型计算中有无此类问题?16. x2max与(L/G)min是如何受到技术上的限制的? 技术上的限制主要是指哪两个制约条件?17. 有哪几种N OG的计算方法? 用对数平均推动力法和吸收因数法求N OG的条件各是什么?18. H OG的物理含义是什么? 常用吸收设备的H OG约为多少?19. 吸收剂的进塔条件有哪三个要素? 操作中调节这三要素, 分别对吸收结果有何影响?20. 吸收过程的数学描述与传热过程的数学描述有什么联系与区别?21. 高浓度气体吸收的主要特点有哪些?22. 化学吸收与物理吸收的本质区别是什么? 化学吸收有何特点?23. 化学吸收过程中,何时成为容积过程? 何时成为表面过程?。