盐水浓度凝固点密度对照表
- 格式:docx
- 大小:7.97 KB
- 文档页数:1
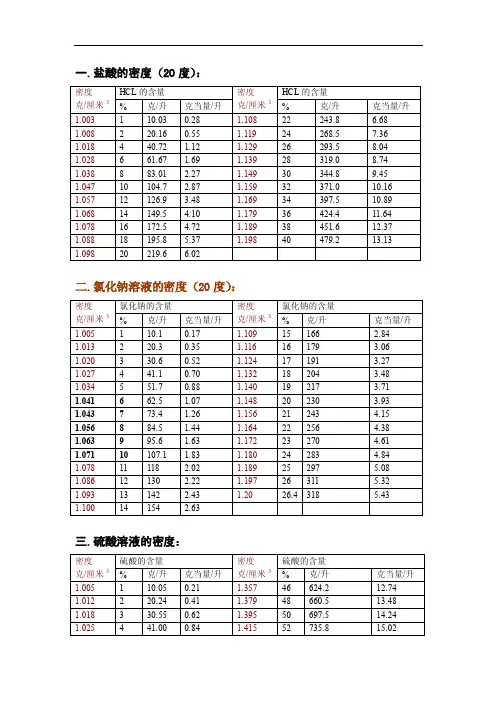

盐水浓度与凝固点盐水是指将盐溶解在水中形成的溶液。
在盐水中,盐的分子会与水分子相互作用,形成离子,其中阳离子是盐中金属离子,阴离子是盐中的非金属离子。
盐水浓度是指盐溶液中的盐的质量或摩尔浓度的大小。
而凝固点是指物质从液态转变为固态时的温度。
本文将围绕盐水浓度与凝固点的关系展开讨论。
在盐水溶液中,随着盐的浓度的增加,溶液的凝固点会降低。
这是因为溶质(盐)的添加会干扰水分子的结构,使得水分子形成的晶格结构变得不规则,从而需要更低的温度才能使溶液凝固。
这个现象被称为“冰点降低”。
盐水中的溶质通过与溶剂(水)分子相互作用,阻碍了水分子的结晶过程,所以需要更低的温度才能使溶液凝固。
盐水浓度与凝固点之间的关系可以通过一个称为“摩尔冰点降低常数”的物理常数来描述。
摩尔冰点降低常数是一个与溶质和溶剂相关的常数,它表示单位浓度的溶质在单位溶剂中引起的凝固点降低。
不同的盐有不同的摩尔冰点降低常数,这是因为不同的盐在水中的溶解度和离子化程度不同。
除了盐的浓度,其他因素也可以影响盐水的凝固点。
例如,压力的变化会对凝固点产生影响。
根据气候条件和海拔的不同,地球上的海水凝固点与我们通常理解的0℃有所不同。
在较低的温度和较高的压力下,海水的凝固点会降低,这是因为压力增加会压缩溶剂分子,从而降低了凝固点。
盐水中还存在一种现象叫做“过冷”。
过冷是指溶液的温度低于其凝固点,但仍保持在液态的状态。
这种情况下,溶液处于不稳定的状态,一旦有核心物质(如冰晶)引起结晶,整个溶液会迅速凝固。
过冷现象在盐水中更容易出现,因为盐的存在增加了结晶的难度。
盐水浓度与凝固点之间的关系在实际应用中具有重要意义。
例如,在冬季,道路上会撒盐以防止结冰。
这是因为撒盐会使冰的凝固点降低,从而减缓冰的形成速度,提高道路的安全性。
同样地,煮食时加盐也可以使水的沸点升高,加快食物的煮熟速度。
盐水浓度与凝固点之间存在着密切的关系。
随着盐水的浓度增加,溶液的凝固点会降低。

10%浓度盐水的凝固点
10%浓度盐水的凝固点取决于盐的种类。
一般来说,普通食用
盐(氯化钠)溶解在水中会降低水的冰点,使盐水的凝固点较纯水低。
但是具体的降低程度取决于溶液的浓度和盐的种类。
根据Raoult's Law(瑞尔定律),浓度越高,凝固点下降的越多。
对于10%浓度的氯化钠(食盐)溶液来说,根据一般的估算,它的凝固点约为-6度摄氏度。
这意味着在正常的冰点0度以下
6度,盐水仍然是液态而不会结冰。
请注意,这个数值仅仅是
一个估计,实际的凝固点可能会受到其他因素的影响而有所变化。
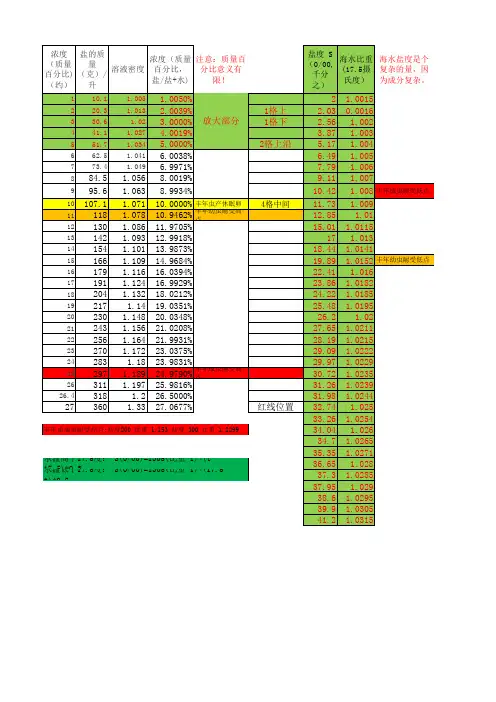

不同浓度溶液的凝固点的高低1. 引言:冬天的冰与盐在寒冷的冬天,咱们总会看到街道上撒盐来融化冰雪。
这可不是因为有人喜欢玩盐,而是因为盐能降低水的凝固点。
听起来很高大上对吧?其实,这就是物理化学的小妙招!今天,我们就来聊聊不同浓度的溶液是怎么影响它们的凝固点的,顺便给大家开个小脑洞,看看这个知识怎么能在生活中派上用场。
2. 溶液的秘密:浓度与凝固点的关系2.1 溶液是什么?首先,咱们得搞明白“溶液”是什么。
简单来说,溶液就是把一种东西(溶质)溶解到另一种东西(溶剂)里。
想象一下,咱们把糖放进水里,水就变成了甜甜的糖水。
嘿,水不再是单纯的水了,它变成了糖水溶液。
这时候,糖就是溶质,水就是溶剂。
是不是很简单?这就是溶液的基本概念。
2.2 凝固点是什么?接下来,咱们再来看看什么是凝固点。
通俗来说,凝固点就是液体变成固体的温度。
比如,水的凝固点是0°C。
当温度降到0°C时,水就会变成冰,变得硬邦邦的。
不过,如果在水里加点盐,就会发现水的凝固点会下降。
简单点说,咱们可以把水的“冰点”拉得更低。
哈哈,这就像是给水穿了一件冬衣,让它在更低的温度下才“结冰”!3. 浓度的影响:从稀到浓的变化3.1 稀溶液的凝固点那么,浓度的变化是怎么影响凝固点的呢?咱们先来聊聊稀溶液。
比如说,咱们在水里放了少量的盐,盐水就是一个稀溶液。
在这种情况下,水的凝固点会稍微降低一点点,但不会降得太多。
这就好比是在外面冬天穿了一件薄外套,冷风吹过来,还是能忍受得住。
虽然寒冷,但依然能挺过去。
3.2 浓溶液的凝固点再看看浓溶液,如果咱们往水里放了好多好多盐,甚至达到饱和状态,这时候凝固点就会大大下降。
这就好比你穿上了超级厚的羽绒服,走在街上,外面再冷也不怕,反正你是“冻”不住的!浓盐水的凝固点可以降到20°C甚至更低,这时候,如果你想喝冰水,得多小心了,别把舌头冻住了!4. 生活中的应用:冷知识变生活妙招4.1 冬天的妙用在冬天,许多地方都会用盐来融化路上的冰雪。