从铜氨废液中回收铜
- 格式:pdf
- 大小:212.43 KB
- 文档页数:4

铜氨废液中铜回收的新工艺流程铜氨废液是一种常见的含铜废水,通常产生于电镀、冶炼和化学制剂生产等工业过程中。
传统的铜氨废液处理方法主要是通过化学还原、溶解、电析和电积等步骤将废液中的铜回收。
然而,这些方法存在着许多问题,包括操作复杂、设备投资高、产生大量废物等。
为了解决这些问题,近年来出现了一种新的铜回收工艺流程,该工艺使用离子液体作为溶剂,并借助离子液体的独特性质实现高效的铜回收。
离子液体是一类由有机阳离子和无机阴离子组成的液体。
其具有低熔点、广阔的电化学窗口、优异的溶解性能和良好的可重复使用性等特点,因此在废液处理等领域具有广泛的应用前景。
对于铜氨废液处理而言,离子液体可以替代传统的有机溶剂,与废液中的铜离子发生配位反应并形成络合物,实现铜的有效回收。
基于离子液体的铜回收工艺流程一般包括以下几个步骤:1. 提取:首先将铜氨废液与适量的离子液体混合,通过相分离技术将铜络合物从废液中提取到离子液体相中。
2. 洗涤:将离子液体相中的铜络合物用水或酸性溶液进行洗涤,去除其中的杂质和离子液体残留。
3. 脱水:通过蒸发或其他适当方法将洗涤后的溶液中的水分脱除,得到含有高浓度铜络合物的浓缩液。
4. 还原:将浓缩液与适量的还原剂反应,将铜络合物转化为可溶性的金属铜。
5. 结晶/电积:通过结晶或电积等方法将金属铜从溶液中回收,得到高纯度的铜产品。
可以看出,基于离子液体的铜回收工艺流程相比传统的方法具有以下优势:1. 高效:离子液体作为溶剂,能够与废液中的铜离子快速发生配位反应,并形成稳定的络合物,提高了铜的提取效率。
2. 环保:离子液体具有低挥发性和低溶解性有机物的特点,因此在铜回收过程中几乎没有挥发物和废气排放,达到了绿色环保的要求。
3. 经济:离子液体的可重复使用性和稳定性很高,可以降低处理成本,并减少废物的产生。
4. 高纯度:离子液体的溶解性能良好,可以实现对铜的高效分离和纯化,得到高纯度的铜产品。
总结起来,基于离子液体的铜回收工艺流程是一种具有广泛应用前景的新型工艺。

1.从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO2-3等中回收铜的工艺流程如图:步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为______________________________,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为______。
答案2[Cu(NH3)4]2++Cl-+5H++3H2O===Cu2(OH)3Cl↓+8NH+46(或5.5~6.5)解析步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为2[Cu(NH3)4]2++Cl-+5H++3H2O===Cu2(OH)3Cl↓+8NH+4,由图可知为尽可能提高铜的回收率,需控制的pH约为6(或5.5~6.5)。
2.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn 的工艺流程如图所示。
“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
则适宜的浸出时间和液固比分别为________、________。
答案 3MnO 2+2Fe +12H +===3Mn 2++2Fe 3++6H 2O 60 min 3∶1(或3)解析 “酸浸”时,MnO 2将Fe 氧化为Fe 3+,自身变为Mn 2+,其反应的离子方程式为3MnO 2+2Fe +12H +===3Mn 2++2Fe 3++6H 2O ;该过程中浸出时间60 min 达到80%,以后浸出率不再上升,液固比等于3时锰浸出率最大,因此适宜的浸出时间和液固比分别为60 min 、3∶1(或3)。
3.金属钛在航天、潜海和医疗方面应用广泛。
以钛铁矿[主要成分为钛酸亚铁(FeTiO 3),含少量Fe 2O 3]为原料制备钛的工艺流程如图所示。

第5期2008年10月 矿产综合利用M ulti purpose Utili za ti on of M i n era l Resources No .5O ct .2008从铜氨溶液中萃取分离铜的试验研究徐建林,史光大,钟庆文,李元坤,余平(中国地质科学院矿产综合利用研究所,四川 成都 610041) 摘要:采用N902萃取剂从氨2氯化铵体系浸出液中萃取分离二价铜,考察了萃取剂浓度、萃取相比和振荡时间对铜萃取率的影响。
结果表明:在单级萃取中,铜萃取率平均为98.60%;在两级萃取中,铜萃取率大于99.99%,而且铜离子也得到了富集。
关键词:萃取;铜;氨溶液;N902中图分类号:TF111.3 文献标识码:A 文章编号:100026532(2008)0520007203 我国铜矿资源呈富矿少、贫矿多和矿石品位低的特点,而且低品位难处理氧化铜矿占有的比例较大。
随着铜矿石品位的逐年下降和近年铜价的上涨,使处理低品位铜矿的浸出-萃取-电积这一湿法冶金工艺日益受到人们的重视[1]。
在对低品位氧化铜矿采用浸出-萃取-电积工艺时,对氨-铵体系浸出液进行萃取分离和富集铜是其中重要的一道工序。
从铜氨溶液中萃取分离铜的萃取剂有多种,如N902,L ix984N 和L ix54-100等。
国内的华南师范大学[2]、北京矿冶研究总院[3]等都对从氨-铵体系浸出液中萃取分离铜进行了研究。
本文介绍了采用N902萃取剂对氨-氯化铵体系浸出液中的铜进行萃取分离和富集铜的试验研究,经过对萃取试验条件的探索,在二级萃取流程试验中,铜离子萃取率大于99.99%,负载有机相中铜浓度较浸出液中提高了近4倍。
1 试验原理及方法1.1 试验原理试验采用N902为萃取剂,它是由中国科学院上海有机化学研究所研制的。
N902萃取剂外观为琥珀色液体,无可见杂质,密度0.95~0.97g/L,粘度<190CP,闪点>62℃。
N902萃取剂是一种类似M5640的萃取铜的螯合萃取剂,主要活性成分为2-羟基-5-壬基水杨醛肟,属于醛肟类铜萃取剂[4]。

2023年高三化学对接新高考全真模拟试卷(一)(云南,安徽,黑龙江,山西,吉林五省通用)(考试时间:50分钟 试卷满分:100分)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回可能用到的相对原子质量:H 1 C12 N14 O16 Na 23 Mg 24 P 31 S 32 Cl 35.5 Cr52 Fe 56 Cu 64 Ag 108一、选择题:本题共7个小题,每小题6分。
共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2022·江苏·海门中学高三阶段练习)我国承诺在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。
下列措施中对促进“碳中和”最直接有效的是A .将重质油裂解为轻质油作为燃料B .大规模开采可燃冰作为新能源C .通过清洁煤技术减少煤燃烧污染D .研究推广将二氧化碳转化为淀粉 【答案】D【详解】A .将重质油裂解为轻质油作为燃料,轻质油燃烧仍会产生CO 2,无法有效促进碳中和,A 错误;B .可燃冰成分为甲烷等,甲烷燃烧产生CO 2,无法有效促进碳中和,B 错误;C .通过清洁煤技术减少煤燃烧污染,只是减小了SO 2的排放,并没有减少CO 2的排放,C 错误;D .将二氧化碳转化为淀粉,可减少二氧化碳的排放,对促进碳中和最直接有效,D 正确;故答案选D 。
2.(2022·黑龙江·大庆实验中学高三开学考试)设A N 为阿伏加德罗常数的值,下列说法正确的是A .227.8gNa O 和2Na S 混合物中所含的阴离子总数为A 0.15NB .-12271L 0.1molL K Cr O 溶液中2-27Cr O 离子数为A 0.1NC .常温常压下,124g P 4中所含P-P 键的数目为A 4ND .向密闭容器中充入2molNO 与21mol O 充分反应后容器内的分子数小于A 2N 【答案】D【详解】A .过氧化钠是由1个钠离子和1个过氧根离子构成的、硫化钠是由1个钠离子和1个硫离子构成的,1分子中均含有3个离子,且两者的相对分子质量均为78;则227.8gNa O 和2Na S 混合物可看作NaM ,且物质的量为0.1mol ,其所含的阴离子总数为A 0.1N ,A 错误;B .-12271L 0.1molL K Cr O 溶液中存在Cr 2O 27-+H 2O CrO 24-+2H +,导致2-27Cr O 离子数小于A 0.1N ,B 错误;C .1分子P 4中存在6个P -P 键,常温常压下,124g P 4(物质的量为1mol )中所含P-P 键的数目为A 6N ,C 错误;D .向密闭容器中充入2molNO 与21mol O 充分反应后生成2molNO 2,二氧化氮会发生反应2NO 2N 2O 4,故容器内的分子数小于A 2N ,D 正确;故选D 。

废液中金属铜的回收方法1. 嘿,你知道吗?可以用置换反应来回收废液中的金属铜呀!就像你拿一个宝贝去换另一个更棒的宝贝一样。
比如说,把铁放进含铜离子的废液中,铜离子就会跑出来和铁结合,这不就把铜给置换出来啦!是不是很神奇?2. 哇塞,还可以用电解法回收金属铜呢!这就好比给废液通上电流,让铜乖乖地出来集合。
就像你引导一群小朋友排好队一样,让铜离子顺着电流的方向聚集到电极上,太有趣啦!比如在一些工厂里就是这么干的呢!3. 嘿呀,沉淀法也是个好办法哟!把能和铜离子反应生成沉淀的物质加进去,让铜沉淀下来。
这就好像捕鱼一样,把铜一网打尽!像加入氢氧化钠,就能看到铜离子变成好看的蓝色沉淀啦,你不想试试吗?4. 哈哈,吸附法也不错呀!找些能吸附铜的东西,把铜吸附住带出来。
就好像一个小魔术贴,紧紧地把铜抓住。
比如活性炭就能干这个事儿,厉害吧?5. 哎呀,利用膜分离技术也能回收铜呢!这就像是给铜建造了特别的通道,让它单独通过。
真的好神奇呀!在一些高科技的地方就会用到这样高端的手段哦。
6. 哟呵,溶剂萃取法了解一下呀!就好像把铜从废液这个大部队里挑选出来,专门带到另一个地方。
就像你在人群中一眼认出你的好朋友一样,精准地把铜弄出来,是不是很牛?7. 嘿,微生物法也很有意思哦!让微生物去和铜打交道,把铜弄出来。
这多像小动物们帮我们干活呀!有些微生物还真的很厉害呢,能把铜吃得死死的。
8. 哇哦,离子交换法也能行!这就像是给铜准备了特殊的座位,让它乖乖坐上去。
是不是很形象?就像在实验室里经常会用到这样的方法来得到纯纯的铜呢!9. 总之,回收废液中金属铜的方法好多呀,各有各的奇妙之处!我们可以根据实际情况选择最合适的方法,让那些铜都能被有效地利用起来,而不是白白浪费掉呀!发挥我们的聪明才智,把铜都好好回收吧!。
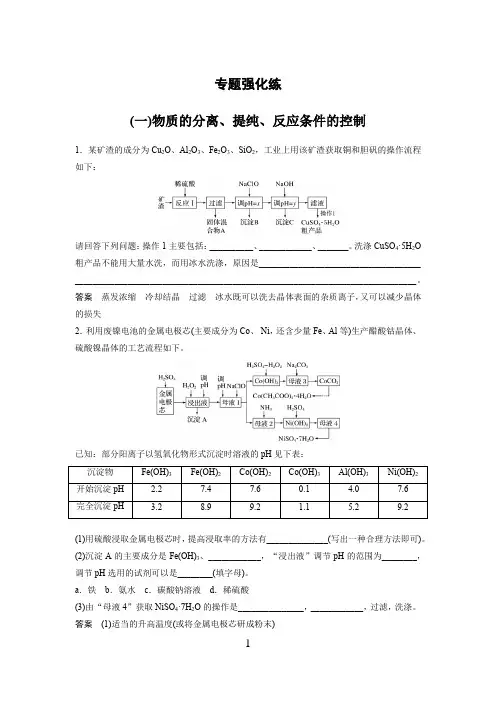
专题强化练(一)物质的分离、提纯、反应条件的控制1.某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:请回答下列问题:操作1主要包括:__________、____________、_______。
洗涤CuSO4·5H2O 粗产品不能用大量水洗,而用冰水洗涤,原因是_____________________________________ ______________________________________________________________________________。
答案蒸发浓缩冷却结晶过滤冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失2.利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Co(OH)3Al(OH)3Ni(OH)2开始沉淀pH 2.27.47.60.1 4.07.6完全沉淀pH 3.28.99.2 1.1 5.29.2(1)用硫酸浸取金属电极芯时,提高浸取率的方法有______________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、____________,“浸出液”调节pH的范围为________,调节pH选用的试剂可以是________(填字母)。
a.铁b.氨水c.碳酸钠溶液d.稀硫酸(3)由“母液4”获取NiSO4·7H2O的操作是_______________,____________,过滤,洗涤。
答案(1)适当的升高温度(或将金属电极芯研成粉末)(2)Al(OH)3 5.2≤pH<7.6 bc(3)蒸发浓缩 冷却结晶解析 (2)金属电极芯中的主要成分是Co 、Ni ,还含少量Fe 、Al 等,加入稀硫酸酸浸时,金属单质都转化为金属离子(Ni 2+、Co 2+、Fe 2+、Al 3+),浸出液中加入过氧化氢的作用是氧化亚铁离子为铁离子,由流程图中最终产物可知,调节pH 的作用是除去溶液中的Fe 3+、Al 3+,故沉淀A 的主要成分是Fe(OH)3、Al(OH)3;为了保证Fe 3+、Al 3+沉淀完全而Ni 2+、Co 2+不沉淀,由表格数据可知,要调节pH 的范围为5.2≤pH<7.6;调节pH 时不能加入铁,因为铁能还原铁离子为亚铁离子,不能加入稀硫酸,因为要将溶液的pH 调大,由流程图中后续所加试剂可知,调节pH 选用的试剂可以是氨水、碳酸钠溶液。


醋酸铜氨废液中铜的回收及其废水处理研究醋酸铜氨废液中铜的回收及其废水处理研究摘要:本研究旨在探究醋酸铜氨废液中铜的回收及其废水处理方法。
通过实验研究,我们确定了一种有效的回收铜离子的方法,并成功实现了废水的处理。
实验结果表明,在一定条件下,通过电解法可以有效地回收废液中的铜离子,并且可将废水处理后达到国家排放标准,具有良好的经济效益和环境效益。
关键词:醋酸铜氨废液;铜离子回收;废水处理1. 引言随着工业化的快速发展,铜在许多领域被广泛应用,如电子、建筑、冶金等。
然而,大量生产和使用铜也导致了大量废液的产生,这些废液中富含高浓度的铜离子,对环境造成了严重的污染。
因此,如何有效地回收废液中的铜离子并进行废水处理,成为一个重要的课题。
2. 实验方法2.1 样品收集我们在工业生产过程中收集了醋酸铜氨废液样品作为研究对象。
废液中铜离子的浓度为50 g/L。
2.2 铜离子回收法实验中,我们采用了电解法进行铜离子的回收。
废液样品中的铜离子经过过滤和预处理后,注入电解池中作为阳极,同时,我们还在电解池中设置了一对不锈钢板作为阴极。
经过一定时间的电解过程后,废液中的铜离子将在阳极上析出。
2.3 废水处理法为了达到废水处理的目的,我们采用了沉淀法。
首先,我们向废液中加入硫化钠,与废液中的铜离子发生反应,生成CuS沉淀。
然后,经过过滤和烘干处理,得到固态的CuS。
最后,将废液进行中和处理,使其达到国家排放标准。
3. 实验结果与分析3.1 铜离子回收效果经过一定时间的电解过程后,我们观察到阳极上析出了大量的铜离子。
通过称量阳极上的铜的质量,我们计算得到铜离子的回收率为90%。
3.2 废水处理效果在进行废水处理实验后,我们对处理后的废水样品进行了分析。
结果表明,经过沉淀和中和处理后,废水中的铜离子浓度被降低到10 mg/L以下,大大低于国家排放标准。
4. 经济效益分析本实验中,我们成功地回收了醋酸铜氨废液样品中的铜离子,并达到了废水处理的要求。

碱性蚀刻液中铜回收与废液、铜氨废水的循环使用目前碱性蚀刻液由危险废物回收商进行资源化回收铜,生产硫酸铜产品,没有对氨进行回收和处理,也不能回收失效的蚀刻液和铜氨废水的循环使用,对环境有一定的影响,且导致运输过程的能源消耗和成本增加。
为响应国家“清洁生产、变废为宝、发展循环经济、创建节约型社会”的号召,计划安装“在线含铜废蚀刻液的资源化回收”成套设备。
2009年1~7月份含铜废蚀刻液产生量为:碱性蚀刻废液和后面的水洗产生的铜氨废水为本公司主要NH3-N的排放源。
二、减少末端处理前的污染因子—NH3-N1、氨氮对环境的影响氮素物质对水体环境和人类都具有很大的危害,主要表现在以下几个方面:氨氮会消耗水体中的溶解氧;氨氮会与氯反应生成氯胺或氮气,增加氯的用量;含氮化合物对人和其它生物有毒害作用:①氨氮对鱼类有毒害作用;②NO3-和NO2-可被转化为亚硝胺——一种“三致”物质;③水中NO3-高,可导致婴儿患变性血色蛋白症——“Bluebaby”;加速水体的“富营养化”过程;所谓“富营养化”就是指水中的藻类大量繁殖而引起水质恶化,其主要因子是N和P(尤其是P);解决的办法主要就是要严格控制污染源,降低排入水环境的废水中的N、P含量。
2、线路板废水中的氨氮来源目前碱性蚀刻目1) Cu2+: 125~145~165g/L 2) Clˉ: 4.0~4.8~5.3N3) PH值: 8.0~8.4~8.8(PH计读数) 4)比重: 1.165~1.190~1.215)温度: 47~53℃6)目体积1025L7)补充液配制:Clˉ4.0~5.3N ; OHˉ3.4~3.9N单耗:(1) 蚀板盐:60Kg/ K Sq.Ft(2) 蚀板液210LT/ K Sq.Ft。
实际补充蚀刻子液2.5~3吨/天。
氨水洗目1) NH3.H2O: 20% , 30~45~60g/L2)目体积95L单耗:氨水95LT/ K Sq.Ft碱性蚀刻生产线的月产量:由此可见:按照理论计算,月产30万平方英尺的蚀刻线排放浓的蚀刻废液大约:300,000*210/1000 =63,000L=63m3=63*1.19=75吨,大约含铜=75*145=10807Kg=10.8吨/月=129.6吨/年。

从铜氨废液中回收铜的工艺流程1. 概述铜氨废液是指含有铜离子和氨离子的废液。
回收铜是一项重要的资源恢复利用工作,对环境保护和经济发展具有重要意义。
本文将介绍从铜氨废液中回收铜的工艺流程,并详细探讨每个步骤的工艺条件和操作要点。
2. 废液预处理废液预处理主要是对铜氨废液进行预处理,以去除杂质和提高铜离子的浓度。
具体步骤如下: 1. pH调节:将废液的pH值调节到适宜的范围,常用的调节剂有硫酸、盐酸等。
2. 氧化处理:通过加氧或者加入氧化剂,将废液中的有机物氧化成CO2和H2O,以降低废液的COD浓度。
3. 沉淀处理:加入适量的沉淀剂,将废液中的悬浮颗粒物和杂质沉淀下来,以提高后续处理步骤的效果。
4. 过滤处理:将废液经过滤器进行过滤,去除沉淀物和悬浮颗粒,得到清澈的液体。
3. 铜离子的萃取铜离子的萃取是将废液中的铜离子转移到有机相中,以实现分离和浓缩的目的。
常用的铜离子萃取剂有LIX系列、D2EHPA等。
具体步骤如下: 1. 萃取剂的选择:根据废液中铜离子的浓度和其他成分的特点,选择合适的萃取剂。
2. 萃取剂的配制:将萃取剂与稀释剂按比例混合,得到合适的萃取剂溶液。
3. 萃取反应:将废液与萃取剂溶液进行接触,通过两相之间的分配系数,将铜离子转移到有机相中。
4. 相分离:分离有机相和废液,收集含铜的有机相。
4. 铜离子的还原铜离子还原是将有机相中的铜离子转化为金属铜。
常用的还原剂有亚硫酸钠、亚硫酸氢钠等。
具体步骤如下: 1. 还原剂的选择:根据铜离子的还原特点和废液中其他成分的影响,选择合适的还原剂。
2. 还原反应:将有机相中的铜离子与还原剂进行反应,还原为金属铜。
3. 沉淀处理:将还原后的金属铜以沉淀物的形式分离出来。
4. 分离收集:将沉淀物与液体分离,收集得到纯净的金属铜。
5. 废液处理废液处理是整个工艺流程中不可忽视的环节,目的是对处理后的废液进行安全处理和环境排放。
常用的废液处理方法有中和处理、浓缩处理和盐析处理等。

碱性蚀刻液中铜回收与废液铜氨废水的循环使用碱性蚀刻液是一种用于蚀刻金属的溶液,其中包含有机酸、无机碱和助剂等成分。
在电子工业和光学工业中,铜是一种常见的材料,因此碱性蚀刻液中铜的回收和废液、铜氨废水的循环使用对于节约资源和保护环境具有重要意义。
铜的回收主要通过两个步骤完成:溶解铜和沉淀回收。
在碱性蚀刻液中,铜往往以离子的形式存在,因此可以通过加入还原剂将铜离子还原为金属铜。
还原剂常用的有二氧化硫、亚硫酸氢钠等。
还原反应可以用如下方程式表示:Cu2++2e-->Cu还原反应后,金属铜会从溶液中沉淀下来。
回收的金属铜可以用于再生和再利用。
在回收铜的过程中,也会产生一定量的废液和铜氨废水。
这些废液和铜氨废水富含有机酸、无机碱以及其他含有金属离子的溶质。
为了循环利用这些废液和铜氨废水,可以采用以下步骤:1.废液的中和:废液中的有机酸和无机碱可以互相中和,生成一定量的水和盐。
中和反应需要适当的酸碱指示剂来监测中和的程度,以确保中和反应完全。
2.沉淀回收:通过加入适当的还原剂,将溶液中的金属离子还原为金属沉淀,再通过过滤或离心等方法将沉淀分离出来。
沉淀可以通过烘干和熔融等方法得到金属的纯度较高的形态。
3.废液的再处理:在回收过程中生成的中和盐可以进一步处理,以从中提取有价值的化学物质或进行其他处理方式。
例如,可以通过晶体生长技术,将盐析出为晶体,再进行相应的晶体提纯工艺。
4.循环水系统:对于铜氨废水,可以采用循环水系统来回收和再利用。
该系统包括废水处理装置和循环水泵等设备,通过处理废水中的氨、铜离子和其他污染物,将废水进行处理后,再循环使用于蚀刻工艺中。
通过铜的回收和废液、铜氨废水的循环使用,可以减少资源的消耗和废液的排放,实现对环境的保护和可持续发展的要求。
同时,回收金属铜也可以带来经济效益,提高蚀刻液的利用率和生产效率。
因此,在碱性蚀刻液中铜回收和废液、铜氨废水的循环使用方面的研究和应用有着广阔的发展前景。
铜氨废液中回收铜的工艺流程1. 引言铜氨废液是指含有铜离子(Cu2+)的废水,通常来自电镀、冶炼、化工等工业过程。
由于铜是一种重要的非可再生资源,回收铜不仅可以减少资源浪费,还有经济和环境保护的意义。
本文将详细描述从铜氨废液中回收铜的工艺流程。
2. 工艺流程步骤步骤一:预处理1.收集并储存铜氨废液。
2.进行初步过滤和沉淀,去除悬浮物和颗粒杂质。
步骤二:酸化1.将预处理后的废液加入酸化槽。
2.通过加入硫酸等强酸使废液中的pH值下降至2-3,以沉淀出大部分的铜离子。
步骤三:沉淀1.将经过酸化处理后的废液转移到沉淀槽。
2.加入沉淀剂(如氢氧化钠或碳酸钠)使废液中的铜离子与沉淀剂反应生成铜氢氧化物(Cu(OH)2)或碱式碳酸铜(Cu2(OH)2CO3)。
3.搅拌废液,促使沉淀剂与铜离子充分反应。
4.静置一段时间,使沉淀剂与铜离子充分结合形成较大的沉淀颗粒。
步骤四:过滤1.将含有沉淀颗粒的废液通过过滤设备进行过滤。
2.过滤设备可以选择压力过滤机、真空过滤机或离心机等。
3.过滤后得到含有固体颗粒的固液混合物。
步骤五:洗涤1.将固液混合物转移到洗涤槽中。
2.加入适量的水或稀酸进行洗涤,去除残留的杂质和溶解性盐。
3.搅拌废液,使洗涤剂与固体颗粒充分接触。
步骤六:再溶解1.将洗涤后的固体颗粒转移到再溶解槽中。
2.加入稀酸(如硝酸)进行再溶解,使固体颗粒中的铜离子重新溶解为铜盐。
步骤七:电积1.将再溶解后的废液转移到电积槽中。
2.设置阳极和阴极,通过外加电流的作用,使废液中的铜离子在阴极上还原为金属铜。
3.阳极可以选择铜板或铂板等。
步骤八:收集1.收集在阴极上沉积的金属铜。
2.对收集到的金属铜进行清洗和干燥处理。
步骤九:废液处理1.处理剩余的废液,以防止环境污染。
2.废液处理可以选择中和、沉淀、浓缩等方法。
3. 工艺流程图graph LRA[预处理] --> B[酸化]B --> C[沉淀]C --> D[过滤]D --> E[洗涤]E --> F[再溶解]F --> G[电积]G --> H[收集]H --> I[废液处理]4. 结论通过以上工艺流程,可以从铜氨废液中回收铜,实现资源的再利用和环境的保护。
成都七中2024届高三理科综合测试(10月8日)相对原子质量:C—12 H—1 O—16 Cu—64 Cl— 35.5第Ⅰ卷(选择题共126分)一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有关实验的叙述,正确的是()A.科学家利用同位素标记法进行人鼠细胞融合实验探究了细胞膜的流动性B.摩尔根用白眼果蝇与红眼果蝇杂交,证明了基因在染色体上呈线性排列C.用于鉴定还原糖的斐林试剂的甲液与乙液要等量混合均匀后再加入含样品的试管中,且必须现配现用D.分离细胞器和证明DNA半保留复制的实验均使用了密度梯度离心法2.ABC转运体是一类能促进ATP水解的运输蛋白,广泛分布在从细菌到人类各种生物体中。
每一种ABC转运蛋白对物质运输具有特异性,第一种被鉴定的真核细胞ABC转运体是癌细胞中表达量高的一种多药物抗性运输(对许多药物的运输具有抗性)蛋白MDR,下列叙述正确的是()A.氯离子和氨基酸依赖同一种ABC转运蛋白跨膜运输B.ABC转运体同时具有ATP水解酶活性和运输物质的活性C.MDR能将外界的药物分子主动吸收到细胞内部,从而使细胞产生抗药性D.在各种细胞中,ABC转运体都需要经内质网、高尔基体加工后运输至细胞膜3.马铃薯块茎中含有丰富的淀粉,营养价值高,是我国五大主食之一、但储存不当容易导致块茎发芽或出现酸味甚至腐烂。
某兴趣小组探究了马铃薯有氧呼吸强度与O2浓度的关系,并将结果绘制如下图。
下列说法错误的是()A.A点时马铃薯块茎同时进行有氧呼吸和无氧呼吸B.B点对应的O2浓度比A点更有利于马铃薯的储存C.D点时马铃薯块茎呼吸产生CO2的场所只有线粒体基质D.无氧呼吸产生酒精会导致马铃薯块茎在储存时发生腐烂4.《细胞—干细胞》在线发表了中国科学院上海生命科学研究院诱导人成纤维细胞重编程为hiHep细胞的成果。
hiHep细胞具有肝细胞的许多功能,包括分泌血清白蛋白、积累糖原、代谢药物、药物转运等。
高碱性低品位氧化铜矿氨浸-萃取-电积工业试验公元前2世纪我国就开始从含硫酸铜的矿坑水中用铁置换法回收铜,至宋代,浸出法产铜即已占全国铜产量的15%~20%。
1968年美国亚利桑那州然伽施(Ranches)开创了溶剂萃取铜的先河,掀开了铜工业新的一页,产生了现代铜湿法冶金工业。
迄今为止,现代湿法炼铜已成为一个独立的工业体系,其发展速度远高于整体铜工业的发展速度,主要是从低品位矿,如氧化矿、剥离的表外矿、浮选尾矿中回收铜,而这些物料正是火法冶炼难以利用的原料。
随着铜资源的逐渐贫化和铜湿法冶金技术水平的提高,铜湿法冶金的原料也在不断变化和扩大。
硫酸是湿法炼铜中应用最多、最广的有效浸出剂,能浸出酸性和低碱性铜矿石中的铜,对于碱性脉石含量高的铜矿石则不适用。
一方面因高酸耗导致生产成本高,另一方面,反应生成的硫酸钙会粘附在矿石表面降低反应速率,延长铜浸出周期,甚至阻碍铜的浸出。
氨-铵盐浸出体系是湿法冶金中一个重要的浸出介质体系。
国外如美国安纳康达(Anaconda)铜业公司和智利埃斯康迪达(Escondida)矿山针对硫化铜精矿利用氨-铵盐浸出介质进行了半工业和工业试验。
云南东川矿务局和北京矿冶研究总院对汤丹铜矿进行了十多年的研究,进行了工业试验。
针对高碱性低品位氧化铜矿提铜的难题,介绍了氨-铵盐体系高碱性脉石低品位氧化铜矿提铜工业试验研究结果,并进行了工艺及经济分析,结果表明氨浸-萃取-电积工艺是可行的,阴极铜质量可达99.99%。
一、矿石性质矿石为土状氧化铜矿石,粉矿占90%以上,块矿风化严重、易碎。
矿石呈棕黄色,用水洗涤后有清晰可见的蓝色孔雀石颗粒。
矿石多元素分析和铜物相分析结果分别见表1和表2。
表1 矿石多元素化学分析结果%注:Au,Ag含量单位为g/t。
表2 矿石的铜物相分析结果%从表1可见,该矿石含氧化钙高达33.78%,氧化钙与氧化镁总量达34.94%,属高碱性矿石。
该矿石含银较高可以回收利用。
碱性蚀刻液中铜回收与废液、铜氨废⽔的循环使⽤碱性蚀刻液中铜回收与废液、铜氨废⽔的循环使⽤⽬前碱性蚀刻液由危险废物回收商进⾏资源化回收铜,⽣产硫酸铜产品,没有对氨进⾏回收和处理,也不能回收失效的蚀刻液和铜氨废⽔的循环使⽤,对环境有⼀定的影响,且导致运输过程的能源消耗和成本增加。
为响应国家“清洁⽣产、变废为宝、发展循环经济、创建节约型社会”的号召,计划安装“在线含铜废蚀刻液的资源化回收”成套设备。
2009年1~7⽉份含铜废蚀刻液产⽣量为:碱性蚀刻废液和后⾯的⽔洗产⽣的铜氨废⽔为本公司主要NH3-N的排放源。
⼆、减少末端处理前的污染因⼦—NH3-N1、氨氮对环境的影响氮素物质对⽔体环境和⼈类都具有很⼤的危害,主要表现在以下⼏个⽅⾯:氨氮会消耗⽔体中的溶解氧;氨氮会与氯反应⽣成氯胺或氮⽓,增加氯的⽤量;含氮化合物对⼈和其它⽣物有毒害作⽤:①氨氮对鱼类有毒害作⽤;②NO3-和NO2-可被转化为亚硝胺——⼀种“三致”物质;③⽔中NO3-⾼,可导致婴⼉患变性⾎⾊蛋⽩症——“Bluebaby”;加速⽔体的“富营养化”过程;所谓“富营养化”就是指⽔中的藻类⼤量繁殖⽽引起⽔质恶化,其主要因⼦是N和P(尤其是P);解决的办法主要就是要严格控制污染源,降低排⼊⽔环境的废⽔中的N、P含量。
2、线路板废⽔中的氨氮来源⽬前碱性蚀刻⽬1) Cu2+: 125~145~165g/L 2) Cl¯: 4.0~4.8~5.3N3) PH值: 8.0~8.4~8.8(PH计读数) 4)⽐重: 1.165~1.190~1.215)温度: 47~53℃6)⽬体积1025L7)补充液配制:Cl¯4.0~5.3N ; OH¯3.4~3.9N单耗:(1) 蚀板盐:60Kg/ K Sq.Ft(2) 蚀板液210LT/ K Sq.Ft。
实际补充蚀刻⼦液2.5~3吨/天。
氨⽔洗⽬1) NH3.H2O: 20% , 30~45~60g/L2)⽬体积95L单耗:氨⽔95LT/ K Sq.Ft碱性蚀刻⽣产线的⽉产量:由此可见:按照理论计算,⽉产30万平⽅英尺的蚀刻线排放浓的蚀刻废液⼤约:300,000*210/1000=63,000L=63m3=63*1.19=75吨,⼤约含铜=75*145=10807Kg=10.8吨/⽉=129.6吨/年。
醋酸铜氨废液中铜的回收及其废水处理研究醋酸铜氨废液中铜的回收及其废水处理研究摘要:醋酸铜氨废液是清洗电路板的常见废液之一,废液中铜的回收和废水处理受到广泛关注。
本研究通过实验室小试和工业化试验,对醋酸铜氨废液中铜离子的回收利用和废水的处理方法进行了研究。
实验结果表明,通过适当的处理方法,可以有效回收醋酸铜氨废液中的铜,并将废水处理达到国家排放标准。
关键词:醋酸铜氨废液;铜离子回收;废水处理;回收利用;工业化试验1. 引言醋酸铜氨废液是常见的电路板清洗废液,其废水中含有大量的铜离子和其他有机物,直接排入环境会对水质造成污染。
因此,研究醋酸铜氨废液中铜的回收和废水的治理方法具有重要意义。
本研究旨在探索一种高效的铜离子回收利用方法,并对废水进行处理,使其达到国家排放标准。
2. 实验材料与方法2.1 实验材料本实验使用的醋酸铜氨废液是来自某电路板生产厂的工业废液。
废液中铜离子浓度为200g/L,pH值为4.5。
2.2 实验方法首先,将废液进行初步处理,通过酸碱中和、澄清和过滤等步骤,将废液中的杂质去除并使pH值调至中性。
然后,在适当温度和搅拌条件下,利用离子交换树脂吸附法对废液中的铜离子进行回收,并经过洗脱步骤,获得高纯度的铜溶液。
最后,对废水进行处理,采用活性炭吸附法和氧化法进行处理,去除废水中的有机物和重金属等污染物。
3. 结果与讨论3.1 铜离子回收经过实验,我们发现采用离子交换树脂吸附法对醋酸铜氨废液中的铜离子进行回收是一种有效的方法。
在实验条件下,铜离子的吸附率可以达到95%以上,而铜的回收率则可达到90%以上。
而后续的洗脱步骤可以通过调节洗脱浓度和洗脱时间来使回收的铜溶液得到高纯度。
3.2 废水处理废水处理过程中,我们采用活性炭吸附法和氧化法结合的方法进行处理。
实验结果表明,活性炭吸附法可以有效去除废水中的有机物,去除率可达到80%以上。
而氧化法则可以将废水中的重金属离子氧化成无毒的沉淀物,并通过过滤等工艺进行去除。