温度对反应速率的影响
- 格式:ppt
- 大小:3.47 MB
- 文档页数:40

反应速率与温度的关系引言:反应速率是指单位时间内反应物消失或产物生成的数量与时间的比值。
在化学反应中,温度是影响反应速率的重要因素之一。
本文将探讨反应速率与温度之间的关系,以及其背后的科学原理。
1. 温度对反应速率的影响1.1 温度升高引发反应速率增加的原因随着温度升高,反应物分子的平均动能增加,分子碰撞频率增加,碰撞过程中的能量也越大。
这导致更多的反应物分子能够克服反应的活化能,从而使反应发生的机会增加,进而加速反应速率。
1.2 温度对反应速率的影响符合阿伦尼乌斯方程根据阿伦尼乌斯方程,反应速率与温度的关系可以用以下公式表示:k = A * e^(-Ea/RT)其中,k为反应速率常数,A为阿伦尼乌斯因子,Ea为反应的活化能,R为气体常数,T为温度(单位为开尔文)。
该方程表明,随着温度的升高,反应速率常数也会增加。
2. 实例证明反应速率与温度的关系2.1 水中的氧化反应考虑水中的氧化反应:2H₂O₂ → 2H₂O + O₂在不同温度下,用相同浓度的氧化剂H₂O₂溶液进行反应,测量生成的氧气体积。
结果显示,在较高温度下,氧气的生成速率更快,反应速率更高。
2.2 燃烧反应以丙酮酒精灯的燃烧反应为例:C₃H₆O + 4O₂ → 3CO₂ + 3H₂O在不同温度下操作,发现随着温度的升高,反应的火焰变得更明亮,丙酮完全燃烧的速率也增加。
3. 反应速率与温度的控制与应用3.1 利用温度控制反应速率在实际化学生产中,温度常常被用来控制反应速率。
通过提高温度,可以加速反应过程,提高产率和工艺效率。
相反,降低温度可以降低反应速率,有助于控制副反应或减缓反应速度。
3.2 温度变化对食物烹饪的影响在烹饪过程中,根据食材的不同,合理地调节温度可以达到最佳的烹调效果。
高温可以促使食物快速熟化,增加味道和质地的变化。
低温则可以保持食材的营养价值和口感。
结论:温度是影响化学反应速率的重要因素,温度升高可以导致反应速率增加。

化学反应速率与温度的关系化学反应速率是指单位时间内反应物消耗或产物生成的量。
在化学反应中,温度是影响反应速率的重要因素之一。
本文将探讨化学反应速率与温度之间的关系,并解释其背后的科学原理。
1. 温度对反应速率的影响反应速率与温度之间存在着密切的关系。
一般来说,提高温度会增加反应速率,而降低温度则会减慢反应速率。
这是因为温度的升高会增加反应物分子的热运动速度,使其具有更大的碰撞能量,从而促进反应发生。
2. 碰撞理论碰撞理论是解释温度对反应速率影响的重要理论基础。
根据碰撞理论,只有具有足够能量的分子碰撞才能引发化学反应。
提高温度会增加分子的平均动能,使更多的分子具有足够的能量来克服反应物之间的吸引力,从而增加有效碰撞的频率。
3. 温度对反应活化能的影响反应活化能是指反应物分子在反应中必须克服的能垒。
提高温度可以降低反应活化能,使反应物分子更容易达到或超过临界能量,从而促进反应发生。
这是因为温度的升高会增加分子的平均动能,使分子更容易具有克服反应活化能所需的能量。
4. 温度对反应速率常数的影响反应速率常数是描述反应速率的物理量,它与反应速率成正比。
根据阿累尼乌斯方程,反应速率常数随着温度的升高而增加。
这是因为温度的升高会增加分子的平均动能,使更多的分子具有达到或超过临界能量的能力,从而增加反应速率。
5. 温度对化学平衡的影响化学反应达到平衡时,反应物和生成物的浓度保持不变。
根据勒夏特列原理,温度的升高会导致反应平衡向反应物或生成物的方向移动。
这是因为温度的升高会改变反应物和生成物的摩尔热力学性质,从而影响化学平衡。
6. 温度对催化剂的影响催化剂是能够加速化学反应速率的物质。
温度对催化剂的活性具有重要影响。
一般来说,提高温度可以增加催化剂的活性,从而加速反应速率。
这是因为温度的升高会增加催化剂表面上的反应活性位点,使其更容易吸附反应物分子并促进反应发生。
7. 温度对反应选择性的影响反应选择性是指在复合反应中,不同反应路径的选择程度。



温度对反应速率的影响及其动力学解释在化学反应中,温度是一个非常重要的因素,它对反应速率有着显著的影响。
本文将探讨温度对反应速率的影响,以及背后的动力学解释。
一、温度对反应速率的影响温度是物质内部分子热运动的体现,高温意味着分子的热运动更加剧烈。
对于大多数化学反应来说,高温下反应速率会显著增加。
1. 反应速率与能量活化在化学反应中,反应物需要克服能量壁垒才能转化为产物。
这个能量壁垒称为能量活化。
随着温度的升高,反应物分子的动能增加,碰撞的力量增大,从而有更大的概率克服能量活化,速率也就提高了。
2. 碰撞频率的增加反应速率与反应物分子的碰撞频率有关。
温度升高,分子的平均动能增加,分子的平均速率也加快,这就导致了更频繁的碰撞。
更频繁的碰撞意味着反应速率的增加。
二、动力学解释为了更深入地理解温度对反应速率的影响,我们可以从动力学的角度进行解释。
1. 阿伦尼乌斯方程根据化学动力学理论,反应速率与反应物的浓度有关。
阿伦尼乌斯方程描述了反应速率与反应物浓度的关系:v = k[A]^m[B]^n其中,v代表反应速率,k是速率常数,[A]和[B]分别代表反应物A和B的浓度,m和n是反应级数。
当温度增加时,速率常数k会随之增加。
这是因为高温下分子的碰撞更加频繁,更多的碰撞会导致更多的有效碰撞,从而增加反应速率。
2. 碰撞理论碰撞理论认为,化学反应发生的前提是分子之间的碰撞。
只有当反应物分子碰撞时,反应才有可能发生。
温度升高会增加分子的动能,使得分子碰撞的能量更高,也会促进反应的发生。
此外,碰撞理论还指出,只有一部分碰撞具有足够的能量来克服能量活化,这些碰撞被称为有效碰撞。
随着温度的升高,有效碰撞的概率也会增加,从而提高反应速率。
三、温度对反应速率的应用温度对反应速率的影响具有重要的应用价值。
在工业生产中,合理控制温度有助于提高反应速率,提高产品产量。
此外,在生物体内,许多生化反应也受到温度的影响。
生物体往往会通过调节体温来加快或减缓特定的生化反应。

化学反应速率与温度的关系及实验结果的处理技巧化学反应速率与温度的关系一直以来都是化学实验研究的一个重要方面。
温度是影响反应速率的主要因素之一,了解并研究温度对反应速率的影响,对于化学实验的设计和结果的处理具有重要的指导意义。
本文将会详细探讨温度对反应速率的影响,并提供一些实验结果处理技巧。
一、温度对反应速率的影响在化学反应中,温度对反应速率起到了至关重要的作用。
一般来说,温度的升高会导致反应速率的增加,而温度的降低则会使反应速率减小。
这是因为在高温下,反应物的分子会更具活动性,反应物分子的平均能量也会增加,从而更容易发生有效碰撞,使得反应速率增加。
具体而言,一般来说,当温度升高10摄氏度时,反应速率大约会增加两到三倍。
这是由于温度升高会导致反应物分子的平均动能增加,反应物分子的动能超过反应物之间的键能时,就会发生反应。
因此,高温下反应分子的平均动能增加,有效碰撞的概率也随之增加,从而使得反应速率提高。
二、实验结果的处理技巧在进行化学实验时,我们需要对实验结果进行处理和分析,以提取有用的信息并得出有意义的结论。
在研究温度对反应速率的影响时,以下是一些关于实验结果处理的技巧。
1. 统计数据处理:在实验中,我们通常会收集多个数据点,涉及不同温度条件下的反应速率。
为了得出可靠的结论,我们需要对这些数据进行统计处理。
常见的统计方法包括计算平均值、标准偏差和误差分析等。
这些统计数据可以帮助我们了解数据的稳定性和可靠性,从而提高实验结果的准确性。
2. 绘制图表:通过将实验数据绘制成图表,可以更直观地展示温度对反应速率的影响。
一般来说,我们可以将温度作为自变量,反应速率作为因变量,在坐标轴上进行绘制。
这样的图表可以帮助我们观察和比较不同温度下的反应速率变化趋势,进一步分析温度与反应速率之间的关系。
3. 曲线拟合和斜率计算:通过对实验数据进行曲线拟合和斜率计算,可以更准确地描述温度与反应速率之间的数学关系。
对于呈现出线性关系的数据,我们可以使用线性拟合方法,确定温度与反应速率之间的直线关系。
6.3 温度对反应速率的影响6.3.1 范特霍夫(Van ′t Hoff )经验规则温度对反应速率的影响很大。
1884年,范特霍夫根据实验事实总结出一条近似规则:温度每升高10K ,反应速率大约增至原来的2~4倍,即TT k k 10+=2~4 (1)如果不需要精确的数据或手边数据不全,则可根据这个规则粗略地估计温度对反应速率的影响。
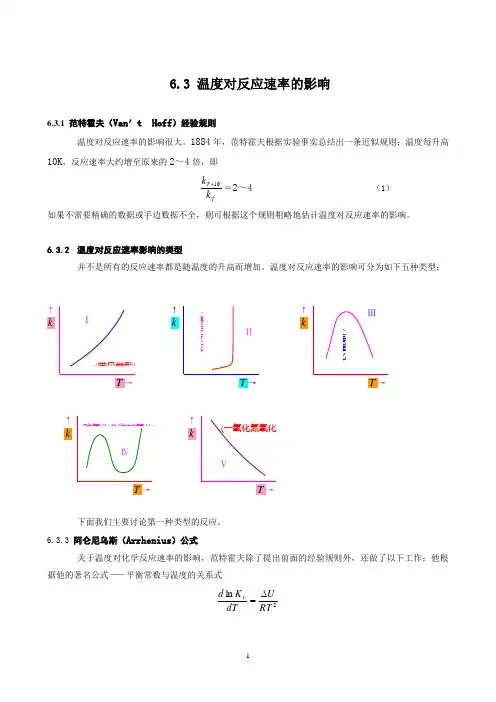
6.3.2 温度对反应速率影响的类型并不是所有的反应速率都是随温度的升高而增加。
温度对反应速率的影响可分为如下五种类型:下面我们主要讨论第一种类型的反应。
6.3.3 阿仑尼乌斯(Arrhenius )公式关于温度对化学反应速率的影响,范特霍夫除了提出前面的经验规则外,还做了以下工作:他根据他的著名公式-平衡常数与温度的关系式2ln RTUdT K d c ∆= (爆炸反应)↑ kT → Ⅱ↑ kT →Ⅲ(酶催化)↑ k T → Ⅰ(常见类型)(碳氢化合物的氧化) ↑kT → Ⅳ↑ kT →Ⅴ(一氧化氮氧化借助于气相对峙反应的平衡常数与正逆反应的速率常数的关系11-=k k K c ,导出 211ln ln RT UdT k d dT k d ∆=--(2)如果把反应的内能变化看作是两项表征某种特殊性质的能量之差,即-+-=∆E E U ,则式(2)可写为2211ln ln RTERT E dT k d dT k d -+--=-(3)此式可拆开写成分别属于正、逆反应的两个式子:B RTEdT k d +=+21lnB RTEdT k d +=--21ln (4)这就是范特霍夫推测出来的速率常数与温度的关系式,但他没有解释公式中+E 、-E 和B 的物理意义。
1889年,阿仑尼乌斯在范特霍夫等人研究的基础上,实验测得了许多化学反应的速率常数与温度关系的数据,以k ln 对T1作图,结果都得直线,直线的斜率因反应的不同而不同,但都小于零,即b T d kd =⎪⎭⎫ ⎝⎛1ln <0 即2ln TbdT k d -=>0 (5)阿仑尼乌斯根据式(5)得知范特霍夫的推测式(4)中的,0=B REb -=。

反应速率与温度在化学反应中,反应速率是描述反应过程快慢的一个重要指标,而温度则是影响反应速率的主要因素之一。
本文将探讨反应速率与温度之间的关系,以及温度对反应速率的影响机制。
一、反应速率与温度的关系1.1 温度对反应速率的影响根据反应速率理论,温度的增加可以提高反应速率。
这是因为在较高的温度下,分子和离子的平均动能增加,碰撞频率和能量也随之增加,从而加快反应物粒子之间的有效碰撞,进而增加反应速率。
1.2 反应速率常数与温度的关系根据阿伦尼乌斯方程(Arrhenius equation),反应速率常数k与温度之间成正比关系。
阿伦尼乌斯方程可表示为:k = A * exp(-Ea/RT)其中,k为反应速率常数,A为指前因子(pre-exponential factor),Ea为活化能(activation energy),R为气体常数,T为温度。
该方程表明,随着温度的升高,反应速率常数也会增大。
二、温度对反应速率的影响机制2.1 动能分布和平均动能在较低的温度下,反应物粒子的动能分布较窄,只有少数高能粒子具备足够的能量克服反应的活化能,因此反应速率较低。
而在较高的温度下,动能分布变得更加宽泛,更多的粒子具备足够的能量,可以更容易地碰撞并发生反应,从而提高反应速率。
2.2 反应的活化能活化能是指在反应中,反应物必须克服的能垒,才能转化为产物。
活化能的来源包括反应物之间的碰撞和形成中间态等。
提高温度可以增加反应物的平均动能,使分子更容易达到活化能,从而加快反应速率。
2.3 碰撞频率和有效碰撞反应速率的增加在于增加反应物粒子的碰撞频率和提高碰撞的有效性。
温度的升高可以增加分子的平均速度,加快粒子之间的碰撞频率。
同时,温度的升高还使碰撞的能量增加,增加了碰撞的有效性,使更多的碰撞具有足够的能量来发生反应。
三、实验观察与应用实验表明,温度对反应速率的影响具有普适性。
许多化学反应都能够观察到温度增加时反应速率的增加。

反应速率与温度温度对反应速率的影响反应速率与温度:温度对反应速率的影响反应速率是描述化学反应中物质转化的快慢程度的指标之一。
温度是影响反应速率的重要因素之一。
本文将探讨温度对反应速率的影响,并分析其中的原因。
一、引言在化学反应中,反应速率是指单位时间内反应物消失或产物产生的量。
反应速率通常取决于多种因素,如物质浓度、化学键能、反应物间障碍等。
其中,温度是影响反应速率最显著的因素之一。
二、温度与反应速率的关系1. 温度升高会使反应速率增加温度升高会导致反应物分子的平均动能增大,从而增加碰撞发生的概率和能量。
根据反应速率理论,反应速率与反应物分子碰撞的频率和能量有关。
因此,温度升高会促进反应物分子的碰撞频率和能量,进而提高反应速率。
2. 温度升高会改变反应物分子的分布在反应物分子的分布中,存在着一部分分子具有高于平均能量的状态,称为“活跃分子”。
随着温度的升高,活跃分子的比例将增加。
这是因为,在高温下分子的平均动能增大,不同分子动能的分布也会发生变化。
因此,温度升高会增加活跃分子的数量,从而促进反应速率的提高。
3. 温度升高会改变反应物分子的反应途径反应物分子在反应过程中需要克服一定的能垒。
温度升高会增加反应物分子的平均能量,使得局部能垒降低,从而改变了反应物分子的反应途径。
在某些情况下,这种改变可能会导致反应速率的增加。
三、温度与反应速率的实验验证实验方法:取相同浓度的反应物溶液,分别在不同温度下进行反应,并记录反应速率。
实验结果:经过实验观察和记录,发现在相同浓度下,反应温度越高,反应速率越快。
四、温度与反应速率的应用1. 工业生产中的反应速率控制根据温度与反应速率的关系,工业生产中可以通过调节反应温度来控制反应速率。
当需要加快反应速率时,可以提高反应温度;相反,当需要减慢反应速率时,可以降低反应温度。
2. 优化反应条件温度是影响反应速率的一个重要因素,因此在反应条件优化的过程中,合理选择和控制反应温度对于提高反应效率和产品纯度都具有重要意义。

化学反应速率与温度的变化规律化学反应速率与温度之间存在着密切的关系,温度的变化可以对化学反应速率产生显著的影响。
本文将探讨化学反应速率与温度的关系,并分析温度变化对反应速率的影响规律。
一、温度对反应速率的影响对于多数化学反应而言,温度的升高会导致反应速率的增加。
这可以通过两个方面进行解释。
首先,温度的升高会提高分子的平均动能,使分子具有更大的撞击能量。
根据碰撞理论,只有当分子撞击具有足够的能量时,才能跨越能垒,进而发生反应。
其次,温度的升高也可以增加反应物分子的碰撞频率,因为分子的热运动会变得更加激烈,使得分子之间的相对速率增大。
二、反应速率与温度变化的规律根据实验观察得知,当反应物浓度固定时,反应速率随着温度的升高而迅速增加。
反应速率与温度之间存在着一种指数关系,即在一定范围内,温度每升高10摄氏度,反应速率大致翻倍。
这可以用下面的公式来表示:k2 = k1 * (T2/T1)^n其中k1和k2分别表示两个不同温度下的反应速率常数,T1和T2分别表示两个不同温度,n表示反应速率与温度之间的倍数关系。
三、活化能与反应速率的关系在反应过程中,分子需要克服能垒才能发生反应,而这个能垒就是活化能。
活化能是指单位物质在反应中发生转变的最小能量。
在理论上,只有当反应物分子的能量大于等于活化能时,反应才能发生。
通过草图可以看出,活化能决定了反应速率的高低。
温度的升高可以提供更多的分子具备大于等于活化能的能量,从而增加反应速率。
换句话说,温度的升高降低了反应物分子对活化能的需求,使得更多的反应物分子能够成功地克服能垒,进而发生反应。
四、变温反应速率常数与Arrhenius方程根据Arrhenius方程,温度对反应速率常数的影响可以用以下公式表示:k = A * exp(-Ea/RT)其中k表示反应速率常数,A表示碰撞频率因子,Ea表示活化能,R表示气体常数,T表示温度。
该方程说明了温度对反应速率常数的指数关系。
§9.5 温度对反应速率的影响(1) 阿累尼乌斯经验公式前面讨论浓度对反应速率的影响时都以温度一定为前提,现在来讨论温度对反应速率的影响时,也需把浓度的影响消除,所以通常都是讨论速率常数k 随温度的变化。
温度对反应速率的影响比浓度的影响更为显著,一般说来反应的速率常数随温度的升高而很快增大。
关于速率常数k 与反应温度T 之间的定量关系,早在19世纪末,阿累尼乌斯(Arrhenius)等人总结了大量的实验数据提出了下述经验公式2ln a E d kdTRT = (9.24) 式中的E a 称为“实验活化能”,一般可将它看作与温度无关的常数,其单位为J ⋅mol -1或kJ ⋅mol -1。
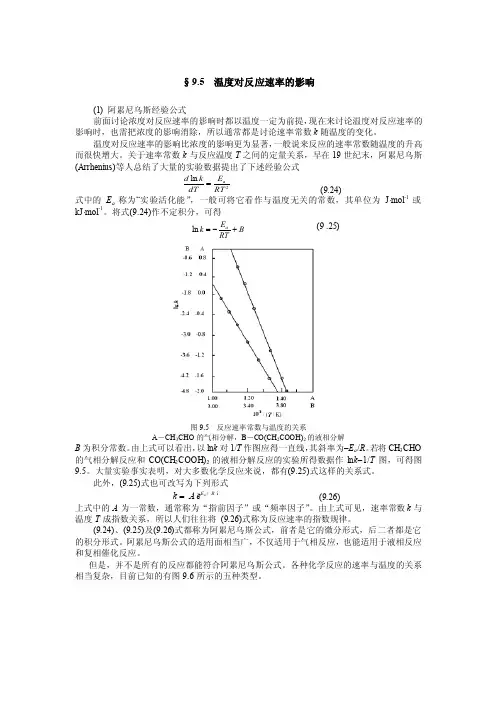
将式(9.24)作不定积分,可得B RTEk a +-=ln (9 .25)图9.5 反应速率常数与温度的关系A -CH 3CHO 的气相分解,B -CO(CH 2COOH)2的液相分解B 为积分常数。
由上式可以看出,以ln k 对1/T 作图应得一直线,其斜率为-E a /R 。
若将CH 3CHO 的气相分解反应和CO(CH 2COOH)2的液相分解反应的实验所得数据作ln k -1/T 图,可得图9.5。
大量实验事实表明,对大多数化学反应来说,都有(9.25)式这样的关系式。
此外,(9.25)式也可改写为下列形式/a E R Tk A e -= (9.26) 上式中的A 为一常数,通常称为“指前因子”或“频率因子”。
由上式可见,速率常数k 与温度T 成指数关系,所以人们往往将 (9.26)式称为反应速率的指数规律。
(9.24)、(9.25)及(9.26)式都称为阿累尼乌斯公式,前者是它的微分形式,后二者都是它的积分形式。
阿累尼乌斯公式的适用面相当广,不仅适用于气相反应,也能适用于液相反应和复相催化反应。
但是,并不是所有的反应都能符合阿累尼乌斯公式。
各种化学反应的速率与温度的关系相当复杂,目前已知的有图9.6所示的五种类型。
温度对反应速率的影响温度是化学反应速率的重要影响因素之一。
通过调节温度可以对反应速率进行控制。
本文将探讨温度对反应速率的影响,并分析其中的原因。
一、温度提高导致反应速率加快当温度升高时,大部分反应速率会显著加快。
这是因为温度的升高能够提供更多的能量,使得分子在碰撞时具有更高的活动性和更大的能量。
这些高能分子碰撞会更加频繁和有效率,从而加快反应的进行。
二、活化能的降低温度升高能够降低活化能,进而加快反应速率。
活化能是指反应开始前,分子之间必须达到的最低能量状态。
当温度升高时,分子的平均动能增加,使得更多的分子能够达到活化能,从而增加反应发生的概率,加快反应速率。
三、温度对反应的速率常数的影响根据阿伦尼乌斯方程,反应速率常数与温度成指数关系。
即:k = A * exp(-Ea/RT),其中k为反应速率常数,A为指前因子,Ea为活化能,R为气体常量,T为温度。
由此可见,温度的升高将导致反应速率常数的增加。
四、反应速率与温度的关系曲线一般来说,反应速率与温度呈正相关。
当温度升高,反应速率也随之增加,但是当温度超过一定阈值后,反应速率开始下降。
这是因为当温度过高时,反应物分子过分激动,乃至分解,导致反应速率下降。
五、应用与实践温度对反应速率的影响在化学工业中具有重要的应用。
例如,在某些化学反应过程中,需要快速获得产物,可以通过提高温度来加快反应速率。
另外,在有机合成中,通过调节温度,可以选择得到不同的产物,实现对反应过程的控制。
在实验室中,温度控制是常见的实验技术之一。
通过在不同温度下进行反应,可以获得反应速率与温度的关系曲线,进一步了解反应动力学规律。
总结:温度对反应速率有显著的影响。
温度升高可以加快反应速率,主要原因是由于能量的提供使得分子具有更高的活动性,从而增加碰撞的频率和能量。
此外,温度升高还能够降低活化能,增加反应发生的概率。
然而,温度过高也可能导致反应速率下降。
探究温度对反应速率的影响不仅有助于理解化学反应的动力学规律,也具有广泛的应用前景。
化学反应中的温度对反应速率的影响温度是影响化学反应速率的重要因素之一。
在化学反应中,改变温度可以显著影响反应的速率。
本文将探讨温度对反应速率的影响,并探讨其原因和实际应用。
1. 温度与反应速率的关系温度对反应速率有着显著的影响。
一般而言,随着温度的升高,反应速率将增加。
这可以通过以下实验观察来验证。
实验:在相同的反应物浓度条件下,将两个反应容器分别加热至不同温度,观察反应速率的差异。
观察结果:在高温条件下,反应速率较快,反应物迅速消耗,产物迅速生成。
而在低温条件下,反应速率较慢,反应物消耗和产物生成的过程较为缓慢。
2. 温度对反应速率的原因温度对反应速率的影响主要是由于分子动能的改变。
随着温度的升高,反应物分子的动能增加,分子之间的碰撞频率和碰撞能量也相应增加。
在反应过程中,反应物分子需要克服一定的能垒才能发生有效碰撞和反应。
温度的增加会提高反应物分子动能分布的平均值,使更多的分子能够具备足够的能量以克服能垒,从而增加有效碰撞的发生率,加快反应速率。
此外,温度升高还会导致反应物分子的平均速度增加,分子之间的碰撞频率也随之增加。
这也会增加反应速率,因为更多的碰撞将导致更多的反应。
3. Arrhenius方程Arrhenius方程是描述温度对反应速率的定量关系的数学表达式。
Arrhenius方程如下所示:k = A * exp(-Ea/RT)其中,k是反应速率常数,A是预指数因子,Ea是反应物质的活化能,R是气体常数,T是温度。
从Arrhenius方程可以看出,温度的增加会使反应速率常数k增大,进而加快反应速率。
这再次强调了温度对反应速率的重要作用。
4. 温度对反应速率的实际应用温度对反应速率的影响在许多实际应用中都有重要意义。
例如,在化学工业中,许多反应需要控制在一定的速率范围内进行。
通过调节温度,可以实现反应速率的调控,以满足工业需求。
另外,温度对药物代谢速率的影响也是医药领域关注的焦点。
医药研究人员需要了解温度对药物代谢的影响,以设计出更合理的药物剂量和给药方式。
化学反应速率与温度影响在化学领域中,反应速率是指化学反应在单位时间内发生的变化。
温度是影响化学反应速率的重要因素之一。
本文将探讨化学反应速率与温度之间的关系,并介绍其中的影响机理。
1. 温度对反应速率的影响温度对化学反应速率具有显著的影响。
一般而言,增加温度会加速化学反应速率,而降低温度则会减慢反应速率。
这是因为温度的升高增加了反应物分子的平均动能,使得分子间碰撞的频率和能量都增加,从而增加了反应发生的可能性。
2. 阿伦尼乌斯方程化学反应速率与温度之间的关系可以用阿伦尼乌斯方程来描述。
阿伦尼乌斯方程表示为:k = Ae^(-Ea/RT)其中k为反应速率常量,A为频率因子,Ea为活化能,R为理想气体常数,T为反应温度。
该方程证明了温度对反应速率的直接影响。
3. 温度对反应速率常数的影响根据阿伦尼乌斯方程,温度的升高会导致反应速率常数的增加。
随着温度的增加,分子的平均动能增加,活化能变得更容易被克服,使得反应更容易发生。
因此,随着温度的升高,反应速率常数的值会增加。
4. 温度与反应速率的关系图示为了更直观地理解温度与反应速率之间的关系,我们可以绘制一个温度-反应速率曲线。
这个曲线通常呈指数形式递增,随着温度的升高而增加。
温度每增加10摄氏度,反应速率常数大约增加2倍至3倍。
5. 温度变化对反应平衡的影响温度的变化不仅会对反应速率产生影响,还会对反应平衡产生一定的影响。
在一个反应达到平衡时,正向反应和逆向反应速率相等。
根据勒沃里耶定律,当温度升高时,平衡反应偏向于吸热反应;当温度降低时,平衡反应偏向于放热反应。
6. 应用:化学反应速率控制的例子温度对反应速率的影响在工业生产中非常重要。
例如,对于聚合物的生产,温度的控制非常关键。
过高或过低的温度都会影响物质的分子间动力学特性,进而影响聚合反应的速率。
因此,在实际应用中,需要根据所需的反应速率来控制反应温度,以确保产品质量和生产效率。
总结:温度对化学反应速率的影响是一个重要的研究领域。
化学反应速率与温度的关系及影响因素在化学反应中,反应速率是指单位时间内反应物数量的变化量。
温度是影响化学反应速率的重要因素之一。
本文将介绍化学反应速率与温度的关系,并探讨影响反应速率的因素。
一、反应速率与温度的关系1. 温度对反应速率的影响根据化学动力学理论,温度升高可以增加分子的平均动能和碰撞频率,从而增加反应物分子之间的碰撞几率。
因此,一般来说,温度升高将使反应速率增加。
2. 反应速率与反应物分子的能量在反应过程中,反应物分子需要克服能垒才能转变为产物分子。
较高的温度可以提供足够的能量,使反应物分子更容易克服能垒,从而增加反应速率。
3. 温度对反应物分子碰撞的影响温度的升高使反应物分子的运动速度加快,从而增加分子之间的碰撞频率和碰撞能量。
高能碰撞使得反应物分子更容易发生化学反应,因此反应速率增加。
4. 温度对平衡态的影响根据Le Chatelier原理,温度的改变可以影响化学反应的平衡态。
一般来说,温度升高会使平衡向反应物或产物的方向移动。
因此,在某些情况下,温度的改变可能会对反应速率产生复杂的影响。
二、影响化学反应速率的因素1. 反应物浓度其他条件相同的情况下,反应物浓度越高,反应物分子之间的碰撞频率越高,故反应速率也越快。
2. 催化剂催化剂是可以改变反应速率而不参与反应本身的物质。
催化剂能够提供新的反应路径,降低反应物转变为产物所需的能垒,从而加速反应速率。
3. 反应物表面积反应物表面积的增大将有利于反应物分子之间的碰撞,从而提高反应速率。
例如,将固体反应物细粉末化可以增加其表面积,有利于反应进行。
4. 压力对于气体反应,增加系统压力将使气体分子的浓度增加,从而增加反应速率。
5. 响应物的性质和化学键的强度不同反应物的性质和化学键的强度也会影响反应速率。
一般来说,键强度越大,反应所需的能量越高,反应速率越慢。
6. 其他因素除了上述因素外,还有其他因素可能会影响反应速率,如溶液的溶剂、光照、压力等。
化学反应速率与温度的关系与计算方法化学反应速率是指单位时间内反应物消失量或产物生成量的变化率。
温度是影响化学反应速率的重要因素之一。
本文将讨论化学反应速率与温度的关系,并介绍计算反应速率的方法。
1. 温度对化学反应速率的影响温度对化学反应速率有显著的影响。
一般来说,在一定范围内,随着温度的升高,化学反应速率会增加;反之,温度的降低会使反应速率减小。
温度的影响可以通过考虑分子动力学理论来解释。
随着温度的升高,反应物分子的平均动能增加,分子碰撞的频率和能量也随之增加。
这会导致更多的反应物分子具备足够的能量,使得反应能够发生。
因此,温度的升高可以提高反应物分子的反应活性,进而加快反应速率。
2. 温度与反应速率的计算方法化学反应速率的计算方法可以通过实验来确定。
一般情况下,在实验中,我们可以通过测量反应物浓度或产物浓度随时间的变化来确定反应速率。
反应速率的计算公式如下:速率 = △浓度/△时间其中,△浓度表示浓度的变化量,△时间表示时间的变化量。
通过测量不同时间点的浓度并计算△浓度和△时间,可以确定反应速率。
在探讨温度与反应速率的关系时,我们可以通过使用不同温度下的实验数据来计算反应速率。
例如,可以在不同温度下测量反应物浓度随时间的变化,并通过计算△浓度和△时间来确定反应速率。
然后,比较不同温度下的反应速率,分析温度对反应速率的影响。
3. 温度对反应速率的影响因素除了温度对反应速率的影响之外,其他因素也可能影响反应速率。
这些因素包括反应物浓度、催化剂、反应体系的物理状态等。
在研究温度对反应速率的影响时,需要保持其他影响因素不变,以便准确地分析温度的影响。
另外,温度与反应速率之间的关系可以通过阿伦尼乌斯方程来表达:ln(k2/k1) = (Ea/R) * (1/T1 - 1/T2)其中,k1和k2分别表示在温度T1和T2下的反应速率常数,Ea表示活化能,R为气体常数,T1和T2为反应的温度。
阿伦尼乌斯方程描述了温度对反应速率常数的影响,通过计算Ea可以了解温度对反应速率的影响程度。
反应速率与温度的关系及解释反应速率与温度之间存在着密切的关系,温度的提高可以显著地加快反应速率。
在化学反应中,反应速率是指单位时间内反应物的消失量或产物的生成量。
而温度则是衡量分子动力学能量的指标,高温意味着分子更具有活力和能量。
1. 温度对反应速率的影响温度增加会引起反应物分子的平均动能增加,这意味着分子更容易相互碰撞,从而发生反应。
具体来说,温度升高会增加分子的平均速度和动能,导致反应物分子碰撞的频率和能量增加,从而增加了发生有效碰撞的几率。
2. 反应速率与温度的关系根据阿伦尼乌斯方程,可知反应速率与温度的关系可用以下公式描述:k = Ae^(-Ea/RT)其中,k表示反应速率常数,A表示指前因子,Ea表示活化能,R 表示气体常数,T表示温度。
由公式可见,温度的升高将导致指前因子A变大,从而增大反应速率常数k。
同时,温度的升高会减小指数幂内的指数项,意味着活化能Ea的影响减小,从而增大反应速率。
这表明在同一反应物浓度下,反应速率与温度成正比。
3. 解释反应速率与温度关系的分子层面机制在分子层面,温度提高引起分子的平均动能增加,这导致以下几个重要影响:(1)反应物分子碰撞频率的增加:在一定体系中,分子的平均速度和动能增加,分子相互碰撞的频率增加。
随着反应物分子碰撞的频率增加,更多的分子接近并发生有效碰撞,进而促进反应速率的提高。
(2)碰撞能量的增加:分子动能的增加使碰撞的能量也增加。
在反应速率较快的反应中,需要一定的能量才能克服反应物之间的相互作用力,进而发生有效碰撞。
高温使得更多的分子具有足够的能量,有助于克服活化能的阻碍。
(3)反应物的立体要求:某些反应物需要具有特定的相对速度和碰撞角度,以便发生有效反应。
高温使分子的平均速率增加,增加了满足反应物立体要求的概率。
总结:反应速率与温度之间存在着明显的正相关关系。
温度的升高提高了反应物分子的平均动能,增加了反应物的碰撞频率和能量,从而促进了反应速率的升高。