广东省医疗机构基本用药供应目录管理指南
- 格式:doc
- 大小:68.50 KB
- 文档页数:16

广东省基本医疗保险用药管理暂行办法(征求意见稿)第一章总则第一条为保障我省参保人员基本用药需求,提升基本医疗保险用药科学化、精细化管理水平,提高基本医疗保险基金使用效益,推进治理体系和治理能力现代化,依据《中华人民共和国社会保险法》等法律法规和《中共中央国务院关于深化医疗保障制度改革的意见》(中发〔2020〕5号)、《基本医疗保险用药管理暂行办法》(国家医疗保障局令第1号),制定本暂行办法。
第二条广东省范围内各级医疗保障部门对基本医疗保险用药范围的确定、调整,以及基本医疗保险用药的支付、管理和监督等,适用本办法。
第三条根据国家的规定,广东省基本医疗保险用药范围通过制定《广东省基本医疗保险药品目录》(以下简称《药品目录》)进行管理,符合《药品目录》的药品费用,按照国家、省的规定由基本医疗保险基金支付。
《药品目录》实行通用名管理,《药品目录》内药品的同通用名药品自动属于基本医疗保险基金支付范围。
第四条基本医疗保险用药管理坚持以人民为中心的发展思想,切实保障参保人员合理的用药需求;坚持“保基本”的功能定位,既尽力而为,又量力而行,用药保障水平与基本医疗保险基金和参保人承受能力相适应;坚持分级管理,明确各层级职责和权限;坚持专家评审,适应临床技术进步,实现科学、规范、精细、动态管理;坚持中西药并重,充分发挥中药和西药各自优势。
第五条《药品目录》由凡例、西药、中成药、协议期内的国家谈判药品、中药饮片、医院制剂六部分组成。
广东省医疗保障行政部门按国家规定增补的药品单列。
为维护临床用药安全和提高基本医疗保险基金使用效益,《国家基本医疗保险药品目录》内药品限定医保支付条件的,从其规定。
第六条广东省医疗保障行政部门负责广东省内的基本医疗保险用药管理,制定本省基本医疗保险用药管理政策措施,负责《药品目录》的监督实施等工作。
广东省医疗保障行政部门以国家《基本医疗保险药品目录》为基础,按照国家规定的调整权限和程序将符合条件的民族药、医院制剂、中药饮片纳入广东省医保支付范围,按规定向国家医疗保障行政部门备案后实施。

广东省2024年版基本药物增补品种书目及说明一、书目的构成《增补品种书目》中的药品包括化学药品和生物制品、中成药2部分。
二、书目的编排除在“备注”一栏标有“注释”的药品外,化学药品和生物制品、中成药按药品品种编号,药品编号的先后次序无特殊的涵义。
三、书目的分类化学药品和生物制品主要依据临床药理学分类,共120 个品种;中成药主要依据功能分类,共124 个品种。
临床各科医师依据病情用药,不受《增补品种书目》分类的限制。
四、书目中品种的名称除在“备注”一栏标有“注释”的药品外,化学药品和生物制品名称采纳中文通用名称和英文国际非专利药名称(InternationalNonproprietary Names,INN)中表达的化学成分的部分,剂型单列。
除个别药品明确酸根和盐基外,其他主要化学成分部分与《增补品种书目》中的名称一样且剂型相同,而不同酸根或不同盐基的化学药品,均属于《增补品种书目》的药品;中成药采纳药品通用名称。
五、书目中品种的剂型化学药品和生物制品剂型在《中华人民共和国药典》(2024 年版)“制剂通则”规定的基础上进行归类处理,未归类的剂型以《增补品种书目》标注的为准。
化学药品和生物制品中的口服常释剂型包括口服一般片剂、肠溶片、分散片,硬胶囊、肠溶胶囊、软胶囊(胶丸);缓释控释剂型包括缓释片、控释片,缓释胶囊、控释胶囊;外用软膏剂型包括软膏剂、乳膏剂;注射剂包括注射液、注射用无菌粉末、注射用浓溶液。
剂型编排的先后次序无特殊的涵义。
中成药的剂型不单列,以“药品名称”栏中标注的为准。
六、对备注栏的说明(一)化学药品和生物制品注释1:书目第1 号“阿莫西林”,限儿童及吞咽困难者。
注释2:书目第3 号“哌拉西林舒巴坦”,限重度感染者。
注释3:书目第22号“缓解感冒症状的复方OTC制剂”详见下表:注释4:书目第38 号“厄贝沙坦”,限对血管惊慌素转换酶抑制剂治疗不能耐受的患者。
注释5:书目第39 号“缬沙坦”,限对血管惊慌素转换酶抑制剂治疗不能耐受的患者。

凡例《广东省基本医疗保险、工伤保险和生育保险药品目录》(2019年版)(简称《药品目录》)是基本医疗保险和生育保险基金支付药品费用的标准。
临床医师根据病情开具处方、参保人员购买与使用药品不受《药品目录》的限制。
工伤保险基金支付药品费用范围参照本目录执行。
凡例是对《药品目录》中药品的分类与编号、名称与剂型、备注等内容的解释和说明,是《药品目录》的组成部分,其内容与目录正文具有同等政策约束力。
一、目录构成(一)《药品目录》西药部分、中成药部分、协议期内谈判药品部分、中药饮片部分和医院制剂部分所列药品为基本医疗保险、工伤保险和生育保险基金准予支付费用的药品。
(二)《药品目录》共有西药和中成药2934个,其中西药部分1425个,中成药部分1461个(含民族药97个),协议期内谈判药品部分48个(含西药43个、中成药5个)。
西药、中成药和协议期内谈判药品分甲乙类管理,西药甲类药品398个,中成药甲类药品242个,其余为乙类药品。
协议期内谈判药品按照乙类药品支付。
(三)中药饮片部分共有药品1157个,按照乙类药品支付。
(四)医院制剂部分1411个(含西药238个,中成药1173个),按照乙类药品支付。
(五)《药品目录》包括限工伤保险基金准予支付费用的品种14个;限生育保险基金准予支付费用的品种5个。
工伤保险和生育保险支付药品费用时不区分甲、乙类。
二、编排与分类(六)药品分类上西药品种主要依据解剖-治疗-化学分类(ATC),中成药主要依据功能主治分类,中药饮片按中文笔画数排序。
临床具有多种治疗用途的药品,选择其主要治疗用途分类。
临床医师依据病情用药,不受《药品目录》分类的限制。
(七)西药、中成药、协议期内谈判药品分别按药品品种编号。
同一品种只编一个号,重复出现时标注“★”,并在括号内标注该品种编号。
药品排列顺序及编号的先后次序无特别含义。
三、名称与剂型(八)除在“备注”一栏标有“◇”的药品外,西药名称采用中文通用名,未包括命名中的盐基、酸根部分,剂型单列。
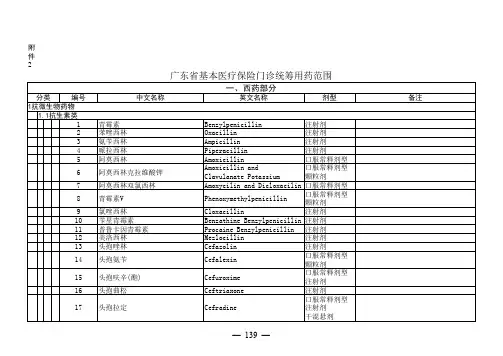
附件2
复方倍他米松
编号中文名称英文名称剂型备注分类
374吲达帕胺Indapamide 口服常释剂型缓释控释剂型
375硝苯地平Nifedipine 口服常释剂型缓释控释剂型
376维拉帕米Verapamil 口服常释剂型缓释控释剂型注射剂
377尼群地平Nitrendipine口服常释剂型378氨氯地平Amlodipine口服常释剂型
379地尔硫 Diltiazem 口服常释剂型缓释控释剂型注射剂
380非洛地平Felodipine 口服常释剂型缓释控释剂型
381拉西地平Lacidipine口服常释剂型382贝尼地平Benidipine口服常释剂型383普萘洛尔Propranolol口服常释剂型384阿替洛尔Atenolol口服常释剂型
385美托洛尔Metoprolol 口服常释剂型缓释控释剂型注射剂
386比索洛尔Bisoprolol口服常释剂型387索他洛尔Sotalol口服常释剂型388酚妥拉明Phentolamine注射剂
389哌唑嗪Prazosin口服常释剂型
390利血平Reserpine 口服常释剂型注射剂
391酚苄明Phenoxybenzamine 口服常释剂型注射剂
392甲基多巴Methyldopa口服常释剂型393可乐定Clonidine口服常释剂型
鱼肝油酸钠。

广东省医疗机构基本用药供应目录管理指南根据《医疗机构药事管理规定》(卫医政发[2 011] 11号)、《处方管理办法》(卫生部[2007]第53号令)、《医疗机构药品集中采购工作规范》(卫规财发[2010] 64号)、《广东省医疗机构药品阳光采购实施方案》(粤纠医药办[2009]3号)及《广东省医疗机构药品阳光采购医疗机构药品遴选实施办法(试行)》(粤纠医药办[2009]9号)等药物政策法规的要求,为加强我省医疗机构基本用药供应目录的规范管理,建立透明和受到监督的药品遴选和定期调整、动态管理制度,优化新药引进、品种增补及替换、淘汰机制,确保药品购销行为的合法性和规范性,特提出如下贯彻意见,请遵照执行。
一、建立基本用药供应目录管理机构基本用药供应目录管理是指医疗机构应当根据临床需要,建立基本用药供应目录的遴选和定期调整、动态管理制度,包括对供应目录的周期性调整及新药引进、品种增补和替换、淘汰制度。
在基本用药供应目录使用周期中,在保持目录相对稳定的基础上,由药事管理与药物治疗学委员会和纪检监察部门监控药品临床使用情况,监测、评价药物治疗的疗效,分析、评估用药安全性,并进一步根据监测评价的结果、相关政策及临床科室和药学部门的建议,实行基本用药供应目录的定期调整和动态管理。
原则上每一个药品采购周期对目录进行一次全面审核和调整。
医疗机构药事管理与药物治疗学委员会主要由具有高级专业技术职务任职资格的药学、临床医学、临床微生物学、护理学、医院感染管理等相关专业高级技术职务任职资格的人员,及药学、医务、护理等部门负责人组成,负责本机构基本用药供应目录的遴选和管理工作。
其日常工作由药学部门负责。
医疗机构药事管理与药物治疗学委员会的职责是:1、贯彻执行医疗卫生及药事管理等有关法律、法规和规章。
审核制定本机构药事管理和药学工作规章制度,并监督实施;2、根据国家及省《基本药物目录》、《处方管理办法》、《中国国家处方集》、《药品采购供应质量管理规范》等,制订本机构《药品处方集》、《基本用药供应目录》(含抗菌药物供应目录);3、建立新药引进和药品遴选制度,审核本机构临床科室的新药申请,调整药品品种或者配送企业或供应商,审核医院制剂申报等事宜;4、建立规范的药品使用和管理制度。
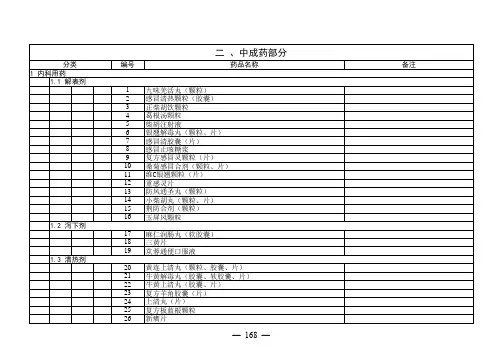
编号药品名称备注分类
143活心丸
144冠心苏合丸(胶囊、软胶囊)
145速效救心丸
146地奥心血康胶囊(软胶囊)
147银杏叶口服制剂同《药品目录》中成药部分第496号★(147)银杏叶注射制剂同《药品目录》中成药部分★(496)号148银杏酮酯分散片(滴丸)
149杏灵滴丸
150通心络胶囊
151灯盏花素片
152毛冬青胶囊
153星瑙灵片
154脑栓通胶囊
155脑络通胶囊
156脑栓康复胶囊
157大黄 虫丸(胶囊)
158复方鳖甲软肝片
159心脑联通胶囊
160脑心通胶囊
161前列倍喜胶囊
1.12 理气剂
162丹栀逍遥丸
163逍遥丸(颗粒)
164柴胡舒肝丸
165加味逍遥丸
166木香顺气颗粒
167四逆散
168越鞠丸
169气滞胃痛颗粒(片)
170胃苏颗粒
171胃乃安胶囊。

凡例《广东省基本医疗保险、工伤保险和生育保险药品目录》(2019年版)(简称《药品目录》)是基本医疗保险和生育保险基金支付药品费用的标准。
临床医师根据病情开具处方、参保人员购买与使用药品不受《药品目录》的限制。
工伤保险基金支付药品费用范围参照本目录执行。
凡例是对《药品目录》中药品的分类与编号、名称与剂型、备注等内容的解释和说明,是《药品目录》的组成部分,其内容与目录正文具有同等政策约束力。
一、目录构成(一)《药品目录》西药部分、中成药部分、协议期内谈判药品部分、中药饮片部分和医院制剂部分所列药品为基本医疗保险、工伤保险和生育保险基金准予支付费用的药品。
(二)《药品目录》共有西药和中成药2934个,其中西药部分1425个,中成药部分1461个(含民族药97个),协议期内谈判药品部分48个(含西药43个、中成药5个)。
西药、中成药和协议期内谈判药品分甲乙类管理,西药甲类药品398个,中成药甲类药品242个,其余为乙类药品。
协议期内谈判药品按照乙类药品支付。
(三)中药饮片部分共有药品1157个,按照乙类药品支付。
(四)医院制剂部分1411个(含西药238个,中成药1173个),按照乙类药品支付。
(五)《药品目录》包括限工伤保险基金准予支付费用的品种14个;限生育保险基金准予支付费用的品种5个。
工伤保险和生育保险支付药品费用时不区分甲、乙类。
二、编排与分类(六)药品分类上西药品种主要依据解剖-治疗-化学分类(ATC),中成药主要依据功能主治分类,中药饮片按中文笔画数排序。
临床具有多种治疗用途的药品,选择其主要治疗用途分类。
临床医师依据病情用药,不受《药品目录》分类的限制。
(七)西药、中成药、协议期内谈判药品分别按药品品种编号。
同一品种只编一个号,重复出现时标注“★”,并在括号内标注该品种编号。
药品排列顺序及编号的先后次序无特别含义。
三、名称与剂型(八)除在“备注”一栏标有“◇”的药品外,西药名称采用中文通用名,未包括命名中的盐基、酸根部分,剂型单列。

广东省医疗机构基本药物交易办法(试行)第一章总则第一条为深化我省医药卫生体制改革,建立基本药物供应保障体系,进一步规范医疗机构基本药物采购行为,根据国家有关法律法规和政策,结合本省实际,制定本办法。
第二条本办法所称的基本药物交易是运用现代电子信息技术,建立全省集中的第三方药品电子交易平台(以下简称“交易平台”),实行“在线竞价、在线交易、在线支付、在线融资、在线监管”。
第三条全省范围内政府办基层医疗卫生机构和县级以上公立医疗机构、医保定点的民营医疗机构基本药物交易适用本办法,鼓励其他民营医疗机构进入交易平台进行交易。
第四条基本药物包括国家基本药物和广东省增补基本药物目录药品。
第五条基本药物交易应遵循公开、公平、公正和诚实信用原则。
第二章报名及审核第六条实行药品生产企业直接报名。
药品生产企业设立的仅销售本公司产品的商业公司、境外产品国内总代理可视同生产企业。
第七条生产企业报名应符合下列条件:(一)依法取得《药品生产许可证》、《GMP认证证书》及《营业执照》。
药品生产企业设立的仅销售本公司产品的商业公司、进口药品全国总代理必须依法取得《药品经营许可证》、《GSP 认证证书》及《营业执照》。
(二)政府定价品种必须按国家和广东省价格主管部门的规定报备出厂(口岸)价格。
(三)企业或其生产的品种未被列入广东省药品非诚信交易名单。
广东省药品非诚信交易名单及其管理办法由省卫生主管部门会同省食品药品监管等部门根据国家和省有关规定制定并公布。
第八条凡国家基本药物目录和省增补基本药物目录内的品种和规格,符合规定的均可随时报名。
进口品种由国外生产企业授权的总代理企业参与报名。
新取得生产批件的基本药物可随时报名。
第九条低价药品及临床必须且采购困难品种目录包括低价药品(日平均使用费用西药及生物制品≤1元、中成药≤1.5元的品种,由省价格主管部门制定)、基本药物目录内的管制药品(包括国家实行特殊管理的麻醉药品、第一、二类精神药品、医疗用放射药品、医疗用毒性药品),以及短缺的急救药品(含人血白蛋白等血液制品)等。

医院基本用药供应管理制度(试行)根据《医疗机构药事管理规定》、《处方管理办法》、《广东省医疗机构基本用药供应目录管理指南》等政策法规的要求,为加强我院基本用药供应目录的规范管理,建立透明和受到监督的药品遴选、调整管理制度,优化新药引进、品种增补及替换、淘汰机制,确保药品购销行为的合法性和规范性,特制定本制度,请遵照执行。
一、基本用药供应目录管理机构医院药事管理与药物治疗学委员会(以下简称医院药事会)负责本院基本用药供应目录的初步遴选、审核、提出调整建议和日常管理工作。
医院药事会定期组织召开医院药品遴选专家会议,负责基本用药供应目录的遴选、新药引进、品种增补和替换、淘汰等管理工作。
药品采购监督委员会负责对基本用药供应目录的遴选、审核、新药引进、药品采购全过程实施监督管理。
当进行目录遴选或新药引进评审时,须抽派代表参加,负责对全过程进行监督。
‘二、基本用药供应目录遴选调整原则1、医院基本用药供应目录的品规数原则上不超过1000种。
2、医院基本供应目录药品原则上从广东省药品集中采购挂网目录中遴选,优先选择国家和省市医保药品目录和基本药物目录中的药品。
3、目录调整严格执行如下规定:同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1~2种,因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外。
4、各临床科室每一年度要在医院现有基本用药供应目录中,按照防治必需、安全有效、价格合理、使用方便、临床首选的原则,结合本科的诊疗科目、用药特点,合理确定本科基本用药的药品品种、剂型,建立科内基本用药供应目录,做到品种齐全,比例恰当。
同时上报医院药事会统一备案。
5、医院药事会综合分析各科的基本用药供应目录,每一年度定期组织召开一次遴选会议,参加遴选的专家应当在25人以上,对医院基本用药供应目录进行一次全面审核和调整。
6、基本用药供应目录内药品应当由药库统一采购供应,临床上非经医务科同意不得使用非由药库采购供应的药物。

医院基本用药供应目录管理制度一、总则为了加强医院基本用药供应目录(以下简称“用药目录”)的管理,保障医疗质量和患者安全,根据《中华人民共和国药品管理法》、《医疗机构药事管理规定》等相关法律法规,结合医院实际情况,特制定本制度。
二、用药目录的制定与调整1. 用药目录的制定(1)医院药事管理与药物治疗学委员会(以下简称“药事会”)负责用药目录的制定工作。
(2)用药目录应包括药品名称、规格、剂型、产地、生产厂家、价格等信息。
(3)用药目录的制定应充分考虑临床需求、药品安全性、有效性、经济性等因素。
2. 用药目录的调整(1)药事会应定期对用药目录进行评审和调整,确保用药目录的合理性和适应性。
(2)药品的增减、替换等调整应经过药事会讨论决定,并报医院领导批准。
(3)调整用药目录时,应充分考虑药品的临床疗效、安全性、经济性、市场供应情况等因素。
三、用药目录的执行与监督1. 用药目录的执行(1)医院各临床科室应根据用药目录进行药品采购、使用和管理。
(2)医院药剂科负责用药目录的执行和监督工作。
(3)临床科室在特殊情况下需要使用非用药目录药品时,应向药剂科提出申请,经批准后方可使用。
2. 用药目录的监督(1)医院药事会负责对用药目录的执行情况进行监督和评估。
(2)药事会应定期对用药目录的执行情况进行检查,发现问题及时整改。
(3)医院应建立用药目录执行情况的反馈机制,及时了解临床科室的需求和意见。
四、药品采购与供应管理1. 药品采购(1)医院药剂科负责药品的采购工作,应选择质量可靠、价格合理的药品供应商。
(2)采购药品应符合用药目录的要求,确保药品的质量和供应。
(3)采购药品应遵循公平、公正、公开的原则,保证药品采购的透明度。
2. 药品供应(1)医院药剂科负责药品的供应工作,确保临床科室的药品需求得到满足。
(2)药剂科应建立药品库存管理制度,合理控制药品库存,避免药品短缺和浪费。
(3)医院应建立药品供应保障机制,确保药品的供应稳定和安全。
医院基本用药供应目录管理制度医院已有药品的增补应当严格遵循临床必需、安全有效、价格合理、使用方便、临床首选的原则,经过科室讨论决定后,填写相关申请表并经过临床药学室审核备案。
四、药品替换和淘汰1、药品替换是指将本院已有药品(按药品通用名计)替换为同一治疗作用、同一剂型、规格和生产厂家不同的药品。
2、药品淘汰是指将本院已有药品(按药品通用名计)从基本用药供应目录中剔除。
3、药品替换和淘汰应当由医院药事会组织专家会议进行讨论决定,并严格按照政策法规的要求执行。
五、监督管理1、药品采购监督委员会应当对基本用药供应目录的遴选、审核、新药引进、采购、使用等全过程实施监督管理,并及时发现和纠正不规范行为。
2、医院药事会应当对基本用药供应目录的管理工作进行日常监督,并定期组织召开专家会议进行审核和调整。
3、临床科室应当按照规定程序申请药品增补,并严格按照规定使用药品,不得擅自更换或淘汰药品。
4、药库应当严格按照规定采购和供应药品,并对药品的质量和使用情况进行监督管理。
本制度自颁布之日起试行,如有需要修改的地方,经医院药事会讨论决定后报医务科备案。
药品说明书最好提供药品样品,并附上相关文献证据,如指南推荐、专家共识意见、系统评价、随机对照试验等。
此外,还需要提供其他相关资料,如新药证书、中药保护品种证书、进口药品注册4证、药品检验报告、推介人员委托证明、生产和经营企业的许可证、营业执照、认证证书等。
为了客观公正地评估所有新药申请,医务科、临床药学室和药库共同派人组成新药评估小组,根据招标入围情况、在用同类品种情况、循证医学和药物经济学等资料填写《新药申请评估报告》。
在药事会召开前三天,临床药学室会将需要讨论审核的所有新药申请资料放到内网“临床药学室/新药申请”文件夹中,并通知药事会委员和新药遴选专家库成员上网下载审阅。
医院药事会每季度召开一次会议,讨论审核该季度所有新药申请资料,2/3以上以会委员投票同意的新药申请可进入新药引进评审专家会议。
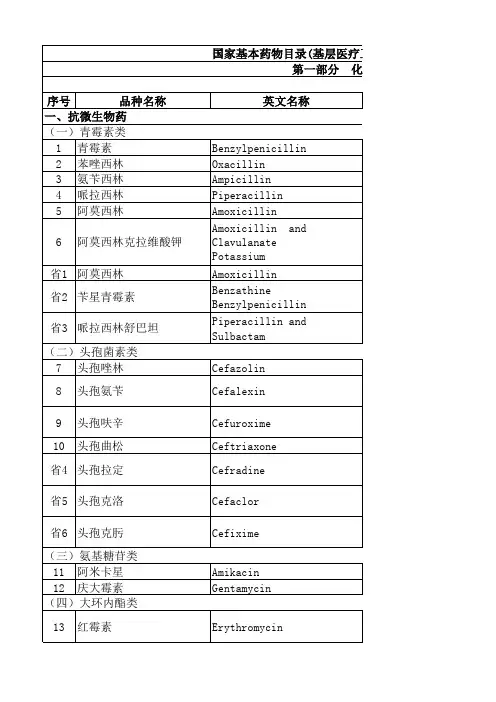
广州市基层医疗卫生机构增加配备使用的129种基本药物目录外药品序药物名称剂型本院品种备注一、抗微生物药物(一)合成抗菌药物1 洛美沙星口服常释剂型、注射剂、滴耳剂2 奥硝唑注射剂3 呋喃唑酮口服常释剂型(二)抗病毒药物4 拉米夫定口服常释剂型(三)抗生素类药物5 妥布霉素注射剂、滴眼剂、眼膏剂6 林可霉素注射剂、口服常释剂型、软膏剂、滴眼剂、滴耳剂7 头孢他啶注射剂8 头孢噻肟注射剂9 克拉霉素口服常释剂型、颗粒剂10 头孢哌酮舒巴坦注射剂11 阿奇霉素注射剂(四)抗真菌药物12 伊曲康唑口服常释剂型、口服液体剂、注射剂二、麻醉用药物(一)局部麻醉药物序药物名称剂型本院品种备注13 罗哌卡因注射剂14 丁卡因注射剂、口服液体剂、溶液剂15 左布比卡因注射剂(二)麻醉辅助药物16 麻黄碱注射剂17 维库溴铵注射剂(三)全身麻醉药物18 咪达唑仑注射剂、口服常释剂型19 丙泊酚注射剂三、解热镇痛及非甾体抗炎药物(一)解热镇痛及非甾体抗炎药物20 尼美舒利口服常释剂型21 复方对乙酰氨基酚口服常释剂型22 氨基葡萄糖口服常释剂型、颗粒剂23 氯芬黄敏口服常释剂型24 双氯芬酸二乙胺软膏剂、凝胶剂四、神经系统用药物(一)抗癫痫药物25 丙戊酸钠缓释控释剂型(二)抗帕金森病药物26 多巴丝肼口服常释剂型27 左旋多巴卡比多巴缓释控释剂型(三)脑血管病用药物28 倍他司汀口服常释剂型、注射剂29 桂利嗪口服常释剂型序药物名称剂型本院品种备注30 七叶皂苷注射剂(四)其他31 脑蛋白水解物注射剂、口服常释剂型五、治疗精神障碍药物(一)抗焦虑药物32 硝西泮(硝基安定)口服常释剂型33 氯硝西泮(氯硝安定)口服常释剂型34 阿普唑仑(佳静安定)口服常释剂型(二)抗精神病药物35 氟哌利多注射剂36 氯氮平口服常释剂型37 舒必利口服常释剂型38 利培酮口服常释剂型39 阿立哌唑口服常释剂型(三)抗抑郁药物40 帕罗西汀口服常释剂型41 氯西汀口服常释剂型(四)抗躁狂药物42 碳酸锂口服常释剂型六、呼吸系统药物(一)平喘药物43 布地奈德吸入剂、44 复方异丙托溴铵(异丙托溴铵沙丁胺)吸入剂45 孟鲁司特口服常释剂型、颗粒剂序药物名称剂型本院品种备注46 特布他林口服常释剂型(二)祛痰药物47 氨溴索注射剂(三)其他48 复方甲氧那明口服常释剂型七、消化系统药物(一)肝病辅助治疗药物49 乳果糖口服散剂、口服液体剂、糖浆剂50 甘草酸二铵注射剂(二)抗酸药物及抗溃疡病药物51 泮托拉唑口服常释剂型、注射剂52 奥美拉唑注射剂(三)其他消化系统药物53 奥曲肽[8肽] 注射剂(四)微生态制剂54 枯草杆菌二联活菌制剂口服常释剂型(五)胃肠解痉药物55 东莨菪碱口服常释剂型、注射剂、眼膏剂(六)泻药56 液状石蜡溶液剂八、泌尿系统药物(一)前列腺疾病用药物57 非那雄胺口服常释剂型九、血液系统药物序药物名称剂型本院品种备注(一)抗凝血药物及溶栓药物58 尿激酶注射剂(二)抗血小板药物59 氯吡格雷口服常释剂型(三)升白细胞药物60 辅酶A 注射剂(四)止血药物及抗纤维蛋白溶解药物61 酚磺乙胺注射剂62 鱼精蛋白注射剂63 血凝酶(巴曲酶)注射剂64 氨甲苯酸注射剂十、激素及调节内分泌功能药物(一)雌激素、孕激素及抗孕激素类药物65 米非司酮口服常释剂型66 已烯雌酚口服常释剂型、注射剂67 炔诺酮口服常释剂型、丸剂68 结合雌激素口服常释剂型(二)钙代谢调节药物69 降钙素注射剂、吸入剂70 阿法骨化醇口服常释剂型(三)肾上腺皮质激素类药物71 曲安奈德注射剂、吸入剂72 泼尼松龙口服常释剂型、注射剂、滴眼剂73 甲泼尼龙注射剂序药物名称剂型本院品种备注(四)胰岛素及其他影响血糖的药物74 吡格列酮口服常释剂型75 瑞格列奈口服常释剂型76 二甲双胍缓释控释剂型十一、维生素及矿物质缺乏症用药物(一)矿物质类药物77 碳酸钙D3(维生素D3碳酸钙)口服常释剂型、颗粒剂(二)维生素类药物78 水溶性维生素注射剂79 五维他口服液体剂十二、调节水、电解质及酸碱平衡药物(一)糖类80 果糖二磷酸钠口服常释剂型、注射剂(二)血容量扩充药物81 羟乙基淀粉注射剂十三、解毒药物(一)有机磷酸酯类解毒药物82 碘解磷定注射剂十四、生物制品83 精制破伤风抗毒素注射剂84 人血白蛋白注射剂十五、诊断用药物(一)造影剂85 复方泛影葡胺注射剂序药物名称剂型本院品种备注十六、专科特殊用药物(一)妇产科用药物86 米索前列醇口服常释剂型87 卡前列素氨丁三醇注射剂(88)依沙吖啶外用液体剂、注射剂(二)皮肤科外用药物88 依沙吖啶外用液体剂89 酮康唑软膏剂90 莫匹罗星软膏剂91 曲咪新软膏剂92 硫磺软膏剂93 复方地塞米松乳膏剂林可霉素软膏剂(三)耳鼻喉科用药(43) 布地奈德吸入剂(71) 曲安奈德注射剂、吸入剂(6) 林可霉素注射剂、口服常释剂型、软膏剂、滴耳剂(1)洛美沙星口服常释剂型、注射剂、滴耳剂(四)眼科用药(3)妥布霉素注射剂、滴眼剂、眼膏剂(6)林可霉素注射剂、口服常释剂型、软膏剂、滴眼剂(72)泼尼松龙口服常释剂型、注射剂、滴眼剂(55)东莨菪碱口服常释剂型、注射剂、眼膏剂序药物名称剂型本院品种备注十七、营养治疗药物(一)肠内营养药物94 复方a-酮酸口服常释剂型(二)肠外营养药物95 复方氨基酸(15AA)注射剂96 复方氨基酸(9AA)注射剂97 脂肪乳(C14-24)(大豆油)注射剂十八、抗凝血药物及溶栓药物(一)抗凝血药物98 低分子肝素注射剂十九、循环系统药物(一)β受体阻滞药物99 比索洛尔口服常释剂型(二)调血脂药物100 阿托伐他汀口服常释剂型(三)钙拮抗药物101 非洛地平口服常释剂型、缓释控释剂型102 左旋氨氯地平口服常释剂型103 硝苯地平控释片(四)其他药物104 三磷酸腺苷注射剂105 川芎嗪注射剂106 曲美他嗪口服常释剂型(五)血管紧张素Ⅱ受体拮抗药物序药物名称剂型本院品种备注107 坎地沙坦口服常释剂型108 氯沙坦钾口服常释剂型(六)血管紧张素转换酶抑制药物109 贝那普利口服常释剂型110 福辛普利口服常释剂型二十、镇痛药物(一)阿片类镇痛药物111 吗啡口服常释剂型、注射剂、缓释控释剂型112 芬太尼贴剂(二)非阿片类镇痛药物113 曲马多口服常释剂型、缓释控释剂型、口服液体剂、注射剂114 厄贝沙坦氢氯噻嗪口服常释剂型(限慢性门诊用)115 塞来昔布口服常释剂型(限慢性门诊用)116 氟奋乃静葵酸酯注射剂(限精神病免费门诊用)117 氟哌啶醇葵酸酯注射剂(限精神病免费门诊用)118 氯丙咪嗪口服常释剂型(限精神病免费门诊用)中成药序药物名称剂型本院品种备注一、内科用药(一)扶正剂119 复方阿胶浆(二)化痰、止咳、平喘剂120 强力枇杷露(胶囊)121 肺力咳合剂(胶囊)(三)开窍剂122 醒脑静注射液(四)袪湿剂123 尿毒清颗粒(五)祛瘀剂124 心脑舒通胶囊(片)125 心宝丸(六)治风剂126 全天麻胶囊(片)二、外科用药(一)清热剂127 湿润烧伤膏三、眼科用药(一)扶正剂128 珍珠明目滴眼液四、骨伤科用药(一)活血通络剂129 正红花油。
广东省医疗机构基本用药供应目录管理指南根据《医疗机构药事管理规定》(卫医政发[2 011] 11号)、《处方管理办法》(卫生部[2007]第53号令)、《医疗机构药品集中采购工作规范》(卫规财发[2010] 64号)、《广东省医疗机构药品阳光采购实施方案》(粤纠医药办[2009]3号)及《广东省医疗机构药品阳光采购医疗机构药品遴选实施办法(试行)》(粤纠医药办[2009]9号)等药物政策法规的要求,为加强我省医疗机构基本用药供应目录的规范管理,建立透明和受到监督的药品遴选和定期调整、动态管理制度,优化新药引进、品种增补及替换、淘汰机制,确保药品购销行为的合法性和规范性,特提出如下贯彻意见,请遵照执行。
一、建立基本用药供应目录管理机构基本用药供应目录管理是指医疗机构应当根据临床需要,建立基本用药供应目录的遴选和定期调整、动态管理制度,包括对供应目录的周期性调整及新药引进、品种增补和替换、淘汰制度。
在基本用药供应目录使用周期中,在保持目录相对稳定的基础上,由药事管理与药物治疗学委员会和纪检监察部门监控药品临床使用情况,监测、评价药物治疗的疗效,分析、评估用药安全性,并进一步根据监测评价的结果、相关政策及临床科室和药学部门的建议,实行基本用药供应目录的定期调整和动态管理。
原则上每一个药品采购周期对目录进行一次全面审核和调整。
医疗机构药事管理与药物治疗学委员会主要由具有高级专业技术职务任职资格的药学、临床医学、临床微生物学、护理学、医院感染管理等相关专业高级技术职务任职资格的人员,及药学、医务、护理等部门负责人组成,负责本机构基本用药供应目录的遴选和管理工作。
其日常工作由药学部门负责。
医疗机构药事管理与药物治疗学委员会的职责是:1、贯彻执行医疗卫生及药事管理等有关法律、法规和规章。
审核制定本机构药事管理和药学工作规章制度,并监督实施;2、根据国家及省《基本药物目录》、《处方管理办法》、《中国国家处方集》、《药品采购供应质量管理规范》等,制订本机构《药品处方集》、《基本用药供应目录》(含抗菌药物供应目录);3、建立新药引进和药品遴选制度,审核本机构临床科室的新药申请,调整药品品种或者配送企业或供应商,审核医院制剂申报等事宜;4、建立规范的药品使用和管理制度。
按照国家药物政策和法律、法规,建立规章制度和技术操作规程,监督、指导麻醉药品、精神药品、医疗用毒性药品及放射性药品和高危药品的临床使用与规范管理;5、推动建立本机构的药物治疗相关的临床诊疗指南和药物临床应用指南。
根据本机构基本用药目录和国家药物政策及各类药钧临床应用指导原则,组织制定并监督实施本机构“药物临床应用管理办法”、“抗菌药物临床应用指南”、“糖皮质激素类药物临床应用指南”、“中成药临床应用指南”等。
建立抗菌药物临床使用分级管理制度。
6、建立临床用药安全监管制度。
建立临床用药监测、处方点评制度,实行药品用量动态监测和超常预警制度,对本机构药物临床使用的安全性、有效性和经济性进行监测、分析和评价,提出干预和改进措施,指导临床合理用药;7、建立药物不良反应监测报告制度,分析、评估用药风险和药物不良反应、药品损害事件,提供咨询与指导;8、对医务人员进行有关药事管理法律法规、规章制度和合理用药知识教育培训,向公众宣传安全用药知识。
二、建立基本用药供应目录遴选制度(一)建立基本用药供应目录遴选专家库在医院药事管理与药物治疗学委员会名下成立基本用药供应目录遴选专家库,负责药品目录的遴选、审核,以及新药引进、品种增补和替换、淘汰的评审工作。
基本用药目录遴选专家库原则上由副高以上职称,长期在医疗一线工作的药学(含药理学)、临床医学、临床检验、临床微生物、医院感染管理、护理学等专业人员组成,三级综合医院150人以上,专科医院和二级综合医院50人以上,一级医院和社区卫生服务中心、乡镇卫生院的专家库人数由当地卫生行政部门确定。
二级以上医院应根据临床专科或系统(心血管、呼吸、肾脏、脑神经、消化和肝脏、骨骼肌肉、眼耳鼻喉)用药,儿童、孕产妇用药及感染性疾病用药等成立各“专科用药小组”,对专科用药目录的遴选、审核、使用、新药引迸、增补、品种更换或淘汰等提出建议,制订临床用药指引。
(二)成立药品采购监督委员会负责对医疗机构基本用药供应目录的遴选、审核、新药引进、药品采购全过程实施监督管理。
药品采购监督委员会由纪检监察、财务、审计、医学、药学等相关人员组成,三级综合医院30人以上,其它医院原则上10人以上。
当医疗机构遴选基本用药供应目录或新药引进评审时,抽派药品采购监督委员会的代表参加,负责对基本用药供应目录遴选及新药引进全过程进行监督。
药品采购监督委员会成员与基本用药目录遴选专家库人员原则上不交叉重复。
(三)遴选专家参加遴选和审核的专家应在医疗机构基本用药供应目录遴选专家库中以随机方式临时抽取产生,按药品类别或“专科用药小组”分别遴选。
三级综合医院每次参加基本用药供应目录遴选的专家应当在75人以上,每专业组的专家人数不少于15人;专科医院和二级综合医院每次参加遴选的专家应当在25人以上,每专业组的专家人数不少于10人。
其他医院每组的专家人数不少于11人。
被抽中的遴选专家按照组别,必须在统一时间、统一地点集中投票,不得分散进行。
遴选会议开始后,除大会集中、统一的药品临床应用情况报告和公开讨论,投票过程药品遴选专家不能交流与具体品种有关的任何内容。
药品采购监督委员会成员全程参与监督。
(四)基奉用药供应目录的遴选原则1、医疗机构要建立基本用药供应目录,保证临床用药安全有效。
2、各医疗机构要按照防治必需、安全有效、价格合理、使用方便、临床首选的原则,结合本机构的诊疗科目、用药特点,合理确定基本用药供应目录中药品品种、剂型和数量,做到品种齐全,比例恰当。
3、各医疗机构建立目录遴选、周期性审核调整、新药引进、品种增补和替换、淘汰的原则、范围、方法和程序,并形成制度和规范。
4、基本用药供应目录的品规数应按规定控制在合理范围:三级综合医院原则上不超过1500种,三级专科医院原则上不超过1200种,二级综合医院原则上不超过1 000种,二级专科医院原则上不超过800种,其他医疗机构原则上不超过600种。
5、医疗机构基本用药供应目录的调整应严格执行卫生部令第53号《处方管理办法》中第四章第16条的规定:“同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1—2种。
因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外”。
医疗机构抗菌药物供应目录(包括抗菌药物的品种、剂型和规格)按照国家和省卫生厅有关政策规范制订。
6、医院的药品遴选工作,原则上从广东省药品集中采购挂网目录中遴选,优先选择国家和省市医保药品目录和基本药物目录中药品。
7、医疗机构的基本用药应当由药学部门统一采购供应,临床上不得使用非药学部门采购供应的药物。
三、建立基本用药目录定期调整和动态管理制度各医疗机构应建立新药引进、品种增补和替换、淘汰的原则和规范。
(一)药品增补和新药引进1、药品增补指的是医疗机构根据临床需要,增加基本用药供应目录以外的药品。
新药引进指的是医院引进没有使用过的药品,包括通用名、剂型和规格等,且具有临床无可替代性。
2、医疗机构要建立规范的新药引进、品种增补制度,建立公开、透明的工作流程或指引,提供方便的申请表格下载,定期召开药事管理与药物治疗学委员会会议。
3、确定药品增补和新药引进评审原则:(1)符合本医疗机构关于药品增补和新药引进的原则要求;(2)最大限度满足临床用药需求;(3)严格执行《处方管理办法》的有关规定,新药引进原则上不超过“一品两规”。
如有特殊临床需求,须经过医疗机构药事管理与药物治疗学委员会讨论决定增补。
有多种剂型和规格时,优先考虑临床常用剂型和规格,兼顾特殊人群用药(老人、孕妇、儿童)安全性;(4)同等情况下,优先考虑已进入基本药物目录、医保目录的产品。
涉及同类或同种药品的比较,应综合考虑药品安全质量、坐产企业规模、价格、品牌等因素。
4、药品增补和新药引进程序。
(1)各药品生产、流通企业、临床科室或个人可以根据临床需要向医疗机构药事管理部门提交申请,并提交增补药品和引进新药的资料,包括新药证书、生产批件、质量标准、价格批文和药品挂网信息、药品说明书、药品介绍、生产经营企业证照等资料(参见附录1)。
药学部门应接受所有新药申请。
(2)所有药品增补或新药申请必须征询医疗机构临床科室意见。
临床科室主任组织集体讨论,填写《新药申请表》(参见附录2),同时附科室讨论的集体签名及廉洁承诺书。
(3)药事管理部门或其临床药学科应客观、公正地评估所有新药申请,要根据临床科室提供的新药申请、入围情况、在用同类品种情况、循证医学和药物经济学等资料编写“新药申请评估报告”。
(4)药事管理与药物治疗学委员会召开有关会议,讨论所有新药申请资料,审核《新药申请表》和药学部门的“新药申请评估报告”,集体决定哪些申请提请新药引进评审专家会议审议。
(5)药事管理与药物治疗学委员会组织召开新药引进评审专家会议。
与会专家从药品遴选专家库中随机抽取,每次会议不少于15名。
讨论并对申请目录中的新药逐一进行实名制投票。
赞成票至少超过有效票数50%(不含50%)者视为该药通过最后审议,决定可纳入医疗机构基本用药供应目录。
会议实名制投票,讨论结果一式两份,集体签名,由监察部门和医疗机构药事管理和药物治疗学委员会秘书处分别保存。
(6)通过审议的药品由药学部整理,报医疗机构药事管理和药物治疗学委员会主任委员审批签字后纳入医疗机构基本用药供应目录。
5、审议通过的药品由药学部门限期执行采购,并交付所有药房使用。
药学部门必须按照《药品采购供应质量管理规范》,采取有效措施,保持药品的连续供应,保障临床用药。
6、遴选结果必须予以公开,公开形式由各医疗机构根据实际情况自行选择。
(二)品种替换药品生产厂家或经销商因各种原因不能向医疗机构正常供应基本用药目录中的药品时,原则上不得替换,特别是本机构现有基本用药供应目录已有同类或相类似作用的品种、中成药和辅助性药物泡括能量及营养成分补充药物、免疫增强剂、脑循环与促智药、活血化瘀类药物、抗肿瘤辅助药等)。
医疗机构确因临床需要,需替换不能正常供应的基本用药目录中药品的厂家、剂型或包装规格时,由药事管理部门提出申请,列出所有可供货的候选品种,注明是否入围等情况,由药事管理与药物治疗学委员会主任书面批准后方可临时购买。
基本用药目录中药品恢复供应时,应停止替换。
品种替换必须报医院药事管理与治疗学委员会审核。
长期替换必须经新药引进评审专家会议投票决定。
替换基本用药目录中正常供应的在用药品的厂家、剂型或包装规格时,按药品增补和新药引进程序执行。