有关碱式碳酸铜制备反应条件的讨论
- 格式:doc
- 大小:69.00 KB
- 文档页数:7

碱式碳酸铜的制备实验讨论引言碱式碳酸铜是一种重要的无机化合物,在电池、催化剂和材料科学等领域具有广泛应用。
本实验旨在通过化学反应的方法制备碱式碳酸铜,并对反应过程及产物进行分析和讨论。
实验目的1.掌握制备碱式碳酸铜的化学反应过程;2.分析并评估反应产物的性质与纯度。
实验原理碱式碳酸铜(Cu2(OH)2CO3)是由铜离子(Cu2+)与氢氧根离子(OH-)和碳酸根离子(CO32-)共同组成的化合物。
制备碱式碳酸铜的化学反应可以通过以下方程式表示:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 (1)Cu(OH)2 + CO2 → CuCO3 + H2O (2)方程式(1)表示了铜硫酸和氢氧化钠反应生成碱式铜(OH)2和硫酸钠。
方程式(2)描述了生成的碱式铜与二氧化碳反应生成碱式碳酸铜和水。
实验步骤材料与设备1.铜(II)硫酸(CuSO4);2.氢氧化钠(NaOH);3.二氧化碳气体(CO2);4.蒸馏水;5.烧杯、磁力搅拌器、漏斗。
实验步骤1.在一个烧杯中加入一定量的铜(II)硫酸溶液;2.加入适量的氢氧化钠溶液,并用磁力搅拌器搅拌均匀;3.通过漏斗向反应体系中通入二氧化碳气体,保持反应体系中气体的稳定流动;4.持续搅拌反应体系,直到观察到沉淀形成,并且反应液的pH值保持稳定;5.关闭通入二氧化碳气体的装置,收集沉淀;6.用蒸馏水反复洗涤沉淀,以去除杂质;7.将洗涤后的沉淀放置在低温烘箱中干燥,直至恒定重量。
实验结果与讨论在实验过程中,观察到反应液发生颜色变化,并观察到大量沉淀生成。
这些观察结果表明实验成功制备了碱式碳酸铜。
接下来对反应产物进行分析和讨论。
稳定性评估在制备碱式碳酸铜的实验过程中,通过通入二氧化碳气体来稳定反应体系,并促使反应进行。
通入二氧化碳是因为二氧化碳可以参与方程式(2)中的反应,生成稳定的碱式碳酸铜。
纯度评估为了评估产物的纯度,我们可以进行以下实验: 1. 测定产物的重量:通过称量产物的质量,可以得到产物的相对纯度。

碱式碳酸铜制备的实验报告一、实验目的1、掌握碱式碳酸铜的制备原理和方法。
2、熟悉沉淀生成、过滤、洗涤、干燥等基本实验操作。
3、培养观察实验现象、分析问题和解决问题的能力。
二、实验原理碱式碳酸铜的化学式为 Cu₂(OH)₂CO₃,呈绿色。
它可以通过硫酸铜(CuSO₄)溶液与碳酸钠(Na₂CO₃)溶液反应制得。
反应的化学方程式为:2CuSO₄+ 2Na₂CO₃+ H₂O = Cu₂(OH)₂CO₃↓ + 2Na₂SO₄+ CO₂↑在反应过程中,溶液中的铜离子(Cu²⁺)与碳酸根离子(CO₃²⁻)结合,同时受到溶液酸碱度的影响,生成碱式碳酸铜沉淀。
三、实验用品1、仪器:托盘天平烧杯(250 mL 2 个、100 mL 2 个)玻璃棒漏斗滤纸蒸发皿酒精灯三脚架石棉网药匙2、药品:硫酸铜晶体(CuSO₄·5H₂O)碳酸钠粉末(Na₂CO₃)四、实验步骤1、称取 125 g 硫酸铜晶体(CuSO₄·5H₂O),放入 100 mL 烧杯中,加入 50 mL 蒸馏水,用玻璃棒搅拌,使其完全溶解,得到硫酸铜溶液。
2、称取 53 g 碳酸钠粉末(Na₂CO₃),放入 100 mL 烧杯中,加入 20 mL 蒸馏水,用玻璃棒搅拌,使其完全溶解,得到碳酸钠溶液。
3、将碳酸钠溶液缓慢倒入硫酸铜溶液中,同时用玻璃棒不断搅拌。
可以观察到有浅蓝色沉淀生成,并伴有少量气泡产生。
4、继续搅拌一段时间,使反应充分进行。
然后静置,待沉淀完全沉降。
5、用普通漏斗进行过滤,将沉淀与溶液分离。
过滤时要注意“一贴、二低、三靠”。
6、用蒸馏水洗涤沉淀 2 3 次,以除去沉淀表面附着的杂质离子。
7、将沉淀转移到蒸发皿中,用小火加热,使沉淀干燥。
在加热过程中要不断搅拌,防止沉淀局部过热而分解。
8、当沉淀的颜色变为墨绿色,且不再有水分蒸出时,停止加热,冷却后得到碱式碳酸铜产品。
五、实验现象与记录1、混合硫酸铜溶液和碳酸钠溶液时,立即有浅蓝色沉淀生成,并伴有少量气泡产生。

碱式碳酸铜的制备实验报告碱式碳酸铜的制备实验报告引言:碱式碳酸铜是一种重要的无机化合物,具有广泛的应用领域,如催化剂、电池材料等。
本实验旨在通过化学反应制备碱式碳酸铜,并研究其形貌和性质。
实验步骤:1. 实验前准备:准备所需的实验器材和试剂,包括氢氧化钠溶液、硫酸铜溶液、乙醇、滤纸等。
2. 实验操作:(1) 将一定量的硫酸铜溶液加入容器中,并加入适量的氢氧化钠溶液。
(2) 搅拌溶液,观察溶液的变化。
(3) 加入适量的乙醇,继续搅拌。
(4) 过滤产物,用滤纸将固体和液体分离。
(5) 将固体产物洗涤干净,用乙醇洗涤数次,然后用滤纸吸干。
3. 实验结果:(1) 观察到溶液由蓝色逐渐变为深蓝色,形成了碱式碳酸铜的沉淀。
(2) 过滤后得到的固体产物呈现出细小的颗粒状,呈现出深蓝色。
4. 实验讨论:(1) 碱式碳酸铜的制备是通过反应溶液中的硫酸铜和氢氧化钠生成碱式盐沉淀的过程。
(2) 反应中加入乙醇是为了去除杂质,并使产物更纯净。
(3) 产物的颗粒状形态可能与反应条件、溶液浓度等因素有关,需要进一步研究。
5. 实验结论:通过本实验的操作,成功制备得到了碱式碳酸铜的沉淀。
产物呈现出深蓝色,具有细小的颗粒状形态。
这为进一步研究碱式碳酸铜的性质和应用提供了基础。
结语:本实验以制备碱式碳酸铜为目标,通过化学反应得到了深蓝色的碱式碳酸铜沉淀。
实验结果表明,碱式碳酸铜的制备是可行的,为后续研究和应用提供了基础。
然而,实验中仍存在一些问题,如产物形态的变化和纯度的提高,需要进一步探索和改进。
通过这个实验,我们不仅了解了碱式碳酸铜的制备方法,还培养了实验操作和观察分析的能力,为我们今后的科学研究和实践提供了有益的经验。

实验碱式碳酸铜的制备[实验目的]1.通过碱式碳酸铜制备条件的探求和生成物颜色、状态的分析,研究反应物的合理配料比并确定制备反应适合的温度条件,以培养独立设计实验的能力。
2.碱式碳酸铜为天然孔雀石的主要成分,呈暗绿色或淡蓝绿色,加热至200o C即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。
[实验原理]2CuSO4 + 2Na2CO3 + H2O=Cu2(OH)2CO3↓ + CO2↑ + Na2SO4碱式碳酸铜为天然孔雀石的主要成分,呈暗绿色或淡蓝绿色,加热至200℃即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。
[实验用品]仪器:试管、水浴锅、抽滤瓶、布氏漏斗、烧杯药品:0.5 mol·L-1的CuSO溶液、0.5 mol·L-1的Na2CO3溶液4材料:滤纸[实验内容]一、实验条件的探求1.温度对碱式碳酸铜制备的影响取8支试管分成两列,其中4支管内各放2 ml 0.5 mol·L-1的CuSO4溶液,另外4支管中各放2 ml 0.5 mol·L-1的Na2CO3溶液,分别成对置于40 ℃、55 ℃、70 ℃、85 ℃水浴中平衡一段时间,然后将CuSO4溶液倒入Na2CO3溶液的试管中,振荡,再放入各自水浴中,观察沉淀的生成及其转变的快慢、沉淀的颜色。
由实验结果得出最佳实验条件。
2.CuSO4和Na2CO3配比的影响取8支试管分成两列,其中4支试管内各加入2 ml 0.5 mol·L-1CuSO4溶液,另外4支分别加入1.6 ml、2.0 ml、2.4 ml、2.8 ml 0.5 mol·L-1Na2CO3溶液,分别成对置于你所选定温度的水浴中,平衡一段时间后,依次将CuSO4溶液分别倒入Na2CO3溶液的试管中,振荡,观察各试管生成沉淀的颜色、多少及转化的快慢,确定你的配比。
二、碱式碳酸铜的制备取2只250 ml烧杯,分别加入100 ml、0.5 mol·L-1CuSO4溶液及你所选择的配比加入0. 5 mol·L-1Na2CO3溶液,置于你所选定的温度的水浴中平衡,然后将CuSO4溶液倒入Na2CO3溶液的烧杯中,等沉淀下沉后,用倾泌法洗涤沉淀数次,抽滤,用水洗至滤液中不含SO42-为止,将所得产品于50 ℃左右烘1小时,称量,计算产率。
![碱式碳酸铜的制备[1]](https://img.taocdn.com/s1/m/3eca83d8846a561252d380eb6294dd88d1d23d4f.png)
碱式碳酸铜的制备[1]碱式碳酸铜是一种常见的无机化合物,具有广泛的应用,如电镀、颜料、催化剂等。
本文介绍了碱式碳酸铜的制备方法及其影响因素。
一、基本介绍碱式碳酸铜是一种绿色粉末状的固体,化学式为Cu2(OH)2CO3,分子量为221.11。
它是一种典型的碱性盐类,可以在中性或酸性溶液中水解产生碱性。
由于具有多种化学性质,在工业生产和实验室使用中广泛应用,如化学镀铜、颜料、催化剂等。
二、制备方法1. 热水法热水法是制备碱式碳酸铜的常用方法。
具体步骤如下:步骤一:准备反应溶液。
将适量的碳酸铜溶解在热水中,调节pH值为7-8,并加入一定量的氨水或氢氧化钠,使反应溶液保持碱性。
步骤二:加入碳酸钠。
将适量的碳酸钠粉末缓慢加入反应溶液中,同时用搅拌器搅拌,使其充分混合。
加入足够的碳酸钠可以使反应溶液中的氯离子沉淀为氯化铜,并转化为碳酸铜离子。
步骤三:滤液和洗涤。
将反应溶液过滤,收集沉淀。
使用蒸馏水和乙醇等流动不良的洗涤液进行洗涤,以去除任何未能反应的杂质。
步骤四:干燥。
将洗涤后的沉淀风干或烘干,直到制得的碱式碳酸铜呈现出绿色粉末状态。
2. 氨水沉淀法步骤二:加入氨水。
将适量的氨水缓慢滴入反应溶液中,同时用搅拌器搅拌。
步骤三:沉淀和洗涤。
在溶液中产生的碳酸铜沉淀经粗略过滤后,立即用蒸馏水洗涤,以去除任何未能反应的杂质。
此时,沉淀的颜色从蓝色逐渐变为绿色。
三、影响因素碱式碳酸铜的制备受多种因素的影响,包括反应溶液的酸碱度、原料比例、反应时间和温度等。
以下是一些影响因素的详细解释:1. pH值制备碱式碳酸铜的反应需要在弱碱性的条件下进行。
当反应溶液中的pH值偏高时,会促使碳酸根离子与氢氧根离子(xOH-) 发生酸碱反应,生成水和二氧化碳分子。
因此,过高的pH值会降低碳酸根离子的浓度,从而减少沉淀的产生。
2. 原料比例碳酸铜和碳酸钠的摩尔比例是制备碱式碳酸铜的关键因素,也是影响反应速率和沉淀质量的因素。
对于时效性较短的化学试剂,过高或过低的摩尔比可能导致反应时间不足或反应过度,从而影响沉淀的产生。

碱式碳酸铜制取碱式碳酸铜(又称碱式硫酸铜、碱式铜碳酸盐)是一种重要的无机化合物,广泛应用于颜料、催化剂、防腐剂等领域。
它由硫酸铜和碱性物质反应得到,其制备过程相对简单,但仍需要严格控制反应条件以获得高纯度的产物。
本文将详细介绍碱式碳酸铜的制备方法及其相关知识。
一、碱式碳酸铜的化学性质碱式碳酸铜的化学式为Cu2(OH)2CO3,其结构中包含两个Cu(OH)2基团和一个CO32-离子。
由于其中的铜离子(Cu2+)在溶液中呈现强还原性,碱式碳酸铜具有一定的催化性能,能够促进许多有机反应的进行。
此外,它还具有良好的稳定性和可溶性,是一种重要的无机化合物。
二、制备方法碱式碳酸铜的制备方法主要有常规沉淀法和气相沉淀法两种。
1. 常规沉淀法制备碱式碳酸铜的常用方法是将适量的硫酸铜溶液和碳酸盐溶液缓慢混合,控制pH值在特定的范围内。
具体步骤如下:(1)将一定量的硫酸铜溶液加入容器中;(2)将碳酸盐溶液缓慢滴加到硫酸铜溶液中,同时用磁力搅拌使反应均匀进行;(3)调节溶液的pH值,通常在8-10之间,可以通过添加碱性物质(如氢氧化钠或氨水)来实现;(4)继续搅拌反应混合液,并保持适当的温度,通常在室温下进行;(5)反应一段时间后,通过过滤将沉淀分离出来,并用纯水洗涤去除杂质;(6)将洗涤后的沉淀干燥得到纯净的碱式碳酸铜。
2. 气相沉淀法气相沉淀法是一种较新的碱式碳酸铜制备方法,其优点是反应速度快、操作简单,并且可以得到高纯度的产物。
具体步骤如下:(1)将适量的碳酸铜溶解于水中,制备成浓溶液;(2)将浓溶液通过喷雾器喷入高温炉中,使其成为微小颗粒;(3)在高温炉中,将氨气与空气混合并进行燃烧,生成氨气的氢氧化反应;(4)将燃烧后的气体通过喷嘴引入炉内,与碳酸铜颗粒进行反应;(5)反应后得到的碱式碳酸铜颗粒通过过滤和洗涤,最终干燥得到纯净的产物。
三、注意事项在进行碱式碳酸铜制备时,需要注意以下几个方面:1. 反应条件的控制:包括溶液pH值、温度、反应时间等,这些因素会影响产物的纯度和收率,应根据实际情况进行调整。

碱式碳酸铜的制备实验现象及结论
1、实验过程与现象;分别称取12.5gCuSO4·5H2O,
14.3gNa2CO3·10H2O,各配成200mL溶液(溶液浓度为
0.25mol·L-1).在室温下,把Na2CO3溶液滴加到CuSO4溶液中,并搅拌,用红色石蕊试纸检验溶液至变蓝为止,得到蓝色沉淀.抽滤,用水洗沉淀,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝色晶体.该晶体的主要成分为5CuO·2CO2.如果使沉淀与
Na2CO3的饱和溶液接触数日,沉淀将转变为Cu(OH)2。
如果先加热Na2CO3溶液至沸腾,滴加CuSO4溶液时会立即产生黑色沉淀.如果加热CuSO4溶液至沸腾时滴加Na2CO3溶液,产生蓝绿色沉淀,并一直滴加Na2CO3溶液直至用红色石蕊试纸检验变蓝为止,但条件若控制不好的话,沉淀颜色会逐渐加深,最后变成黑色。
如果不加热溶液,向CuSO4溶液中滴加Na2CO3溶液,并用红色石蕊试纸检验至变蓝为止,然后加热,沉淀颜色也易逐渐加深,最后变成黑色.出现黑色沉淀的原因可能是由于产物分解成CuO的缘故.因此,当加热含有沉淀的溶液时,一定要控制好加热时间。
2、实验结论;在稀的硫酸铜溶液中加入碳酸钠,或将二氧化碳通入氢氧化铜悬浮液中,都可得到碱式碳酸铜沉淀。


无机化学实验中碱式碳酸铜的制备方法探讨碱式碳酸铜是一种重要的无机化合物,在无机化学实验中经常被用于制备其他铜化合物或者作为催化剂。
下面将探讨一种常用的制备碱式碳酸铜的方法。
实验所需的试剂和设备如下:1.碳酸氢铵(NH4HCO3)2.硝酸铜(Cu(NO3)2)3.高锰酸钾(KMnO4)4.烧杯、玻璃棒、移液管等基本实验设备实验步骤:1.首先,准备两个烧杯。
一个用来提供氨气,另一个用来反应。
2.在第一个烧杯中加入约1g的碳酸氢铵,并加入适量的蒸馏水溶解。
3.将第二个烧杯放在第一个烧杯上,并在两个烧杯之间加入适量的高锰酸钾。
高锰酸钾可以作为氨气产生的驱动剂。
4.用玻璃棒将两个烧杯密封,并等待几分钟。
在这个过程中,高锰酸钾会氧化铵离子,产生氨气。
5.当烧杯内压力增加时,可以轻轻移动第二个烧杯,使氨气传递到第二个烧杯中。
6.接下来,在第二个烧杯中加入适量的硝酸铜溶液,并使用玻璃棒搅拌。
7.在搅拌的同时,可以观察到溶液的颜色由蓝色逐渐转变为绿色。
这是由于氨气与硝酸铜反应生成碱式碳酸铜的结果。
8.继续搅拌,并加热溶液。
在加热的过程中,可以观察到溶液变浓,直到出现沉淀。
9.当溶液开始沉淀时,停止加热,并继续搅拌一段时间。
10.最后,用玻璃棒将沉淀收集并过滤。
11.沉淀可以通过水洗和乙醚或醇的洗涤来去除杂质。
12.最后,将沉淀放置在通风处晾干,以得到纯净的碱式碳酸铜。
制备碱式碳酸铜的关键是氨气的生成。
在实验中,我们利用高锰酸钾作为氨气的产生剂。
高锰酸钾通过氧化铵离子产生氨气,而铵离子则来自于碳酸氢铵。
氨气与硝酸铜反应生成碱式碳酸铜,反应过程中会有气体的放出。
加热溶液有助于溶质的溶解和沉淀的形成。
最后,通过过滤、洗涤和干燥等步骤,可以得到纯净的碱式碳酸铜。
总之,以上是一种常用的制备碱式碳酸铜的方法。
此方法简单可行,经济实用,并且可以得到较高纯度的产物。
在无机化学实验中,制备碱式碳酸铜的方法是非常重要且常用的,为后续实验提供了基础材料。

碱式碳酸铜实验报告碱式碳酸铜实验报告引言:碱式碳酸铜是一种重要的无机化合物,具有广泛的应用领域。
本实验旨在通过合成和表征碱式碳酸铜,深入了解其结构和性质,并通过实验结果验证理论知识。
实验部分:1. 实验材料和仪器本次实验所需材料有:氢氧化铜、碳酸氢铵、蒸馏水等。
仪器有:烧杯、试管、玻璃棒、移液管等。
2. 实验步骤(1) 准备工作:将所需材料准备齐全,清洗干净,以免产生杂质。
(2) 合成碱式碳酸铜:先将适量的氢氧化铜溶解于蒸馏水中,加热搅拌使其充分溶解,再逐滴加入碳酸氢铵溶液,同时继续搅拌。
观察到溶液由蓝色逐渐变为浑浊的深蓝色。
停止加入碳酸氢铵后,继续搅拌一段时间,使反应充分进行。
(3) 沉淀分离:将反应液静置,观察到溶液中出现蓝色沉淀,即为碱式碳酸铜。
用玻璃棒轻轻搅拌,使沉淀均匀分布。
(4) 洗涤沉淀:将沉淀转移到试管中,加入适量蒸馏水,摇晃试管使沉淀悬浮于水中,然后用玻璃棒轻轻搅拌,使沉淀充分洗涤。
(5) 干燥沉淀:将洗涤后的沉淀倒入烧杯中,用适当的温度和时间进行干燥,直至沉淀完全干燥。
结果与讨论:1. 实验结果观察通过实验,我们成功合成了碱式碳酸铜。
在反应过程中,观察到溶液由蓝色逐渐变为深蓝色,并出现蓝色沉淀。
这些观察结果与我们的预期相符。
2. 结构和性质分析碱式碳酸铜的化学式为Cu2(OH)2CO3,属于一种碱式盐。
它具有蓝色的颜色,是由于其中的铜离子所致。
其结构中含有两个氢氧化铜离子和一个碳酸根离子,形成了一个稳定的化合物。
碱式碳酸铜在溶液中不稳定,容易分解成氢氧化铜和二氧化碳。
3. 实验结果验证通过实验结果,我们验证了碱式碳酸铜的合成过程和结构。
实验中,我们首先将氢氧化铜溶解于蒸馏水中,这是因为氢氧化铜在水中具有较好的溶解性。
随后,我们逐滴加入碳酸氢铵溶液,这是因为碳酸氢铵可以提供碳酸根离子,与氢氧化铜反应生成碱式碳酸铜。
最后,我们观察到溶液中出现蓝色沉淀,这是由于碱式碳酸铜的生成。
结论:通过本次实验,我们成功合成了碱式碳酸铜,并观察到了其特征性蓝色沉淀。

无机化学实验中碱式碳酸铜的制备方法探讨碱式碳酸铜(cupric carbonate)是一种无机化合物,主要成份是铜和碳酸盐,是由铜离子(Cu^2+)和碳酸根(COCO3^2-)组成。
它以淡黄绿色结晶化合物出现,是广泛应用于无机合成、制药、催化、着色剂和电镀工业等领域的重要物质。
高纯度的碱式碳酸铜可以用于高级材料的制备,具有抗结晶能力、耐酸、腐蚀抗性高等特点。
一、实验原理碱式碳酸铜的制备是以碳酸钠(Na2CO3)为碱,以铜盐(CuSO4)为酸的反应过程,两者的反应物形式为:Na2CO3 + CuSO4 = CuCO3 + Na2SO4反应物之间存在明显的物理化学反应,在反应过程中,可以看到碳酸钠逐渐溶解,直至反应物完全消解。
同时,反应温度升高,反应产物也不断沉淀,即碱式碳酸铜,从而实现碱式碳酸铜的制备。
二、实验步骤(1)准备实验用具和材料:准备碱性和酸性的实验用具和材料,即Na2CO3,CuSO4,混合容器,搅拌器,烧杯,滴定管,蒸馏装置等;(2)将Na2CO3和CuSO4分别加入搅拌容器中,以滴定管定量加入;(3)将滴定管中的Na2CO3和CuSO4混合,然后将混合液加入烧杯中;(4)烧杯中的混合液加热,调节温度,使混合液蒸发;(5)将烧杯中的精确的混合液用凝胶过滤装置中的滤袋过滤,获得混合液的渣滓;(6)将渣滓中的碱式碳酸铜晾干,然后用滤纸将其分离,保存入干燥箱中,以备使用。
三、实验结果(1)最终用凝胶过滤装置中的滤袋过滤后,从渣滓中可以获得碱式碳酸铜,其外观为淡黄绿色的结晶化合物;(2)将获得的碱式碳酸铜放入干燥箱中进行干燥,经过多次升温、保温、降温操作后,最终收获的碱式碳酸铜的结晶率达到80%左右;(3)经滤纸分离后,碱式碳酸铜的晶形表现出较为丰满,小晶体结晶后整体表现出客观美而洁净,外观质量良好。
四、实验结论本次实验成功制备出碱式碳酸铜,该碱式碳酸铜具有较为纯净的外观质量,结晶率达到80%左右,能够满足一定的实验和应用要求。

碱式碳酸铜是一种非常重要的金属酸,更多地用于合成有机物中,它
有着明显的非对映反应,在有机合成中扮演着不可或缺的角色。
因此,在大学课程中,如无机化学实验中,碱式碳酸铜的制备技术也被用来
让学生们更加深入的理解。
碱式碳酸铜通常由铜氧化物(如CuO或Cu2O)在碱性溶液(如氢氧
化钠溶液)中氧化而制得,大学实验室中常用来制备该盐的方法是采
用固体化学路线,即先将铜氧化物和碱水解为铜根离子和碱根离子,
然后将碱溶液中的碱根离子与铜根离子反应形成碱式碳酸铜。
采用这
种方法制备碱式碳酸铜的一般步骤如下:
首先,将比较细的碱氧化物(如CuO)定容入实验烧杯中,然后加入
适量的碱液。
接下来,将注入的各类溶液搅拌均匀,搅拌后,烧杯内
形成大量热量,使得溶液变得很热,碱溶液中的碱根离子与铜根离子
反应形成碱式碳酸铜,现在把烧杯中的溶液冷却,碱式碳酸铜结晶就
会形成,最后使用过滤装置将碱式碳酸铜收集并晾干,就可以得到所
需的碱式碳酸铜了。
经过上述方法的操作,便可以准确的制备出碱式碳酸铜,它具有较高
的活性和纯度,为实验室中制备其它金属酸打下基础。
总之,碱式碳酸铜的制备方法在大学实验室中有着重要意义,它既可
以帮助学生们更加深入的理解反应机理,又能有效的制备出高纯度的
碱式碳酸铜,为未来实验室中其它金属酸的制备奠定基础。

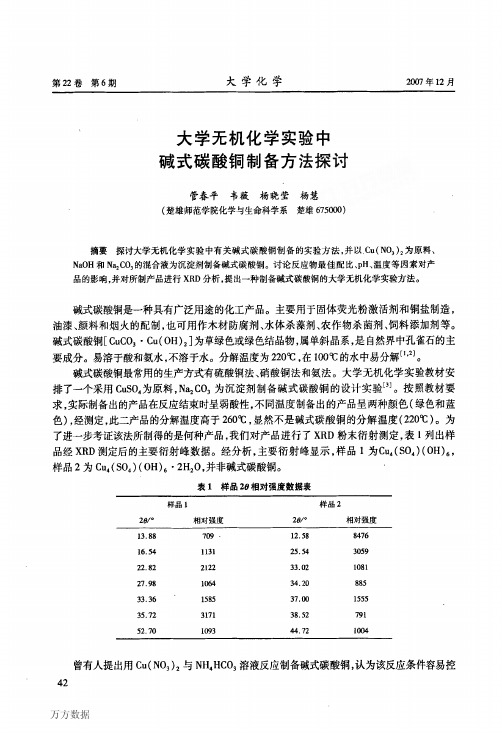
碱式碳酸铜的制备[摘要]探究大学无机化学实验中有关碱式碳酸铜制备的实验方法,碱式碳酸铜制备实验的最佳反应条件,讨论反应的最佳配比,以及生成物颜色、状态、温度等因素对碱式碳酸铜的影响。
本实验目的在于通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析,研究反应物的合理配料比,确定制备反应的合适温度条件,以培养独立设计实验的能力.[关键词]碱式碳酸铜;制备;反应条件;温度;配料比;产率;【前言】碱式碳酸铜化学式为CU 2(OH )2CO 3,分子量为221.12美观的绿色粉末状晶体. 相对密度为3.8525,加热至220℃时分解.不溶于水和乙醇,溶于酸形成相应的铜盐,溶于氰化物、氨水、铵盐和碱金属碳酸盐的水溶液中,形成铜的配合物.在水中煮沸或在强碱溶液中加热时则可生成褐色的氧化铜.可与硫化氢反应生成硫化铜.在自然界中以孔雀石的形式存在.(1)碱式碳酸铜是一种具有广泛用途的化工产品。
其主要用于制造油漆、颜料、烟火、杀虫剂、其他铜盐和固体荧光粉激活剂等,也用于种子处理及作杀菌剂等.(2)碱式碳酸铜为天然孔雀石的主要成分,呈暗红色或淡蓝色,加热至200℃即分解。
(3)碱式碳酸铜属单斜晶系,易溶于酸和氨水,在水中溶解度很小,新制备的试样在沸水中很易分解。
(4)碱式碳酸铜最常用的生产方式有硫酸铜法,硝酸铜法和氨法。
制备碱式碳酸铜有如下的的几种方法:①由Na 2CO 3·10H 2O 跟CuSO 4·5H 2O 反应制备②由Na 2CO 3溶液跟CuSO 4溶液反应制备③由NaHCO 3跟CuSO 4·5H 2O 反应制备④由Cu (NO 3)2跟Na 2CO 3反应制备在此,我采用由Na 2CO 3溶液跟CuSO 4溶液反应制备并计算其产率。
。
[正文]1.实验原理:碱式碳酸铜制备的原理: CuSO 4·5H 2O 与Na 2CO 3在合适的配比及温度下反应:↑++↓=++2423222324CO SO 2Na CO (OH)Cu O H CO 2Na 2CuSO2.用品(1)药品: CuSO 4·5H 2O, Na 2CO 3(s);蒸馏水(2)仪器:台秤,容量瓶(250ml ),胶头滴管,烧杯,带标号的试管(10支),玻璃棒,水浴锅,布氏漏斗及吸滤瓶,恒温水浴箱,循环水真空泵,移液管,洗耳球,(3)材料:滤纸,纸条.3.实验步骤(1)溶液的配制称取12.5g CuSO4固体和5.3g Na2CO3固体,分别溶解于两支烧杯中后转移至100ml容量瓶,定容,摇匀.CuSO4·5H2O的质量:m=MCV=250×0.1×0.5g=12.5gNa2CO3固体的质量:m=MCV=106×0.1×0.5g=5.3g(2)反应合适条件的探究①反应物合适配比的探究在4支小试管中分别加入2.0ml 0.5mol/L的CuSO4(aq),再将1.6ml,2.0ml,2.4ml,2.8ml 0.5mol/L的Na2CO3(aq)分别加入到另外的4支小试管中.75℃水浴数分钟后依次将CuSO4(aq)倒入Na2CO3(aq)中,振荡,比较沉淀生成速度、状态、数量及颜色,选择合适配比.②合适反应温度的探究在5支小试管中分别加入 2.0ml 0.5mol/L的CuSO4(aq),再将合适配比的Na2CO3(aq)置于另5支试管中,分为5组,分别于室温、40℃水浴、60℃水浴、80℃、100℃下静置片刻,后将CuSO4(aq)倒入Na2CO3(aq)中,振荡,比较沉淀生成速度、状态、数量及颜色,确定合适温度.(3)碱式碳酸铜的制备取30ml 0.5mol/L的CuSO4(aq)及36ml 0.5mol/L的Na2CO3(aq)在60℃下水浴,至溶液明显分层且上层液体无色澄清时沉淀完全,用清洗法洗涤沉淀数次至检测不出SO42-,抽滤,100℃烘干半小时,待干燥,称量计算产率.4.实验数据的记录与处理根据表4.2沉淀颜色得到最佳温度为60℃;5.实验讨论(1)根据沉淀的数量所得:实验中沉淀生成的速度很快,区分不同配比之间的速度快慢有一定困难;沉淀生成的颜色均为蓝色,且放置一段时间后,颜色均变为绿色,此项也不能作为配比依据.沉淀的数量开始无明显差别,但放置一段时间,合适配比中生成较多颗粒沉淀;(2)根据沉淀生成的颜色知,当T<60℃,所得产品颜色偏蓝;当T>80℃时,产品的颜色偏绿,并会伴随沉淀;而60℃时数量和质量都比较好。

碱式碳酸铜的制备实验讨论一、实验目的二、实验原理三、实验步骤四、实验结果与分析五、实验注意事项一、实验目的:1.了解碱式碳酸铜的制备方法和反应原理;2.掌握测定产物质量和纯度的方法;3.培养仔细认真,精益求精的科学态度。
二、实验原理:碱式碳酸铜是一种蓝色固体,化学式为Cu2(OH)2CO3,又称基本铜碳酸盐。
它是由氢氧化铜和碳酸钠在水中反应制得。
反应方程式为:Cu(OH)2 + Na2CO3 → CuCO3·Cu(OH)2↓ + 2NaOH在这个反应中,氢氧化铜和碳酸钠先发生双替换反应生成碱式碳酸铜和氢氧化钠。
随后,由于Cu(OH)2不溶于水,在溶液中逐渐沉淀形成蓝色固体。
三、实验步骤:1.称取适量的Na2CO3溶解于足量去离子水中;2.称取适量的CuSO4·5H2O加入到Na2CO3溶液中,搅拌使反应充分进行;3.用滤纸将沉淀过滤,用足量去离子水洗涤干净;4.将过滤得到的固体放入烘箱中烘干至恒重。
四、实验结果与分析:1.实验数据记录表:试剂名称质量/gNa2CO3CuSO4·5H2OCuCO3·Cu(OH)22.实验结果分析:通过称取的质量计算,可以得出制备出来的碱式碳酸铜的产率。
同时,通过对产物的外观、颜色等特征进行观察,可以初步判断制备是否成功。
最后,通过测定产物的质量和纯度,可以进一步确认制备出来的碱式碳酸铜的质量和纯度。
五、实验注意事项:1.操作时要注意安全,避免接触皮肤和吸入粉尘;2.称取试剂时要精确,并注意防潮;3.反应容器要干燥无油无水;4.反应过程中需要充分搅拌以保证反应充分进行;5.过滤时要注意不要让固体溶解或者带走太多水分;6.烘干时温度要控制在适宜范围内,避免产物分解或者燃烧。

碱式碳酸铜制备方案的探索张谦(武汉大学化学与分子学院)摘要:对碱式碳酸铜的制备方案进行了探索。
依次对原料配比.反应最适温度.投料方式进行了探索。
得出了最佳方案:原料配比CuSO4:NaCO3=1:1.2,反应温度70摄氏度,投料方式一次性加入。
40mL0.5mol/LCuSO4制得1.77g碱式碳酸铜,产率79.7%。
为了寻求碱式碳酸铜的最佳制备方案,练习各项实验操作,提升实验设计和操作能力,以硫酸铜和碳酸钠为原料,进行了该探究。
1.实验部分1.1实验试剂硫酸铜碳酸钠蒸馏水1.2实验仪器抽滤装置试管若干100毫升烧杯两个水浴装置加热装置1.3实验方法原理:2CuSO4+2NaCO3+H2O = Cu2(OH)2CO3+2Na2SO4+CO2配置0.5摩尔每升硫酸铜溶液,0.5摩尔每升碳酸钠溶液1.原料配比的确定取4只试管分别加入0.5摩尔每升硫酸铜溶液2毫升,另取上述碳酸钠溶液2mL.2.2mL.2.4mL.2.6ml于试管中,并标号1234。
分别把硫酸铜加入1234四只试管中,振荡搅拌使之充分反应。
抽滤称重。
2反应温度的确定取4只试管分别加入2毫升0.5摩尔每升硫酸铜溶液,另取四只试管加入上步确定的最佳碳酸钠量,试管标号1234。
1234四组分别在50.60.70.80摄氏度的水浴中反应,观察产物,抽滤称重。
3投料方式探索取六只试管,分为两组,按上步加入相应量的硫酸铜溶液和碳酸钠溶液,加碳酸钠的试管分别标号123 ,将试管均置于最适温度的水浴中。
将硫酸铜一次性投入1号试管中,分2次投入2号管中,逐滴滴入3号试管中,观察记录反应所耗时间。
4按照上述条件取40毫升硫酸铜溶液制备碱式碳酸铜。
记录产量计算产率。
2.结果和讨论2.1配比确定不同配比结果:(1:1,1:1.1,1:1.2,1:1.3)3>>4>2>1。
硫酸铜与碳酸钠配比为1:1.2时产量最高2.2温度确定结果:均迅速反应80度时试管壁上有大量褐色物质生成。

碱式碳酸铜制备的注意事项
1.碱式碳酸铜的制备需要使用高纯度的碳酸铜和碱性溶液,因此在制备前需要对原材料进行严格的筛选和检测。
2. 制备过程中需要注意溶液的浓度和温度,控制好反应速率和反应条件,避免出现不必要的化学反应。
3. 制备过程中需要注意反应容器的选择和使用,应该选用耐腐蚀性好的材料,并保持反应容器的干净和无污染。
4. 制备后需要对产物进行严格的检测和分析,确保其纯度和品质符合要求。
5. 在使用碱式碳酸铜时需要注意安全问题,避免其接触皮肤和吸入其粉尘,以免产生不良反应和伤害。
6. 碱式碳酸铜应储存于干燥、阴凉、通风良好的地方,避免与其他化学品混放,以免产生不必要的危险。
- 1 -。

有关碱式碳酸铜制备反应条件的讨论[摘要]探讨大学无机化学实验中有关碱式碳酸铜制备的实验方法, 碱式碳酸铜的制备实验的最佳反应条件,讨论反应物最佳配比、温度、加料方式、pH等因素对产品的影响。
[关键词] 碱式碳酸铜; 制备;反应条件[前言]碱式碳酸铜是一种具有广泛用途的化工产品。
主要用于固体荧光粉激活剂和铜盐制造,油漆、颜料和烟火的配制,也可用作木材防腐剂、水体杀藻剂、农作物杀菌剂、饲料添加剂等[1]。
碱式碳酸铜Cu2(OH)2CO3为天然孔雀石的主要成分,呈暗红色或淡蓝色(由于所含成分Cu (OH)2和CuCO3的比例不同,而颜色不同),加热至200℃即分解,碱式碳酸铜[CuCO3·Cu (OH)2 ]属单斜晶系。
易溶于酸和氨水,在水中溶解度很小,新制备的试样在沸水中很易分解[2.3]。
碱式碳酸铜最常用的生产方式有硫酸铜法、硝酸铜法和氨法。
大学无机化学实验教材安排了一个采用CuSO4为原料,Na2CO3为沉淀剂制备碱式碳酸铜的设计实验[4]。
[正文]1实验原理为了适于碱式碳酸铜的生成和离取,根据碱式碳酸铜的性质和铜盐的性质,选用硫酸铜溶液和碳酸钠溶液。
其反应方程式如下:2CuSO4+2NaCO3+H2O水浴加热Cu2(OH)2CO3+CO2↑+2NaSO4反应过程中,反应温度、反应物浓度及反应物配比对反应物均有影响。
2实验仪器带标号的试管;烧杯(250mL);容量瓶(250mL);恒温水浴锅(YXS型,余姚长江温度仪表厂)。
3反应物配比的探究3·1反应溶液的配置配置0.5mol/L的CuSO4溶液和0.5mol/L Na2CO3溶液各250mL。
称取固体药品硫酸铜31.2110g和碳酸钠13.2488g,分别倒入两个250mL的烧杯中,用100mL蒸馏水溶解,再转入250mL容量瓶中,配成250mL溶液。
静置,备用。
3·2反应物合适配比取五只已编号的试管,均加入2.0mL的0.5mol/L的CuSO4溶液,再分别取0.5mol/L Na2CO3溶液1.6mL、2.0mL、2.4mL、2.8mL及3.2mL依次加入另外五只编号的试管中。

碱式碳酸铜的制备及条件探究以碱式碳酸铜的制备及条件探究为题,本文将探讨碱式碳酸铜的制备方法以及影响制备过程的条件。
碱式碳酸铜是一种重要的无机化合物,具有广泛的应用领域,如化学试剂、催化剂、颜料等。
其制备方法主要有化学反应和物理方法两种。
化学反应方法是最常见的制备碱式碳酸铜的方法之一。
其中一种常见的化学反应是通过碱式化合物和碳酸盐反应生成碱式碳酸铜。
具体的反应方程式为:碱式化合物 + 碳酸盐→ 碱式碳酸铜 + 无机盐在实际制备过程中,可以选择不同的碱式化合物和碳酸盐进行反应。
常用的碱式化合物有氢氧化铜、碳酸铜,常用的碳酸盐有碳酸钠、碳酸钾等。
根据反应方程式,可以选择不同的碱式化合物和碳酸盐的配比,以获得所需的碱式碳酸铜。
除了化学反应方法,物理方法也可以用于制备碱式碳酸铜。
其中一种常见的物理方法是沉淀法。
该方法通过将含有铜离子的溶液与碳酸盐混合,使碳酸铜沉淀出来。
然后通过过滤、洗涤和干燥等步骤,得到纯净的碱式碳酸铜。
制备碱式碳酸铜的条件对于产率和纯度等方面都有一定的影响。
其中,反应温度是一个重要的条件。
在大多数情况下,反应温度越高,反应速率越快,但也可能导致副反应的发生。
因此,在选择反应温度时需要权衡速率和产物纯度之间的关系。
反应时间也是一个重要的条件。
反应时间过长可能导致副反应的发生,而反应时间过短则可能导致产率不高。
因此,在实际操作中需要根据具体情况选择合适的反应时间。
反应物的摩尔比也会影响到碱式碳酸铜的制备。
不同的摩尔比会导致不同的产物生成,因此需要根据所需的碱式碳酸铜的配比选择合适的摩尔比。
总结起来,碱式碳酸铜的制备方法包括化学反应和物理方法,其中化学反应方法是最常见的制备方法。
制备碱式碳酸铜的条件包括反应温度、反应时间和反应物的摩尔比等。
在实际操作中,需要根据具体情况选择合适的制备方法和条件,以获得所需的碱式碳酸铜。
有关碱式碳酸铜制备反应条件的讨论
[摘要]探讨大学无机化学实验中有关碱式碳酸铜制备的实验方法, 碱式碳酸铜的制备实验的最佳反应条件,讨论反应物最佳配比、温度、加料方式、pH等因素对产品的影响。
[关键词] 碱式碳酸铜; 制备;反应条件
[前言]
碱式碳酸铜是一种具有广泛用途的化工产品。
主要用于固体荧光粉激活剂和铜盐制造,油漆、颜料和烟火的配制,也可用作木材防腐剂、水体杀藻剂、农作物杀菌剂、饲料添加剂等[1]。
碱式碳酸铜Cu2(OH)2CO3为天然孔雀石的主要成分,呈暗红色或淡蓝色(由于所含成分Cu (OH)2和CuCO3的比例不同,而颜色不同),加热
至200℃即分解,碱式碳酸铜[CuCO3·Cu (OH)2 ]属单斜晶系。
易溶于酸和氨水,在水中溶解度很小,新制备的试样在沸水中很易分解[2.3]。
碱式碳酸铜最常用的生产方式有硫酸铜法、硝酸铜法和氨法。
大学无机化学实验教材安排了一个采用CuSO4为原料,Na2CO3为沉淀剂制备碱式碳酸铜的设计实验[4]。
[正文]
1实验原理
为了适于碱式碳酸铜的生成和离取,根据碱式碳酸铜的性质和铜盐的性质,选用硫酸铜溶液和碳酸钠溶液。
其反应方程式如下:
2CuSO4+2NaCO3+H2O水浴加热Cu2(OH)2CO3+CO2↑+2NaSO4
反应过程中,反应温度、反应物浓度及反应物配比对反应物均有影响。
2实验仪器
带标号的试管;烧杯(250mL);容量瓶(250mL);恒温水浴锅(YXS型,余姚长江温度仪表厂)。
3反应物配比的探究
3·1反应溶液的配置
配置0.5mol/L的CuSO4溶液和0.5mol/L Na2CO3溶液各250mL。
称取固体药品硫酸铜31.2110g和碳酸钠13.2488g,分别倒入两个250mL的烧杯中,用100mL蒸馏水溶解,再转入250mL容量瓶中,配成250mL溶液。
静置,备用。
3·2反应物合适配比
取五只已编号的试管,均加入2.0mL的0.5mol/L的CuSO4溶液,再分别取0.5mol/L Na2CO3溶液1.6mL、2.0mL、2.4mL、2.8mL及3.2mL依次加入另外五只编号的试管中。
将十只试管放在70℃恒温水浴中加热。
几分钟后,依次将CuSO4溶液分别倒入Na2CO3溶液中,振荡试管,比较各试管沉淀生成的速度、沉淀的数量及颜色。
用精密pH 试纸检测pH 值。
实验结果:
Cu2(NO3)2与Na2CO3物料配比对反应的影响
图表表明,当CuSO4与Na2CO3摩尔比为2.0:2.4 即1.0:1.2 时,所得产品品质较好,且收率高,故确定1.0:1.2 为最佳原料比。
3·3 温度对反应的影响
取5 只已编号的试管,均加入2.0mL 0.5mol/L 的CuSO4溶液,再分别取5 只试管,均加入2.4mL 的Na2CO3溶液,将其中一组放在室温(25℃)下静置,其他四组分别放入40℃,60℃,70℃,85℃的恒温水浴锅中加热,待温度均达到预定温度时,将第一组在室温条件下将CuSO4溶液缓慢倒入Na2CO3溶液中进行混合,而其它四组分别在预设温度下进行混合,然后振荡使其充分反应,观察其反应速度。
待充分反应后,将已编号的试管放入离心机中进行离心分离。
最后取出观察比较各试管中沉淀的多少,沉淀颜色。
实验结果:
温度对反应的影响
由表3 可知:CuSO4与Na2CO3
反应时,当T<60℃,所得产品颜色偏蓝,且颗粒大小不是很均匀,这
是由于温度过低会生成的大多为无定形产品;当T>85℃,产品的颜色偏绿但会伴随有黑色沉淀,这是由于温度多高生成了杂质CuO。
而反应温度在60℃时在品质和量上都较好,所以CuSO4和Na2CO3的最佳反应温度是60℃。
3·4 加料方式对产品影响
取三支试管,均加入2mL0.5mol/L 的CuSO4溶液,再取三支试管分别加入2.4mL0.5mol/L 的Na2CO3溶液,将这两列试管放入预先已加热到60℃的恒温水浴锅中加热。
然后两列试管中各取一支,将CuSO4
溶液迅速以一次加料的方式倒入Na2CO3溶液中,使之在60℃反应.再各取一支试管,以每次1/2 量的方式分两次将CuSO4溶液加入到Na2CO3溶液中。
最后两支试管在以滴加的方式将CuSO4
溶液缓慢加入Na2CO3溶液中,观察这三组各试管中的现象,比较差异,实验结果见表
加料方式对反应的影响
由图表可知,一次加料的方式有利于生成品质更好的产品,若加料
方式过慢反而会产生大量的黑褐色的CuO 沉淀,故在制备时宜采用一次加料的方式。
3·5 反应pH 值对反应产率的影响
根据3·3和3·2 计算出来的最佳配比和最佳反应温度, 即在60℃和1:1.2 的配料比下, 用pH 试纸测定反应液的pH 值, 过滤, 烘干, 计算产率, 用水洗的方法求出不同pH 值对反应产率的影响, 如下图。
从图中可看出, 反应后溶液的最佳pH 值应为8.5~9.2 之间, 而且产品顏色随pH 值增大而变得更翠绿。
这是由于反应过程中, 硫酸铜呈弱酸性, 因此碱式碳酸铜合成中硫酸铜是否因包裹而影响其转化, 可由反应后溶液的pH 值反应出来。
pH对反应产率的影响
70
75
80
8590
95
8.59.211
反应液的pH
产率/%
CuSO 4 和Na 2CO 3 反应溶液最佳pH 值的选择
3·6 结论
(1)碱式碳酸铜溶液水解呈弱碱性。
当CuSO 4与Na 2CO 3优化摩尔比为1.0:1.2 ( 此时溶液pH ≈8.5), 此酸度与0.5mol/L 碱式碳酸铜水
溶液的pH 相当,有利于碱式碳酸铜产品生成。
(2)温度在60℃,反应温度不宜超过80℃,且要处于恒温中。
温度过低反应不完全,温度过高则易形成CuO 等杂质。
(3)宜采用一次加料方式进行混合碱式碳酸铜。
反应过程中不可将Na2CO3溶液倒入Cu(NO3)2溶液中。
(4)反应后溶液的最佳pH 值应为8.5~9.2 之间,
(5)在优化条件下,碱式碳酸铜产品收率可以达到90.10%。
4本实验应注意的问题
1、反应过程中要注意洗涤干净, 烘干要有一定的时间, 否则会出现产率超过100%现象;
2、注意温度不能太高( 95℃以上) , 而且反应时要恒温且不断搅拌, 否则会出现部分顏色变黑的现象;
3、要注意测溶液的pH 值, pH 值太低( pH<7) 时要不断洗涤, 直到大于8 左右, 否则会出现大量硫酸铜和未反应的溶液包裹着沉泻,造成产品品质不佳的现象;
4、若反应后不能观察到暗绿色或淡蓝色沉淀, 可将反应物保持原样(不可将滤液滤去) 静置1 - 2 天, 再作观察;
5、反应过程中要注意用反滴法, 将CuSO4溶液倒入Na2CO3溶液中。
6、沉淀要洗涤干净;
[参考文献]
[1]天津化工研究院. 无机盐工业手册( 上)[M] . 北京: 化学工业出版社,1995,142.
[2] 化学工业部天津化工研究院. 化工产品手册(无机化工产品) . 北京:化学工业出版社, 1989
[3] 甘肃师范大学化学系. 简明化学手册. 兰州:甘肃人民出版社, 1980
[4]北京师范大学无机化学研究室. 无机化学实验. 北京:高等教
育出版社, 2001,232.。