实验 家兔呼吸运动的调节(参考提供)
- 格式:doc
- 大小:255.00 KB
- 文档页数:5

一、实验目的1. 观察家兔呼吸运动的生理变化,了解呼吸运动的调节机制。
2. 分析血液中化学因素(PCO2、PO2、[H])对家兔呼吸频率、节律、通气量的影响及调节机制。
3. 探讨迷走神经在家兔呼吸运动调节中的作用。
二、实验原理呼吸运动是呼吸肌在神经系统控制下进行的有节律的收缩和舒张造成的。
呼吸中枢分布于大脑皮层、间脑、桥脑、延髓、脊髓等部位,各级部位相互配合,共同完成呼吸节律性运动。
呼吸运动受体内、外各种因素影响,如血液中CO2分压、PO2、[H]等化学因素,以及迷走神经、肺牵张反射等神经调节机制。
三、实验材料与仪器1. 实验动物:家兔2. 实验仪器:兔体手术台、常用手术器械、张力传感器、引导电极、计算机采集系统、气管插管、注射器、橡皮管、20%氨基甲酸乙酯、生理盐水3. 实验试剂:20%氨基甲酸乙酯、生理盐水四、实验方法与步骤1. 麻醉与固定:将家兔置于兔体手术台上,用20%氨基甲酸乙酯进行麻醉。
待家兔麻醉后,将其背位固定在手术台上。
2. 气管插管:在颈部切开皮肤,分离气管,插入气管插管,连接呼吸传感器。
3. 分离迷走神经:在颈部分离双侧迷走神经,穿线备用。
4. 记录呼吸运动:启动计算机采集系统,记录家兔呼吸频率、节律、通气量。
5. 观察血液中化学因素对呼吸运动的影响:a. 向气管插管内注入一定量的CO2,观察呼吸运动的变化;b. 向气管插管内注入一定量的生理盐水,观察呼吸运动的变化;c. 向气管插管内注入一定量的[H],观察呼吸运动的变化。
6. 观察迷走神经对呼吸运动的影响:a. 切断双侧迷走神经,观察呼吸运动的变化;b. 重新连接双侧迷走神经,观察呼吸运动的变化。
五、实验结果与分析1. 观察到在注入CO2后,家兔呼吸频率、节律、通气量均增加,表明CO2对呼吸运动具有促进作用。
2. 观察到在注入生理盐水后,家兔呼吸运动无明显变化,表明生理盐水对呼吸运动无明显影响。
3. 观察到在注入[H]后,家兔呼吸频率、节律、通气量均降低,表明[H]对呼吸运动具有抑制作用。

家兔呼吸运动的调节(详细参考)家兔呼吸运动的调节⼀、实验⽬的1、掌握家兔⽿缘静脉注射法、家兔颈部⼿术操作、神经⾎管分离、⽓管插管技术、记录家兔呼吸曲线2、观察⾎液中化学因素(CO2,O2和[H+])及药物对呼吸运动的影响、迷⾛神经对呼吸运动的调节⼆、实验原理呼吸运动是受呼吸中枢控制的呼吸肌节律性活动,伴随着压⼒变化⽽使⽓体进出呼吸道。
呼吸运动受神经以及⾎液中PO2,PCO2,[H+]等因素的调节。
药物能作⽤于呼吸中枢⽽影响呼吸运动。
肺牵张反射的传⼊神经是迷⾛神经,通过此反射弧完成正常地节律性呼吸。
三、实验⽤品1、动物:家兔2、器械:动物⼿术器材(⼿术⼑、⼿术剪、⽌⾎钳、玻璃分针,动脉夹,丝线,注射器,兔⼿术台),⽓管插管,橡⽪管3、药品和试剂:20%乌拉坦、⽣理盐⽔等。
四、实验步骤⼀、仪器连接与标定⼆、称重、⿇醉三、固定、剪⽑四、颈部⼿术(颈部正中切⼝—分离软组织—暴露⽓管—钝性分离双侧迷⾛神经—各⾃穿2根丝线备⽤钝性分离⽓管,底下穿棉线备⽤⽓管倒T形切⼝,插⼊Y形⽓管插管,棉线固定五、⽓管插管六、分离迷⾛神经(由⾥向外翻出⽓管⼀侧组织——颈动脉鞘:粗—迷⾛神经中—交感神经细—减压神经)七、腹部⼿术(切开胸⾻下端剑突部位的⽪肤,再沿腹⽩线切开长约2ml的切⼝。
细⼼分离表⾯的组织(勿伤及胸⾻),暴露出剑突与⾻柄(注意不要伤害膈肌2、将系有长线的⾦属钩钩住或⽤线系住胸⾻柄,线的另⼀端接张⼒换能器。
)注意事项分离神经时不能⽤尖的或锋利的⾦属机械;实验观察中,在刺激开始、撤除时,应做好标记。
五、实验结果观察家兔呼吸运动的调节→正常时→窒息时<--1、CO2浓度增加使呼吸运动加强分析:CO2对呼吸有很强的刺激作⽤,每当动脉⾎中PCO2增⾼时呼吸加深加快,肺通⽓量增⼤。
H+刺激延髓化学感受器,间接作⽤于呼吸中枢。
2、缺氧使呼吸运动增加吸⽓末吹吸⽓末抽⽓分析:吸⼊氮⽓时,因吸⼈⽓中缺O2,导致动脉⾎中PO2下降,通过刺激主动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌活动加强,反射性引起呼吸运动增加。

兔子的呼吸运动的调节实验报告引言呼吸是生物体维持生命活动的基本过程之一。
呼吸运动的调节对于维持正常生理功能非常重要。
兔子作为常见的哺乳动物,其呼吸运动机制一直是研究的热点之一。
本实验旨在研究兔子的呼吸运动的调节过程,并探讨外界环境因素对呼吸运动的影响。
实验方法实验材料和设备•实验兔(6只)•注射器和针头•氧气供应系统•呼吸频率记录仪•麻醉剂实验步骤1.实验前准备:将实验兔置于实验舱中,使其适应环境。
准备好氧气供应系统和呼吸频率记录仪。
2.注射麻醉剂:使用注射器和针头给实验兔注射一定剂量的麻醉剂,使其进入麻醉状态。
3.观察呼吸运动:记录兔子在麻醉状态下的呼吸频率和呼吸深度,并观察呼吸运动的变化情况。
4.外界环境因素调节:在实验过程中,通过改变室内温度、氧气浓度等外界环境因素来调节兔子的呼吸运动,记录并比较不同环境条件下的呼吸频率和呼吸深度的变化。
5.数据记录和分析:将实验过程中观察到的数据记录下来,使用适当的统计方法进行数据分析,并绘制相应的图表。
实验结果与讨论实验数据显示,在麻醉状态下,兔子的呼吸频率较平时明显降低。
此外,呼吸深度也较平时有所减弱。
这可能是由于麻醉剂的作用导致兔子神经系统的抑制,进而影响了呼吸运动。
在外界环境因素调节下,实验结果显示温度的变化对兔子的呼吸运动有一定的影响。
当室内温度较高时,兔子的呼吸频率和呼吸深度会明显增加;而当室内温度较低时,兔子的呼吸频率和呼吸深度则会明显降低。
这说明温度是调节兔子呼吸运动的一个重要因素。
另外,实验结果还显示氧气浓度的变化也会对兔子的呼吸运动产生影响。
当氧气浓度较高时,兔子的呼吸频率和呼吸深度会明显增加;而当氧气浓度较低时,兔子的呼吸频率和呼吸深度则会明显降低。
这表明氧气浓度是调节兔子呼吸运动的另一个重要因素。
结论通过本次实验,我们了解到兔子的呼吸运动受到多种因素的调节。
其中,外界环境因素如温度和氧气浓度对兔子的呼吸频率和呼吸深度有明显的影响。

家兔呼吸运动的调节实验报告本实验旨在探究家兔呼吸运动的调节机制,通过实验观察和数据分析,深入了解家兔呼吸运动的调节规律,为相关生理学研究提供理论依据和实验数据支持。
实验材料与方法。
1. 实验材料,健康的家兔若干只,呼吸频率计、呼吸深度计、心率监测仪等实验设备。
2. 实验方法,将家兔置于实验箱内,记录其正常呼吸状态下的呼吸频率和呼吸深度,并监测其心率。
接着通过不同方式的刺激(如运动、音响刺激等)观察家兔呼吸频率、呼吸深度和心率的变化情况。
实验结果。
1. 正常状态下,家兔的呼吸频率约为每分钟40-60次,呼吸深度约为每次10-15毫升,心率约为每分钟120-150次。
2. 运动刺激后,家兔的呼吸频率明显增加,呼吸深度也有所增加,心率也随之加快。
3. 音响刺激后,家兔的呼吸频率和呼吸深度均有所增加,但心率的变化不明显。
实验分析。
1. 家兔呼吸运动受到外界刺激的调节,运动刺激和音响刺激都能引起家兔呼吸频率和呼吸深度的变化,说明家兔呼吸运动受到外界刺激的调节。
2. 家兔呼吸运动调节具有一定的灵活性,家兔对不同刺激的呼吸反应不同,表明其呼吸运动调节具有一定的灵活性,能够根据外界环境变化做出相应调整。
实验结论。
家兔呼吸运动的调节受到外界刺激的影响,具有一定的灵活性,这为家兔在不同环境下适应生存提供了生理基础。
同时,本实验结果也为相关呼吸生理学研究提供了重要的实验数据支持。
结语。
通过本次实验,我们对家兔呼吸运动的调节机制有了更深入的了解,同时也为今后的相关研究提供了重要的实验基础。
希望本实验结果能够为相关领域的科研工作者提供参考,推动相关领域的研究进展。


家兔呼吸运动的调节实验报告家兔呼吸运动的调节实验报告引言:呼吸是生物体生命活动中不可或缺的过程之一。
对于家兔这类哺乳动物来说,呼吸运动的调节对其生存和适应环境至关重要。
本次实验旨在探究家兔呼吸运动的调节机制,以增进我们对生物体呼吸系统的理解。
实验方法:1. 实验材料准备:本次实验所需材料包括家兔、呼吸频率计、呼吸深度计、氧气浓度计、二氧化碳浓度计等。
2. 实验步骤:首先,将家兔置于实验室的呼吸室中,确保环境温度和湿度适宜。
然后,使用呼吸频率计和呼吸深度计来测量家兔的呼吸频率和呼吸深度。
接下来,使用氧气浓度计和二氧化碳浓度计来测量家兔所处环境中的氧气和二氧化碳浓度。
3. 实验记录:记录家兔在不同环境条件下的呼吸频率、呼吸深度以及环境中的氧气和二氧化碳浓度。
实验结果:通过实验记录的数据,我们得出以下结论:1. 温度对家兔呼吸运动的调节有显著影响。
在较高温度下,家兔的呼吸频率和呼吸深度明显增加,以促进体内热量的散发。
而在较低温度下,家兔的呼吸频率和呼吸深度减少,以减少体内热量的散失。
2. 湿度对家兔呼吸运动的调节也有一定影响。
在较高湿度下,家兔的呼吸频率和呼吸深度增加,以帮助散发体内的湿气。
而在较低湿度下,家兔的呼吸频率和呼吸深度减少,以减少体内水分的流失。
3. 氧气浓度对家兔呼吸运动的调节非常重要。
在较低氧气浓度下,家兔的呼吸频率和呼吸深度明显增加,以增加氧气的摄入量。
而在较高氧气浓度下,家兔的呼吸频率和呼吸深度减少,以避免氧中毒。
4. 二氧化碳浓度也对家兔呼吸运动的调节产生影响。
在较高二氧化碳浓度下,家兔的呼吸频率和呼吸深度明显增加,以增加二氧化碳的排出量。
而在较低二氧化碳浓度下,家兔的呼吸频率和呼吸深度减少,以避免呼出过多二氧化碳。
讨论:通过本次实验,我们可以看到家兔呼吸运动的调节是一个相当复杂的过程。
它受到温度、湿度、氧气浓度和二氧化碳浓度等多个因素的影响。
家兔通过调节呼吸频率和呼吸深度来适应不同的环境条件,以保持体内的氧气和二氧化碳平衡。

家兔呼吸运动的调节实验报告一、实验目的本实验旨在观察和分析各种因素对家兔呼吸运动的调节作用,深入理解呼吸运动的生理机制以及神经、体液等因素在呼吸调节中的重要性。
二、实验原理呼吸运动是呼吸肌节律性收缩和舒张所引起的胸廓有节律的扩大和缩小。
呼吸运动受神经和体液因素的调节。
神经调节主要包括迷走神经和交感神经,体液调节则包括血液中二氧化碳分压、氧分压和氢离子浓度等的变化。
三、实验材料与方法(一)实验材料1、实验动物:健康家兔 1 只,体重 20 25kg。
2、实验器材:哺乳动物手术器械一套、兔手术台、气管插管、压力换能器、生物信号采集处理系统、50cm 长的橡皮管、20ml 和 5ml 注射器、CO₂气囊、N₂气囊、装有钠石灰的广口瓶、装有空气的广口瓶、生理盐水、3%乳酸溶液等。
(二)实验方法1、家兔称重后,用 20%乌拉坦溶液(5ml/kg)于耳缘静脉缓慢注射麻醉。
将家兔仰卧固定于手术台上,剪去颈部手术部位的被毛。
2、颈部正中切开皮肤,分离气管并插入气管插管,通过压力换能器与生物信号采集处理系统相连,记录呼吸运动曲线。
3、分离双侧迷走神经,穿线备用。
4、观察并记录正常呼吸运动曲线。
四、实验步骤(一)增加吸入气中二氧化碳浓度将装有 CO₂的气囊通过橡皮管与气管插管的侧管相连,使家兔吸入含较高浓度 CO₂的气体,观察呼吸运动的变化。
(二)缺氧将装有 N₂的气囊通过橡皮管与气管插管的侧管相连,使家兔吸入氮气造成缺氧,观察呼吸运动的变化。
(三)增大无效腔将一段 50cm 长的橡皮管连接在气管插管的侧管上,增加无效腔,观察呼吸运动的变化。
(四)静脉注射乳酸溶液用 5ml 注射器经耳缘静脉缓慢注入 3%乳酸溶液 2ml,观察呼吸运动的变化。
(五)切断迷走神经分别切断双侧迷走神经,观察呼吸运动的变化。
然后再分别刺激切断后的迷走神经中枢端和外周端,观察呼吸运动的变化。
五、实验结果(一)增加吸入气中二氧化碳浓度当家兔吸入含较高浓度 CO₂的气体后,呼吸运动明显加深加快。
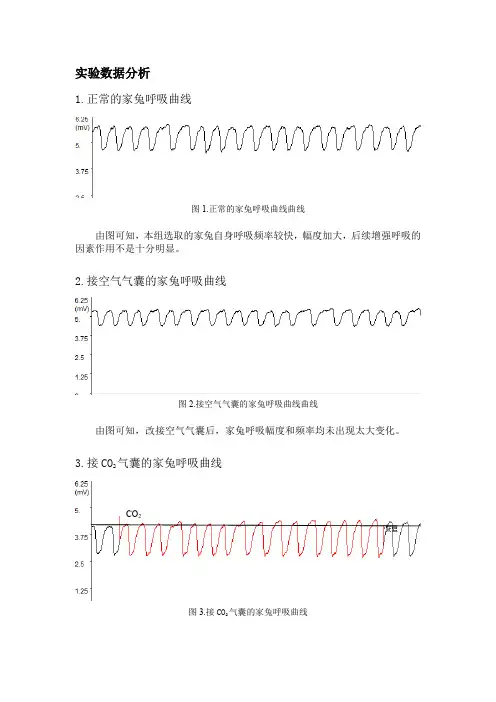
实验数据分析1.正常的家兔呼吸曲线由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
2.接空气气囊的家兔呼吸曲线图2.接空气气囊的家兔呼吸曲线曲线由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
3.接CO2气囊的家兔呼吸曲线CO2图3.接CO2气囊的家兔呼吸曲线由图可知,接CO2气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO2浓度升高,血液中CO2浓度随之升高,CO2透过血脑屏障使脑脊液的CO2浓度也升高。
CO2与水反应生成H 2CO3,随后水解成HCO3-和H+,由H+刺激延髓化学感受器,间接作用于呼吸中枢,通过一系列调控使得呼吸作用加强。
此外,当CO2浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
4.接N2气囊的家兔呼吸曲线图4.接N2气囊的家兔呼吸曲线由图可知,接N2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N2时,因吸入气体中缺乏O2,肺泡气O2浓度下降,导致动脉血中O2浓度下降;而CO2浓度却基本不变(CO2扩散速度较快)。
随着动脉血中O2浓度下降,通过刺激主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌和肋间外肌活动加强,反射性引起呼吸运动增加。
5.增长解剖无效腔的家兔呼吸曲线图5.增长解剖无效腔的家兔呼吸曲线由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮气量,即每次的有效气体更新变小。
结果促使O2分压下降,CO2分压上升,使其反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。


第1篇一、实验目的1. 观察兔子呼吸运动的基本规律,包括呼吸频率、节律和幅度。
2. 探讨影响兔子呼吸运动的各种因素,如无效腔、二氧化碳浓度、缺氧等。
3. 分析迷走神经在兔子呼吸运动调节中的作用。
4. 掌握气管插管术和神经血管分离术等基本操作。
二、实验原理呼吸运动是呼吸中枢节律性活动的反映。
在不同生理状态下,呼吸运动所发生的适应性变化有赖于神经系统的反射性调节,其中较为重要的有呼吸中枢、肺牵张反射以及外周化学感受器的反射性调节。
因此,体内外各种刺激,可以直接作用于中枢部位或通过不同的感受器反射性地影响呼吸运动。
三、实验材料与器材1. 实验动物:家兔2. 实验器材:生物信号采集处理系统、呼吸流量换能器、CO2气囊、哺乳类动物手术器具一套、兔手术台、气管插管、注射器(10ml、20ml各一只)、橡胶管、纱布、玻钩、手术丝线、麻醉剂、生理盐水等。
四、实验步骤1. 实验动物准备:选择健康成年家兔,称重后进行麻醉。
2. 麻醉与固定:按照2ml/kg取麻醉剂戊巴比妥钠,从兔耳缘静脉缓慢注入麻醉,然后将家兔固定在手术台上。
3. 颈部手术:颈部剪毛,于颈部正中切开皮肤,钝性分离肌肉组织,暴露并分离气管。
在3-4气管环之间切开气管,做一倒T形切口,气管插管后用手术丝线固定,两侧迷走神经穿线备用。
4. 连接仪器:将呼吸流量换能器连接在气管插管上,并连接生物信号采集处理系统。
5. 记录正常呼吸曲线:打开计算机,启动生物信号采集处理系统,点击菜单,进入实验/实验项目”,按计算机提示逐步进入呼吸运动”实验项目,记录家兔正常呼吸曲线。
6. 增加无效腔:通过改变气管插管长度,增加无效腔,观察呼吸曲线的变化。
7. 增加二氧化碳浓度:使用CO2气囊,向气管插管中注入一定浓度的二氧化碳,观察呼吸曲线的变化。
8. 轻度缺氧实验:使用低氧气体,向气管插管中注入一定浓度的氧气,观察呼吸曲线的变化。
9. 剪短迷走神经:剪断一侧迷走神经,观察呼吸曲线的变化。

家兔呼吸运动调节实验报告家兔呼吸运动调节实验报告引言:呼吸是生命的基本活动之一,通过呼吸,我们摄取氧气,排出二氧化碳,维持身体的正常功能。
而家兔作为常见的实验动物,其呼吸系统的研究对于人类健康和医学研究具有重要意义。
本实验旨在探究家兔呼吸运动的调节机制,为进一步了解呼吸系统的功能提供实验依据。
材料与方法:实验所需材料包括家兔、呼吸测量仪器、呼吸刺激剂等。
首先,选择健康的家兔作为实验对象,并确保其处于安静无干扰的环境中。
然后,将呼吸测量仪器安装在家兔鼻腔附近,以便实时监测呼吸频率和呼吸深度。
接下来,通过给予呼吸刺激剂,如二氧化碳或低氧气体,来刺激家兔的呼吸系统。
记录下刺激前后的呼吸数据,并进行统计和分析。
结果与讨论:实验结果显示,在给予家兔呼吸刺激剂后,其呼吸频率明显增加,呼吸深度也有所增加。
这表明家兔的呼吸系统能够通过感知外界刺激并做出相应调节,以维持正常的呼吸功能。
进一步的分析发现,家兔的呼吸系统对不同刺激剂的反应程度有所差异。
例如,当给予二氧化碳刺激时,家兔的呼吸频率和深度增加较为明显,而当给予低氧气体刺激时,呼吸频率的增加更为显著。
这些结果提示了家兔呼吸系统的调节机制可能与体内化学物质的浓度变化密切相关。
在正常情况下,呼吸中枢通过感知体内二氧化碳和氧气浓度的变化,调节呼吸频率和深度,以维持酸碱平衡和氧气供应。
当体内二氧化碳浓度升高或氧气浓度降低时,呼吸中枢会向呼吸肌发送指令,促使家兔加快呼吸频率和增加呼吸深度,以增加氧气摄取和二氧化碳排出。
此外,家兔呼吸运动的调节还受到其他因素的影响,如温度、情绪和运动等。
在实验过程中观察到,当家兔处于紧张或兴奋状态时,其呼吸频率和深度也会有所增加。
而当家兔进行剧烈运动时,呼吸频率和深度的增加更为显著,以满足身体对氧气的需求。
这些结果进一步证明了家兔呼吸系统的调节机制的复杂性和多样性。
结论:通过本次实验,我们得出了家兔呼吸系统具有调节呼吸频率和深度的能力,以适应不同的刺激和需求。
家兔呼吸运动的调节实验目的:1.用气管插管描记呼吸流量间接反映家兔呼吸运动(呼吸频率、节律、幅度)的方法,研究吸入二氧化碳、静脉注射乳酸溶液、增大解剖无效腔以改变血液中二氧化碳浓度、氧气浓度、[H+]和气道阻力、切断颈部迷走神经、电刺激迷走神经中枢端对呼吸运动的影响并初步探讨其作用部位,并分析机制。
2.掌握气管插管术和神经血管分离术。
实验材料:对象:家兔;试剂:20g/L 乳酸溶液,氨基甲酸乙酯;仪器:RM6240生物信号采集系统,手术器械一套,兔手术台,T型气管插管,注射器,50cm长橡皮管一条,CO2气袋,丝线,铁架台,婴儿秤,呼吸换能器,电刺激连线。
实验方法:1.麻醉固定:家兔称重后,将氨基甲酸乙酯以5ml/kg 的体重剂量由兔耳缘静脉内缓慢注入,注意观察家兔的反应。
待麻醉后,将家兔仰卧固定于兔手术台上,先后固定四肢及兔头。
2.手术:剪去家兔颈部的被毛,沿颈部正中线作一长6~7cm的切口,用止血钳钝性分离皮下组织,暴露并游离气管,并于气管下穿线备用。
在气管两侧肌肉深面颈动脉鞘内分离迷走神经,并在其下穿线备用。
在甲状软骨下第4~5个气管软骨处作一“⊥”形切口。
将T型气管插管向肺的方向插入气管内,用预留备用线线结扎固定。
手术完毕后用纸巾擦拭手术伤口部位。
3.观察准备:用皮管连接气管插管和呼吸换能器。
打开呼吸换能器,启动计算机RM6240生物信号采集系统,点击“实验”菜单,选择“呼吸运动调节”,双击一通道,调节增益、采样参数,使基线归零,令图形位于屏幕中央,便于观察。
4.观察项目(1)记录正常呼吸曲线作为对照,辨认曲线上呼气、吸气的波形方向。
(2)在气管插管一个侧管上接一根长50cm胶管(流量法:接通气口),观察和记录呼吸运动的变化。
(3)增加吸入气中CO2浓度:待呼吸曲线恢复正常,将装有CO2气袋的皮管口移近气管插管的侧管,打开皮管夹子,使吸入气中含有较多的CO2。
记录并观察吸入高浓度的CO2对呼吸运动的影响。
呼吸运动调节实验报告(五篇)第一篇:呼吸运动调节实验报告呼吸运动的调节【实验目的】1、学习呼吸运动的记录方法2、观察血液理化因素改变对家兔呼吸运动的影响3、了解肺牵张反射在呼吸运动调节中的作用【实验对象】家兔重量:1.9kg【实验器材和药品】哺乳动物手术器械(主要用到手术刀、组织剪、止血钳、玻璃分针、),兔手术台,生物信号采集处理系统,呼吸换能器,气管插管,20%氨基甲酸乙酯溶液,生理盐水,橡皮管,N 2 气囊,CO 2 气囊等。
【实验方法与步骤】1.取家兔并称重,由家兔腹腔缓慢注入20%氨基甲酸乙酯溶液10ml,(因注射过程中出现差错,后补注入20%氨基甲酸乙酯溶液8ml)待家兔麻醉后,仰卧用绳子固定于手术台上。
2.剪去颈前部兔毛,颈前正中用手术刀切开皮肤5-7cm,少量出血,用纱布蘸取生理盐水擦拭。
分离气管并穿线备用。
分离颈部双侧迷走神经,穿线备用。
以倒T 型剪开气管,有少量出血,止血后用镊子清理其中异物,做气管插管。
手术完毕后,用温生理盐水纱布覆盖手术范围。
3.实验装置(1)将呼吸换能器与生物信号采集处理系统的相应通道相连接,橡皮管连接气管插管和呼吸换能器。
(2)打开计算机,启动生物信号采集处理系统,设置好参数,开始采样。
(3)采样项目①缺氧对呼吸运动的影响:方法同上,将氮气气囊管口与气管插管的通气管用手掌罩住,打开气囊,使吸入气中含较多的氮气,造成缺氧,观察呼吸运动的变化,移开气囊和手掌,待呼吸恢复正常后进行下一步实验。
②CO 2 对呼吸运动的影响:将二氧化碳气囊管口与气管插管的通气管用手掌罩住,打开气囊,使吸入气中含较多的二氧化碳,观察呼吸运动的变化,移开气囊和手掌,待呼吸恢复正常后进行下一步实验。
③增大无效腔对呼吸运动的影响:将橡皮管连接于气管插管的一个侧管上,观察此时呼吸运动的变化。
变化明显后,去掉橡皮管,观察呼吸运动的恢复过程。
④迷走神经在呼吸运动调节中的作用:先剪断一侧迷走神经,观察呼吸运动的变化,再剪断另一侧迷走神经,观察呼吸运动又有何变化。
兔子呼吸运动的调节实验报告一、实验目的通过对兔子呼吸运动的观察和分析,了解呼吸运动的调节机制,包括神经调节和化学因素对呼吸的影响。
二、实验原理呼吸运动是一种节律性的活动,其频率和深度受到多种因素的调节。
神经系统通过呼吸中枢发放冲动,调节呼吸肌的收缩和舒张,从而控制呼吸运动的节律和深度。
化学因素如血液中的二氧化碳分压(PCO₂)、氧分压(PO₂)和氢离子浓度(H⁺)等也能通过刺激外周化学感受器和中枢化学感受器,反射性地调节呼吸运动。
三、实验材料1、实验动物:健康成年兔子,体重 2 3kg。
2、实验器材:兔手术台、手术器械(手术刀、镊子、剪刀等)、气管插管、压力换能器、生物信号采集处理系统、5ml 和20ml 注射器、20%氨基甲酸乙酯溶液、3%乳酸溶液、氮气、氧气。
四、实验步骤1、麻醉与固定称取兔子体重,按照 5ml/kg 的剂量,从耳缘静脉缓慢注射 20%氨基甲酸乙酯溶液进行麻醉。
待兔子麻醉后,将其仰卧固定在手术台上。
2、手术操作剪去颈部的毛,在颈部正中做一约 6 8cm 的切口,分离皮下组织和肌肉,暴露气管。
在气管下方穿一根丝线,在气管上做一“T”形切口,插入气管插管,并用丝线固定。
将气管插管通过压力换能器与生物信号采集处理系统相连。
3、观察正常呼吸运动打开生物信号采集处理系统,记录兔子的正常呼吸运动曲线,观察呼吸频率和幅度。
4、迷走神经对呼吸运动的调节找到一侧迷走神经,用玻璃分针轻轻分离,穿线备用。
先观察呼吸运动,然后用丝线结扎迷走神经并剪断,观察呼吸运动的变化。
以相同的方法处理另一侧迷走神经,观察呼吸运动的变化。
5、化学因素对呼吸运动的调节从耳缘静脉缓慢注射 3%乳酸溶液 2ml,观察呼吸运动的变化。
用气囊向气管插管内快速注入氮气,使兔子吸入氮气,观察呼吸运动的变化。
用气囊向气管插管内快速注入氧气,使兔子吸入氧气,观察呼吸运动的变化。
五、实验结果1、正常呼吸运动兔子的正常呼吸运动呈现节律性,呼吸频率约为每分钟 30 60 次,呼吸幅度适中。
一、实验目的1. 观察家兔呼吸运动的调节机制,了解呼吸中枢、化学感受器和肺牵张反射在呼吸调节中的作用。
2. 掌握呼吸运动的观察方法,包括呼吸频率、幅度和节律等指标。
3. 研究不同因素对家兔呼吸运动的影响,如CO2、H+、缺氧等。
二、实验原理呼吸运动是一种节律性的运动,其深度和频率受体内外因素影响。
呼吸中枢位于大脑皮层、间脑、桥脑、延髓和脊髓等部位,各级部位相互配合,共同完成呼吸节律性运动。
化学感受器位于主动脉和颈动脉窦,可感受血液中CO2、H+等化学因素的变化,通过神经反射调节呼吸运动。
肺牵张反射是指肺扩张时引起吸气抑制的反射,其输入神经为迷走神经。
三、实验材料与器材1. 实验材料:家兔2. 实验器材:手术台、常用手术器械、生理信号采集处理系统、呼吸传感器、止血钳、气管插管、20ml及1ml注射器、橡皮管、刺激电极、20%氨基甲酸乙酯、CO2、乳酸、生理盐水、棉线、纱布。
四、实验步骤1. 家兔麻醉:取一只家兔,称重后,用剪刀剪去耳缘静脉上的毛。
用20ml注射器由耳缘静脉缓慢推注25%氨基甲酸乙酯(1g/kg体重)进行麻醉。
2. 建立呼吸记录系统:将气管插管插入家兔气管,连接呼吸传感器,记录呼吸频率和幅度。
3. 记录正常呼吸曲线:观察家兔的呼吸频率、幅度和节律,记录正常呼吸曲线。
4. CO2吸入实验:将家兔置于CO2环境中,观察呼吸频率、幅度和节律的变化,记录实验结果。
5. H+吸入实验:将家兔置于H+环境中,观察呼吸频率、幅度和节律的变化,记录实验结果。
6. 缺氧实验:将家兔置于缺氧环境中,观察呼吸频率、幅度和节律的变化,记录实验结果。
7. 肺牵张反射实验:剪断双侧迷走神经,观察呼吸频率、幅度和节律的变化,记录实验结果。
五、实验结果与分析1. 正常呼吸曲线:家兔的呼吸频率约为60-80次/分钟,幅度约为1-2cmH2O,节律较为规律。
2. CO2吸入实验:CO2吸入后,家兔的呼吸频率和幅度明显增加,呼吸加深加快,表明CO2对呼吸运动有促进作用。
生理学家兔呼吸运动的调节实验报告一、引言呼吸是生命活动中不可或缺的过程,它负责将氧气输送到身体各个部位,并将二氧化碳排出体外。
兔作为常见的实验动物,其呼吸系统较为相似于人类,因此被广泛应用于呼吸运动的调节实验中。
本报告将介绍我们对兔呼吸运动调节机制的研究结果。
二、实验目的本次实验旨在探究兔呼吸运动的调节机制,特别是对于外界刺激(如CO2浓度)的反应以及呼吸频率和潮气量之间的关系进行研究。
三、实验方法1. 实验动物:选取健康成年雄性白色家兔10只。
2. 实验仪器:生物信号采集仪、呼吸频率测定器、CO2浓度检测仪等。
3. 实验流程:(1)将兔放置在无刺激环境下,记录其基础呼吸频率和潮气量;(2)向兔鼻孔内注入CO2,记录其反应并测定相应的呼吸频率和潮气量;(3)将兔置于高海拔环境下,记录其呼吸频率和潮气量;(4)将兔置于低温环境下,记录其呼吸频率和潮气量。
四、实验结果1. CO2刺激实验:注入CO2后,兔的呼吸频率和潮气量均有明显增加。
其中,呼吸频率从基础的30次/分钟增加到了45次/分钟,潮气量从基础的0.5毫升/次增加到了1毫升/次。
2. 高海拔实验:在高海拔环境下,兔的呼吸频率明显增加,而潮气量略有降低。
其中,呼吸频率从基础的30次/分钟增加到了50次/分钟,潮气量从基础的0.5毫升/次降低到了0.4毫升/次。
3. 低温实验:在低温环境下,兔的呼吸频率和潮气量均有明显降低。
其中,呼吸频率从基础的30次/分钟降低到了20次/分钟,潮气量从基础的0.5毫升/次降低到了0.3毫升/次。
五、实验分析1. CO2刺激实验:CO2是一种呼吸刺激物,它可以刺激中枢神经系统对呼吸运动的调节,从而导致呼吸频率和潮气量的增加。
2. 高海拔实验:高海拔环境下氧气浓度降低,为了保证身体各部位的氧供应,兔会通过增加呼吸频率来提高氧摄取量。
同时,由于高海拔环境下空气稀薄,兔需要通过减少潮气量来避免过度通气。
3. 低温实验:低温环境下,兔需要通过减少呼吸频率和潮气量来减少热损失并保持体温稳定。
实验28 家兔呼吸运动的调节
浙江中医药大学
1.摘要
目的观察血液中化学因素(PCO2、PO2、[H﹢])改变对家兔呼吸频率、节律、通气量的影响及机制。
观察迷走神经在家兔呼吸运动调节中的作用及机制。
学习气管插管术和神经血管分离术。
方法通过增大 CO2分压,增大无效腔,快速注射 2%乳酸,先后切断两侧迷走神经,以及电刺激迷走神经中枢端,观察呼吸运动的改变情况。
结果增大无效腔气量、提高 PCO2、注射乳酸均可使家兔呼吸加深加快,而剪断一侧及两侧迷走神经、电刺激迷走神经中枢端则使呼吸变浅、频率变慢。
结论增加 PCO2,增大无效腔,快速注射乳酸后,可使家兔通气量、呼吸频率及平均呼吸深度明显增加;剪断一侧迷走神经对呼吸运动影响不大,剪断双侧迷走神经,呼吸变慢变深。
2.材料和方法
2.1材料
家兔;CO2,氨基甲酸乙酯,乳酸;呼吸换能器;微机生物信号采集处理系统。
2.2方法
2.2.1实验系统连接及参数设置用胶管连接流量头与气管插管,流量头连接呼吸流量换能器。
呼吸换能器输出线连接微机生物信号处理系统。
打开RM6240系统:点击“实验”菜单,选择“呼吸运动调节”,仪器参数:通道时间常数为直流,滤波频率30Hz,灵敏度10cmH2O(或50ml/s),采样频率800Hz,扫描频率1s/div。
连续单刺激方式,刺激强度5-10V,刺激波宽2ms,刺激频率30Hz。
2.2.2麻醉固定家兔称重后,按1g/kg体重剂量耳缘静脉注射200g/L氨基甲酸乙酯。
待兔麻醉后,将其仰卧,先后固定四肢及兔头。
2.2.3手术剪去颈前被毛,颈前正中切开皮肤6-7cm,直至下颌角上1.5cm,用止血钳钝性分离组织及颈部肌肉,暴露气管及与气管平行的左、右血管神经鞘,细心分离两侧鞘膜内迷走神经,在迷走神经下穿线备用。
分离气管,在气管下两根粗棉线备用。
2.2.4气管插管在甲状软骨下约1cm处,做倒“T”形剪口,用棉签将气管切开及气管里的血液和分泌物擦净,气管插管由剪口处向肺端插入,插时应动作轻巧,避免损伤气管粘膜引起出血,用意粗棉线将插管口结扎固定,另一棉线在切口的头端结扎止血。
2.3实验观察
2.3.1记录正常呼吸曲线启动生物信号采集处理系统记录按钮,记录一段正常呼吸运动曲线作为对照。
辨认曲线上吸气、呼气的波形方向(呼气曲线向上、吸气曲线向下)。
2.3.2增加吸入气中CO2分压待呼吸曲线恢复正常,将CO2导管口使气体冲入气管插管,是家兔吸入较高浓度CO2的空气。
待家兔呼吸运动增强后,立即移去CO2气体导管。
待呼吸正常后再做下一步实验。
2.3.3在气管插管一个侧管上接一根长50cm胶管(流量法:接通气口),观察和记录呼吸运动的变化。
2.3.4 增加血液中[H+] 耳缘静脉缓慢注入3%乳酸溶液2ml,观察呼吸运动的变化。
2.3.5 迷走神经对呼吸运动的调节作用分别观察切断一侧迷走神经和切断两侧迷走神经以后呼吸运动的变化。
以5-10V强度,15-30Hz,2ms波宽的连续电脉冲间断刺激迷走神经中枢端,观察呼吸运动较之切断前有何改变。
3.实验结果
图一正常呼吸曲线
图二增加吸入气中CO2分压后的呼吸变化曲线
图三接无效腔后的呼吸变化曲线
图四注入乳酸后的呼吸变化曲线
图五剪断左侧迷走神经后的呼吸变化曲线
图六剪短两侧迷走神经后的呼吸变化曲线
图七电刺激左侧迷走神经后的呼吸变化曲线
从实验结果可以看出(参照的均为正常呼吸):
1.吸入高浓度CO2的空气候呼吸明显加深,频率明显加快。
2.增大无效腔后呼吸加深,频率加快。
3.通过家兔耳缘静脉注射0.06g乳酸后,呼吸亦加深,频率加快。
4.剪断一侧及两侧迷走神经后,家兔呼吸均加深,频率均减慢,且后者比前者变化更大。
5.电刺激一侧迷走神经中枢端后家兔呼吸变浅,频率加快,几乎成一条直线。
4.讨论与分析
4.1 CO2是调节呼吸运动最重要的生理性化学因素,一定水平的PCO2水平对维持呼吸和呼吸中枢的兴奋性是必要的CO2刺激呼吸是通过两条途径实现的:①通过刺激中枢化学感受器再兴奋呼吸中枢;②刺激外周化学感受器,冲动经窦神经
和迷走神经传入延髓呼吸有关核团,反射性地使呼吸加深、加快,增加通气量。
肺通气量增加可以增加CO2的排出,肺泡气和动脉血P CO2可重新接近正常水平。
4.2 无效腔是指未进行气体交换的一部分肺泡容量,包括解剖无效腔和肺泡无效腔。
且肺泡通气量=(潮气量﹣无效腔气量)×呼吸频率,所以当给家兔气管插管的侧管连接 50cm 长的胶管时,增大了解剖无效腔,使肺泡通气量减少,因此家兔通过调节增大潮气量即呼吸加深,增加呼吸频率是肺泡通气量保持不变,维持正常呼吸。
4.3 动脉血[H﹢]增加,呼吸加深加快,肺通气量增加;[H﹢]降低,呼吸受到抑制。
H﹢对呼吸的调节也是通过外周化学感受器和中枢化学感受器实现的。
中枢化学感受器对H﹢的敏感性较外周的高,约为外周的25倍。
但是,H﹢通过血液屏障的速度慢,限制了它对中枢化学感受器的作用。
所以以外周化学感受器的途径为主。
4.4 切断一侧迷走神经后,由于这一侧迷走神经的神经冲动传递受阻,使得呼吸运动的调节受阻;随后由于迷走神经为混合神经,另一侧迷走神经将起到呼吸调节作用,此时发挥负反馈调节作用,加速吸气和呼气活动的交替,即呼吸频率加快。
4.5 肺牵张反射的肺扩张反射的作用在于阻抑吸气过长过深,促使吸气及时转入呼气。
肺扩张反射的感受器位于从气管到细支气管的平滑肌中,当吸气时肺扩张牵拉呼吸道,感受器兴奋,冲动经迷走神经传入延髓,在延髓内通过一定的神经联系是吸气切断机制兴奋,切断吸气,转入呼气。
这样便加速了吸气向呼气转换,使呼吸频率增加。
所以切断两侧迷走神经后,吸气延长、加深,呼吸变得深而慢4.6 当用5V的电脉冲刺激迷走神经中枢端时,相当于恢复了迷走神经的功能,又由于刺激电压过大,使呼吸频率显著加快,呼吸也由此变浅。
5.结论
增加 PCO2,增大无效腔,快速注射乳酸后,可使家兔通气量、呼吸频率及平均呼吸深度明显增加;剪断一侧迷走神经对呼吸运动影响不大,剪断双侧迷走神经,呼吸变慢加深;电刺激迷走神经中枢端呼吸变浅加快。