(方案)标准溶液的配制与标定.ppt
- 格式:ppt
- 大小:548.00 KB
- 文档页数:14

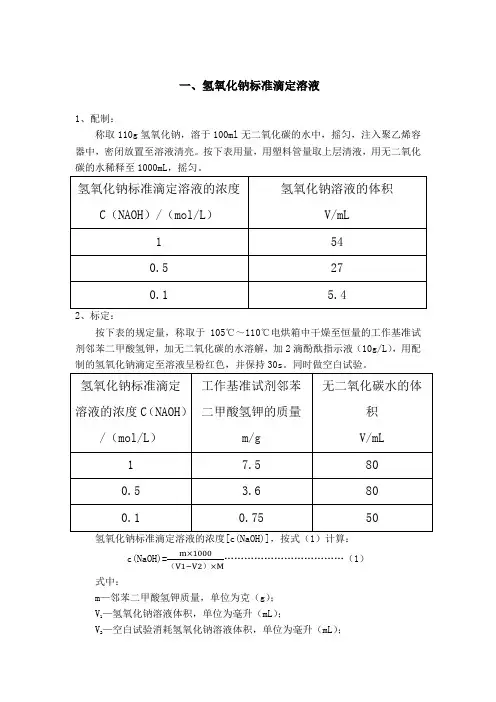
一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀。
2、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10g/L),用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
氢氧化钠标准滴定溶液的浓度[c(NaOH)],按式(1)计算:c(NaOH)= (1)()式中:m—邻苯二甲酸氢钾质量,单位为克(g);—氢氧化钠溶液体积,单位为毫升(mL);V1—空白试验消耗氢氧化钠溶液体积,单位为毫升(mL);V2M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
同时做空白试验。
盐酸标准滴定溶液的浓度c[HCl],按式(2)计算:c(HCl)=() (2)式中:m—无水碳酸钠质量,单位为克(g);V1—盐酸溶液体积,单位为毫升(mL);V2—空白试验消耗盐酸溶液体积,单位为毫升(mL);M—无水碳酸钠的摩尔质量,单位为克每摩尔(g/mol)[M(1/2Na2CO3)=52.994]三、硫酸标准滴定溶液1、配制:按下表规定量,量取硫酸,缓缓注入1000mL水中,冷却,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。




标准溶液的配置及标走方法Is O.lmoL/L氢氧化钠的配制及标定⑴配制:将氢氧化钠配制成饱和溶液(约为52% ),贮存于乙烯塑料瓶内,密闭放置数日,使碳酸钠沉淀。
小心吸取8.2mL上清液,加无二氧化碳的纯水稀释为lOOOmL。
(2)标定:准确称取0.5 ~ 0.6g于105 ~ 110°C烘干至恒重的基准邻苯二甲酸氢钾,共称三份。
分别置于250mL三角瓶内,加入不含二氧化碳的纯水使邻苯二甲酸氢钾溶解。
加2滴1%酚酎指示剂溶液,用0.1moL/L氢氧化钠溶液滴定至溶液显淡粉红色即到终点。
同时作空白。
按下式计算氢氧化钠溶液的准确浓度:C=mx 1000/(V-V)x 204.22 21式中:C氢氧化钠溶液的浓度,moL/L ;m---邻苯二甲酸氢钾质量,g ;V——滴定邻苯二甲酸氢钾氢氧化钠用量,mL ;1 V-…空白试验氢氧化钠用量,mL ; 2 204.22—邻苯二甲酸氢钾的式量。
(3 )贮存于塑料瓶中,如需要其它浓度的氢氧化钠溶液,可取浓氢氧化钠溶液照上法稀释后标定,或直接以O.lmoL/L标准溶液稀释即得。
2、0.1moL/L盐酸标准溶液配制及标定(1 )配制:量取9inL浓盐酸,用纯水稀释为lOOOmL ,混匀。
此溶液的浓度为0.1moL/L o(2 )标定:准确称取0.15 -0.2g于270 ~ 300°C灼烧至恒重的基准无水碳酸钠。
共称三份,分别于250inL三角烧瓶中,各加50mL纯水使之溶解,加1 ~ 2滴甲基橙指示剂,用上述盐酸滴定至溶液由黄色变为橙色。
同时作空白试验。
按下式计算HCL溶液的准确浓度:C= 2m x 1000/ ( V-V ) *M21 1式中:C盐酸溶液的浓度,moL/L ;m…无水碳酸钠的质量,g ;V…滴定碳酸钠消耗的盐酸溶液体积,niL; 1 V—空白试验消耗盐酸的体积,mL ; 2 M ( 106.0 )--碳酸钠的式量。
3、0・02moL/L乙二胺四乙酸二钠标准溶液配制及标定(1 )配制:称取7-5g乙二胺四乙酸二钠(即EDTA-2Na ),溶于纯水中,并稀释为lOOOmL ,摇匀即得。


标准溶液的配制与标定容量法基本标准溶液的配制与标定[1]目录1、中和法邻苯二甲酸氢钾标准溶液的配制0.05M NaOH溶液的配制0.05M NaOH溶液的标定2、氧化还原法KMnO4-Na2C2O4法0.0500MNa2C2O4标准溶液的配制0.0500MKMnO4溶液的配制及标定K2Cr2O7 -(NH4)2Fe(SO4)2法0.0500MK2Cr2O7标准溶液的配制0.05M(NH4)2Fe(SO4)2溶液的配制0.05M(NH4)2Fe(SO4)2溶液的标定碘量法0.05M Na2S2O3溶液的配制0.05M Na2S2O3溶液的配制0.05M Na2S2O3溶液的标定3、络合滴定法0.0500MZn标准溶液的配制0.05M EDTA溶液的配制0.05M EDTA溶液的标定1. 中和法1.1 标准溶液的配制及标定1.1.1 0.0500M邻苯二甲酸氢钾标准溶液的配制基准试剂邻苯二甲酸氢钾于110~120℃干燥2小时,干燥器中冷却至室温后,感量0.1mg光电天平上称量瓶中称取10.2114g,烧杯中以冷沸的去离子水溶解、转移至1000ml容量瓶中并稀释至刻度,摇匀并粘贴标签;1.1.2 0.05M NaOH溶液的配制感量0.1g粗天平上称取NaOH 2.0g,在烧杯中以约150ml煮沸并冷却的去离子水溶解,待冷却至室温后转移至1000ml容量瓶中以此去离子水稀释至刻度,摇匀并粘贴标签。
1.1.3 标定以20ml吸液管分别吸取0.0500M邻苯二甲酸氢钾标准溶液2~3份于250ml锥形瓶中,分别加去离子水约80ml并略加摇振。
以待标定的0.1MNaOH溶液洗涤25ml滴定管2~3次,加此NaOH溶液至此滴定管中并调整液面至滴定管的“0”位置。
滴定,加0.1%酚酞溶液指示剂2~3滴,滴定至局部出现较明显的红色时放慢滴定速度至约十秒钟一滴,并以洗瓶冲洗锥形瓶内壁,滴定至锥形瓶中溶液刚呈现粉红色且半分钟内不消褪为终点,记录此数据并计算、取平均值。


