氧化还原反应和四大基本反应类型的关系
- 格式:ppt
- 大小:6.51 MB
- 文档页数:6

氧化还原一、基本概念从本质上:定义:从化合价角度:特征及判断依据三氧三还:(氧化剂)降→得→还(发生还原反应或被还原,生成还原产物)(还原剂)升→失→氧(发生氧化反应或被氧化,生成氧化产物)氧化还原反应与四种基本反应类型的关系:[检测]1、在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是()A.该反应属于复分解反应B.该反应中KClO3被还原为Cl2C.该反应中氧化产物为Cl2D.该反应中氧化剂为I22、在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是()A.2F2+2H2O==4HF+O2B.C+H2O==CO+H2(加热)C.2Na+2H2O==2NaOH+H2↑D.Cl2+H2O==HCl+HClO3、铁屑溶于过量的盐酸后,再加入下列物质,会有三价铁生成的是()A、硫酸B、氯水C、硝酸锌D、氯化钙4、硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。
反应中生成的氧化产物和还原产物的分子个数之比是( )A. 1:3B. 2:3C. 1:1D. 4:36、下列说法错误的是()A.2H2S+ SO2 =3S+2H2O中,氧化产物和还原产物物质的量之比为2:1B.4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2C.3I2 + 6KOH5KI + KIO3 + 3H2O中,被氧化和被还原的碘元素物质的量之比为1:5D.2FeS+ 6H2SO4(浓)Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:37、锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。
从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原,下列说法正确的是:()2Sb2S3+3O2+6Fe=Sb4O6+6FeS①;Sb4O6+6C=4Sb+6CO②。

氧化还原反应专项练习一、氧化还原反应1、氧化还原反应与四大基本反应类型关系2、氧化还原反应的概念:氧化还原反应实质:电子的转移(得失或偏移) 氧化还原反应特征:化合价变化氧化还原反应中的概念一般是成对出现的,理清概念是解决问题的关键。
还原剂→失去电子→化合价升高→被氧化→得氧化产物氧化剂→获得电子→化合价降低→被还原→得还原产物3、氧化还原反应中电子转移方向和数目的表示方法:双线桥法4、常见的氧化剂和还原剂:氧化剂:易得电子或化合价易降低的物质。
①活泼的非金属单质:O2、Cl2、S等②高价态的金属阳离子:Fe3+、Cu2+等③其它高价态的物质:HNO3、KMnO4、浓H2SO4、KClO3等④过氧化物:H2O2、Na2O2等还原剂:易失电子或化合价易升高的物质。
①活泼的金属②不十分活泼的非金属:C、P、S、Si等③低价态的金属阳离子:Fe2+④部分阴离子:SO32–、S2–、I–、Br–等⑤低价态的物质:H2S、CO等例1、下列反应中,属于非氧化还原反应的是( )A.3CuS+8HNO3 == 3Cu(NO3)2+2NO↑+3S↓+4H2O B。
3Cl2+6KOH == 5KCl+KClO3+3H2OC。
3H2O2+2KCrO2+2KOH == 2K2CrO4+4H2O D.3CCl4+K2Cr2O7 == 2CrO2Cl2+3COCl2+2KCl常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
判断下列物质中元素的化合价CuFeS2K2FeO4Li2NH LiNH2AlN Na2S2O3C2O错误!HCN CuH K2FeO4Si3N4例2、KMnO4+HBr—Br2+MnBr2+KBr+H2O 氧化剂,还原剂,氧化产物,还原产物,若消耗0。
1mol氧化剂,则被氧化的还原剂的物质的量为mol。
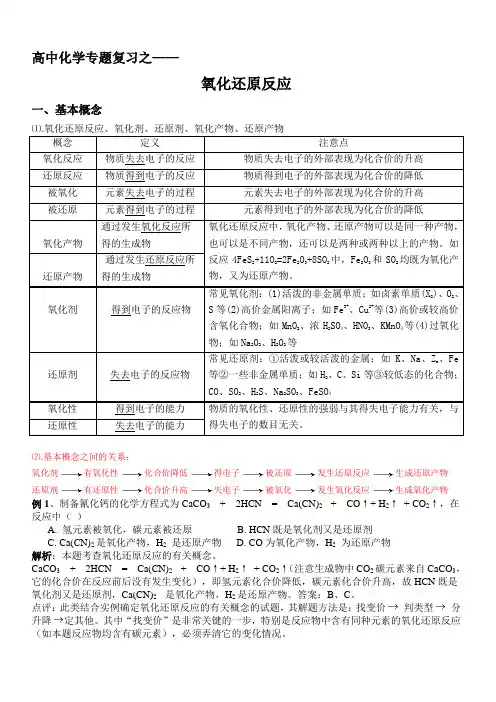
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。


氧化还原反应知识点复习与练习1、氧化还原反应定义:有化合价变化的反应就叫做氧化还原反应。
(判断的依据)本质:有电子转移(得失或偏移)2、氧化反应:化合价升高,失去电子的反应叫氧化反应。
还原反应:化合价降低,得到电子的反应叫还原反应。
3、氧化还原反应实质的表示方法(1)电子得失法即双线桥法a、两条线桥从反应物指向生成物,且对准同种元素b、要标明"得"、"失"电子,且数目要相等。
c、箭头不代表电子转移的方向。
(2)电子转移法即单线桥法a、一条线桥表示不同元素原子得失电子的情况。
b、不需标明"得"、"失"电子,只标明电子转移的数目。
c、箭头表示电子转移的方向。
d、单线桥箭头从还原剂指向氧化剂。
4、氧化剂、还原剂5、氧化还原反应与四种基本反应类型的关系(1) 置换反应都是氧化还原反应。
(2)化合反应不都是氧化还原反应,有单质参加的化合反应是氧化还原反应。
(3)分解反应不都是氧化还原反就,有单质生成的分解反应才是氧化还原反应。
(4)复分解反应都不是氧化还原反应。
6、氧化性还原性强弱的判断(1)氧化性:氧化剂>氧化产物(2)还原性:还原剂>还原产物(3)金属单质的还原性看金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au失电子能力逐渐减弱,还原性逐渐减弱单质还原性强,其对应的离子的氧化性就弱。
金属离子的氧化性看金属活动顺序表倒过来的顺序。
例如下列几种阳离子氧化性由强到弱的顺序是:Ag+>Cu2+>Fe2+>Al3+>K+(注:Fe3+>Cu2+)8、氧化还原方程式的配平一般用"化合价升降法"或"电子得失法"配平。
配平原则是"化合价升降总数相等"或"得失电子总数相等"。
下面以硫与浓硝酸反应为例,说明配平的一般步骤:(1)标变价:标出氧化剂、还原剂、氧化产物、还原产物中价变元素的化合价。

初中四大基本反应类型特点
初中学习化学时,学生们需要学习四大基本反应类型,它们分别
是酸碱反应、氧化还原反应、置换反应和双水解反应。
酸碱反应: 酸和碱在反应中互相中和,产生盐和水。
通常会产生
气体,如二氧化碳等。
酸强度与pH值成反比关系,而碱强度则与pOH
值成正比关系。
氧化还原反应: 氧化还原反应是指一种或多种物质失去电子,而
另一种或多种物质同时获得电子的反应。
氧化剂能够氧化其他物质,
而还原剂则能够还原其他物质。
置换反应: 置换反应是指一个单质A中的原子或原子团被另一个
单质B中的原子或原子团所替换,产生新的单质C和新的单质D。
原子量大的单质能够取代原子量小的单质,而活泼性较高的元素能够取代
活泼性较低的元素。
双水解反应: 双水解反应是指一个物质被水分子同时作为酸和碱
而水解的反应。
产生两种反应物和两种生成物。
但是一般情况下只有
一种物质发生水解。
以上这些反应类型在日常生活中也有很多应用,例如酸碱中和可
以用来调节水的pH值,氧化还原反应可以用来发电和制造化学品等等。




专题04 氧化还原反应的基本概念和规律【知识梳理】【归纳总结】一.氧化还原反应的认识1.氧化还原反应的本质和特征2.氧化还原反应的基本概念【巧解巧记】升失氧、降得还,剂性一致,其他相反。
3.氧化还原反应与四种基本反应类型的关系二.氧化还原反应的表示方法1.双线桥法双线桥法是用两条线桥来表示氧化还原反应中化合价变化或电子转移方向和数目的方法。
方法如下:一条线箭头由氧化剂中得电子的原子指向还原产物中的同种元素的原子,并标明得到的电子数,另一条线箭头由还原剂中失电子的原子指向氧化产物中的同种元素的原子,并标明失去的电子数。
可概括为“标变价、画箭头、算数目、说变化”。
2.单线桥法单线桥法是用一条线桥来表示氧化还原反应中电子转移的方向和数目的方法。
方法如下:在反应物一侧,箭号起点为失电子原子,终点为得电子原子,在线上只标转移电子总数,不标“得到”“失去”。
三.氧化性、还原性强弱的比较方法1.依据氧化还原反应原理判断(1)氧化性强弱:氧化剂>氧化产物(2)还原性强弱:还原剂>还原产物2.依据元素活动性顺序判断(1)金属越活泼,其单质的还原性越强,对应阳离子的氧化性逐渐减弱。
(2)非金属越活泼,其单质氧化性越强,对应阴离子的还原性越弱。
F2、Cl2、Br2、I2、SF-、Cl-、Br-、I-、S2-由左至右,非金属单质的氧化性逐渐减弱;F-、Cl-、Br-、I-、S2-,由左至右,阴离子的还原性逐渐增强。
3.依据产物中元素价态的高低判断(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
例如:(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
例如:4.依据影响因素判断(1)浓度:同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强。

氧化还原反应部分复习一、氧化还原反应基础1、氧化还原反应的实质:2、氧化还原反应的特征:3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、元素由化合态变游离态,可能被氧化,也可能被还原。
6、元素最高价态只有氧化性,;元素最低价态只有还原性。
7、氧化还原反应与四大反应类型的关系:8、氧化还原反应应用模型:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物一、氧化还原反应概念1.下面有关氧化还原反应的叙述不正确的是 ( )A.在反应中不一定所有元素的化合价都发生变化B.肯定有一种元素被氧化,另一种元素被还原C.在氧化还原反应中,失去电子的物质,所含元素化合价降低D.氧化还原反应的本质是电子的转移2.氧化还原反应的实质是( ) A.得氧和失氧B.化合价的升降C.有无新物质生成D.电子的转移3.下列叙述正确的是()A.在氧化还原反应中,做氧化剂的物质不能做还原剂B.分解反应都是氧化还原反应C.反应中某元素的原子变为阳离子,则该元素的单质在反应中一定是还原剂D.凡是没有电子转移也就没有化合价升降的反应,就不属于氧化还原反应4.下列反应中,属于氧化还原反应的是( )A.CaCO3+2HCl CaCl2+CO2↑+H2O B.CaO+H2O Ca(OH)2C.Fe+CuSO4FeSO4+Cu D.5.下列反应属于非氧化还原反应的是( )A.Fe2O3+3CO====2Fe+3CO2B.NH4NO3====N2O↑+2H2OC.2NaHCO3==Na2CO3+CO2↑+H2OD.Cu2(OH)2CO3==2CuO+CO2↑+H2O 6.实验室利用氧化还原反应制取的气体是()A.O2 H2CO2B.O2CO2C.CO2D.H2O2二、氧化还原反应与四大基本反应类型的关系7.下列反应一定属于氧化还原反应的是()A.化合反应式B.分解反应 C.置换反应D.复分解反应8.下列说法中错误的是( )A.凡是氧化还原反应,都不可能是复分解反应B.化合反应不可能是氧化还原反应C.置换反应一定是氧化还原反应D.分解反应可能是氧化还原反应三、氧化剂、还原剂(一)氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物判断题型一:氧化剂、还原剂;氧化产物、还原产物判断10.在下列反应中,水作还原剂的是( )A.SO3+H2O=H2SO4B.2Na+2H2O=2NaOH+H2↑C.2H2+O22H2O D.2F2+2H2O=4HF+O211.CaH2常做生氢剂,其中氢元素是-1价,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,其中水是()A.还原剂B.既是氧化剂,又是还原剂C.氧化剂D.既不是氧化剂,又不是还原剂12.在2KMnO4==2K2MnO4 + MnO2 + O2↑中,KMnO4所起的作用是:()A.氧化剂B.既不是氧化剂又不是还原剂C.还原剂D.既是氧化剂又是还原剂14.下列表示SO2被还原的反应是()A.SO2+2H2O+Cl2==H2SO4+2HClB.SO2+2H2S==3S↓+2H2OC.SO2+H2O==H2SO3D.2SO2 + O2 ===2SO315.(05江苏)在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是A.硫在空气中燃烧B.铜片与浓硫酸共热C.红热的木炭与浓硫酸反应 D.亚硫酸钠与稀硫酸反应16.在下列反应中,氧化产物与还原产物是同一种物质的是()A.二氧化碳通过赤热的炭层B.氧化铜和木炭在高温下反应C.氢气通过灼热的氧化铜D.一氧化碳通过高温的赤铁矿17.某元素在化学反应中由化合态变为游离态,则该元素()A.可能被氧化B.一定被还原C.既可能被氧化又可能被还原D.以上都不是18.在K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O反应中,______是氧化剂;______是还原剂;______元素被氧化;______元素被还原;______是氧化产物;______是还原产物题型二:氧化性、还原性判断20.下列微粒①Al3+②Cl-③N2④MnO4- ⑤CO2⑥H2O2⑦Fe2+⑧MnO42-既具有氧化性又具有还原性的是A.①④⑤⑦B.③⑥⑦⑧C.④⑤⑥⑧D.①②③⑥21.下列离子最容易给出电子的是()A.Cl— B.Cu2+C.Fe2+ D.F—22.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与O2的结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有()A.酸性B.碱性C.氧化性D.还原性23.阅读下列材料后,回答相应问题一个体重50Kg的健康人,含铁2g。
氧化还原反应知识点总结标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]一、氧化还原基本概念1、四组重要概念间的关系(1)氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学变化叫氧化还原反应。
氧化还原反应的特征:元素化合价的升降;氧化还原反应的实质:电子转移。
(2)氧化反应和还原反应:在氧化还原反应中,反应物所含元素化合价升高(或者说物质失去)电子的反应成为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。
(3)氧化剂、还原剂是指反应物。
所含元素化合价降低的物质叫做氧化剂,所含元素化合价升高的物质叫做还原剂。
(4)氧化产物、还原产物是指生成物。
所含元素化合价升高被氧化,所得产物叫做氧化产物,所含元素化合价降低被还原,所得产物叫做还原产物。
关系:口诀:化合价升.高,失.电子,被氧.化,还.原剂,氧.化反应;(升失氧还氧)化合价降.低,得.电子,被还.原,氧.化剂,还.原反应;(降得还氧还)2、氧化还原反应与四种基本反应类型注意:有单质参加的化合反应和有单质生成的分解反应均为氧化还原反应。
二、氧化还原反应的有关计算1.氧化还原中的电子转移表示法(1)双线侨法:在反应物和生成物之间表示电子转移结果,该法侧重于表示同一元素的原子或离子间的电子转移情况,如注意:○1线桥从方程式的左侧指向右侧;○2箭头不表示得失,只表示变化,所以一定要标明“得”或“失”。
(2)单线桥法:在反应物中的还原剂与氧化剂之间箭头指向氧化剂,具体讲是箭头从失电子的元素出发指向得电子的元素。
如三、氧化还原反应的类型1.还原剂+氧化剂氧化产物+还原产物此类反应的特点是还原剂和氧化剂分别为不同的物质,参加反应的氧化剂或还原剂全部被还原或氧化,有关元素的化合价全部发生变化。
例如:2.部分氧化还原反应此类反应的特点是还原剂或氧化剂只有部分被氧化或还原,有关元素的化合价只有部分发生变化,除氧化还原反应外,还伴随非氧化还原反应。
一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展二、氧化还原反应与四种基本反应类型1.四种基本类型的反应2.氧化还原反应与四种基本类型反应的关系①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!解释:四、氧化还原反应电子转移表示方法双线桥法:(1)两条桥线从反应物指向生成物,且对准同种元素;(2)要标明“得”“失”电子,且数目要相等;(3)箭头不代表电子转移的方向。
单线桥法:(1)一条桥线表示不同元素原子得失电子的情况;(2)不需标明“得”“失”电子,只标明电子转移的数目;(3)箭头表示电子转移的方向;(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)(2)元素处于高价时的含氧酸(硝酸、浓硫酸)(3)元素处于高价时的盐:(KClO3、KMnO4、FeCl3)(4)过氧化物(H2O2、Na2O2)(5)其它(HClO)常见的还原剂(处于低价态的元素的单质或化合物):(1)活泼的金属单质:K、Na、Mg等;(2)非金属单质:H2、C、Si等;(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
氧化还原反应一、基础知识点回顾得、降,氧化剂,一氧对三还;失、升,还原剂,一还对三氧。
反氧化剂→得电子→化合价降低→被还原→还原反应→还原产物生应成物还原剂→失电子→化合价升高→被氧化→氧化反应→氧化产物物1、几组概念的理解氧化剂→氧化性氧化反应→氧化产物还原剂→还原性还原反应→还原产物氧化剂+ 还原剂= 氧化产物+ 还原产物强强弱弱2、氧化还原反应与四大基本反应类型之间的关系二、经典应用(“双线桥”表示氧化还原反应)举例讲解:加热4HCl(浓) + MnO2 ==== MnCl2 + 2H2O + Cl2↑①注明元素化合价,并用“桥线”连接处于不同价态的同一种元素②在“桥线”上注明:得失电子、化合价升降、元素被氧化、被还原情况③注明得失电子的具体数目(最好写成a×b e-的形式)a:得失电子的原子的数目,b:每个原子得失电子的数目(即元素化合价降、升的数值)④判断氧化剂、还原剂、氧化产物、还原产物等⑤比较物质氧化性、还原性的强弱三、具体考点:一、)有关基本概念的考查(判断是否是氧化还原反应;氧化剂、还原剂;氧化产物、还原产物;氧化反应过程、还有反应过程)例1:下列有关氧化还原反应的叙述正确的是()A、氧化还原反应的本质是元素化合价发生了改变B、化合价升高的物质,得到电子被氧化C、还原剂在反应中发生还原反应D、同一反应物可能既发生氧化反应又发生还原反应【答案:】D例2:下列说法中,正确的是()A、还原剂在反应中被还原B、失去电子越多的还原剂,还原性越强C、氧化还原反应中,某元素由游离态变为化合态,此元素可能被还原也可能被氧化D、氧化汞加强热的分解反应中,氧化汞既不是氧化剂又不是还原剂【答案:】C例3:下列反应中,不属于氧化还原反应的是()A、2H2O2 = 2H2O + O2↑B、Cl2+ 2NaOH = NaCl + NaClO + H2OC、Fe2O3+ 3CO = 2Fe + 3CO2D、2Al(OH)3= Al2O3+ 3H2O【答案:】D例4:下列反应中属于氧化还原反应,但水既不作氧化剂,又不作还原剂的是()A、2F2+ 2 H2O = 4HF + O2B、3NO2+ H2O = NO + 2HNO3C、2Na2O2+ 2 H2O = 4NaOH + O2↑D、2Na + 2 H2O = 2 NaOH + H2↑E、2 H2O = 2 H2↑+ O2↑F、SO2+ H2O = H2SO3【答案:】BC例5:氢化钙可作生氢剂,反应的化学方程式为:CaH2+ 2 H2O = Ca(OH)2+ 2H2↑下列说法错误的是()A、CaH2是还原剂,H2O是氧化剂B、H2既是氧化产物,又是还原产物C、CaH2既是还原剂,又是氧化剂D、氧化产物与还原产物的质量比为1:1【答案:】C【补充】价态归中法则与邻位转化规律:指出下列氧化还原反应中的氧化剂、还原剂,氧化产物、还原产物分别是什么1、CaH2+ 2 H2O = Ca(OH)2+ H2↑2、2Na2O2+ 2 H2O = 4NaOH + O2↑3、H2S + H2SO4= S ↓+ SO2↑+ 2 H2O例6:在下列氧化还原反应中,酸的作用除了体现出酸性还体现出氧化性的是()A、Zn + 2HCl = ZnCl2 + H2↑加热B、MnO2 + 4HCl(浓)===== MnCl2 + Cl2↑+ 2H2O加热C、Cu + 2H2SO4(浓) ===== CuSO4 + SO2↑+ 2H2O通电D、2HCl ===== H2↑+ Cl2↑【答案:】C【结论:】判断酸的作用应关注中心元素的化合价:中心元素化合价升高体现还原性;中心元素化合价降低体现氧化性;中心元素化合价不变体现酸性。