金属腐蚀理论及防护第二章
- 格式:ppt
- 大小:1.90 MB
- 文档页数:34


第二章金属的电化学腐蚀通常规定凡是进行氧化反应的电极称为阳极;进行还原反应的电极就叫做阴极。
由此表明,作为一个腐蚀电池,它必需包括阴极、阳极、电解质溶液和电路四个不可分割的部分。
而腐蚀原电池的工作历程主要由下列三个基本过程组成:1、阳极过程:金属溶解,以离子的形式进入溶液,并把当量的电子留在金属上;2、阴极过程:从阳极过来的电子被电解质溶液中能够吸收电子的氧化性物质所接受;3、电流的流动:金属部分:电子由阳极流向阴极;溶液部分:正离子由阳极向阴极迁移。
4、腐蚀电池的类型可以把腐蚀电池分为两大类:宏观腐蚀电池和微观腐蚀电池一、宏观腐蚀电池1)、异金属接触电池2)、浓差电池3)、温差电池二、微观腐蚀电池在金属表面上由于存在许多极微小的电极而形成的电池称为微电池。
微电池是因金属表面的电化学的不均匀性所引起的1、金属化学成分的不均匀性2、组织结构的不均匀性3、物理状态的不均匀性4、金属表面膜的不完整性当参与电极反应的各组分活度(或分压)都等于1,温度规定为25 C,这种状态称为标准状态,此时,平衡电位Ee等于E0,故E0称为标准电位。
由于通过电流而引起原电池两极间电位差减小并因而引起电池工作电流强度降低的现象,称为原电池的极化作用。
当通过电流时阳极电位向正的方向移动的现象,称为阳极极化。
当通过电流时阴极电位向负的方向移动的现象,称为阴极极化。
消除或减弱阳极和阴极的极化作用的电极过程称为去极化作用或去极化过程根据控制步骤的不同,可将极化分为两类:电化学极化和浓度极化极化分类:电化学极化:电子转移步骤最慢为控制步骤所导致浓度极化:电子转移步骤快,而反应物从溶液相中向电极表面运动成产物自由电极表面向溶液相内部运动的液相传质成为控制步骤电阻极化:电流通过电解质溶液和电极表面的某种类型膜而产生的欧姆降。
产生阳极极化的原因:1、阳极的电化学极化2、阳极的浓度极化3、阳极的电阻极化。
析氢腐蚀以氢离子作为去极化剂的腐蚀过程,称为氢离子去极化腐蚀吸氧腐蚀以氧作为去极化剂的腐蚀过程,称为氧去极化腐蚀氢去极化腐蚀的特征1、阴极反应的浓度极化小,一般可以忽略。

我国腐蚀与防护学会金属防腐蚀手册第一章:金属腐蚀的基本概念1. 金属腐蚀的定义金属腐蚀是指在金属与其周围环境接触的情况下,金属表面受到化学或电化学的侵蚀,导致金属的质量和结构发生变化的过程。
金属腐蚀是一个不可逆转的过程,对金属的损坏是永久性的。
2. 金属腐蚀的分类根据腐蚀介质的不同,金属腐蚀可分为化学腐蚀和电化学腐蚀两种类型。
化学腐蚀是指金属直接受到化学物质的腐蚀,而电化学腐蚀是指金属与电解质溶液接触时发生的一种电化学过程。
3. 金属腐蚀的危害金属腐蚀不仅会导致金属的质量和结构损坏,还会影响到金属制品的外观和使用寿命。
金属腐蚀也会对环境造成污染,对人体健康和安全构成威胁。
第二章:金属防腐蚀的原理和方法1. 金属防腐蚀的原理金属防腐蚀的原理是通过改变金属与其周围环境的接触状态,阻止金属腐蚀的发生。
常用的金属防腐蚀方法包括物理防腐蚀、化学防腐蚀和电化学防腐蚀等。
2. 金属防腐蚀的方法(1)涂层防腐蚀:将金属涂覆一层具有耐腐蚀性的涂层,以隔离金属与环境的接触,防止腐蚀的发生。
(2)阳极保护:在金属的表面放置一块较活泼的金属,使其成为阳极,从而保护被保护金属。
(3)合金化:将一种或多种金属或非金属添加到金属中,改变金属的组织结构和物理性能,提高金属的抗腐蚀能力。
(4)阴极保护:通过外加电流或外加电源,使金属表面成为阴极,从而抑制金属腐蚀的发生。
第三章:金属防腐蚀的应用实践1. 工业领域中的金属防腐蚀在石化、船舶、汽车、航空航天等工业领域中,金属制品往往需要具备较高的耐腐蚀性能,以确保设备和产品的安全、稳定和持久运行。
2. 城市基础设施中的金属防腐蚀城市基础设施中的钢结构、管道、桥梁、隧道等金属构件,常常需要经过防腐蚀处理,以保证其在潮湿、高盐度环境下的使用寿命和安全性。
3. 日常生活中的金属防腐蚀在日常生活中,我们经常接触到各种金属制品,如家具、电器、汽车等,这些金属制品也需要经过防腐蚀处理,以延长其使用寿命和美观度。


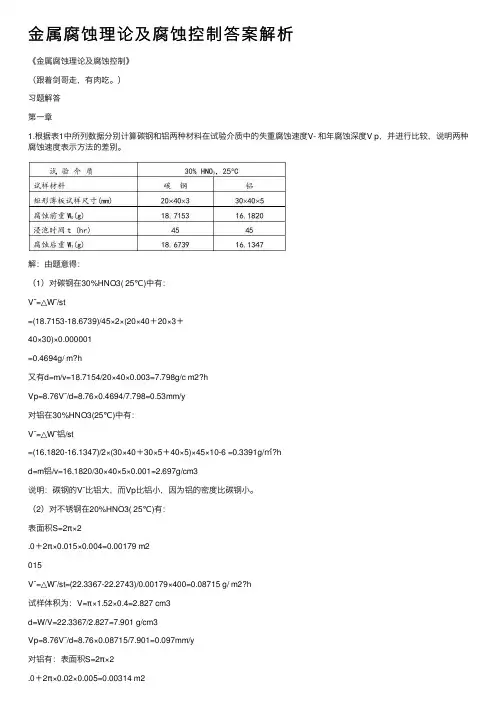
⾦属腐蚀理论及腐蚀控制答案解析《⾦属腐蚀理论及腐蚀控制》(跟着剑哥⾛,有⾁吃。
)习题解答第⼀章1.根据表1中所列数据分别计算碳钢和铝两种材料在试验介质中的失重腐蚀速度V- 和年腐蚀深度V p,并进⾏⽐较,说明两种腐蚀速度表⽰⽅法的差别。
解:由题意得:(1)对碳钢在30%HNO3( 25℃)中有:V¯=△W¯/st=(18.7153-18.6739)/45×2×(20×40+20×3+40×30)×0.000001=0.4694g/ m?h⼜有d=m/v=18.7154/20×40×0.003=7.798g/c m2?hVp=8.76V¯/d=8.76×0.4694/7.798=0.53mm/y对铝在30%HNO3(25℃)中有:V¯=△W¯铝/st=(16.1820-16.1347)/2×(30×40+30×5+40×5)×45×10-6 =0.3391g/㎡?hd=m铝/v=16.1820/30×40×5×0.001=2.697g/cm3说明:碳钢的V¯⽐铝⼤,⽽Vp⽐铝⼩,因为铝的密度⽐碳钢⼩。
(2)对不锈钢在20%HNO3( 25℃)有:表⾯积S=2π×2.0+2π×0.015×0.004=0.00179 m2015V¯=△W¯/st=(22.3367-22.2743)/0.00179×400=0.08715 g/ m2?h试样体积为:V=π×1.52×0.4=2.827 cm3d=W/V=22.3367/2.827=7.901 g/cm3Vp=8.76V¯/d=8.76×0.08715/7.901=0.097mm/y对铝有:表⾯积S=2π×202V¯=△W¯/st=(16.9646-16.9151)/0.00314×20=0.7882 g/m2?h 试样体积为:V=π×22×0.5=6.28 cm3d=W/V=16.9646/6.28=2.701 g/cm3Vp=8.76V¯/d=8.76×0.7882/2.701=2.56mm/y试样在98% HNO3(85℃)时有:对不锈钢:V¯=△W¯/st=(22.3367-22.2906)/0.00179×2=12.8771 g/ m2?hVp=8.76V¯/d=8.76×12.8771/7.901=14.28mm/y对铝:V¯=△W¯/st=(16.9646-16.9250)/0.00314×40=0.3153g/ m2?hVp=8.76V¯/d=8.76×0.3153/2.701=1.02mm/y 说明:硝酸浓度温度对不锈钢和铝的腐蚀速度具有相反的影响。





第二章金属的电化学腐蚀2.5 腐蚀极化图2.6 金属的钝化2.7 塔菲尔关系2.8 能斯特方程一、伊文思(Evans)极化图二、腐蚀电流三、腐蚀控制因素伊文思(Evans)极化图不考虑电位随电流变化细节,将两个电极反应所对应的阴极、阳极极化曲线简化成直线画在一张图上,这种简化了的图称为伊文思极化图伊文思(Evans)极化图↘在一个均相的腐蚀电极上,如果只进行两个电极反应,则金属阳极溶解的电流强度一定等于阴极还原反应的电流强度↘在实验室里,一般用外加电流测定阴、阳极极化曲线来绘制伊文思极化图伊文思(Evans)腐蚀图↘AB阳极极化曲线BC阴极极化曲线OG欧姆电位降CH欧姆、阴极极化总线↘阳极极化率Pa=tgβ阴极极化率Pc=tgα伊文思(Evans )腐蚀图↘考虑欧姆压降,腐蚀电流为I ’,↘阳极极化的电位降:ΔE a = E ’a –E 0a =I ’tgβ= I ’Pa阴极极化的电位降:ΔE c = E ’c –E 0c =I ’tg α= I ’Pc欧姆压降:ΔE r = I ’R腐蚀电池总压降:E 0c -E 0a = I ’(Pa+Pc+ R )腐蚀电流:腐蚀控制因素1)初始电位差与腐蚀电流的关系2)极化率与腐蚀电流的关系3)氢过电位与腐蚀速度的关系阴极析氢过电位:阴极电极材料表面状态不同金属表面上氢过电位不同。
腐蚀控制因素1)虽然锌的氢过电位比较铁的电位负,但由于氢过电位高,锌在还原性酸溶液中的腐蚀速度反而比铁小;2)如果在溶液中加入少量的Pt 盐,由于氢在析出的铂上的过电位比锌、铁都低,所以铁和锌的腐蚀速度都明显增加。
钝化现象1)实际情况中,一些较活泼的金属在某些特定的环境介质中,都具有较好的耐蚀性。
2)Fe在不同浓度的硝酸中的腐蚀w < 30%:硝酸浓度上升,腐蚀速率增加w=30~40%:腐蚀速率最大w > 40%:硝酸浓度上升,腐蚀速率突然急剧降低—钝化w-80%:腐蚀速率又增加,—过钝化钝化现象1)金属或合金在某种条件下,由活化态转为钝态的过程称为钝化。
绪论金属腐蚀的定义: 金属材料和环境介质发生化学或电化学作用,引起材料的退化与破坏称为金属的腐蚀.本课程研究的内容• 1. 研究金属和周围介质作用时所发生的化学或电化学的现象、机理及其一般规律。
• 2. 研究各种条件下金属材料的防止腐蚀的方法和措施。
三、金属腐蚀与防护的重要性经济损失:•直接损失:指采用防护技术的费用和发生腐蚀破坏以后的维修、更换费用和劳务费用。
•间接损失:指设备发生腐蚀破坏造成停工、停产;引起的物资跑、冒、滴、漏损失;对环境污染以至爆炸、火灾等事故的间接损失更是无法估量。
第一章金属材料的高温化学腐蚀第一节概述一、高温化学腐蚀定义:高温化学腐蚀是研究金属材料和与它接触的环境介质在高温条件下所发生的界面反应过程的科学。
金属高温腐蚀与常温腐蚀的区别:高温腐蚀:主要是以界面的化学反应为特征。
常温腐蚀:主要是电化学过程。
金属材料的高温腐蚀反应式:Me(金属)+X(介质)--MeX(腐蚀产物)二、高温腐蚀分类按环境介质状态分1)高温气态介质腐蚀(2)高温液态介质腐蚀(3)高温固态介质腐蚀(1)高温气态介质腐蚀:气态介质中包括有单质气体分子。
非金属化合物气体分子。
金属氧化物气态分子,和金属盐气态分子。
由于这种高温腐蚀是在高温,干燥的气体分子环境中进行的,所以常被称为“高温气体腐蚀”“干腐蚀”“化学腐蚀”。
(2)高温液态介质腐蚀:液态介质(包括液态金属,液态融盐及低熔点氧化物)对固态金属材料的高温腐蚀。
这种腐蚀包括界面化学反应,也包括液态物质对固态物质的溶解。
(3)高温固态介质腐蚀:金属材料在带有腐蚀性的固态颗粒状物质的冲刷下发生的高温腐蚀。
这类腐蚀包括固态燃灰与盐颗粒对金属材料的腐蚀。
又包括这些固态颗粒状物质对金属材料表面的机械磨损,所以人们又称为“磨蚀”或“冲蚀”。
高温腐蚀现象(1)在金属热处理过程中,碳氮共渗和盐浴处理易于产生增碳、氮化损失和熔融盐的腐蚀。
(2)含有燃烧的各个过程,比如柴油发动机、燃气轮机、焚烧炉等所产生的复杂气氛的高温氧化等腐蚀。