电化学-极化 原电池 电解池
- 格式:ppt
- 大小:791.00 KB
- 文档页数:31

第9章电分析化学法导论【9-1】解释下列名词。
原电池,电解池,电池电动势,电极电位,液接电位,标准电位,条件电位,平衡电位,浓差极化,电化学极化,超电位,指示电极,参比电极,工作电极。
答:原电池:将化学能编为电能的装置。
电解池:将电能变为化学能的装置。
电池电动势:流过电池的电流为零或接近于零时两电极间的电位差,以E池表示。
电极电位:任何电极与标准氢电极构成原电池所测得的电动势作为该电极的电极电位。
液接电位:在两个组成不同或浓度不同的电解质溶液互相接触的液-液界面间所存在的一个微小的电位差,称为液体接界电位,简称液接电位。
标准电位:298.15K时,以水为溶剂,当氧化态和还原态活度等于1时的电极电位。
条件电位:由于电极电位受溶液离子强度、配位效应、酸效应等因素的影响,因此使用标准电极电位ϕ0有其局限性。
对于一个实际体系在某一特定条件下,该电对的氧化型总浓度和还原型总浓度均为1mol·.L-1时的实际电位的实际电位。
平衡电位:在一个可逆电极中,金属成为阳离子进入溶液以及溶液中的金属离子沉积到金属表面的速度相等时,反应达到动态平衡,亦即正逆过程的物质迁移和电荷运送速度都相同,此时该电极上的电位值称为平衡电极电位。
浓差极化:发生电极反应时,电极表面附近溶液浓度与主体溶液浓度不同所产生的现象称为浓差极化。
电化学极化:由于电极反应的速率较慢而引起的电极电位对平衡电位值的偏离现象。
超电位:由于极化,使实际电位和可逆电位之间存在差异,此差异即为超电位η。
指示电极:用于无电极反应发生的平衡体系或在测量过程中溶液浓度不发生可觉察变化体系的电极。
参比电极:在测量过程中其电极电位几乎不发生变化的电极。
工作电极:有电极反应发生电极表面溶液浓度随电极反应发生显著变化体系的电极的电极。
【9-2】盐桥的作用是什么?对盐桥中的电解质溶液应有什么要求?答:盐桥的作用是尽可能降低液接电位。
盐桥电解质的要求是:(1)正、负离子的迁移速率大致相等(如KCl,KNO3, NH4NO3等),且可达到较高浓度;(2)与半电池中溶液不发生化学反应。

原电池原理及应用考点一原电池的工作原理及其应用1.原电池的概念:将化学能转化为电能的装置。
2.原电池的构成条件:(1)能自发地发生氧化还原反应。
(2)两个活泼性不同的电极(材料可以是金属或导电的非金属)。
①负极:活泼性较强的金属。
②正极:活泼性较弱的金属或能导电的非金属。
(3)电极均插入电解质溶液中。
(4)构成闭合回路(两电极接触或用导线连接)。
3.工作原理以锌铜原电池为例:单液单池:双液双池::(1)原电池将一个完整的氧化还原反应分为两个半反应,负极发生,正极发生,(简称:)一般将两个电极反应中得失电子的数目写为相同,相加便得到电池总反应方程式。
(2)不参与电极反应的离子从微观上讲发生移动,但从宏观上讲其在溶液中的浓度,(3)原电池反应速率一定比直接发生的氧化还原反应快。
4.原电池原理的三大应用(1)加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(3)设计制作化学电源①首先将氧化还原反应分成两个半反应。
②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
如:根据反应2FeCl3+Cu===2FeCl2+CuCl2设计的原电池为:【互动思考】1.原电池内部阴、阳离子如何移动?电解池内部阴、阳离子如何移动?2.判断正误,正确的划“√”,错误的划“×”(1)在原电池中,发生氧化反应的一极一定是负极( )(2)在原电池中,负极材料的活泼性一定比正极材料强( )(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )(4)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )答案(1)√(2)×(3)×(4)√[示向题组]1.某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。

原电池和电解池的基本原理原电池和电解池都是电化学装置,利用化学反应将化学能转化为电能或者将电能转化为化学能。
它们的基本原理有所不同。
首先来讨论原电池。
原电池是通过化学反应产生电能的装置。
它由两种不同金属通过电解质桥或者盐桥相连而构成。
其中一种金属被称为负极或阳极,另一种金属被称为正极或阴极。
电解质桥或者盐桥的作用是保持负极和正极之间的电中性。
在原电池中,两种金属的电势差会引起在电解质桥或者盐桥上移动的离子流。
这个流动的离子携带着电荷,产生电流。
原电池的工作原理基于两种不同金属之间的电化学电位差。
每种金属都有一个固有的电势差,被称为标准电极电势。
当这两种金属在电解质溶液中相互接触时,电解质中的离子会在两种金属之间移动,以平衡电势差。
这种移动产生的电流就是原电池的输出电流。
具体来说,当两种金属以及电解液结合在一起时,会发生氧化还原反应。
在这种反应中,一种金属会氧化成离子形式,而另一种金属则从离子形式还原回到金属形态。
这个氧化还原反应释放的能量会被转化为电能。
例如,经典的原电池就是锌-铜电池。
在这种电池中,锌金属(负极)会氧化成锌离子,铜金属(正极)则从铜离子还原回到铜金属。
这个氧化还原反应产生的电子将通过外部电路流动,从而产生电流。
电解池是另一种电化学装置,它将电能转化为化学能。
电解池由两个电极(阴极和阳极)和浸泡在电解质溶液中的物质组成。
当电流通过电解质溶液时,氧化反应(在阳极处)和还原反应(在阴极处)会同时进行。
这种反应可能是非自发的,即需要外部施加的电势才能进行。
阴极是电解池中的负极,在阴极上进行还原反应。
在还原反应中,金属离子从溶液中还原回到金属形态,同时从溶液中吸收电子。
阳极是电解池中的正极,在阳极上进行氧化反应。
在氧化反应中,金属原子氧化为离子,同时释放出电子。
电解质溶液中的离子扮演着重要的角色。
这些离子通过移动来维持电荷平衡,并在电解池中形成离子流。
需要注意的是,阴极和阳极中的离子流方向是相反的。

化学原电池和电解池知识点原电池和电解池是化学中两个重要的概念,两者的区别在于其电化学反应的方向。
本文将介绍原电池和电解池的基本概念、工作原理、以及一些相关实验和应用。
一、原电池原电池是指能够产生电流的装置,由电池内部的氧化还原(redox)反应释放出电子,从而产生电势差,并推动电流在电路中流动。
在原电池中,产生电流的反应是不可逆的,电极上的材料一旦被消耗,电池就无法再产生电流。
原电池也叫做伏安电池或电化学电池。
1. 基本概念(1)电极原电池中的电极一般由金属或导电材料制成,分为阳极和阴极两种。
阳极是电池的正极,是一个能够氧化的电极,在化学变化中会释放出电子。
阴极是电池的负极,是一个容易被还原的电极,在化学变化中会吸收电子。
(2)电解质电解质是电池中起电离导电作用的化学物质,能够分解成离子,从而产生电荷泵效应。
常用的电解质包括酸、碱、盐等。
(3)电动势电动势是指电池产生电流的能力,是一个能够推动电流流动的力量。
单位为伏特(V),一般用符号E表示。
在原电池中,电动势是由电池两极之间的电势差产生的。
2. 工作原理锌铜电池是最简单的原电池之一,由一个锌(Zn)电极和一个铜(Cu)电极以及一个电解质(如盐酸)组成。
阳极为锌电极,阴极为铜电极,电解质中含有氯离子和氢离子。
当锌电极和铜电极连接起来时,锌原子向氯离子释放电子,形成锌离子和电子。
电子从锌电极流向铜电极,由于电子流向铜电极,就形成了电流。
在铜电极上,铜离子由于吸收了电子而被还原成为铜原子。
锌电极逐渐消耗,铜电极上的铜原子逐渐增多。
当锌电极完全消耗时,电池停止工作。
铅酸电池是一种常见的存储电池,由铅(Pb)的阴极、氧化铅(PbO2)的阳极和硫酸(H2SO4)的电解质组成。
在电池工作时,硫酸电解质会溶解掉氧化铅阳极上的物质,同时,铅阴极上的铅物质也会随着电池工作逐渐脱落。
铅酸电池是一种可逆反应,即可以通过外部电源来反向充电。
在充电状态下,电池的阴极和阳极会反转,电池会从外部电源吸收电能,并将电能存储在电池中。

原电池和电解池的异同一、引言原电池和电解池是电化学领域中两种常见的装置,它们在能量转换、储存和使用等方面起着重要作用。
本文将从结构、工作原理、应用等方面对原电池和电解池进行比较,以便更好地了解它们的异同之处。
二、结构比较1. 原电池原电池通常由两个电极(正极和负极)和电解质组成。
正极和负极之间通过电解质实现离子传导,并在正负极之间产生电势差。
常见的原电池有干电池、锂电池、铅酸电池等。
2. 电解池电解池由一个电解槽、阳极和阴极以及电解质组成。
阳极是正极,阴极是负极,它们通过电解质中的离子传导进行反应。
电解池通常用于电解反应,如电镀、电解制氢等。
三、工作原理比较1. 原电池的工作原理原电池通过化学反应将化学能转化为电能。
在反应过程中,正极发生氧化反应,负极发生还原反应,形成电势差。
电流在外部电路中流动,实现能量转换。
例如,干电池中,锌离子在负极被氧化为锌离子,同时,氧化剂在正极还原,形成电势差。
2. 电解池的工作原理电解池通过外加电压将电能转化为化学能。
当外加电压大于电解质中的离子电位差时,正极发生还原反应,负极发生氧化反应。
外加电压提供了足够的能量,使电解质中的离子发生迁移,进而实现化学反应。
例如,电解水时,外加电压使得水分子发生电解,产生氢气和氧气。
四、应用比较1. 原电池的应用原电池广泛应用于日常生活和工业领域。
干电池被广泛用于电子设备、遥控器等小型电子产品中。
锂电池在移动电子设备、电动车等领域具有重要地位。
铅酸电池广泛应用于汽车、太阳能储能等方面。
2. 电解池的应用电解池在化学合成、电镀、电解制氢等方面具有重要的应用。
例如,电镀过程中,电解池用于将金属离子沉积在基底上,实现金属件的防锈、装饰等目的。
电解制氢是一种重要的清洁能源生产技术,通过电解水制氢,可以实现氢能源的储存和利用。
五、总结通过对原电池和电解池的比较,可以发现它们在结构、工作原理和应用方面存在一些异同。
原电池主要将化学能转化为电能,广泛应用于日常生活和工业领域;电解池主要将电能转化为化学能,用于化学合成、电镀、电解制氢等方面。

原电池和电解池是电化学中两个重要的概念,它们在放电和充电的过程中起着不同的作用。
本文将介绍原电池、电解池的工作原理,并从化学能与电能相互转化的角度进行阐述,旨在帮助读者更好地理解这两个概念。
一、原电池原电池是一种能够将化学能转化为电能的装置。
它的工作原理基于“氧化还原反应”和“电化学反应”。
在原电池中,化学反应产生电子,这些电子通过外部电路流动,形成电流。
1. 氧化还原反应:原电池中的化学反应通常涉及氧化剂和还原剂。
在反应过程中,电子从还原剂转移到氧化剂,从而产生电子的流动。
这些电子可以通过导线或外部电路流动,形成电流。
2. 电化学反应:原电池中的电化学反应是由正极和负极引起的。
正极通常由氧化剂组成,能够从反应中获得电子;负极通常由还原剂组成,将电子释放到反应中。
这些电子的流动导致电流的产生。
二、电解池电解池则是将电能转化为化学能的装置。
电解池的工作原理基于“电位差”和“电化学反应”。
在电解池中,电流通过电解质溶液,将电能转化为化学能。
1. 电位差:电解池中的电位差是由电源提供的。
电源的正极与电解池的阴极相连,负极与阳极相连。
在电位差的作用下,电解质溶液中的离子发生迁移和氧化还原反应。
2. 电化学反应:电解池中的电化学反应是由阳极和阴极引起的。
阳极通常由氧化性较强的物质组成,而阴极通常由还原性较强的物质组成。
在电解过程中,阳极释放出电子,而阴极获得电子,从而引发氧化还原反应。
三、应用原电池和电解池在许多领域都有应用,如能源、制造、医疗等。
例如,锂电池是一种常见的二次电池,它利用原电池的原理将化学能转化为电能,被广泛应用于电子设备中。
此外,电解池在金属的电镀、工业废水处理等领域也有广泛应用。
通过电解法,可以将废水中的有害物质分离出来,同时回收有价值的金属材料。
总之,原电池和电解池是电化学中两个重要的概念,它们通过不同的方式将化学能转化为电能或电能转化为化学能。
了解这两个概念的工作原理和应用,有助于我们更好地理解和应用电化学知识。

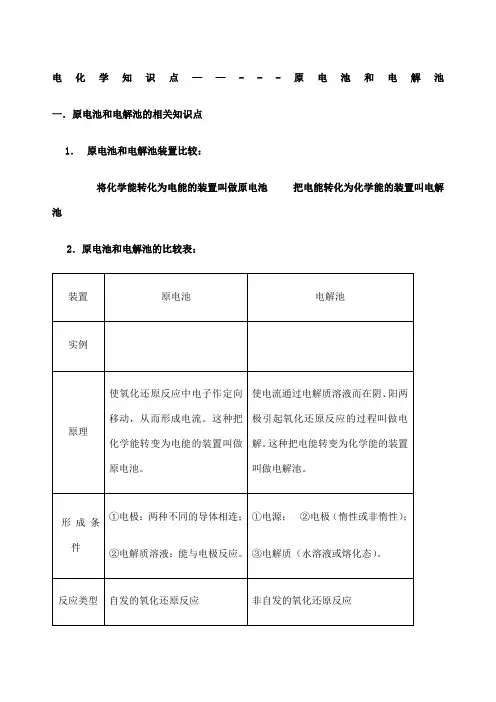
电化学知识点——---原电池和电解池一.原电池和电解池的相关知识点1.原电池和电解池装置比较:将化学能转化为电能的装置叫做原电池把电能转化为化学能的装置叫电解池2.原电池和电解池的比较表:原电池的本质:氧化还原反应中电子作定向的移动过程电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程3.化学腐蚀和电化腐蚀的区别4.吸氧腐蚀和析氢腐蚀的区别5.电解、电离和电镀的区别6.电镀铜、精炼铜比较说明、原电池正、负极的判断:(1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
(2)从电子的流动方向负极流入正极(3)从电流方向正极流入负极(4)根据电解质溶液内离子的移动方向阳离子流向正极,阴离子流向负极(5)根据实验现象①溶解的一极为负极②增重或有气泡一极为正极二.高频考点1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2+ H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2、原电池的应用:①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。
②比较金属活动性强弱。
可以利用原电池比较金属的活动性顺序(负极活泼)。
将两种不同金属在电解质溶液里构成原电池后,根据电极的活泼性、电极上的反应现象、电流方向、电子流向、离子移动方向等进行判断。
③设计原电池。
④利用原电池原理可以分析金属的腐蚀和防护问题金属的腐蚀分为化学腐蚀和电化学腐蚀两种,但主要是电化学腐蚀。
根据电解质溶液的酸碱性,可把电化学腐蚀分为:吸氧腐蚀和析氢腐蚀两种。

原电池和电解池极化曲线电池的极化曲线是描述电池在不同工作条件下的电压与电流之间关系的曲线。
在电池中,极化是指由于电极上的反应而导致的电压降低。
极化曲线可以用来分析电池的性能、稳定性和寿命。
原电池的极化曲线:
原电池(也称为非充电性电池)是一种一次性电池,不能通过外部电源重新充电。
其极化曲线通常表现为电池在使用过程中电压逐渐下降的趋势。
原电池的极化主要包括两个方面:
1. 浓差极化(Concentration Polarization):电池中的化学反应产生了产物,导致反应物在电极附近浓度下降,从而影响电池的性能。
2. 极化由于电解质移动:随着电池放电,电解质中的离子在电极表面移动,这可能导致极化,特别是在高电流密度下。
电解池的极化曲线:
电解池是一种可以通过外部电源进行充电和放电的电池。
其极化曲线通常显示为充电和放电过程中电流密度和电压之间的关系。
1. 充电时的极化:在电解池充电时,可能会出现极化,其中一些能量被用于克服电极上的电化学反应的阻力。
2. 放电时的极化:在电解池放电时,极化可能是由于反应物的浓度变化、电化学反应速率的限制等原因。
极化曲线的形状和特性取决于电池的类型、电极材料、电解质以及操作条件等因素。
在研究电池性能、设计电池系统或优化电池操作
时,分析极化曲线是一种常见的手段。
极化曲线的测量有助于了解电池的动力学行为,为电池性能的优化提供指导。
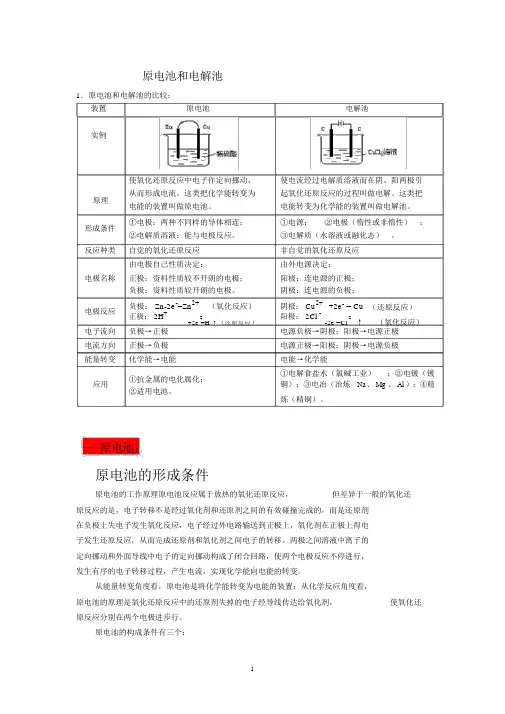
原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例使氧化还原反应中电子作定向挪动,使电流经过电解质溶液而在阴、阳两极引原理从而形成电流。
这类把化学能转变为起氧化还原反应的过程叫做电解。
这类把电能的装置叫做原电池。
电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同样的导体相连;①电源;②电极(惰性或非惰性);②电解质溶液:能与电极反应。
③电解质(水溶液或融化态)。
反应种类自觉的氧化还原反应非自觉的氧化还原反应由电极自己性质决定:由外电源决定:电极名称正极:资料性质较不开朗的电极;阳极:连电源的正极;负极:资料性质较开朗的电极。
阴极:连电源的负极;电极反应负极: Zn-2e-=Zn2+(氧化反应)阴极: Cu2++2e- = Cu(还原反应)正极: 2H+-2阳极: 2Cl --2↑(氧化反应)+2e =H ↑(还原反应)-2e =Cl电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转变化学能→电能电能→化学能①抗金属的电化腐化;①电解食盐水(氯碱工业);②电镀(镀应用铜);③电冶(冶炼Na、 Mg 、 Al );④精②适用电池。
炼(精铜)。
一原电池;原电池的形成条件原电池的工作原理原电池反应属于放热的氧化还原反应,但差异于一般的氧化还原反应的是,电子转移不是经过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子经过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。
两极之间溶液中离子的定向挪动和外面导线中电子的定向挪动构成了闭合回路,使两个电极反应不停进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转变。
从能量转变角度看,原电池是将化学能转变为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失掉的电子经导线传达给氧化剂,使氧化还原反应分别在两个电极进步行。

原电池和电解池的所有知识点原电池和电解池是电化学中的两个基本概念,它们都涉及到化学能与电能之间的转换。
原电池是将化学能转化为电能的装置,而电解池则是将电能转化为化学能的装置。
1. 原电池的工作原理原电池通过氧化还原反应产生电流。
在原电池中,一个电极发生氧化反应,另一个电极发生还原反应。
氧化反应是物质失去电子的过程,而还原反应是物质获得电子的过程。
2. 原电池的组成原电池由两个电极(阳极和阴极)、电解质溶液以及连接电极的导线组成。
阳极是发生氧化反应的电极,阴极是发生还原反应的电极。
3. 原电池的类型原电池可以根据电极材料、电解质类型等不同因素分为多种类型,如丹尼尔电池、伏打电池等。
4. 原电池的电势原电池的电势由电极电势和电解质的浓度决定。
电极电势是电极在标准状态下的电势,而电解质的浓度会影响电势的大小。
5. 电解池的工作原理电解池是将电能转化为化学能的装置。
在电解池中,电流通过电解质溶液,使得溶液中的离子在电极上发生氧化还原反应。
6. 电解池的组成电解池由两个电极(阳极和阴极)、电解质溶液以及电源组成。
阳极是电流进入溶液的电极,阴极是电流离开溶液的电极。
7. 电解池的类型电解池可以根据电解过程的不同分为电镀池、电解精炼池、电解合成池等。
8. 电解池的效率电解池的效率受到多种因素的影响,包括电极材料、电解质类型、电流密度、温度等。
9. 原电池和电解池的应用原电池和电解池在工业和日常生活中有着广泛的应用,如电池、电镀、金属精炼、水的电解等。
10. 原电池和电解池的比较原电池和电解池虽然在能量转换方向上相反,但它们在原理上有许多相似之处,如都涉及氧化还原反应、都需要电解质等。
不过,电解池通常需要外加电源,而原电池则不需要。
以上总结了原电池和电解池的基本概念、工作原理、组成、类型、电势、效率以及应用等方面的知识点。
高考电化学知识点——电解原理(一)电解原理1. 电解池:把电能转化为化学能的装置,也叫电解槽。
2. 电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程。
3. 放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程。
4. 电子流向:(电源)负极—(电解池)阴极—(离子定向运动)电解质溶液—(电解池)阳极—(电源)正极。
5. 电极名称及反应阳极:与直流电源的正极相连的电极,发生氧化反应阴极:与直流电源的负极相连的电极,发生还原反应6. 电解CuCl2溶液的电极反应:阳极:2Cl- -2e-=Cl2 (氧化)阴极:Cu2++2e-=Cu(还原总反应式:CuCl2=Cu+Cl2 ↑7. 电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程规律总结:电解反应离子方程式书写:放电顺序:阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电的)>Pb2+>Sn2+>Fe2+>Zn2+> Al3+ > Mg2+ >Na+ >Ca2+ >K+阴离子的放电顺序:是惰性电极时:S2->I->Br->Cl->OH->NO3->SO42-(等含氧酸根离子)> F-是活性电极时:电极本身溶解放电注先要看电极材料,是惰性电极还是活性电极,若阳极材料为活性电极(Fe、Cu)等金属,则阳极反应为电极材料失去电子,变成离子进入溶液;若为惰性材料,则根据阴阳离子的放电顺序,依据阳氧阴还的规律来书写电极反应式。
电解质水溶液电解产物的规律:类型电极反应特点实例电解对象电解质浓度分解电解质型电解质电离出的阴阳离子分别在两极放电HCl 电解质减小CuCl2放H2生成碱型阴极:水放H2生碱阳极:电解质阴离子放电NaCl电解质和水生成新电解质放氧生酸型阴极:电解质阳离子放电阳极:水放O2生酸CuSO4电解质和水生成新电解质电解水型阴极:4H++4e-==2H2 ↑阳极:4OH--4e-==O2↑+ 2H2ONaOH水增大Na2SO4上述四种类型电解质分类:(1)电解水型:含氧酸,强碱,活泼金属含氧酸盐(2)电解电解质型:无氧酸,不活泼金属的无氧酸盐(氟化物除外)(3)放氢生碱型:活泼金属的无氧酸盐(4)放氧生酸型:不活泼金属的含氧酸盐(二)电解原理的应用1. 电解饱和食盐水以制造烧碱、氯气和氢气(1)电镀应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法(2)电极、电解质溶液的选择:阳极:镀层金属,失去电子,成为离子进入溶液M- ne-==Mn+阴极:待镀金属(镀件):溶液中的金属离子得到电子,成为金属原子,附着在金属表面Mn+ + ne-==M电解质溶液:含有镀层金属离子的溶液做电镀液镀铜反应原理阳极(纯铜):Cu-2e-=Cu2+阴极(镀件):Cu2++2e-=Cu,电解液:可溶性铜盐溶液,如CuSO4溶液2. 电镀应用之一:铜的精炼阳极:粗铜;阴极:纯铜电解质溶液:硫酸铜3. 电冶金(1)电冶金:使矿石中的金属阳离子获得电子,从它们的化合物中还原出来用于冶炼活泼金属,如钠、镁、钙、铝(2)电解氯化钠:通电前,氯化钠高温下熔融:NaCl==Na++Cl-通直流电后:阳极:2Na++ 2e-==2Na阴极:2Cl- - 2e-==Cl2↑规律总结:原电池、电解池、电镀池的判断规律(1)若无外接电源,又具备组成原电池的三个条件。
原电池与电解池一、原电池1. 构成原电池的条件:A.活泼性不同的两个电极①活动性不同的金属或一种金属和一种非金属导体石墨,活泼金属为负极;②两惰性电极——石墨或Pt等燃料电池电极;;B.电解质溶液;C.形成闭合电路;D.自发氧化还原反应;2. 原电池的反应原理电子从负极流出,沿导线流回正极①活动性不同的金属或一种金属和一种非金属导体石墨负极:较活泼金属,失电子,化合价升高,发生氧化反应溶液中的阴离子向负极移动,电极质量减小;正极:不活泼金属或石墨等,得电子,化合价降低,发生还原反应;①当负极材料能与电解液直接反应时,溶液中的阳离子得电子;例:溶液中如果有阳离子,应由金属阳离子先得电子,变成金属单质,锌铜原电池中,电解液为HCl,正极H+得电子生成H2;②当负极材料不能与电解液反应时,溶解在电解液中的O2得电子;如果电解液呈酸性,O2+4e-+4H+==2H2O;如果电解液呈中性或碱性,O2+4e-+2H2O==4OH-判断正负极的依据:金属活动顺序表②两惰性电极——石墨或Pt等燃料电池电极负极:可燃烧的气体正极:氧气3. 各种电池①碱性干电池Zn+2MnO2+2H2O=ZnOH2+2MnOOH②铅蓄电池Pb+PbO2+2H2SO4=2PbSO4+2H2O, 请写出电极反应式;注意:PbSO4是难溶物;③燃料电池二、电解池1. 电解:使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程,叫做电解;2. 电解池的组成条件:①直流电源 ②两个电极 ③电解质溶液或熔融电解质 ④形成闭合回路♦ 判断电解池两极的常用依据①看电源与电池正极相连的是阳极,与负极相连的是阴极 ②看电子方向、两极产物阳离子移向阴极,发生还原反应阴离子移向阳极,发生氧化反应3. 电解反应方程式:阴极:溶液中的阳离子向阴极移动,得电子,发生还原反应;阴极受保护;电镀原理 阳离子的放电顺序:金属活动顺序表的逆序Zn 2+< Fe 2+ < Pb 2+ < H + < Cu 2+ < Fe 3+ < Hg 2+ < Ag +注意: Ag + > Fe 3+ > Cu 2+ ; Fe 2+ > H 2O > Al 3+电镀时:H +浓度较小:H +< Zn 2+< Fe 2+< Pb 2+ < Cu 2+阳极:溶液中的阴离子向阴极移动,失电子,发生氧化反应;放电顺序:① 活性电极Ag 以前,电极失电子 A - ne-==A n+② 惰性电极Pt 、Au 、石墨,阴离子放电 S 2->I ->Br ->Cl - >OH - ♦ 电解硫酸铜溶液的电极反应式和总反应式阴极:2Cu 2+ + 4e- = 2Cu阳极:4OH - - 4e- = 2H 2O + O 2↑4H2O==4H ++4OH-♦ 写出以碳棒作电极电解饱和氯化钠溶液的电极反应式阳极 C : 2Cl -- 2e -=Cl2↑ 阴极 C :2H+ +2e -= H2 ↑ ♦ 写出以铜棒作电极电解氯化铜溶液的电极反应式阳极 Cu : Cu - 2e -=Cu2+ 阴极 Cu : Cu2+ +2e -= Cu4. 电解原理的应用a. 铜的电解精炼⑴粗铜含的杂质: Zn 、Fe 、Ni 、Ag 、Au 等⑵粗铜的精炼粗铜做阳极,纯铜做阴极,CuSO 4溶液做电解液3电极反应式4 阳极上比铜不活泼的金属,沉积于阳极底部,成为阳极泥,可以提炼金、银等贵重金属通电2Cu 2+ + 2H 2O 2Cu + 4H+ + O 2↑b. 电镀⑴概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程;⑵电镀池形成条件①镀件作阴极②镀层金属作阳极③含镀层金属阳离子的盐溶液作电解液⑶电镀的特点电镀液的组成及酸碱性基本保持不变。
高中化学原电池和电解池原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
一原电池;原电池的构成条件有三个:(1)电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。
(2)两电极必须浸泡在电解质溶液中。
(3)两电极之间有导线连接,形成闭合回路。
形成前提:总反应为自发的氧化还原反应电极的构成:a.活泼性不同的金属—锌铜原电池,锌作负极,铜作正极;b.金属和非金属(非金属必须能导电)—锌锰干电池,锌作负极,石墨作正极;c.金属与化合物—铅蓄电池,铅板作负极,二氧化铅作正极;d.惰性电极—氢氧燃料电池,电极均为铂。
化学原电池和电解池知识点
1.化学原电池的构成:化学原电池由两个电极(即阳极和阴极)以及
一个电解质溶液组成。
2.化学原电池的原理:化学原电池的工作原理基于氧化还原反应。
在
阳极处,氧化反应发生,导致电子从金属离子中脱离,形成电子流向阴极。
而在阴极处,还原反应发生,接受来自电子流的电子,并被还原物质接受。
3.化学原电池的电势差:化学原电池的电势差是反应物的化学能转化
为电能的度量。
它可以通过电动势计进行测量。
电动势是指单位正电荷在
电池终端之间移动时所产生的深度影响。
4.化学原电池的电极电势:电极电势是指测量单个电极与相同参考电
极(例如标准氢电极)之间的电势差。
它是一个反应物的电化学测量,并
用于计算整个电池的电动势。
电解池:
1.电解池的构成:电解池由两个电极(即阳极和阴极)以及一个电解
质溶液组成。
与化学原电池不同的是,电解池外加电源,以提供所需的电能。
2.电解池的原理:电流通过电解质溶液,引发氧化反应在阳极发生,
同时还原反应在阴极发生。
该过程被称为电解,其中物质被分解成更简单
的物质。
3.电解程度:电解程度是指溶液中电解质的一部分被氧化或还原的程度。
这取决于电流的强度和时间。
4.法拉第定律:法拉第定律是描述物质电解程度与通过电解质溶液的电荷数量之间的关系。
法拉第定律表明,当通过溶液的电荷数等于物质的摩尔数时,反应会停止。
电解池和原电池的组合原理一、引言电解池和原电池是电化学中常见的两种电池形式。
电解池是指通过电解反应将化学能转化为电能的装置,而原电池则是通过化学反应直接产生电能的装置。
本文将从电解池和原电池的组合原理出发,详细介绍它们的工作原理和应用。
二、电解池的组合原理电解池是由阳极和阴极两个电极以及电解质溶液组成的。
在电解质溶液中,阳极发生氧化反应,阴极发生还原反应。
通过外部电源施加电压,使阳极和阴极之间产生电势差,促使电解质中的离子发生迁移,进而发生氧化还原反应。
这样,化学能就会转化为电能。
电解池的组合原理可以分为以下几个方面来阐述:1. 电解质的选择电解质是电解池中起到导电作用的物质。
常用的电解质有酸、碱、盐等。
选择合适的电解质可以提高电解池的导电性能,进而提高其效率。
2. 电极的材料选择电极是电解池中进行氧化和还原反应的地方。
电极材料的选择直接影响电解池的效率和稳定性。
常见的电极材料有铜、银、铂等,选择适合的电极材料可以提高反应速率和电解质的转化效率。
3. 外部电源的作用外部电源的作用是提供足够的电压和电流,促使电解质中的离子进行迁移。
外部电源可以是直流电源或交流电源,选择适当的电源可以满足电解反应的需要。
三、原电池的组合原理原电池是利用化学反应直接产生电能的装置。
原电池由两个电极和电解质组成。
其中,一个电极进行氧化反应,另一个电极进行还原反应。
两个电极之间的化学反应产生电子,在外部电路中流动,从而产生电流。
原电池的组合原理可以从以下几个方面来说明:1. 化学反应的选择原电池的电极反应是通过化学反应产生电能的。
选择适合的化学反应可以提高电池的效率和稳定性。
常见的原电池有干电池、锂电池、铅酸电池等,它们采用不同的化学反应方式来产生电能。
2. 电解质的选择电解质是原电池中起到导电作用的物质。
选择合适的电解质可以提高电池的导电性能,进而提高其效率。
常见的电解质有酸、碱、盐等。
3. 电极的材料选择电极是原电池中进行氧化和还原反应的地方。