高中化学必修一氮及其化合物测试题 (1)
- 格式:doc
- 大小:211.00 KB
- 文档页数:8

高中化学氮及其化合物单元测试含答案解析一、选择题1.把 a L 含硫酸铵和硝酸铵的混合液分成两等份,一份需用 b mol 烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗 c mol 氯化钡,由此可知原溶液中 NO -3的物质的量浓度(单位:mol·L -1)是 A .2b-c 2aB .2b-4caC .b-2c2aD .4b-2ca【答案】B 【详解】b mol 烧碱刚好把NH 3全部赶出,根据+4NH +OH -═NH 3+H 2O 可知,每份溶液中含有bmol+4NH ;与氯化钡溶液完全反应消耗c mol BaCl 2,根据Ba 2++2-4SO ═BaSO 4↓可知,每份溶液中含有2-4SO 为c mol ;令每份溶液中-3NO 的物质的量为n ,根据电荷守恒,则bmol×1=c mol×2+n ×1;解得n =(b-2c)mol ,每份溶液的体积为0.5a L ,所以每份溶液硝酸根的浓度为()()--13b-2c mol 2b-4c NO ==mol L 0.5aLac ⋅,故D 正确;故选D 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确 C .①③正确 D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。

高考化学氮及其化合物推断题综合试题含详细答案一、氮及其化合物练习题(含详细答案解析)1.氮及其化合物在生产生活中有广泛的应用:(1)甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH-)之比____10(填“大于”“等于”或“小于”),并说明理由_____________________________________。
(2)常温下向含0.5mol溶质的稀盐酸中缓慢通入0.5molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是______________________;在通入氨气的过程中溶液的导电能力___________(选填“变大”、“变小”或“几乎不变”)。
请设计实验检验铵盐中的NH4+:___________。
【答案】小于加水稀释,弱电解质的电离程度增大 c(Cl-)>c(NH4+)>c(H+)>c(OH-)几乎不变取样,加水溶解,加入氢氧化钠浓溶液,加热,若产生的气体能使湿润的红色石蕊试纸变蓝,则证明有NH4+【解析】【分析】【详解】(1)浓溶液加水稀释,越稀越电离,故0.1mol/L的氨水中电离程度更大,故甲、乙两瓶氨水中c(OH-)之比小于10;答案为:小于;加水稀释,弱电解质的电离程度增大;(2)二者恰好反应生成氯化铵,铵根水解溶液呈酸性,即c(H+)>c(OH−),依据溶液呈电中性有:c(H+)+c(NH4+)=c(OH−)+c(Cl−),因为c(H+)>c(OH−),所以c(NH4+)<c(Cl−),故离子浓度大小关系为:c(Cl−)>c(NH4+)>c(H+)>c(OH−);溶液中离子浓度几乎不变,所以导电能力几乎不变;铵盐能与强碱反应放出氨气,则检验铵根离子的实验方案:取样,加水溶解,加入氢氧化钠浓溶液,加热,若产生的气体能使湿润的红色石蕊试纸变蓝,则证明有NH4+。
【点睛】浓溶液加水稀释,越稀越电离;溶液的导电能力主要取决于溶液中离子的浓度及离子所带的电荷数:离子的浓度越大,导电能力越强;离子所带的电荷数越大,导电能力越强。

黑龙江省绥化市青冈县第一中学高中化学氮及其化合物 练习题含答案解析一、选择题1.在一定条件下,将 6 体积的 NO 2(不考虑 NO 2 转化为 N 2O 4)和一定体积的 NO 置于试管中,并将试管倒置于盛有水的水槽中,待试管内液面不变后再通入 4.5 体积的 O 2 充分反应后,剩余 1.5 体积气体,则原 NO 体积可能为( ) ①3 体积 ②4 体积 ③5 体积 ④5.5 体积 ⑤2 体积 A .①③ B .①⑤C .④ 或 ⑤D .② 或 ③【答案】C 【分析】根据4NO 2+O 2+2H 2O ═4HNO 3、4NO+3O 2+2H 2O ═4HNO 3,剩余1.5体积气体,可能为NO ,也可能为氧气,以此来计算。
【详解】2322=4HNO 4NO +O +2H O 416 1.5则一定体积的NO 和3体积的氧气发生4NO+3O 2+2H 2O ═4HNO 3,①若剩余气体为NO ,则由反应可知,消耗NO 为4体积,则原NO 的体积为1.5+4=5.5体积;②若剩余气体为氧气,则4NO+3O 2+2H 2O ═4HNO 3中反应的氧气为1.5体积,则原NO 的体积为1.543=2体积,故选C 。
2.自然界的氮循环如下图所示,下列说法不正确的是( )A .①中N 2与O 2反应生成NOB .②中合成氨属于人工固氮C .③中氮元素只被氧化D .氧元素参与了氮循环 【答案】C 【详解】A. N 2和O 2在放电作用下化合,生成NO ,NO 被氧化生成NO 2,NO 2溶于水生成硝酸,故A 正确;B. 氮的固定是指氮元素由游离态变为化合态的过程,大气中氮气转化成氮肥属于人工固氮,故B正确;C. ③中细菌还原硝酸根中正五价的氮,生成无污染的0价的氮气,所以③中氮元素被还原,而不是被氧化,故C错误;D. 如N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,氧元素参与,二氧化氮易与水反应生成硝酸(HNO3)和一氧化氮,3NO2+H2O=2HNO3+NO,氧元素参加,故D正确;题目要求选不正确的,故选C。

高考化学氮及其化合物(大题培优易错难题)附详细答案一、氮及其化合物练习题(含详细答案解析)1.研究金属与硝酸的反应,实验如下。
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。
乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
②乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
③补全Ⅱ中NO3-被还原为NH 的过程:NO3- + ______e- + ______= NH4+ + ______H2O4⑶研究影响产生H2的因素资料:Fe[(NO)]2+在溶液中呈棕色。
④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。
⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。
⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
【答案】NO 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出NO3-中氮元素的化合价为最高价,具有氧化性取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 8 10H+ 3 相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多 H2金属的种类、硝酸的浓度、温度【解析】【分析】⑴Ⅰ中无色气体NO遇空气生成红棕色的二氧化氮气体。
⑵①依据Ⅰ和Ⅱ硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中生成NO,因此可得NO3-没有发生反应不正确。
②NO3-中氮元素的化合价为最高价,具有氧化性,证明NH4+的方法是去一定量溶液加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体。
③根据化合价降低得到电子配平得到。
⑶④根据现象和温度升高时,化学反应速率增大。
⑤根据元素分析和前面的信息得到答案。

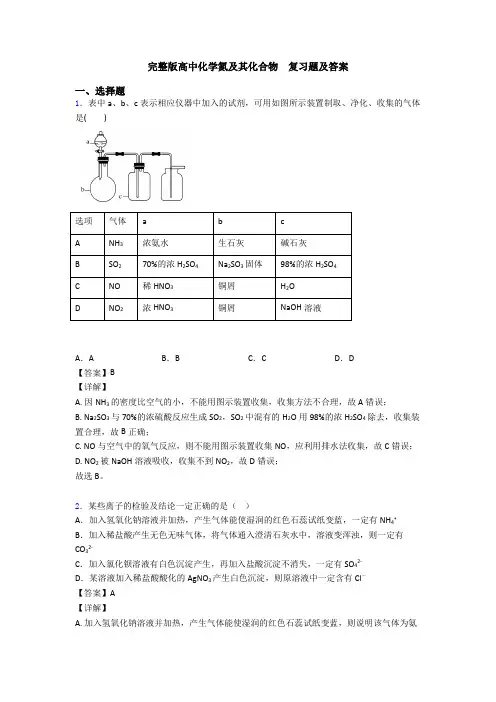
完整版高中化学氮及其化合物复习题及答案一、选择题1.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是()选项气体a b cA NH3浓氨水生石灰碱石灰B SO270%的浓H2SO4Na2SO3固体98%的浓H2SO4C NO稀HNO3铜屑H2OD NO2浓HNO3铜屑NaOH溶液A.A B.B C.C D.D【答案】B【详解】A. 因NH3的密度比空气的小,不能用图示装置收集,收集方法不合理,故A错误;B. Na2SO3与70%的浓硫酸反应生成SO2,SO2中混有的H2O用98%的浓H2SO4除去,收集装置合理,故B正确;C. NO与空气中的氧气反应,则不能用图示装置收集NO,应利用排水法收集,故C错误;D. NO2被NaOH溶液吸收,收集不到NO2,故D错误;故选B。
2.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl,则原溶液中不一定有SO42-,C项错误;D. 加入盐酸酸化的AgNO3溶液时,则引入了Cl-,故不能证明是原溶液中是否含有Cl-,D 项错误;答案选A。
3.浅绿色的Fe(NO3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是A.颜色变浅B.变为红色C.没有改变D.变为黄色【答案】D【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;故选:D。

人教高一化学氮及其化合物 复习题及答案一、选择题1.下列实验方法正确的是A .用洁净的铂丝蘸取某溶液在酒精灯外焰上灼烧,火焰呈黄色,则该溶液中不含K +B .向无色溶液中加入盐酸酸化的 BaCl 2 溶液有白色沉淀出现,则该溶液中一定含有2-4SO C .向某无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有2-3COD .向待测液中加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,待测液中一定有+4NH 【答案】D 【详解】A .做焰色反应实验时,火焰呈黄色,则该溶液中含有Na +,不能确定是否含K +,A 不正确;B .溶液中加入盐酸酸化的 BaCl 2 溶液,有白色沉淀出现,则该溶液中可能含有2-4SO 或Ag +等,B 不正确;C .无色溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体,则该溶液中可能含有2-3CO 或3HCO -等,C 不正确;D .向待测液中加入烧碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则该气体为NH 3,从而证明待测液中一定有+4NH ,D 正确; 故选D 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确C .①③正确D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。

完整版高中化学氮及其化合物测试试题一、选择题1.如图所示,将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留m2体积的气体,该气体与空气接触后立即变为红棕色。
则m与n的比值为()A.3∶2 B.2∶3 C.8∶3 D.3∶8【答案】C【详解】在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器中内,充分反应, NO和O2全部溶于水时按照下列反应进行,化学方程式为:4NO + 3O2+ 2H2O = 4HNO3,由于气体与空气接触后立即变为红棕色,所以容器内残留气体为NO,那么与O2反应的NO气体为m-m2=m2,NO和O2按照4:3混合溶于水恰好全部溶解所以mn2: =4 :3,所以m:n=8:3;故选C。
2.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl,则原溶液中不一定有SO42-,C项错误;D. 加入盐酸酸化的AgNO3溶液时,则引入了Cl-,故不能证明是原溶液中是否含有Cl-,D 项错误;答案选A。
3.浅绿色的Fe(NO3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是A.颜色变浅B.变为红色C.没有改变D.变为黄色【答案】D【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;故选:D。

一、氮及其化合物练习题(含详细答案解析)1.某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在 转化规律,绘制出如下转化关系图,图中A 、B 、C 、D 是由短周期元素组成的物质。
请回答:(1)若A 为单质,其焰色反应为黄色,C 为淡黄色固体。
则组成A 的元素在周期表中的位置是__,C 的电子式为__。
(2)若A 为能使湿润红色石蕊试纸变蓝的气体,C 为红棕色气体。
①A→B 反应的化学方程式是__。
过量的A 的水溶液与AlCl 3溶液反应离子方程式为__。
②A 与C 反应生成E 和水,E 是空气中含量最多的气体。
当生成19.6gE 时,转移电子的物质的量为__mol 。
(3)若B 为能使品红溶液褪色的无色刺激性的气体,B→C 反应的化学方程式是__,B 与KMnO 4溶液反应离子方程式为__。
【答案】第三周期第IA 族 4NH 3+5O 2=4NO+6H 2OAl 3++3NH 3·H 2O=Al(OH)3↓+3NH 4+ 2.4 2SO 2+O 2−−−→←−−−催化剂=2SO 3 5SO 2+2MnO 42-+2H 2O=5SO 42-+2Mn 2++4H +【解析】【分析】(1)若A 为单质,其焰色反应为黄色,C 为淡黄色固体,则A 为Na ,B 为Na 2O ,C 为Na 2O 2,D 为NaOH ;(2)若A 为能使湿润的红色石蕊试纸变蓝的气体,C 是红棕色气体,则A 为NH 3,B 为NO ,C 为NO 2,D 为HNO 3;(3) 若B 为能使品红溶液褪色的无色刺激性的气体,B 为SO 2,C 为SO 3,D 为H 2SO 4,以此解答。
【详解】(1)若A 为单质,其焰色反应为黄色,C 为淡黄色固体,则A 为Na ,B 为Na 2O ,C 为Na 2O 2,D 为NaOH ,A 的元素在周期表中的位置是第三周期第IA 族,Na 2O 2的电子式为:;(2)若A 为能使湿润的红色石蕊试纸变蓝的气体,C 是红棕色气体,则A 为NH 3,B 为NO ,C 为NO 2,D 为HNO 3;①A→B 反应的化学方程式是:4NH 3+5O 2=4NO+6H 2O ;过量的NH 3的水溶液与AlCl 3溶液反应生成氢氧化铝,离子方程式为:Al 3++3NH 3·H 2O=Al(OH)3↓+3NH 4+; ②A 与C 反应生成E 和水,E 是空气中含量最多的气体N 2,化学方程式为:8NH 3+6NO 2一定条件=7N 2+12H 2O ,19.6g N 2的物质的量为19.6g 28g/mol=0.7mol ,则消耗NH 3的物质的量为0.8mol ,NH 3中N 的化合价从-3价上升到0价转移3个电子,共转移电子的物质的量为0.8mol ⨯3=2.4mol ;(3) 若B 为能使品红溶液褪色的无色刺激性的气体,B 为SO 2,C 为SO 3,D 为H 2SO 4,B→C反应的化学方程式是:2SO 2+O 2−−−→←−−−催化剂2SO 3;SO 2与KMnO 4溶液反应生成硫酸,离子方程式为:5SO 2+2MnO 42-+2H 2O=5SO 42-+2Mn 2++4H +。

备战高考化学氮及其化合物(大题培优易错难题)附详细答案一、氮及其化合物练习题(含详细答案解析)1.氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。
写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O2NO2+2NaOH===NaNO2+NaNO3+H2O现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m =_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
【答案】6NO2+8NH37N2+12H2O NO2 NH3 2NO+2CO N2+2CO2 (m+n)/V 3∶2 (n-m)/(3m+n)【解析】【分析】(1)氨气和二氧化氮在一定条件下反应生成氮气和水,反应中元素化合价降低的做氧化剂,元素化合价升高的物质做还原剂;(3)①根据气体和氢氧化钠的关系式计算;②根据二氧化氮、一氧化氮和氢氧化钠反应的方程式中各个物理量之间的关系式计算;③同一溶液中,c(NO3-):c(NO2-)等于其物质的量之比。
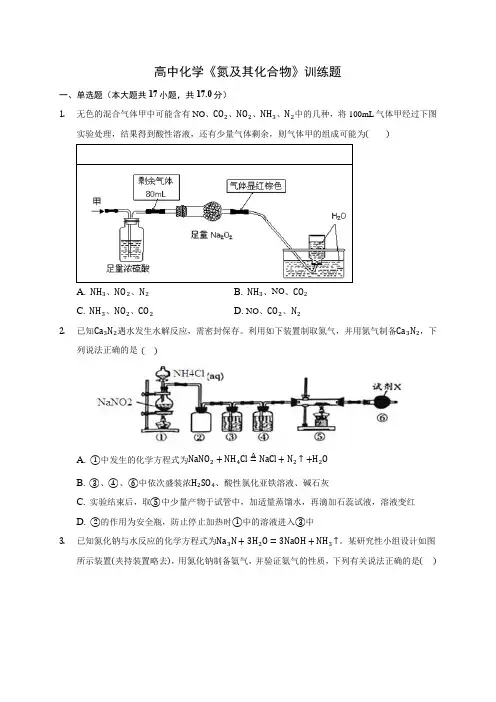
高中化学《氮及其化合物》训练题一、单选题(本大题共17小题,共17.0分)1.无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验处理,结果得到酸性溶液,还有少量气体剩余,则气体甲的组成可能为()A. NH3、NO2、N2B. NH3、NO、CO2C. NH3、NO2、CO2D. NO、CO2、N22.已知Ca3N2遇水发生水解反应,需密封保存。
利用如下装置制取氮气,并用氮气制备Ca3N2,下列说法正确的是()A. ①中发生的化学方程式为NaNO2+NH4Cl=ΔNaCl+N2↑+H2OB. ③、④、⑥中依次盛装浓H2SO4、酸性氯化亚铁溶液、碱石灰C. 实验结束后,取⑤中少量产物于试管中,加适量蒸馏水,再滴加石蕊试液,溶液变红D. ②的作用为安全瓶,防止停止加热时①中的溶液进入③中3.已知氮化钠与水反应的化学方程式为Na3N+3H2O=3NaOH+NH3↑。
某研究性小组设计如图所示装置(夹持装置略去),用氮化钠制备氨气,并验证氨气的性质,下列有关说法正确的是()A. 将装置A中的水换为饱和食盐水可以减缓反应速率B. 单质M为氮气,则装置C中红色粉末变为黑色粉末C. Z为苯,目的是防止硫酸吸收氨气时发生倒吸D. 装置B中盛的是无水氯化钙,目的是干燥氨气4.下列实验装置能达到实验目的的是()A. 用图甲装置制取干燥纯净的NH3B. 图乙可用于“海带提碘”实验中将海带灼烧成灰C. 图丙可以除去食盐中混有的杂质氯化铵D. 用图丁装置制乙炔5.下列物质的转化在给定条件下能实现的是A.B.C.D.6.化学与社会、生产、生活紧切相关,下列说法正确的是()①光导纤维具有很强的导电能力,所以大量用于制造通信光缆②食盐可作为调味品和防腐剂③明矾常用作净水剂,是因为它具有消毒杀菌的作用;④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾⑤氨常用作制冷剂,是因为其沸点较高,且汽化吸收大量的热⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和纯碱A. ①②④⑤B. ①②④⑥C. ②④⑤D. ②④⑥7.下列实验操作、现象和结论均正确的是()选项操作现象结论A①将湿润的红色石蕊试纸靠近试管口试纸不变色NH4Cl受热不分解B②中分液漏斗振荡后静置下层液体颜色变浅NaOH溶液可除去溶在溴苯中的Br2C③加热洗气瓶中溶液褪色生成了乙烯D④通电B极上有红色固体析出锌的金属性比铜强A. AB. BC. CD. D8.某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示,则下列叙述不正确的是()A. 该溶液中一定不含Fe3+、Cu2+B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1:1:1C. 所加NaOH溶液物质的量浓度为0.1mol/LD. a点到b点,发生的化学反应:NH4++OH−=NH3⋅H2O9.将3.2gCu投入到一定浓度的HNO3溶液中,恰好完全反应,产生NO2和NO的混合气体共0.08mol.则原溶液中HNO3的物质的量为()A. 0.34molB. 0.38molC. 0.28molD. 0.18mol10.利用如图所示装置进行下列实验,能得出相应实验结论的是()选项①②③实验结论A浓盐酸KMnO4NaOH能制取、收集氯气并能吸收尾气B浓氨水生石灰酚酞稀溶液能制取氨气并验证氨气的水溶液呈碱性C稀盐酸Na2SO3Ba(NO3)2溶液SO2与可溶性钡盐均可生成白色沉淀D稀硫酸Na2CO3Na2SiO3溶液非金属性:S>C>SiA. AB. BC. CD. D11.将1.52g铜镁合金完全溶于50ml,密度为1.40g·mL−1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L−1的NaOH溶液,当金属离子全部沉淀时,所得沉淀的质量为2.54g。
氮及其化合物完卷时间:50分钟可能用到的相对原子质量:H1 C12 O16 Na23一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·北京高三一模)“封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是A .加热时,①中上部汇集了固体B .加热时,②中溶液变红,冷却后又变为无色C .加热时,③中溶液红色褪去,冷却后溶液变红D .三个“封管实验”中所发生的化学反应都是可逆反应【答案】A【解析】A .加热氯化铵分解,在上方HCl 与氨气化合生成氯化铵,则①中封管内固体由下方转移到上方,A 正确;B .氨气的水溶液显碱性,加热时氨气逸出,酚酞溶液褪色,冷却时氨气溶于酚酞溶液,溶液显红色,B 错误;C .二氧化硫可使品红褪色,化合生成无色物质,加热可分解,则加热时,③中溶液变红,冷却后红色褪去,C 错误;D .可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,D 错误;综上所述答案为A 。
2.(2021·河北唐山市·高三三模)工业上利用3NH 对烟道气进行脱硝(除氮氧化物)的SCR 技术具有效率高、性能可靠的优势。
SCR 技术的原理为3NH 和NO 在催化剂(2MnO )表面转化为2N 和2H O ,反应进程中的相对能量变化如图所示。
下列说法正确的是A .总反应方程式为()22326NO+4NH 5MnO N +6H O ΔH<0B .2NH NO 是脱硝反应的催化剂C .升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度D .决定反应速率的步骤是“2NH NO 的转化”【答案】A【解析】A .由已知SCR 技术的原理为NH 3和NO 在催化剂(MnO 2)表面转化为N 2和H 2O ,可知总反应的方程式为6NO+4NH 32MnO 5N 2+6H 2O ,A 正确; B .观察相对能量-反应进程曲线知,NH 3吸附在催化剂表面后,经过一定的反应形成了NH 2NO ,NH 2NO 又经过反应得到N 2和H 2O ,所以NH 2NO 是脱硝反应的活性中间体,B 错误;C .起始相对能量高于终态,说明这是一个放热反应,升高温度平衡会逆向移动,所以升高温度后,脱硝反应的正反应速率的增大程度小于其逆反应速率的增大程度,C 错误;D .相对能量-反应进程曲线表明,全过程只有H 的移除过程势能升高,这是一个需要吸收能量越过能垒的反应,其速率是全过程几个反应中最慢的,决定了反应的速率,是总反应的速控步骤,D 错误;故答案为:D 。
氮的化合物1.1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL 、质量分数为63%的浓硝酸中,得到NO 2和N 2O 4的混合气体N 2O 4的混合气体1120mL (标准状况)。
向反应后的溶液中加入1.0 mol/LNaOH 溶液,当金属离子全部沉淀时,得到2.54 g 沉淀。
下列说法不正确的是( ) A .该合金中铜与镁的物质的量之比是2:lB .该浓硝酸中HN03的物质的量浓度是14.0 mol/LC .得到2.54 g 沉淀时,加入NaOH 溶液的体积是600 mLD .NO 2和N 2O 4的混合气体中,NO 2的体积分数是80%2、将空气中氮气转化为氮的化合物的过程称为固氮。
下面能实现人工固氮的是( )A .闪电B .电解饱和食盐水车间C .根瘤D .合成氨车间3、下列有关环境保护的说法中错误的是( )A. 含氮、磷化合物的生活污水大量排放可使水体富营养化B. 各国工业大量排放二氧化硫是全球气候变暖的主要原因C. 劣质装修材料中的甲醛、苯、氡气等对人体有害D. 废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染4.Cu 2S 与一定浓度的HNO 3反应,生成Cu(NO 3)2、CuSO 4、NO 2、NO 和H 2O ,当NO 2和NO 的物质的量为1∶1时,实际参加反应的Cu 2S 与HNO 3的物质的量之比为 ( ) A. 1∶7 B. 1∶9 C. 1∶5 D. 2∶95、把40mL 2NO 和NO 的混合气体与20mL 2O 同时通入倒置水槽中充满水的量筒里,充分反应后,量筒里剩下5mL 气体,则原混合气体中2NO 和NO 的体积分别为多少毫升( )A 、20,20 B 、10,30或20,20 C 、27.5,12.5 D 、30,10或12.5,27.56、将22.4 g 铁粉逐渐加入到含HNO 30.8 mol 的稀硝酸中,反应生成的气体的物质的量(x )随消耗铁粉的物质的量(y )变化关系中正确的是( )7.室温时,在容积为 a mL 的试管中充满NO 2气体,然后倒置在水中到管内水面不再上升时为止,再通入 b mLO 2,则管内液面又继续上升,测得试管内最后剩余气体为 cmL ,且该气体不能支持燃烧。
完整版高一化学氮及其化合物 测试试题及答案一、选择题1.下列叙述不正确的是 A .洒落的汞可用硫粉处理 B .浓硫酸可用铁制容器装 C .可用氨水清洗试管壁上的氧化铝 D .可用稀硝酸清洗试管壁上的银【答案】C 【详解】A .汞有毒,常温下能够与硫反应生成硫化汞,撒落的汞可用硫粉处理,故A 正确;B .浓硫酸具有强氧化性,常温下能够使铁钝化,所以浓硫酸可用铁制容器装,故B 正确;C .氨水为弱碱,不能与氧化铝反应,不能用氨水清洗试管壁上的氧化铝,故C 错误;D .硝酸具有强的氧化性,能够氧化单质银,所以可用稀硝酸清洗试管壁上的银,故D 正确; 故选C 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确 C .①③正确 D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
【点睛】相似推理法在化学的学习中会经常遇见,再如HCl 与NaOH 、Na 2CO 3、Zn 、ZnO 都能够发生反应,那么同属酸类的H 2SO 4、HNO 3等酸也能够发生上述反应。
高考化学氮及其化合物(大题培优)一、氮及其化合物练习题(含详细答案解析)1.如图所示,在干燥的圆底烧瓶中充满某气体a,胶头滴管中吸有少量液体b,当把溶液b挤进烧瓶后,打开止水夹不能形成“喷泉”的组合是()A.A B.B C.C D.D【答案】D【解析】【详解】A.氨气极易溶于水,导致烧瓶内压强迅速减小,能形成喷泉,故A不符合题意;B.氯化氢极易溶于水,导致烧瓶内压强迅速减小,能形成喷泉,B不符合题意;C.二氧化碳与氢氧化钠溶液反应生成碳酸钠,导致烧瓶内压强迅速减小,能形成喷泉,故C不符合题意;D.饱和氯化钠溶液中含有氯离子能抑制氯气的溶解,所以氯气不能使烧瓶内压强减小,不能形成喷泉,故D符合题意;答案:D。
【点睛】根据形成喷泉的原理是使烧瓶内外产生压强差,所以只要考虑烧瓶内气体能否和滴管中的液体发生反应进行判断。
2.NH3、NO、NO2都是常见重要的无机物,是工农业生产、环境保护、生命科学等方面的研究热点。
(1)写出氨在催化剂条件下与氧气反应生成NO的化学方程式_____。
(2)氮氧化物不仅能形成酸雨,还会对环境产生的危害是形成_____。
(3)实验室可用Cu与浓硝酸制取少量NO2,该反应的离子方程式是_____。
(4)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为_____。
(5)一定质量的Cu与适量浓硝酸恰好完全反应,生成标准状况下NO2和NO气体均为2240mL。
向反应后的溶液中加入NaOH溶液使Cu2+刚好完全沉淀,则生成Cu(OH)2沉淀的质量为_____克。
【答案】4NH 3+5O 2催化剂 加热4NO +6H 2O 光化学烟雾 Cu +4H ++2NO 3﹣=Cu 2++2NO 2↑+2H 2O 4NH 3+6NO催化剂5N 2+6H 2O 19.6【解析】【分析】 (1)氨气和氧气在催化剂的条件下反应生成一氧化氮和水;(2)氮氧化物还可以形成光化学烟雾,破坏臭氧层;(3)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,浓硝酸和硝酸铜都能写成离子形式; (4)氨气使一氧化氮转化为两种无毒气体,其中一种是水蒸气,另外一种为氮气;(5)根据电子转移守恒计算铜的物质的量,由铜原子守恒可得氢氧化铜的物质的量,在根据m =nM 计算。
人教高中化学氮及其化合物单元测试及答案一、选择题1.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是()选项气体a b cA NH3浓氨水生石灰碱石灰B SO270%的浓H2SO4Na2SO3固体98%的浓H2SO4C NO稀HNO3铜屑H2OD NO2浓HNO3铜屑NaOH溶液A.A B.B C.C D.D【答案】B【详解】A. 因NH3的密度比空气的小,不能用图示装置收集,收集方法不合理,故A错误;B. Na2SO3与70%的浓硫酸反应生成SO2,SO2中混有的H2O用98%的浓H2SO4除去,收集装置合理,故B正确;C. NO与空气中的氧气反应,则不能用图示装置收集NO,应利用排水法收集,故C错误;D. NO2被NaOH溶液吸收,收集不到NO2,故D错误;故选B。
2.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO2的是A.B.C.D.【答案】B【详解】NO不溶于水,对应D图像,SO2在水中的溶解度为1体积水溶解40体积SO2,对应图像A,根据化学方程式3NO2+H2O=2HNO3+NO,剩余气体是反应前的1/3,对于图像B,Cl2+H2O =HCl+HClO,HClO2HCl+O2↑,对应图像C,所以其中原试管充满NO2的是B,答案选B。
3.对于硫酸和硝酸的比较中,下列叙述不正确的是()A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装B.稀硫酸和稀硝酸都具有氧化性C.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性D.硫酸和硝酸都是重要的化工原料【答案】C【详解】A. 铝、铁与冷的浓硫酸和浓硝酸发生的钝化,因此冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装,故A正确;B. 稀硫酸和稀硝酸都具有氧化性,稀硫酸和金属反应生成氢气,表现氧化性,稀硝酸和金属反应生成硝酸盐和一氧化氮表现氧化性,故B正确;C. 浓硫酸和浓硝酸都具有很强的腐蚀性,浓硫酸具有脱水性,浓硝酸不具有,故C错误;D. 化工生产中用硝酸、硫酸生产化肥、农药、炸药、燃料,金属加工前的酸洗等,故D正确。
2.22周六自助5.将 3mol 的 NO2气体依次通入下列三个分别装有足量①NaHCO 3饱和溶液②浓 HSO421. 对二氧化氮的下列说法不正确的是 ()③ Na 2O 2 的装置后,用排水法把残留气体收集起来,则收集到的气体是(同温、同压下测定 )()A .二氧化氮不是硝酸的酸酐A . 1mol NOB .二氧化氮与水的反应是氧化还原反应 B . 1mol NO 2 和 0.05mol O 2C . 二氧化氮不是造成大气污染的气体之一C . 2mol O 2D .在通常状况下测得的NO 2 的相对分子质量是不准确的D . 0.25mol O 22. 某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。
若测得氮气 6.如图所示,当向试管内通入 21mL O 2 时,最后试管中的液面仍在原来的位置,则原试管中和二氧化碳的物质的量之比为1: 2,则该氮的氧化物是 ()NO 体积为 ()A .N 2OB . NOC .NO 2D . N 2O 53. 在体积为 VL 的密闭容器中,通入 amol NO和 bmol O 2,反应后容器内氮原子和氧原子数之比为 ()aA . a/bB.2baaC.a + 2bD.2 a + b4. 如图所示,试管中盛装的是红棕色气体(可能是混合物 ),当倒扣在盛有水的水槽中时,试A . 6mLB . 12mLC . 16mLD . 18mL管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过 7. 一定条件下,将等体积的NO 2 和 O 2 的混合气体置于试管并将试管倒置于水槽中至液面不多次重复后,试管内完全被水充满,对原试管中盛装气体的说法正确的是()再上升时,剩余气体的体积约为原体积的()A .1/4B . 3/4C . 1/8D . 3/88.某氮的氧化物是大气污染物之一,在一定温度和有催化剂存在下,该氧化物与氨气反应只 生成氮气和水,若生成的氮气和水的物质的量之比为5:6,该氧化物的化学式为 ()A .NOB . N 2O 3C . NO2D .N O52A .可能是 N 2 与 NO 2 的混合气体B .可能是 NO 2 气体C .可能是 NO 与 NO 2 的混合气体D .只可能是 NO 2 一种气体周六下午用题1.有关氨的性质的叙述正确的是()A.氨能在空气中燃烧B.氨水呈碱性C.氨气和酸相遇都能产生白色烟雾++D.在反应NH 3+ H ===NH 4中,氨气失去电子,被氧化2.能用如图装置进行喷泉实验的一组气体是()A . HCl 和 CO 2B. NH 3和 COC.O2和 CO 2D.NO2和 NO3.如图所示转化关系中不能一步实现的是()A .①B.②C.③D.④5.下列方法适合实验室制取氨气的是()A.N2和 H2催化加热制取氨气B .加热 NH 4HCO 3制取氨气C.将浓氨水向生石灰固体上滴加D.将 NH 4Cl 稀溶液和NaOH 稀溶液混合6.有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是()A.氨气极易溶解于水的性质可以解释氨气的喷泉实验B.氨气的还原性可以解释氨气与氯化氢的反应实验C.铵盐的水溶性大是实验室中用NH 4Cl 和 Ca(OH) 2固体混合物制取氨气的原因D. NH 3· H 2O 的热不稳定性可以解释液氨用作制冷剂8.某种常见的白色晶体 A ,与盐酸反应产生无刺激性气味的气体B;将 B 通入澄清石灰水中,石灰水变浑浊.若在 A 的水溶液中加氢氧化钡溶液,则析出白色沉淀 C 和无色气体D; D 可以使湿润的红色石蕊试纸变蓝.加热固体A,可生成水、 B 和 D,而且 B 和 D 的物质的量之比为1∶ 1,根据以上事实,可以判断出 A 是 ______,B 是 ______,C 是 ________.加热固体 A 生成水、 B 和 D 的化学方程式是____________________________________________________________________________________________________________________.9.已知 A 、 B、 C、 D 为气体, E、 F 为固体, G 是氯化钙,它们之间的转换关系如图所示:(1)D 的化学式 (分子式 )是 ________,E 的化学式 (分子式 )是 ________.(2)A 和 B 反应生成 C 的化学方程式是__________________________________________ .(3)E 和 F 反应生成 D 、 H 和 G 的化学方程式是____________________________________________________________________________________________________________.10.氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水反应.(1)下面的制取装置图中,方法①应选用装置 ________(填“ A”或“ B”,下同 ),方法②应选用装置 ________.(2) 在制取后,如果要干燥氨气,应选用的干燥剂是________.A .浓硫酸B .固体氢氧化钠C .五氧化二磷(3) 检验集气瓶中是否收集满氨气的方法是___________________________________________________________________________________________________________.答案: (1)NH 34NH Cl点燃(2)H 2+ Cl 2 =====2HCl周六下午用题答案(3)2NH△↑+ 2H O + CaClCl + Ca(OH) =====2NH3221. B422.选 A要利用该装置进行喷泉实验,所选气体必须易溶于 NaOH 溶液或易与 NaOH 反应,10. 解析: A 装置适用于固体与固体加热制气体,B 装置适用于液体与固体 (或液体 )不加热制 B 中的 CO ,C 中的 O ,D 中的 NO 都不溶于 NaOH 溶液也不与 NaOH 反应.气体. NH 3为碱性气体,只能用碱性干燥剂.检验NH3 一般用湿润的红色石蕊试纸.23.选 AN 2 在高温、高压、催化剂存在的条件下可与H 2 直接化合生成 NH 3, NH 3 发生催化答案: (1)A B (2)B(3) 将湿润的红色石蕊试纸靠近集气瓶口,若试纸变蓝,说明NH 3 已集满 (或其他合理答案 )氧化反应生成 NO ,NO 与 O 2直接化合生成22在放电NO , ② 、③ 、 ④ 都能一步实现,只有①, N 条件下与 O 2 反应生成的是 NO 而不是 NO 2.4.选 B氯化铵分解时吸收热量,使周围温度降低,达不到幕布的着火点,且分解产生的气体可隔绝空气也使幕布不易着火.5. C6.选 A B 项氨气与氯化氢的反应不是氧化还原反应; C 项铵盐的水溶性与制氨气无关;D项液氨用做制冷剂是利用氨的易液化的性质.故B 、C 、D 选项均错误, A 项正确.8.解析: 根据 B 的性质可判断 B 应当是 CO 2而不是23SO ,又根据 D 的性质可确定 D 是 NH ,根据 A 分解产生的 NH 3 和 CO 2 物质的量之比为1∶1 知 A 为 NH 4HCO 3.答案: NH 4 HCO 3 CO 2 BaCO 3△NH 4HCO 3=====NH 3↑+ CO 2↑+ H 2O ↑9. 解析: 由图中 C 、 D 两气体生成 E 固体,则 E 不可能是酸或碱, E 固体和 F 固体反应生成D 气体和 CaCl ,通过复分解反应得到 D ,则 D 为酸性或碱性气体, 那么 F 为酸或碱,又因F 是固2体,所以 F 为碱. D 为碱性气体氨气. F 中应有钙元素,则 F 为氢氧化钙, E 为氯化铵, C 为氯化氢, A 、 B 为氢气和氯气.周六下午用题答案1. B 2.选 A要利用该装置进行喷泉实验,所选气体必须易溶于NaOH 溶液或易与 NaOH 反应,B 中的 CO ,C 中的 O 2,D 中的 NO 都不溶于NaOH 溶液也不与 NaOH 反应.3.选 A N 2 在高温、高压、催化剂存在的条件下可与H 2 直接化合生成 NH 3, NH 3 发生催化氧化反应生成 NO , NO 与 O 2 直接化合生成 NO 2, ② 、③ 、 ④ 都能一步实现,只有①, N 2 在放电条件下与 O 2 反应生成的是 NO 而不是 NO 2.4.选 B 氯化铵分解时吸收热量,使周围温度降低,达不到幕布的着火点,且分解产生的气体可隔绝空气也使幕布不易着火.5. C6.选 A B 项氨气与氯化氢的反应不是氧化还原反应;C 项铵盐的水溶性与制氨气无关; D项液氨用做制冷剂是利用氨的易液化的性质.故 B 、 C、 D 选项均错误, A 项正确.8.解析:根据 B 的性质可判断 B 应当是 CO 2而不是 SO2,又根据 D 的性质可确定 D 是NH3,根据 A 分解产生的 NH 3和 CO 2物质的量之比为4 31∶1知 A 为 NH HCO .答案: NH 4 HCO 3 CO2 BaCO 3△↑+H O↑NH HCO =====NH ↑+ CO4 3 3 2 29.解析:由图中 C、 D 两气体生成 E 固体,则 E 不可能是酸或碱, E 固体和 F 固体反应生成D 气体和 CaCl ,通过复分解反应得到D,则 D 为酸性或碱性气体,那么 F 为酸或碱,又因 F 是固2体,所以 F 为碱. D 为碱性气体氨气. F 中应有钙元素,则 F 为氢氧化钙, E 为氯化铵, C 为氯化氢, A 、 B 为氢气和氯气.答案: (1)NH 3 4NH Cl点燃(2)H 2+ Cl 2=====2HCl△(3)2NH 4Cl + Ca(OH) 2=====2NH 3↑+ 2H 2O+ CaCl 210.解析: A 装置适用于固体与固体加热制气体, B 装置适用于液体与固体(或液体 )不加热制气体. NH 3为碱性气体,只能用碱性干燥剂.检验NH 3一般用湿润的红色石蕊试纸.答案: (1)A B(2)B(3) 将湿润的红色石蕊试纸靠近集气瓶口,若试纸变蓝,说明NH 3已集满 (或其他合理答案)周一自助1.有关氨的说法不正确的是()A . NH 3三角锥形,具有还原性B. NH 3极易溶于水,可做喷泉实验,氨气易液化,液氨可用作制冷剂C.氨气是非电解质,NH 3·H 2O 是电解质D.蘸有浓盐酸的玻璃棒遇氨气产生的白烟为小冰晶2.某物质化学式为NH 5,常温下是固态,能与水剧烈反应放出两种气体。
必修一 氮及其化合物检测题1、下列说法中正确的是 ( ) A 、铵盐是由非金属元素互相结合成的化合物,因而是共价化合物 B 、铵盐与碱液共热都能得到氨气C 、除去食盐中少量的NH 4Cl :加过量的烧碱溶液后加热蒸干D 、铵盐受热分解都能生成使红色石蕊试变蓝的气体2、制取相同质量的Cu(NO 3)2时,消耗硝酸质量最多的是 ( )A 、铜与浓HNO 3反应B 、铜与稀硝酸反应C 、氧化铜与硝酸反应D 、氢氧化铜与硝酸反应3、 下列反应中,硝酸只表现出酸性的是 ( ) A. 383243322Cu HNO Cu NO NO H O +=+↑+()()稀 B. 4423222HNO C NO CO H O ()浓+=↑+↑+∆C. 4423222HNO NO O H O ()浓=↑+↑+∆D. CaCO HNO Ca NO CO H O 3332222+=+↑+()4、某单质能跟浓HNO 3 反应,若参与反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是 ( )(1)+1 (2)+2 (3)+3 (4)+4A 、(1)(2)(3)(4)B 、(1)(2)C 、(3)(4)D 、(2)(4) 5、标况下nLNH 3溶于水中得到密度为3-⋅cm g ρ的氨水AL ,则此氨水的质量分数为: ( ) A.%1004.2217⨯A n ρ B. %1002240017⨯A nρC.%1002240035⨯A n ρ D.%10017⨯Anρ 一、 选择题(本题包括10小题,每小题4分,共40分。
每小题有一个或两个选项符合题意。
若该小题的正确答案包含两个选项,全选对的得4分;只选一个且正确的,得2分;但只要有一个选错,该小题为0分。
)6、将下列固体于隔绝空气的密闭容器中加热,在加热过程中发生了化学反应,且冷却后又聚集为原来物质的是( )A 、NH 4ClB 、KMnO 4C 、碘片D 、红磷7、氮和钠可形成化合物Na 3N ,它能与水剧烈反应产生NH 3,下列叙述正确的是: ( ) A 、Na 3N 与水的反应是氧化还原反应 B 、Na 3N 是共价化合物C 、Na 3N 若与足量盐酸作用可生成两种盐D 、Na 3N 中钠离子半径大于氮离子半径8、下列各组离子在水溶液中可以大量共存的是 ( ) A. H K Fe NO +++-、、、23 B. OH Na NH Cl -++-、、、4 C. NO OH Cl K 3---+、、、 D. Mg NO H Al 233+-++、、、9、某金属M 的硝酸盐受热时按下列方式发生分解反应:222322MNO M NO O =+↑+↑∆,加热340.g 该硝酸盐,完全分解生成NO 2和O 2共672mL (标准状况),则M 的相对原子质量为 ( )A. 23B. 40C. 108D. 20110、有四种金属a 、b 、c 、d ,它们与浓HNO 3反应时只有a 不反应;把这四种金属混合加入盐酸,其中b 、c 溶解,过滤后,在滤液中加入过量的稀NaOH 溶液,可得到c 离子的沉淀。
则这四种金属的活动性由强到弱的顺序可能是 ( )①b 、c 、d 、a ②a 、b 、c 、d ③c 、b 、d 、a ④d 、c 、b 、a A 、只有① B 、①或③ C 、②或④ D 、只有③ 11、在一定条件下,将6体积的NO 2和一定体积的NO 与4.5体积的氧气组成的混和气体置于试管中,并将试管倒置于水中,充分反应后,剩余1.5体积气体,则原NO 体积可能为---------------------------------------------------( )A、3体积B、2体积C、5.5体积D、5体积12、下列反应中气体只作氧化剂的是()A、Cl2通入水中 B、Cl2通入Na2SO3溶液中C、SO2通入氢硫酸溶液中 D、NO2通人水中13、把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是()A、氧气B、二氧化氮C、二氧化氮和氧气D、二氧化氮和一氧化氮14、有一种白色固体化合物X,当它与NaOH溶液共热时,放出气体可使湿润的酚酞试纸变红色,这种溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,则X可能是()A、(NH4)2SO3B、(NH4)2SO4C、(NH4)2CO3D、(NH4)3 PO415、常温下,在密闭容器中将等物质的量的下列气体混和,完全反应后,容器内的压强是反应前的14倍,则该组气体是()A、NO和O2B、SO2和O2C、H2S和SO2D、H2S和Cl2三、选择题(本题包括7小题,每小题4分,共28分。
每项小题只有一个选项符合题意)。
16、Na2C2O4能被高锰酸钾氧化生成二氧化碳。
实验测知每生成1120mL(标准状况)二氧化碳需消耗100mL 0.1mol/L的高锰酸钾溶液,则反应后的锰元素的化合价为: A、+6 B、+4 C、+2 D、无法确定()17、工业废气中氮氧化物是主要的大气污染源之一。
已知① 3NO2+2NaOH=2NaNO3+NO+H2O ② NO2+NO+2NaOH=2NaNO2+H2O现有a mol NO 2和b mol NO 的混合气,若用足量的NaOH 溶液能将其完全吸收....,则混合气中两种气体的物质的量必须满足的关系是 ( ) A 、3ba =B 、2a=bC 、a ≥bD 、2a<b 18、下列物质中,既可与硫酸反应,又可以与氢氧化钠溶液反应的是 ( )①NaHSO 4 ②Al(OH)3 ③Ca(H 2PO 4)2 ④(NH 4)2S A 、只有①②④ B 、只有③④ C 、只有②③④ D 、均有 19、在一定温度和压强下,将一支容积为15mL 的试管充满NO 2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O 2,若要使试管内的液面仍保持在原高度,则通入O 2的体积为 ( )A 、3.75mLB 、7.5mLC 、8.75mLD 、10.5mL 20、将NO 2、NH 3、O 2的混和气体22.4L 通过稀硫酸后,溶液的质量增加26.7克,气体体积缩小为 4.48L(气体体积均在标准状况下测定),剩余气体能使带余烬的木条复燃,则混和气体的平均分子量为 ( ) A 、28.1B 、30.2C 、33.1D 、34.021、把aL 含(NH 4)2SO 4和NH 4NO 3的混和溶液分成两等份,一份加入bmol 烧碱并加热,恰好将全部NH 4+转变成NH 3放出;另一份需含c molBaCl 2溶液恰能完全沉淀SO 42-,则原溶液中NO 3-的物质的量浓度是 ( ) A 、2b c a -mol/L B 、b c a -2mol/L C 、 24b c a -mol/L D 、b ca-4mol/L 22、 1.92g 铜投入一定量浓HNO 3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL 气体(标准状况下测定)。
将盛有此气体的容器倒扣在水中,通入一定体积的O 2(标准状况下),恰好使气体完全溶于水中,则通入O 2的体积是 ( )A 、504mLB 、168mLC 、336mLD 、224mL《氮族元素》答卷Ⅰ卷(共83分),选择题答案:题号 1 2 3 4 5 6 7 8 9 10 11 答案题号12 13 14 15 16 17 18 19 20 21 22 答案Ⅱ卷 (共67分)四、填空题(共32分)23、(8分)现有A、B、C、D、E、F、G、H八种气体均为无机物,根据下列事实判断各是哪种气体。
(1)A、B、D、F四种气体是单质。
(2)把A和B混合,在光照下发生爆炸,生成气体C。
(3)A和D在一定条件下发生反应生成气体E。
(4)D和F在放电条件下可生成气体G。
(5)G与空气混合时,由无色变成红棕色气体H。
(6)E与C反应冒白烟。
(7)H溶于水生成一种强酸和气体G。
试写出各种气体的化学式: A_________,B_________,C_________,D_________E_________F________,G_________,H_________。
24、(6分)完成并配平化学方程式(在空格内填入系数或化合物的分子式).(1)(2) □Cu2S+ □HNO3= □Cu(NO3)2+ □NO↑+ □S+ □H2O25、(3分)在热的酸性溶液中,0.1mol KNO3 正好氧化300mL 1mol/L FeCl2溶液,KNO3被还原为氮的氧化物。
完成并配平离子反应方程式:——————————————————————————————26、(3分)高锰酸钾和氢溴酸溶液可以发生下列反应:KMnO4 + HBr Br2+ MnBr2+ KBr + H2O①其中还原剂是。
②若消耗0.1mol 氧化剂,则被氧化的还原剂的物质的量是 mol 。
27、(4分)在一定条件下,RO3n-和I-发生反应的离子方程式为:RO3n- + 6I- + 6H+ = R- + 3I2+ 3H2O(1)RO3n-中R元素的化合价是________;(2)R元素的最外层电子数为_________。
28、(8分)如图所示已知:①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1︰3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1︰2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:(1)甲是,乙是。
(2)甲与丙反应生成X的化学方程式是(3)乙与丁反应生成W的化学方程式是五、实验题 (共19分)29、(8分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
⑴写出实验室制取氨气的化学方程式:___________________________(2)收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。
(3)用左上图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是。
该实验的原理是。
(4)如果只提供如右上图的装置,请说明引发喷泉的方法。
答:_____________________________________________________________________________________________________________________________。
30、(11分)喷泉是一种常见的自然现象,其产生原因是存在压强差。
右图为化学教学中用的喷泉实验装置。
在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。
1、下列组合中不可能形成喷泉的是__________A、 HCl和H2O B、 O2和H2OC、 NH3和H2O D、 CO2和NaOH溶液2、某学生积极思考产生喷泉的其他办法,并设计了如右下图所示的装置。