金属常见的金属腐蚀形式共77页
- 格式:ppt
- 大小:5.22 MB
- 文档页数:77




金属腐蚀的化学过程金属腐蚀是指金属在与环境中的氧气、水或其他化学物质接触时,发生化学反应而导致金属表面的损坏和腐蚀。
这是一种普遍存在的现象,对于金属制品的使用和保养具有重要的意义。
本文将介绍金属腐蚀的化学过程,以及一些常见的腐蚀形式和防腐措施。
一、金属腐蚀的化学过程金属腐蚀是一种电化学反应,涉及到金属的氧化和还原过程。
在腐蚀过程中,金属表面的原子或离子与环境中的氧气、水或其他化学物质发生反应,形成金属离子和电子。
金属离子溶解于溶液中,而电子则通过金属表面的导电路径流动,形成电流。
这个过程可以用下面的化学方程式表示:金属→ 金属离子 + 电子金属离子 + 电子→ 金属在这个过程中,金属的氧化是指金属原子失去电子,形成金属离子;而金属的还原是指金属离子接受电子,重新形成金属原子。
这个过程是一个动态平衡的过程,当金属表面的金属离子溶解速度等于金属离子还原速度时,金属腐蚀停止。
二、金属腐蚀的常见形式金属腐蚀的形式多种多样,常见的有以下几种:1. 酸蚀:金属与酸发生反应,产生金属盐和氢气。
例如,铁与盐酸反应生成氯化铁和氢气。
Fe + 2HCl → FeCl2 + H22. 碱蚀:金属与碱发生反应,产生金属盐和氢气。
例如,铝与氢氧化钠反应生成氢氧化铝和氢气。
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H23. 氧化腐蚀:金属与氧气发生反应,形成金属氧化物。
例如,铁与氧气反应生成铁(III)氧化物。
4Fe + 3O2 → 2Fe2O34. 电化学腐蚀:金属在电解质溶液中发生电化学反应,形成金属离子和电子。
例如,铁在水中发生电化学腐蚀反应。
Fe → Fe2+ + 2e-5. 微生物腐蚀:某些微生物能够利用金属作为能源,通过代谢产生的酸性物质导致金属腐蚀。
例如,硫酸盐还原菌能够利用铁作为电子供体,产生硫酸和铁离子,导致铁的腐蚀。
三、金属腐蚀的防腐措施为了防止金属腐蚀,人们采取了各种防腐措施。

金属材料腐蚀的分类
金属材料的腐蚀可以按照不同的分类方式进行划分,以下是常见的几种分类方式:
1. 电化学腐蚀分类:
- 酸性腐蚀:金属在酸性环境中的腐蚀。
- 碱性腐蚀:金属在碱性环境中的腐蚀。
- 电池腐蚀:由于金属表面产生微观电池,导致腐蚀。
- 微生物腐蚀:由微生物代谢产生的酸、碱或化学物质导致
的腐蚀。
2. 物理腐蚀分类:
- 氧化腐蚀:金属与氧发生化学反应导致腐蚀。
- 湿气腐蚀:金属与湿气中的水蒸气等产生的化学物质发生
反应导致腐蚀。
- 焊接腐蚀:焊接过程中产生的热应力和化学物质导致的腐蚀。
3. 腐蚀形式分类:
- 均匀腐蚀:金属表面均匀腐蚀,使金属材料的厚度逐渐减少。
- 局部腐蚀:金属表面仅部分区域发生腐蚀,如点蚀、缝蚀、孔蚀等。
- 应力腐蚀:金属在受到应力作用的同时,发生化学物质的
腐蚀。
- 磨蚀腐蚀:金属材料在摩擦或冲刷作用下发生的腐蚀。
这些分类方式只是根据不同的角度对金属材料腐蚀进行的分类,实际上金属腐蚀是一个复杂的过程,往往同时存在多种腐蚀形式。
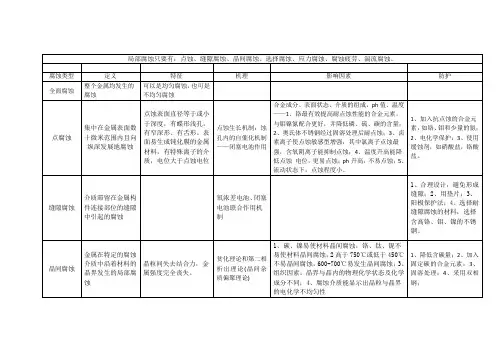


金属常见的几种腐蚀简介一、垢下腐蚀1、定义垢下腐蚀under-deposit corrosion:金属表面沉积物产生的腐蚀2、腐蚀机理一种特殊的局部腐蚀形态,其机理是由于受设备几何形状和腐蚀产物、沉积物的影响,使得介质在金属表面的流动和电介质的扩散受到限制,造成被阻塞的的空腔内介质化学成分与整体介质有很大差别,空腔内介质pH值发生较大变化,形成阻塞电池腐蚀(Occude cell corrosion),尖端的电极电位下降,造成电池腐蚀。
按其腐蚀原理可分为酸性腐蚀和碱性腐蚀两种,通常循环冷却系统的垢下腐蚀为酸性腐蚀。
结垢是指在冷却水中所含成垢组分在水侧金属表面的结垢过程,污垢是包括水垢在内的固形物的集合体。
常见的污垢物有:泥渣及粉尘砂粒,腐蚀产物,天然有机物群生物群体,一般有碎屑、氧化铝、磷酸铝、磷酸铁和污垢的沉积,冷却塔的污垢来自于以下几个方面:①来自补充水的污垢。
②来自空气污垢。
③来自系统本身的污垢。
微生物是一些细小多为肉眼看不见的生物,微生物的种类有细菌、藻类、真菌和原生动物,微生物在冷却水系统中大量繁殖,会使冷却水颜色变黑,发生恶臭。
破坏环境,同时会形成大量粘泥使冷却塔的冷却效率降低,使效率迅速降低的水头损失增加,沉积在金属表面的菌类,会引起严重的垢下腐蚀所有这些总是导致冷却水系统不能长期安全运转影响生产,造成经济损失。
因此,微生物危害与水垢腐蚀对冷却水的危害是一样的重要三者比较起来控制微生物的危害应是首要的。
冷却水的微生物有以下种类:有真菌、硫酸菌、还原菌、自养菌、异样菌、硫细菌、铁细菌、硝化菌、藻类,藻类是低级的绿色植物,没有要茎叶的分化固然又叫原植体植物,藻类与菌类的主要区别在于具有色素体的色素,能进行光合作用。
制造营养物质是光合自养型生物,在循环冷却水系统,常出现的有蓝绿藻、绿藻、硅藻三大类,在循环冷却水池,冷却塔受光照的部分生长繁殖枯死的藻类进入循环冷却系统成为沉积物的一种成份,金属的垢下腐蚀是由于其本身电化学腐蚀存在自催化作用,酸腐蚀是氢的去极化作用(2H++2e→H2),腐蚀产物主要是可溶性盐,这些盐类的水解使介质的酸性进一步增强,加速了金属的腐蚀。



金属的腐蚀问题金属材料受周围介质的作用而损坏,称为金属腐蚀(Metallic Corrosion)。
金属腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。
这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
腐蚀过程一般有两种途径:化学腐蚀和电化学腐蚀。
化学腐蚀:金属表面与周围介质直接发生化学反应而引起的腐蚀。
电化学腐蚀:金属材料(合金或不纯的金属)与电解质溶液接触,通过电极反应产生的腐蚀。
金属腐蚀的主要类型1.均匀腐蚀(Uniform Corrosion)均匀腐蚀是指在与环境接触的整个金属表面上几乎以相同速度进行的腐蚀。
在应用耐蚀材料时,一般以耐均匀腐蚀作为主要的耐蚀性能依据,对于特点介质环境下,则还需考虑耐局部腐蚀的性能。
2.点蚀(Pitting Corrosion)由于金属材料中存在缺陷、杂质和溶质等的不均一性,当介质中含有某些活性阴离子(如氯离子)时,这些活性阴离子首先被吸附在金属表面某些点上,从而使金属表面钝化膜发生破坏。
一旦这层钝化膜被破坏又缺乏自钝化能力时,金属表面就发生腐蚀。
这是因为在金属表面缺陷处易漏出机体金属,使其呈活化状态,而钝化膜处仍为钝态,这样就形成了活性—钝性腐蚀电池,由于阳极面积比阴极面积小得多,阳极电流密度很大,所以腐蚀往深处发展,金属表面很快就被腐蚀成小孔,这种现象被称为点蚀。
一般情况下,点蚀的深度要比其直径大的多。
点蚀经常发生在表面有钝化膜或保护膜的金属上。
在石油、化工的腐蚀失效类型统计中,点蚀约占20%~25%。
流动不畅的含活性阴离子的介质中容易形成活性阴离子的积聚和浓缩的条件,促使点蚀的生成。
粗糙的表面比光滑的表面更容易发生点蚀。
pH值降低、温度升高都会增加点蚀的倾向。
氧化性金属离子(如Fe3+、Cu2+、Hg2+等)能促进点蚀的产生。