Diels_Alder反应合成月桂烯类香料的研究进展
- 格式:pdf
- 大小:209.79 KB
- 文档页数:3

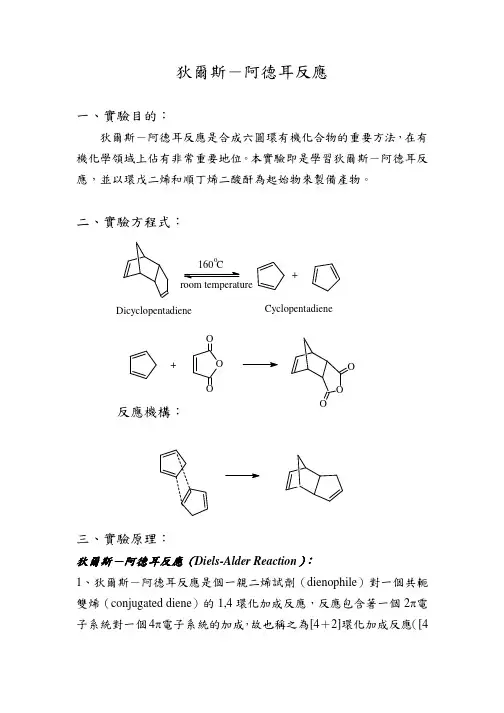

Diels-Alder反应(狄尔斯–阿尔德反应)Diels-Alder反应,反电⼦要求的Diels-Alder反应和Hetero-Diels–Alder reaction(杂-Diels–Alder反应)都是[4+2]环加成反应,都属于协同反应。
是由共轭双烯与亲双烯体构建环⼰烯⾻架的经典反应。
反应有丰富的⽴体化学呈现,兼有⽴体选择性、⽴体专⼀性和区域选择性等。
该反应是可逆反应,正向成环的反应温度较低,逆向开环反应需要较⾼的温度。
此反应⽤很少能量就可以合成六元环,是制备不饱和六元环的⾮常重要的环化⼿段之⼀,对推动有机化学反应理论的发展起到了重要作⽤。
Danishefsky⼆烯与⼀般的双烯相⽐,有更好的反应性及位置选择性。
因此,是熟为⼈知的有机合成试剂。
1950年的诺贝尔化学奖颁给了德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学⽣库尔特·阿尔德(Kurt Alder),以表彰他们在1928年发现了著名的“Diels-Alder双烯合成反应”。
反应机理反应机理⼀般认为,在反应时两反应物彼此靠近,相互作⽤, 形成⼀个环状过滤态。
然后逐渐转化为产物分⼦,即旧键的断裂与新键的形成是相互协调地在同⼀步骤中完成的—协同反应,⽆中间体⽣成。
带有给电⼦基团的双烯体和带有吸电⼦基团的亲双烯体进⾏反应。
因为前沿轨道(双烯的HOMO和亲双烯体的LUMO)的能量差越⼩,能够使轨道相互作⽤⽽稳定,从⽽使反应更容易进⾏(电⼦要求型)。
同理,亲双烯体带有给电⼦基,共轭双烯带吸电⼦基的反应也容易进⾏(反电⼦要求型)。
反应是按协同反应顺式加成来进⾏的,优先⽣成endo加成产物(endo规则)。
电⼦要求型的Diels-Alder反应中,⼆次轨道相互作⽤⼤致能解释这⼀规则,但endo/exo选择性也受⽴体影响,根据不同底物,完全选择⽣成exo产物的例⼦也有报道。
除此之外分⼦内的Diels-Alder 反应由于环状结构固定,构型⾃由度较低,也不完全适⽤endo规则。

Diels-Alder反应的研究进展董海峰理研1105班学号:2011200976导师:李雷教授摘要:本综述介绍了关于Diels-Alder反应的研究新成果: 水相Diels-Alder反应; C60的Diels-Alder反应; 超分子作用下的Diels-Alder反应以及反双烯合成的应用。
对Diels-Alder反应的全新认识无论是对有机合成设计还是有机化学教学内容更新都具有重要意义。
关键词: 综述; Diels-Alder反应; 反双烯合成; C60; 超分子作用Diels-Alder反应是20世纪有机合成方面最主要的发现之一,也是有机化学中非常重要的一类反应。
所谓Diels-Alder反应是指含有共轭二烯结构的双烯体和含不饱和键的亲双烯体, 通过1,4-加成得到环状烯烃, 故又称为双烯合成反应。
Diels-Alder反应的本质是双烯体和亲双烯体发生[4+2]环加成,其历程是协同进行的周环反应。
由于Diels-Alder反应在有机化合物的分离、鉴别以及合成中应用广泛,所以吸引了人们从反应机理、反应条件以及可发生的范围等多方面进行着不断深入地再研究, 本文综述了关于Diels-Alder反应的新近研究成果, 旨在丰富对此类反应的再认识。
1 Diels-Alder反应1.1 Diels-Alder反应定义在加热条件下, 共轭双烯体和亲双烯体发生1,4-加成反应, 生成环状化合物的反应叫双烯合成.双烯合成反应是O.Diels和lder于1928年发现的,所以也叫Diels-Alder反应[1 ].Diels-Alder反应可通式表示如下:因为Diels-Alder反应涉及到一个4P电子体系和一个2P电子体系, 所以它属于(4+ 2)环加成反应Diels-Alder反应机理Diels-Alder反应是协同机理, 即双烯体和亲双烯体通过环状过渡态,旧键的断裂和新键的形成同时进行, 一步完成反应过程:此机理可用前线轨道理论来解释. 双烯体HOMO两端的位相和亲双烯体LUMO的位相相符, 双烯体LUMO两端的位相和亲双烯体HOMO的位相也相符. 如图1所示。

DielsAlder一.機理這是一個一步完成的協同反應。
沒有中間體存在,只有過渡態。
一般條件下是雙烯的最高含電子軌道(HOM)與親雙烯體的最低空軌道(LUMO相互作用成鍵。
由於是不涉及離子的協同反應,故普通的酸鹼對反應沒有影響。
但是路易斯酸可以通過絡合作用影響最低空軌道的能級,所以能催化該反應。
二.立體化學狄耳士-阿德爾反應有如下規律:1、區域選擇性:1.1.lf at least one of the Diels-Alder reagents is symmetrically substituted, thereis only one possible product1.2. Asymmetry in both the die ne and die no phile gen erates two products that arecon stituti onal isomers當有二種產物,到底是鄰位/間位/對位?要視親雙烯體上正電荷之碳優先和雙烯體上之負電荷的碳,鍵結為單鍵,經多次實驗後,多以鄰位為主,或對位為主反應產物往往以「假鄰對位」產物為主。
即若把六元環產物比作苯環,那麼環上官能團(假設有兩個官能團)之間的相互位置以鄰位(如1),或者對位為主(如3)。
3、立體專一性:加熱條件下反應產物以「順旋」產物為唯一產物;光照條件下以「對旋」產物為唯一產物。
比如以下兩個熱反應中,產物7、8的相對立體構型都是唯一的,兩個烯烴原料原有的官能團A,B,C,D的順反立體化學關係都在產物中得到忠實地翻譯。
三.在談Diels-Alder 反應時,為什麼dienophile 上有electronwithdrawing group 會有利於其反應?Ans:要解釋以上的問題需要較深的理論,讓我先用1,4- 丁二烯與乙烯的反應為例來說明,你估妄看之。
首先我們要瞭解1,4- 丁二烯的系統有四個M0 (由每一個碳所提供的p軌域組成)如下圖所示;乙烯的系統則有兩個MO —個較簡單的理論是這個反應只要考慮前沿分子軌域(frontier molecular orbitals) 之間的作用,所謂前沿分子軌域就是指最高佔有電子軌域(highest occupied molecular orbital 簡稱HOMO)以及最低未佔有電子軌域(lowest unoccupied molecular orbital 簡稱LUMO,此處的高低是針對能量而言。

基于Diels-Alder反应_天然产物Applanatumol Z5,Mannolides和Longifolene的合成研究基于Diels-Alder反应:天然产物Applanatumol Z5、Mannolides和Longifolene的合成研究引言:天然产物一直以来都是药物研发的重要来源,近年来对天然产物的合成研究也取得了显著的进展。
Diels-Alder反应是有机合成中的一种重要反应,通过该反应可以合成具有复杂分子结构的化合物。
本文将以天然产物Applanatumol Z5、Mannolides和Longifolene为例,探讨基于Diels-Alder反应的合成研究,分析其合成路线、反应条件和合成效果,为进一步的天然产物合成研究提供参考。
一、Applanatumol Z5的合成研究Applanatumol Z5是从木耳菇属(Ganoderma)中分离出的一种三萜类化合物,具有多重生物活性。
为了合成该天然产物,研究人员首先选择了合适的二烯和二烯丙基区,通过Diels-Alder反应实现环合,合成了目标化合物的核心结构。
接着,他们进行了酮还原、羟基保护、醇脱保护等步骤,最终成功地合成了Applanatumol Z5。
二、Mannolides的合成研究Mannolides是一类天然产物,具有广泛的生物活性。
基于Diels-Alder反应的合成方法,在Mannolides合成中得到了成功应用。
研究人员首先通过选择合适的二烯和二烯丙基区进行Diels-Alder反应,成功地合成了目标化合物的核心结构。
接下来,他们进行了一系列的保护基操作和化学转化,最终合成出了Mannolides。
三、Longifolene的合成研究Longifolene是一种首次从开花植物海洋松属(Pinus pinaster)中分离出的天然烃类化合物,具有重要的生物活性。
为了合成Longifolene,研究人员选择了具有良好反应活性的二烯和二烯丙基区,通过Diels-Alder反应实现环合反应。


Diels-Alder反应是一种常用的有机化学反应,用于合成许多新香料和药物。
在合成新香料中,Diels-Alder反应可以用于合成许多有机分子,其中包含一些特殊的环结构。
这些环结构通常具有独特的香味或气味,因此可以用于制造香料。
例如,Diels-Alder反应可以用于合成苯并环烯(芳香族烯烃)、苯并芘(芳香族芳烃)和苯并吡咯(芳香族芳烃)等多种有机化合物。
这些化合物可以用于制造香皂、香水、化妆品和其他产品。
Diels-Alder反应的反应条件较为宽容,反应速率较快,同时产物的纯度也较高,因此在合成新香料中非常常用。
但是,要注意,在合成过程中需要遵守化学安全规定,以免造成人身伤害或环境污染。

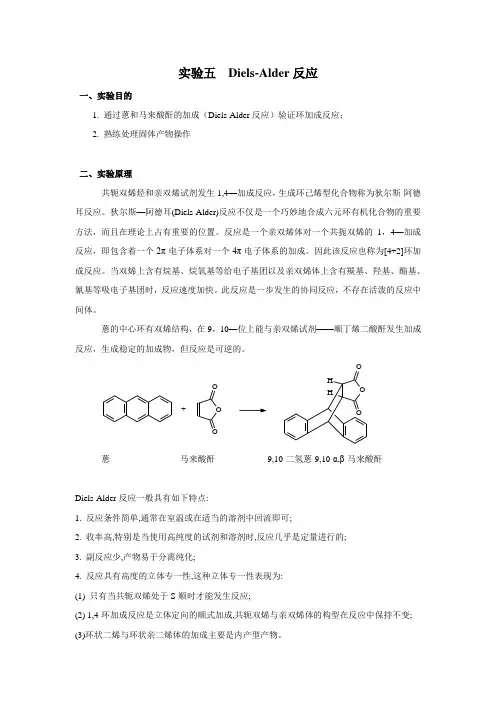
实验五Diels-Alder反应一、实验目的1. 通过蒽和马来酸酐的加成(Diels-Alder反应)验证环加成反应;2. 熟练处理固体产物操作二、实验原理共轭双烯烃和亲双烯试剂发生1,4—加成反应,生成环己烯型化合物称为狄尔斯-阿德耳反应。
狄尔斯—阿德耳(Diels-Alder)反应不仅是一个巧妙地合成六元环有机化合物的重要方法,而且在理论上占有重要的位置。
反应是一个亲双烯体对一个共扼双烯的1,4—加成反应,即包含着一个2π电子体系对一个4π电子体系的加成。
因此该反应也称为[4+2]环加成反应。
当双烯上含有烷基、烷氧基等给电子基团以及亲双烯体上含有羰基、羟基、酯基、氰基等吸电子基团时,反应速度加快。
此反应是一步发生的协同反应,不存在活泼的反应中间体。
蒽的中心环有双烯结构,在9,10—位上能与亲双烯试剂——顺丁烯二酸酐发生加成反应,生成稳定的加成物,但反应是可逆的。
O O O+蒽马来酸酐9,10-二氢蒽-9,10-α,β-马来酸酐Diels-Alder反应一般具有如下特点:1. 反应条件简单,通常在室温或在适当的溶剂中回流即可;2. 收率高,特别是当使用高纯度的试剂和溶剂时,反应几乎是定量进行的;3. 副反应少,产物易于分离纯化;4. 反应具有高度的立体专一性,这种立体专一性表现为:(1) 只有当共轭双烯处于S-顺时才能发生反应;(2) 1,4-环加成反应是立体定向的顺式加成,共轭双烯与亲双烯体的构型在反应中保持不变;(3)环状二烯与环状亲二烯体的加成主要是内产型产物。
三、实验药品,仪器1、药品:2g纯蒽、1g马来酸酐、25ml无水二甲苯。
2、仪器:50ml圆底烧瓶、回流冷凝管、电炉、铁架台、布氏漏斗、抽滤瓶、胶管、玻璃棒、烧杯、量筒、天平四、实验物理常数五、实验步骤在50ml圆底烧瓶中加入2g纯蒽、1g马来酸酐和25ml无水的二甲苯,连接回流冷凝管,加热回流25min。
将液面的边缘上析出的晶体振荡下去,再继续加热5min,停止加热。

Diels-Alder 反应12032202陈曦摘要:由于Diels2Alder 反应具有一系列重要特点(原子经济性、热可逆性、立体选择性、立体专一性和区域选择性等) ,自从1928 年被发现以来,该反应就一直是人们研究的热点。
将其应用于聚合物的合成中,可制备一些具有特殊性能的Diels2Alder 聚合物,人们在这方面作了大量的研究工作,取得了许多研究成果。
本文首先根据不同的分类标准,对应用Diels2Alder 反应制备聚合物的研究进行了分类,然后结合本课题组的相关研究工作,综述了近年来人们在该领域的研究进展,最后展望了其研究前景。
关键词:Diels-Alder 反应;特殊结构聚合物;手性;可逆性;链结构正文:一、Diels-Alder反应的原料分子结构1 、AB型AB 型指在一个原料分子上同时含有双烯体单元和亲双烯体单元,然后通过DA 反应形成线形聚合物。
一般要求双烯体和亲双烯体的反应活性不能太高,以免在制备或贮存过程中发生反应。
Gandini 课题组利用糠胺与马来酸酐反应,合成了一端含有呋喃环单元而另一端含有马来酰亚胺单元的AB 型单体,然后将此单体进行DA 反应制备了一种线状聚合物。
Mikroyannidis 也合成了AB 型的原料分子,并对其进行了表征及聚合研究[2,3] 。
(如图1所示)[1]图12 、AA2BB型AA2BB 型是指一个原料分子上含有两个双烯体单元,而另一个原料分子上含有两个亲双烯体单元通过DA 反应形成聚合物。
Grigoras 等合成了含有两个蒽端基的线性聚合物作为双烯体,通过与四种含有两个马来酰亚胺单元的亲双烯体进行DA 反应制备了一系列的线性聚合物,这些聚合物在极性溶剂中可溶,且具有一定的耐热性[4 ,5 ]。
Mashiko 利用DA 反应将22氯丁二烯与12氰基丙烯酸乙酯共聚制备了一种线性聚合物[ 6 ] 。
Patel 在三嗪环上接入两个呋喃环作为双烯体,然后通过与一系列的含有两个马来酰亚胺单元的交联剂进行DA 反应制备了一系列的新型马来酰亚胺聚合物,这些聚合物均具有良好的耐热性和耐有机溶剂性[7 ] 。
烯酮类化合物的aza Diels-Alder环加成反应研究进展
李金秋;曹国锐
【期刊名称】《合成化学》
【年(卷),期】2018(26)8
【摘要】烯酮类化合物因其特殊的结构和化学性质而广泛应用于环加成反应中.烯酮类化合物的aza Diels-Alder反应研究在近年来得到了迅速发展.根据烯酮在aza Diels-Alder反应中的作用(双烯体、亲双烯体和自身环化)分类,综述了其在aza Diels-Alder反应中的研究进展.
【总页数】8页(P628-635)
【作者】李金秋;曹国锐
【作者单位】青岛科技大学化工学院,山东青岛 266042;青岛科技大学化工学院,山东青岛 266042
【正文语种】中文
【中图分类】O621.1
【相关文献】
1.[60]富勒烯环加成反应研究进展 [J], 金波;彭汝芳;马冬梅;蔡艳华;楚士晋
2.[60]富勒烯环加成反应研究进展 [J], 金波;彭汝芳;马冬梅;蔡艳华;楚士晋
3.硝酮类化合物环加成反应研究进展 [J], 张怀远
4.C59XH(X=N,B)与1,3-丁二烯Diels-Alder环加成反应的区域选择性 [J], 梁云霄;尚贞锋;许秀芳;赵学庄
5.[60]富勒烯[2+1]环加成反应研究进展 [J], 朱玉兰;曹丽;尹起范;阚玉和
因版权原因,仅展示原文概要,查看原文内容请购买。
Diels-alder反应Diels-Alder 反应含有⼀个活泼的双键或叁键的化合物(亲双烯体)与共轭⼆烯类化合物(双烯体)发⽣1,4-加成,⽣成六员环状化合物:这个反应极易进⾏并且反应速度快,应⽤范围极⼴泛,是合成环状化合物的⼀个⾮常重要的⽅法。
带有吸电⼦取代基的亲双烯体和带有给电⼦取代基的双烯体对反应有利。
常⽤的亲双烯体有:下列基团也能作为亲双烯体发⽣反应:常⽤的双烯体有:反应机理这是⼀个协同反应,反应时,双烯体和亲双烯体彼此靠近,互相作⽤,形成⼀个环状过渡态,然后逐渐转化为产物分⼦:反应是按顺式加成⽅式进⾏的,反应物原来的构型关系仍保留在环加成产物中。
例如:正常的Diels-Alder反应主要是由双烯体的HOMO(最⾼已占轨道)与亲双烯体的LUMO(最低未占轨道)发⽣作⽤。
反应过程中,电⼦从双烯体的HOMO“流⼊”亲双烯体的LUMO。
也有由双烯体的LUMO与亲双烯体的HOMO作⽤发⽣反应的。
反应实例本反应具有很强的区域选择性,当双烯体与亲双烯体上均有取代基时,主要⽣成两个取代基处于邻位或对位的产物:当双烯体上有给电⼦取代基、亲双烯体上有不饱和基团如:与烯键(或炔键)共轭时,优先⽣成内型(endo)加成产物:参考⽂献[1] O. Diels and K. Alder, Ann., 460, 98 (1928); 470,62 (1929) Ber., 62, 2081, 2087 (1929)[2] J. A. Norton, Chem. Revs., 31, 319 (1942)[3] M. C. Koetzel, Organic Reactions,4, 1 (1948)[4] H. L. Holmes, Organic Reactions,4, 60 (1948)[5] L. W. Butz, Organic Reactions,5,136 (1949)[6] Madronero, Rev. Scienc. Apl. (Madrid) 12, 397 (1958); C.A. 53, 6984 (1959)[7] P. Yates and P. Eaton, J. Amer. Chem. Soc., 82, 4436 (1960)[8] J. G. Martin and R K. Hill, Chem. Rev., 61, 537 (1961)[9] G. I. Fray and R. Robinson, J. Amer. Chem Soc., 83, 249 (1961)[10] L. F. Fieser and M. Fieser, Advanced OrganicChemistry (Reinhold, New York, 1961), pp 206-210 [11] S. B. Needlernan and M. C. C. Kuo, Chem. Rev., 62, 405 (1962)[12] C. Walling and H. J. Schugar, J. Amer. Chem. Soc., 85, 607 (1963)[13] S. Seltzer, J. Am. Chem. Soc.,85, 1360 (1963)[14] W. J. Middleton, J. Org. Chem., 30, 1390(1965)[15] J. B. Lambert, J. D. Roberts, Tetrahedron Letters, 1965, 1457.。
月桂烯的Diels—AIder反应及基在合成香料方面的应用关永怡;黄志纾
【期刊名称】《香料香精化妆品》
【年(卷),期】1990(000)003
【摘要】本文利用香叶烯和丙烯腈作原料经D-A反应和电环化反应,合成了具有木香香气的腈类香料——双环腈。
通过一系列反应条件的摸索实验,得出了较理想的反应条件。
产物经过光谱测试得到鉴定。
【总页数】2页(P18-19)
【作者】关永怡;黄志纾
【作者单位】不详;不详
【正文语种】中文
【中图分类】TQ655
【相关文献】
1.微波固相法制备ZnCl2/NaY催化剂ZnCl2/NaY在月桂烯Diels-Alder反应中的催化性能 [J], 银董红;尹笃林;伏再辉;李谦和
2.Diels-Alder反应在松节油半合成香料中的应用 [J], 邹志平;刘六军;陈素文
3.月桂烯与对苯醌的Diels-Alder反应研究 [J], 罗金岳;海维;雷福厚
4.固体超强酸SO42-/TiO2-ZrO2 催化β-月桂烯与马来酸酐的Diels-Alder反应研究 [J], 罗金岳;安鑫南;雷福厚
5.山苍籽油与月桂烯Diels—Alder反应产物作定香剂的研究 [J], 陈安力
因版权原因,仅展示原文概要,查看原文内容请购买。
酶催化杂Diels-Alder反应
王翠珍;陈窕;王健博
【期刊名称】《合成生物学》
【年(卷),期】2024(5)1
【摘要】Diels-Alder反应被认为是合成复杂天然产物的最有效的方法之一,一直以来都深受化学家的关注。
而杂原子参与的HDA(Hetero-Diels-Alder)反应是合成各种天然杂环的重要工具,其中以氧杂DA反应和氮杂DA反应最为常见。
酶催化HDA反应以其绿色温和、高效、高选择性等优势受到人们广泛关注。
随着杂环天然产物中酶催化HDA反应的不断发现,对HDA相关酶的立体选择性、底物特异性的研究也不断深入,有效促进了人们对这一类酶序列与功能关系的了解,为其挖掘和改造奠定了基础。
本文集中对目前已知的酶催化HDA反应合成杂环天然产物的成果进行概述,主要包括吡喃类化合物和吲哚生物碱生物合成中涉及的酶促HDA反应,以期通过对途径和催化机理的分析,为发展新的相关生物催化剂用于合成非天然的杂环产物提供思路。
【总页数】19页(P107-125)
【作者】王翠珍;陈窕;王健博
【作者单位】湖南师范大学化学化工学院;浙江大学基础医学院药物生物技术研究所
【正文语种】中文
【中图分类】Q55
【相关文献】
1.有机催化的不对称N-磺酰基-1-氮杂-1,3-丁二烯与醛的反电子需求的氮杂Diels-Alder反应
2.亚胺杂Diels-Alder反应的催化剂
3.光催化的Schiff碱与N-乙烯基吡咯烷酮及N-乙烯基咔唑的Diels-Alder反应研究:合成4-杂环取代的四氢喹啉衍生物
因版权原因,仅展示原文概要,查看原文内容请购买。
食品工程·T echnique技术Chem.,1989(27):17~20.[10]THOMASM,BADGER,MARTIN JJ,et al.The h ealth c onsequencesof e arly s oy c onsumption[J].J.Nutr.2002(132):559~565. [11]张伟,王艳萍.大豆肽的特性及其营养保健功能[J].农技服务,2008,25(11):167~168.[12]汪建斌,邓勇.大豆多肽的生理功能及开发利用[J].广州食品工业科技,2001,17(3):52~53.[13]高长城,胡锐,李煜馨.大豆肽对增强体能的作用[J].大豆通报,2001(2):24.[14]张智,孙凌雪.大豆蛋白活性肽在相关行业中的应用[J].中国调味品,2003(5):11-12.[15]陈成,刘文玉,杨青.大豆蛋白活性肽的生物学功能及其应用[J].黑龙江农业科学,2004,(3):40~42.[16]曲永洵.大豆肽的特性及其应用[J].中国油脂,1996(2):3~5.收稿日期:2010-10-18作者简介:段娜娜(1986—),女,河南睢县人,硕士研究生,研究方向为食品资源开发与利用。
通讯作者:陈复生(1963—),男,河南孟津人,河南工业大学副校长,教授,研究方向为食品资源开发与利用。
通信地址:(450052)河南省郑州市嵩山南路140号Diels-Alder反应合成月桂烯类香料的研究进展杨铭1黎彧2张伟健2徐嘉琪2(1.广东轻工职业技术学院传播工程系2.广东轻工职业技术学院轻化系)【摘要】Diels-Alder反应的产物是重要的有机合成单元反应,广泛用于香料、药物等方面。
传统方法Diels-Alder反应时间长、污染大及后处理困难,微波协同树脂催化Diels-Alder反应具有反应快、高效、能耗低及安全等优点。
本文综述了微波协同树脂催化Diels-Alder反应的研究进展,并展望该方法在合成香料中的发展前景。
【关键词】月桂烯;Diels-Alder反应;树脂;催化;微波中图分类号:TS202.3文献标识码:A文章编号:1000-9868(2011)01-0137-03自从1928年德国化学家O.Diels与其助手K.Alder共同发现Diels-Alder反应以来,Diels-Alder反应已成为了最有效和通用的合成六元环的方法之一。
Diels-Alder反应在温和的条件下可以进行,但反应较慢,反应时间较长,若温度升高或加入合适的催化剂能加快反应速度。
微波辅助有机合成是近年来发展的对环境友好的新型绿色合成方法,微波加热是由里及外的加热,具有快速、均匀、简便的特点,还能催化如酯化、水解、酰化和成环等多种有机反应,该技术具有选择性高、耗时少和能耗低等优点,可克服传统合成方法的缺陷,与相转移催化合成等技术相比,适用面更广,且设备投资不高,是目前国内外有机合成的研究热点。
月桂烯,又名香叶烯,无色或淡黄色油状液体,是一种具有3个双键的共轭双烯体,可由β-蒎烯高温下热异构或者由异戊二烯在碱金属催化作用下二聚而成。
以月桂烯为原料可合成许多种有价值的香料化合物,如月桂烯醇、香叶醇、柑青醛、柑青腈、紫丁香醇以及相关醇类化合物的低级脂肪酸酯。
此外还可用月桂烯合成医药的中间体及聚合物等。
本文就月桂烯的Diels-Alder反应的影响条件进行综述,并且介绍了Diels-Alder反应合成月桂烯类香料的应用。
1Diels-Alder反应合成月桂烯类香料的反应条件进展1.1常规加热月桂烯的Diels-Alder反应通常在加热回流的条件下是可以进行的,但常压加热的条件下,反应时间比较长,产品收率一般。
李秋庭等人研究月桂烯合成柑青醛,温度低于110℃基本不反应,而温度高于140℃又全树脂化,其最适合的工艺条件是130~140℃,常规加热反应时间为1.5h,产率80%。
1.2微波加热1372011.01·李红缨等人利用微波技术快速合成了肉桂酸正丁酯,微波功率462W,微波辐射时间5min,转化率87.4%。
Berlan利用微波辐射技术合成了二氢吡喃衍生物,反应时间为10min,产率为96%,而该反应用常规的加热需6h,产率仅为14%。
由此表明:微波辐射技术作为一种高效的加热技术,若应用到月桂烯的Diels-Alder反应中,可提高其反应的速率和产率。
2Diels-Alder反应合成月桂烯类香料的催化剂进展不同种类的催化剂,其反应的最佳温度、时间、产率均有所不同。
下面对Diels-Alder反应合成月桂烯类香料的催化剂进行综述。
2.1Lewis酸近年来,Lewis酸被用于Diels-Alder反应的催化剂。
尹笃林等人曾用Lewis酸催化月桂烯与丙烯酸甲酯,研究结果表明:选用合适的Lewis酸ZnCl2催化剂使得反应的产率由18.2%提高到61%。
p型异构化体也明显增多,p/m比值由2.0增加到3.6。
Lewis酸性的离子液体催化月桂烯与丙烯醛Diels-Alder反应合成,使得其产率由31.5%提高到69.9%,p型异构化体也明显增多,p/m比值由2.6提高到15。
通常Diels-Alder反应以对位的产物为主,且其产生的香气要比邻位的好,选用合适的Lewis 酸作催化剂能提高此类反应的区域选择性和产率。
但Lewis酸对设备有强腐蚀性,并产生大量的废液。
2.2固体超强酸近年固体超强酸被用作合成香料的催化剂,罗金岳等人曾用固体超强酸SO42-/TiO2-ZrO2催化月桂烯与马来酸酐的Diels-Alder反应,反应4h,月桂烯的转化96.5%,产率为90.7%,产物选择性94.0%。
SO42-/TiO2-ZrO2催化剂可再生重复使用4次左右,这对催化剂的回收利用和资源的可持续利用有着比较深远的影响。
但固体超强酸制备复杂,而且再生重复使用次数相对不多。
2.3大孔树酯大孔树脂作为催化剂合成有机物具有价廉易得、可循环利用、反应温度低与环境友好等优点,能有效催化烷基化、酰化和成环等有机反应,被广泛地应用到香料的合成中。
目前文献报道采用微波-大孔树脂协同催化合成的新工艺合成了7种肉桂酸酯,并优化了工艺条件。
新工艺合成肉桂酸酯的反应速度与传统加热合成法相比反应速度均大幅提高,具有快速、节能和易工业化等优点。
与强酸催化的方法相比,合成肉桂酸正丁酯的反应时间由150min减少为24min,与以NaHSO4作催化剂的一般微波合成工艺相比,新工艺产率提高了9.5%,且醇酸摩尔比由8:1下降为3:1,大大节省了原料。
王桂英等人用大孔树脂作催化剂催化松油醇副产松油烯与马来酸酐反应,产率由34.6%提高到76.2%和纯度由78.3%提高到88.7%。
大孔树脂协同微波催化Diels-Alder反应合成月桂烯类香料在国内外文献中尚未报道。
3Diels-Alder反应合成月桂烯类香料的应用丙烯酸甲酯、丙烯酸乙酯等与月桂烯进行Diels-Alder反应其合成产物一般被称为柑青酸酯。
柑青酸酯作为一种留香时间比较长的香料可以应用到各种高档礼品,特别是高级化妆品或食品的包装材料中,使包装有一种淡雅的木香或花香等香味,起到提高产品档次的作用。
丙烯醛与月桂烯的合成产物称为柑青醛,柑青醛是近年国际上流行的青香型品种之一,具有浓郁的柑桔叶或香草味,表现出强烈的花香、青香、醛香和铃兰香。
大量用于香皂、洗涤剂、香水香精等配方中,其在花香、青香、果香香精中效果甚佳。
丙烯腈与月桂烯的合成产物称为柑青腈,柑青腈具有花香、青香气息,在香料行业中已得到广泛应用。
龙涎香是最有价值的高档香料之一,源于抹香鲸体内的代谢产物。
随着鲸鱼数量的减少和海岸的污染,天然龙涎香已很难获得,多以合成产品代替。
Willem Lenselink等人以月桂烯为原料合成具有龙涎香型的香料,收率达80%,纯度87%。
4展望微波协同树脂催化有机合成具有高效、清洁、环保、耗能低、催化剂可循环利用与环境友好等优点,是符合现代绿色化学的一种新兴技术。
该方法用于Diels-Alder 反应,使其反应速率加快及后处理简单等较好的结果,其主要原因可能有两方面:首先是因为微波加热不同于一般的常规加热方式,后者是由外部热源通过热辐射由表及里的传导式加热,而微波加热是材料在电磁场中由介质损耗而引起的体内加热,这种内加热方式具有加热速度快、加热均匀无梯度和无滞后效应等特点,对于Diels-Alder反应而言,采用微波体加热方式能使反应物快速有效地吸收热能;其次,树脂表面的官能团和内部特有的微孔结构对Diels-Alder反应具有良好的催化作1382011.01·食品工程·T echnique技术用,二者相结合得到更好的催化效果,使得反应速度大大加快。
将来微波协同树脂催化合成方法的发展可能主要有以下几个方面值得注意:(1)微波-树脂催化Diels-Alder反应的机理研究应主要集中于该方法反应过程中微波除快速加热的作用以外是否存在“非热效应”,即微波本身是否可以作为物理催化剂;另外微波与树脂催化Diels-Alder反应中是否具有协同催化效应也是理论研究的关键。
(2)如何调控微波-树脂催化Diels-Alder反应是另一研究热点,目前树脂催化Diels-Alder反应一般反应速度较传统工艺都会有明显提高,但产率则因反应物分子不同而异,这说明反应过程可能存在副反应,如何减少副反应提高产率是其工业化的重要问题。
(3)Diels-Alder反应根据亲双烯化合物上的C=C双键所连接的基团不同,一般反应后都会产生邻位和对位的两种同分异构体的产物,其对位产生的香气要比邻位的好,因此改变反应条件,提高反应的区域选择性对生产更好的香料或者香料中间体有着相当重要的研究意义。
(4)应用微波-树脂催化酯类反应已有一定的研究,但应用微波-树脂催化Diels-Alder反应,目前国内文献尚未有这方面报道,有一定的研究前景。
参考文献[1]Dai M,Sarlah D,Yu M,et al.[J].Am.Chem.Soc.,2007,129:645~657.[2]邹志平,刘六军,陈素文.Diels-Alder反应在松节油半合成香料中的应用[J].林产化工通讯,2002,36(3):35~38.[3]王园园,宋华,孙兴龙,等.微波辐射技术在有机合成中的应用[J].精细石油化工进展,2008,9(8):47~56.[4]Vera N.,Ksenija K.,Slavko K.,et al.Microwave-assisted prepara-tion of naphthenic acid esters[J].J.Serb.Chem.Soc.,2006,71(12):1263~1268.[5]Paula S.K.,Kristiina W..Microwave-assisted synthesis of deuteriumlabeled estrogen fatty acid esters[J].Steroids,2006,71:54~60.[6]Mahajan R.P.,Patil S.L.,Mali R.S..Convenient microwave assistedsynthesis of naturally occuring methyl(E)-cinnamates[J].Organic Pre.and Pro.Inc.,2005,37(3):286~290.[7]罗金岳,王汉忠,彭淑静.β-蒎烯热异构制备月桂烯工艺的研究[J].林产化学与工业,2000,20(3):47~50.[8]范存良,徐佩若,杨忠保,等.由异戊二烯合成月桂烯[J].精细化工,2002,19(3):137~139.[9]Ryoji Noyori.Asymmetric Catalysis:Science and Opportunities(NobelLecture)[R].Angew.Chem.Int.Ed.,2002,41:2008~2022.[10]Kumobayashi Hidenori,Sayo Noboru,Akutagawa Susumu.Industri-al asymmetric synthesis by use of metal-BINAP catalysts[J].Nippon Kagaku Kaishi,1997,12:835~846.[11]李秋庭,陆顺忠.月桂烯合成柑菁醛的研究[J].广西化工,2002,31(1):16~17.[12]李红缨,植中强,杨海贵,等.微波诱导快速合成肉桂酸正丁酯[J].食品与机械,2006,22(6):37~38.[13]Berlan J,Giboreau P.Synthesis of3,5-Dihydroxy Phenyl GlycineDerivatives and the C-terminal Dipetide of Vancomycin[J].Tetra-hedron Lett,1991,32(23):2663~2666.[14]尹笃林,银董红,李熙灿.Lewis酸催化月桂烯与丙烯酸甲酯的Diels-Alder反应研究[J].湖南师范大学:自然科学学报,1992,15(2):139~144.[15]李昌志,银董红,李标模,等.ZnCl2离子液体中高区域选择性合成对位柑菁醛[J].催化学报,2005,26(3):194~198.[16]银董红,尹笃林,李谦和.Lewis酸催化合成柑菁腈的研究[J].湖南师范大学:自然科学学报,1995,18(3):50~54.[17]尹笃林,银董红.高区域选择合成对位柑菁酸甲酯中催化作用机理的研究[J].湖南师范大学:自然科学学报,1993,16(2):136~ 139.[18]罗金岳,安鑫南,雷福厚.固体超强酸SO42-/TiO2-ZrO2催化β-月桂烯与马来酸酐的Diels-Alder反应研究[J].林产化学与工业,2007,27(6):90~94.[19]黎彧,黄利,李善吉,等.微波协同强酸性大孔树脂催化合成肉桂酸正丙酯的研究[J].离子交换与吸附,2008,24(5):467~472.[20]黎彧,黄利,张德志,等.微波-大孔树脂协同催化合成肉桂酸正丁酯的研究[J].日用化学工业,2008,38(1):42~44.[21]王桂英,黄科林,马晓娥,等.松油醇副产松油烯与马来酸酐加成反应条件研究[J].化工生产与技术,2010,17(1):29~32. [22]关永怡,黄志舒,英柏宁.月桂烯的Diels-Alder反应及其在合成香料方面的应用[J].香料、香精、化妆品,1993(3): 1.[23]廖英.从月桂烯合成柑青醛[D].天津大学硕士学位论文,2007.[24]Winter B.Studies related to ambergris-type odorants[J].Pure Ap-pl.chem,1990,69:1377~1380.[25]Lenselink W.Cyclic acetals and ketals and their use in perfumecompositions[P].US252/522,4211674,1980.基金项目:广东省科技计划资助项目(2007B03010300),广东轻院科研启动基金资助课题(KY200921)广东轻院教学改革项目资助课题(JG200904)收稿日期:2010-10-11作者简介:杨铭(1974—),女,广东罗定人,研究生,系办公室主任,讲师/工程师,主要精细有机合成。