(完整版)循环伏安法
- 格式:ppt
- 大小:3.80 MB
- 文档页数:7

循环伏安法原理:循环伏安法(CV)是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63-在电极上还原,反应为:Fe(CN)63-+e-→Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为:Fe(CN)64--e-→Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday定律估算,, 其中m为反应的摩尔量, n为电极反应中的得失电子数,F为图2 氧化还原cv曲线图图1 cv图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。

![《仪器分析实验》(循环伏安法判断电极过程)[详细讲解]](https://uimg.taocdn.com/e2ce933b7275a417866fb84ae45c3b3566ecdd5f.webp)
一、实验目的1、了解电化学工作站的基本构造和使用方法。
2、理解并掌握循环伏安法判断电极过程的原理和方法。
二、实验原理
1、 峰电流方程式:
c
v K i p ⋅⋅=21 c
i p ∝ 21
v i p ∝
2、 可逆性判断?①1≈pc pa
i i ②mV n
pc pa p 56=-=∆ϕϕϕ
三、仪器设备
1、 电化学分析仪:
(LK2005A ,连接到计算
机)。
2、 三电极系统:以铂电极为对电极,Ag|AgCl 电极(或甘汞电极)为参比电极,玻碳电极为工作电极构成三电极系统。
四、实验步骤
1、 电极的预处理。
2、 不同扫描速率下K 3Fe(CN)6溶液的循环伏安图。
3、 不同浓度的K 3Fe(CN)6溶液的循环伏安图。
五、数据处理
循环伏安图
六、思考题
1、为什么要使用三电极系统?
2、循环伏安法如何判断电极过程是否可逆?
附:电化学工作站基本操作
1、打开计算机的电源开关,打开LK2005A电化学工作站主机的电源开关。
2、在WindowsXP操作平台下运行“LK2005A.exe”,进入主界面。
3、方法选择。
4、参数设定。
5、开始实验。
6、保存数据。
7、数据处理。
8、关机。
附:快捷命令
附:三电极系统
目的:减少iR 降
W: 工作电极
R: 参比电极
C: 辅助电极
i : 由W 和C 电路获得 电路获得和由R W w :。

循环伏安法原理及应用小结1 电化学原理1.1 电解池电解池是将电能转化为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
1.2 循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”1.3 经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围-0.25-1V,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安扫描图图2所示CV扫描结果为研究电极上产生的电流随电位变化情况图。
1)横坐标Potential applied(电位)为图1中电压表所测,即Potential applied=P(WE)-P(RE)所有的电位数值都是相对于氢离子的电位值,规定在标准情况下,氢离子的电位为0。
当恒电位仪向工作电极提供负的电位时,其电源连接情况如图1所示,即工作电极与电源的负极相连,作为阴极工作发生还原反应;反之则作为阳极发生氧化反应。

一、循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
1.基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
2.循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
3、循环伏安法的用途(1)、判断电极表面微观反应过程(2)、判断电极反应的可逆性(3)、作为无机制备反应“摸条件”的手段(4)、为有机合成“摸条件”(5)、前置化学反应(CE)的循环伏安特征(6)、后置化学反应(EC)的循环伏安特征(7)、催化反应的循环伏安特征二、循环伏安法相关问题:1、利用循环伏安确定反应是否为可逆反应(一般这两个条件即可)①.氧化峰电流与还原峰电流之比的绝对值等于1.[有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫描速度对峰电位没有影响,但扫描速率越大其电化学反应电流也就越大.]②.氧化峰与还原峰电位差约为59/n mV, n为电子转移量(温度一般是293K).[但是一般我们实验时候不是在这个温度下,因此用这个算是有误差的,一般保证其值在100mv以下都算合理的误差.]2、判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比。





实验12 循环伏安法一、实验目的1.掌握循环伏安法的基本原理和测量技术。
2.通过对-46-36Fe(CN)Fe(CN)体系的循环伏安测量,了解如何根据峰电流、峰电势及峰电势差和扫描速度之间的函数关系来判断电极反应可逆性,以及求算有关的热力学参数和动力学参数。
二、实验原理通过恒电势仪,可使电极电势在一定范围内以恒定的变化速率扫描。
电势扫描讯号如图1a 所示的对称三角波。
电极电势从起始电势i ϕ变化至某一电势r ϕ,再按相同速率从r ϕ变化至i ϕ,如此循环变化,同时记录相应的响应电流,称为“循环伏安扫描法”。
有时也采用单向一次扫描讯号(从i ϕ到r ϕ)而得到单程扫描曲线称为“线性扫描伏安法”。
若电极反应为O +e ⇔R ,反应前溶液中只含有反应粒子O 、且O 、R 在溶液均可溶,控制扫描起始电势从比体系标准平衡电势0平ϕ正得多的起始电势i ϕ处开始作正向电势扫描,电流响应曲线则如图1b 所示。
开始时电极上只有不大的非法拉第电流(双层电容充电电流)通过。
当电极电势逐渐负移到0平ϕ附近时,O 开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O 的浓度必然逐渐下降,因此向电极表面的流量和电流就增加。
当O 的表面浓度下降到近于零,其向表面的物质传递达到一个最大速度,电流也增加到最大值。
即在图中出现峰值电流I pc ,然后由于O 的贫化效应使电流逐渐下降。
当电势达到r ϕ后,又改为反向扫描。
首先是O 的浓度极化进一步发展和还原电流进一步下降。
随着电极电势逐渐变正,电极附近可氧化的R 粒子的浓度较大,在电势接近并通过0平ϕ时,表面上的电化学平衡应当向着越来越有利于生成R 的方向发展。
于是R 开始被氧化,并且电流不断增大直到达到峰值氧化电流I pa ,随后又由于R 的显著消耗而引起电流衰降。
如图1b 所示的整个曲线称为“循环伏安曲线”。
由上可见,循环伏安法实验十分简单,但却能较快地观测到较宽电势范围内发生的电极过程。
循环伏安法实验十一 铁氰化钾在玻碳电极上的氧化还原一、实验目的1、学习循环伏安法测定电极反应参数的基本原理2、熟悉伏安法测定的实验技术3、学习固体电极表面的处理方法二、实验原理循环伏安法(CV)是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
循环伏安法的典型激发信号当工作电极被施加的扫描电压激发时,其上将产生响应电流,以电流对电位作图,称为循环伏安图。
典型的循环伏安图如下:从循环伏安图中可得到几个重要的参数:阳极峰电流(i pa)、阳极峰(E pa )、阴极峰电流( i pc )、阴极峰电位(E pc )扫描电压(V)时间/s对可逆氧化还原电对的式量电位E θ’与E pc 和E pa 的关系为:(1)而两峰之间的电位差值为:(2)对铁氰化钾电对,其反应为单电子过程,ΔE p 是多少?从实验求出来与理论值比较。
对可逆体系的正向峰电流,由Randles –Savcik 方程可表示为:i p = 2.69×105n 3/2AD 1/2υ1/2c (3)其中:i p 为峰电流(A ),n 为电子转移数, A 为电极面积(cm 2), D 为扩散系数(cm 2/s),υ为扫描速度(V / s ), c 为浓度(mol/L)。
根据上式,i p 与υ1/2和c 都是直线关系,对研究电极反应过程具有重要意义。
在可逆电极反应过程中,(4)对一个简单的电极反应过程,式(2)和式(4)是判别电极反应是否可逆体系的重要依据。
三、仪器与试剂仪器 LK2005A 电化学工作站(天津市兰力科公司);三电极系统:玻碳电极为工作电极,Ag/AgCl 电极(或饱和甘汞电极)为参比电极,铂电极为对极(铂丝、铂片、铂柱电极均可);试剂 1.0x10-3mol/L K 3[Fe(CN)6](铁氰化钾)溶液(含0.2mol/L KNO 3)。
四、实验步骤1、选择仪器实验方法:电位扫描技术——循环伏安法。
循环伏安法介绍循环伏安法(Cyclic Voltammetry,简称CV)是一种电化学测试方法,广泛应用于表征电化学反应的动力学、电化学过程的机理和电极材料的性质等方面。
该方法通过不断改变电极电位,并测量对应的电流,来获得电化学反应过程中的电化学信息。
原理循环伏安法基于电化学基础理论和法拉第定律,利用电极材料与电解质溶液之间的电化学反应,在电位范围内,通过施加正向和负向扫描电压,观察电流的变化,得到伏安图。
伏安图表示了电流与电极电位之间的关系,反映了电化学反应的动力学与热力学信息。
实验步骤1.准备工作:清洗电极并将其与计量电位仪连接好。
2.准备电解质溶液:根据实验需求,配置适当浓度的电解质溶液,并使用磁力搅拌器搅拌均匀。
3.实验设置:将电解质溶液注入电解池中,并使电极浸入其中。
根据需要,设置施加电压的扫描范围和扫描速率。
4.实验操作:打开计量电位仪,设置初始电位,并开始扫描。
仪器会逐渐改变电极电位,并记录对应的电流值。
5.数据处理:根据实验结果,绘制伏安图,并分析图形特征。
根据法拉第定律,可以计算电极反应的电荷转移系数、反应速率常数等参数。
应用循环伏安法在电化学和材料科学领域有着广泛的应用。
1.电化学催化研究:循环伏安法可以用于表征电化学催化剂的活性和稳定性,评估催化剂对某种电化学反应的催化效率。
2.电极材料研究:通过循环伏安法可以评估电极材料的电活性表面积、电荷传递速率以及与电解质溶液之间的界面反应。
3.电化学反应动力学研究:利用循环伏安法可以确定电极反应的控制步骤和反应机理,并研究电化学反应速率与温度、扫描速率等因素的关系。
优点和局限循环伏安法具有以下优点:•实验步骤简单,容易操作。
•可以快速获取材料的电活性表面积等信息。
•可以在不同电位下观察电化学反应的动力学与热力学变化。
然而,循环伏安法也存在一些局限性:•无法直接获得电化学反应的反应速率常数等定量信息。
•实验数据分析较为复杂,需要依赖理论模型和数学计算。
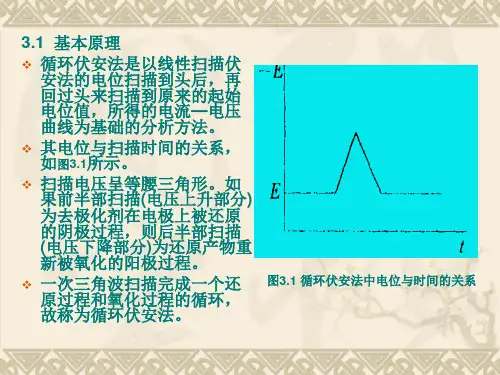
循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为 图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。