化工热力学复习提纲
- 格式:ppt
- 大小:1.67 MB
- 文档页数:27

一、考试的总体要求1. 考察考生是否总体上掌握化工热力学2. 考察考生对化工热力学重点内容掌握深度,同时考察能不能利用化工热力学知识3. 在经典热力学与分子热力学中,重点在前者,但也要求考生对分子热力学有定性的了解。
相应的,在计算模型上,不要求死背公式,但要求理解模型出发点及计算范围、适用性二、考试内容及比例1. 分子间作用力及位能函数2. 液体的PVT关系3. 温度和压力对热力学函数的影响4. 逸度与活度,活度系数关联式5. 相平衡基本关系,汽液平衡,活度系数法及状态方程法6. 气液平衡,液液平衡,固液平衡,超临界萃取平衡的特点7. 热化学与化学平衡8. 工程热力学初步(压缩及冷凝)9. 环境热力学初步10. 化工数据初步其中2~6约占75%,1、7~10约占25%。
三、考试题型及比例1. 小概念及解释题约20分2. 证明题及推演题约20分3. 讨论题及计算题约35分4. 综合讨论题约25分在以上题中,大部都可选做,即可在若干题中选择几个做。
四、考试形式及时间笔试,3小时。
五、主要参考书目1. 马沛生等. 化工热力学(通用型),北京,化学工业出版社,20052. Prausnitz J M, et al. Molecular thermodynamics of Fluid Phase Equilibria, 3rd. ed, Prentice Hall, 19993. 胡英. 流体的分子热力学,北京,高等教育出版社,19824. Smith J M, et al. Introduction to Chemical Engineering Thermodynamics, 7th ed, McGraw-Hill, 2004。

化工热力学”课程,学习重点及要求(2009年11 月12 日)第二章流体的pVT关系(1)理解气体的非理想性,掌握状态方程的基本选择方法(2)掌握截项virial方程、立方型方程、普遍化关联式的使用(3)熟悉状态方程的混合规则(基本类型)与交互作用参数的使用(简化原则与获得方法),掌握混合物pVT关系的原则求解方法(4)熟悉状态方程的基本选择方法(5)掌握饱和液体体积的计算方法(6)理解学习流体的pVT关系的应用意义第三章流体的热力学性质:焓和熵(1)了解单组分流体的热力学基本关系(2)熟悉Bridgeman表的使用(3)熟悉蒸汽压方程,掌握蒸汽压的计算(4)掌握剩余性质的计算,单组分流体的焓变与熵变的计算(5)掌握水蒸汽表、热力学性质图的使用(6)了解多组分流体的热力学基本关系(7)理解多组分流体的非理想性,掌握混合物与溶液的概念区别(8)掌握理想混合物的概念,熟悉混合性质的基本关系(9)熟悉偏摩尔性质及其与混合物性质关系的分析与计算(10)掌握多组分流体的焓变与熵变的计算第四章能量利用过程与循环(1)掌握系统能量平衡方程的表述方法(2)掌握气体压缩过程与膨胀过程在T-S图和lnp-H图上的分析与计算,以及功量计算方法(3)熟悉简单蒸汽动力循环(Rankine cycle)在T-S图和Inp-H图上的分析与计算(4)熟悉简单蒸汽压缩制冷循环在T-S图和Inp-H图上的分析与计算(5)了解热泵的概念与基本原理2(6)了解深度冷冻与液化的基本原理第五章过程热力学分析(1)了解熵产生以及能量质量不守衡定理(2)熟悉函数的概念,熟悉环境基准态的概念。
(3)了解热量、物质标准、稳定流动体系函数的原则求解方法(4)掌握损失的概念、系统铝平衡方程的表述方法(5)熟悉效率(6)了解分析的基本方法第六章流体的热力学性质:逸度与活度(1)了解多组分流体热力学性质标准态的规定(2)掌握气体和液体纯组分逸度的计算,多组分体系中的组分逸度的计算(3)熟悉超额性质及其与活度系数的关系(4)了解用活度计算混合焓(5)熟悉溶解度参数模型、van larr模型、Margulars模型和Wilson模型的使用(包括模型参数的获取)以及活度系数模型的基本选择方法第七章流体相平衡(1)了解二元体系VLE与LLE相图(2)掌握VLE关系的基本模型(3)掌握VLE问题的计算(4)了解VLE数据的热力学一致性检验方法;(5)了解共沸现象的判别方法(6)了解LLE关系的基本模型第八章化学平衡( 1 )熟悉平衡组成的反应进度表示方法(2)了解反应体系的独立反应数的确定方法(3)掌握化学平衡关系的基本模型(4)掌握均相气相反应计算方法(5)了解液体混合物反应、溶液反应和非均相反应平衡的计算方法3总结提纲第二章流体的pVT关系(1)概念:理解气体,非理想性(相关特性的描述参数:偏心因子、偶极距),状态方程,虚拟临界性质,流体的pVT关系的图形表示(p-V图,T-p图等)(2)原理:对比态原理(3)方法:截项virial方程、RK方程、L-K方程等EOS的选择与计算;混合规则(基本类型)与交互作用参数的使用(简化原则与获得方法);混合物pVT关系的原则求解方法(4)其它:流体的pVT关系的应用意义第三章流体的热力学性质:焓和熵(1)概念:蒸汽压方程;剩余性质;混合物与溶液的概念区别;理想混合物;混合性质;偏摩尔性质;无限稀释偏摩尔性质;热力学性质的标准态规定(2)原理:偏摩尔性质加成关系、Gibbs-Duham方程等(3)方法:熟悉Bridgeman表的使用;蒸汽压、气化焓的计算;单组分流体的焓变与熵变的计算;水蒸汽表、热力学性质图(T-S图、lnp-H图、焓浓图等)的使用;偏摩尔性质与多组分流体性质的3个关系分析(包括结合标准态的分析);利用偏摩尔性质、混合性质计算多组分流体的焓变与熵变(4)其它:获得混合性质的方法第四章能量利用过程与循环(1)概念:流动体系的能量数量与焓(2)原理:能量数量守衡定理(焓守衡定理)(3)方法:稳流系能量平衡分析(包括对象系统的界定和系统边界的能流评价等);气体压缩过程与膨胀过程的数值分析与在T-S图和Inp-H图上的分析和计算,包括膨胀过程的温度效应分析以及功量计算方法;简单蒸汽动力循环(Rankine cycle)的在T-S 图和ln»H图上的分析与计算;简单蒸汽压缩制冷循环在T-S图和Inp-H图上的分析与计算(4)其它:第五章过程热力学分析4(1)概念:熵产生;流动体系的能量质量与勺;勺损失(2)原理:能量质量不守衡定理(〒不守衡定理)(3)方法:稳流系2平衡分析(包括对象系统的界定和系统边界的2流、内部损失的评价等);热量〒的计算;物质标准铝的计算;流体勺的计算;〒效率与〒损失率;〒分析的基本方法(4)其它:第六章流体的热力学性质:逸度与活度(1)概念:逸度(逸度系数);活度(活度系数);理想混合物与Lewis/Ra ndall 规则;逸度与活度的标准态规定;超额性质(2)原理:基于逸度或活度的多组分流体偏摩尔Gibbs函数的模型化(3)方法:逸度的计算(气体纯组分逸度的计算,液体纯组分逸度的计算,多组分体系中的组分逸度的计算);用活度计算混合焓;超额性质及其与活度系数的互推关系;溶解度参数模型、van larr模型、Margulars模型和Wilson模型等ACM的选择与活度系数的计算(包括模型参数的获取)(4)其它:第七章流体相平衡(1)概念:二元体系VLE与LLE相图;VLE条件(2)原理:等温等压条件下,基于Gibbs函数变的零判据所建立的VLE模型( 3) 方法:VLE 模型建立(逸度系数模型,逸度系数与活度系数组合模型,标准态的选择,VLE模型的应用选择与简化等);根据VLE问题(5种典型问题)建立原则求解程序;LLE问题的模型化及原则求解;熟悉共沸现象的判别( 4) 其它:第八章化学平衡( 1 ) 概念:反应进度;化学平衡条件;平衡常数(2)原理:等温等压条件下,基于Gibbs函数变的零判据所建立的化学平衡模型( 3) 方法:反应体系的独立反应数的确定;化学平衡模型建立(逸度系数与活度系数在模型中的运用,标准态的选择,化学平衡模型的应用选择与简化等);根据化学平衡问题建立原则求解程序。

化工热力学复习提纲-2010化工热力学复习提纲第二章1.临界点含义及表达式(2-1,2-2)2.立方型方程、普遍化Virial方程(第二、三Virial截断式)的叠代求解摩尔体积、压缩因子(例题2-1);Virial方程B值的普遍化计算(2-39,2-40)。
3.偏心因子定义及表达式,三参数对应态原理。
(2-37),(2-36)4.理想气体模型:(!)理想气体过程变化,如ΔU,ΔH,ΔS,ΔV,Q,W等(2-71,2-72)(2)理想气体通过节流阀过程变化,ΔU,ΔH,ΔS,ΔT 等5.纯物质的P-T,P-V相图(如过热蒸汽、过冷液体)(P5)6.焓、熵的计算式及应用(2-62,2-63),剩余性质的定义;设计计算气体的ΔH,ΔS的状态变化框图(图2-13)。
7. 纯液体ΔH的计算(由等压热容计算)(例题2-10)8. 纯物质逸度及逸度系数的定义,Virial方程第二截断式计算纯物质的逸度系数(2-117)9.纯液体的逸度计算式含义及Virial方程第二截断式计算纯液体的逸度(2-121,及例题2-12)。
第三章1.二元混合物,第二virial系数Bm展开式(3-6)2.偏摩尔性质的定义式及性质(3-22,3-25,3-27),Gibbs-Duhem公式(3-32)3.偏摩尔性质计算(参考例题3-4), 二元溶液偏摩尔体积的计算4.混合物组分逸度、逸度系数的定义式(3-44,3-45,3-46)、组分逸度与混合物逸度、组分逸度系数与混合物逸度系数的关系式(3-51,3-52)。
5. Lewis-Randll规则、Henry定律的适用范围6. 超额性质与混合性质变化的定义及其关系(3-33,3-37,3-83,3-87~3-91)7. 超额吉布斯自由焓与活度系数的关系式及其推导(3-86,3-94)。
8. 理想溶液概念及其混合性质变化(3-64,3-66~3-74)9.由混合物的状态方程推导组分逸度及逸度系数第五章1.封闭体系及稳态流动体系的能量平衡方程表达式及计算(5-4,5-6)2.熵增原理及稳态流动体系的熵平衡式,熵变、熵产与过程可逆性的判断(5-36)3.封闭体系及稳态流动体系的理想功的表达式及计算(换热过程)((5-41,5-44)4.恒温和变温过程热有效能的计算(5-54,5-53)5.稳流体系有效能恒算方程及有效能效率表达式(5-73,5-69)第四章1.相率(自由度)2.汽液平衡关系式及适用范围(表4-1)3.由1111γx P Py s =计算?G 和G E ,由活度系数模型计算参数及活度系数,如Van Laar 活度系数公式(3-103)。

1、化工热力学的研究方法:宏观研究方法 微观研究方法。
2、热力学体系:孤立体系(无物质无能量) 封闭体系(无物质 有能量) 敞开体系(有物质 有能量)。
3、体系 环境:在热力学分析中,将研究中涉及的一部分物质(或空间)从其余物质(或空间)中划分出来。
其划分出来部分称为体系,其余部分称为环境。
4、状态函数:描述体系所处状态的宏观物理量成为热力学变量(状态函数)。
常用的状态函数有压力、温度、比容、内能、焓、熵、自由焓等。
5、循环:体系经过一系列的状态变化过程后,最后由回到最初状态,则整个的变化称为循环。
分为正向循环和逆向循环。
6、临界点:气化线的另一个端点是临界点C ,它表示气液两相能共存的最高压力和温度,即临界压力c p 和临界温度c T 。
7、临界点的数学表达式:临界等温线在临界点上的斜率和曲率都等于零。
数学上表示为0=⎪⎭⎫ ⎝⎛∂∂=cT T V p (2-1) 022=⎪⎪⎭⎫ ⎝⎛∂∂=c T T V p (2-2)8、直线直径定律:当以饱和液体和饱和蒸气密度的算术平均值对温度作图时,得一近似的直线。
9、纯物质的p-V-T 图:P 5 10、理想气体状态方程:RT pV = (2-4)式中,p 为气体压力;V 为气体摩尔体积;T 为绝对温度;R 为通用气体常数 8.314J/(mol ·K)11、范德华方程(van der Waals 方程): 2Va b V RT p --= (2-5) 其中c c p T R a 642722=;cp RT b 8=。
12、R-K 方程: )(5.0b V V T a b V RT p +--= (2-6) 其中c c p T R a /42748.05.22=;c c p RT b /08664.0=。
13、维里方程(Virial 方程):++++==321VD V C V B RT pV Z (2-26) 或者 ++++==32'''1p D p C p B RT pV Z (2-27) 式中, 、、、)'()'()'(D D C C B B 分别称为第二、第三、第四、 Virial 系数。


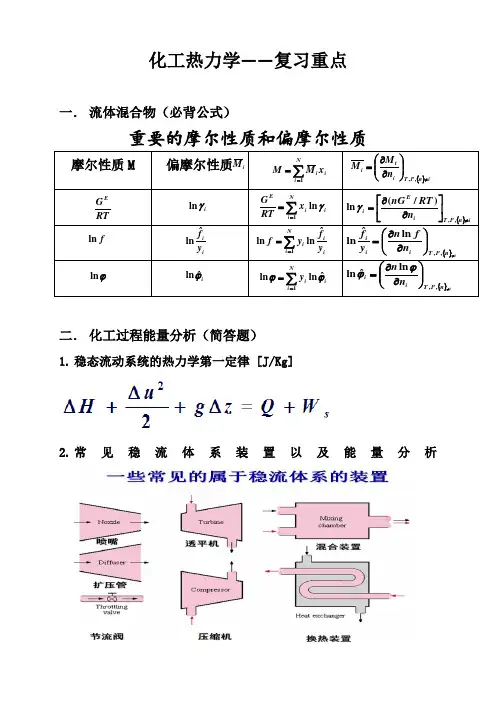
化工热力学——复习重点一. 流体混合物(必背公式)重要的摩尔性质和偏摩尔性质摩尔性质M偏摩尔性质二. 化工过程能量分析(简答题)1. 稳态流动系统的热力学第一定律 [J/Kg]2. 常见稳流体系装置以及能量分析i M ∑==Ni ii x M M 1{}in P T i ti nM M ≠⎪⎪⎭⎫ ⎝⎛∂∂=,,RTG Ei γln ∑==Ni i i Ex RT G 1ln γ{}in P T i E i n RT nG ≠⎥⎦⎤⎢⎣⎡∂∂=,,)/(ln γf ln iiy f ˆln ∑==Ni i ii y fy f 1ˆln ln {}in P T i i i n f n y f≠⎪⎪⎭⎫ ⎝⎛∂∂=,,ln ˆln ϕln iϕˆln ∑==Ni i i y 1ˆln ln ϕϕ{}in P T i i n n ≠⎪⎪⎭⎫⎝⎛∂∂=,,ln ˆln ϕϕ三.蒸汽动力循环与制冷循环(简答题)1.蒸汽动力循环能量分析(Energy Analysis)Turbine汽轮机:1 –2表示过热蒸汽在汽轮机中的可逆绝热膨胀过程,对外所做轴功可由膨胀前后水蒸汽的焓值求出。
Condensor冷凝器:2 –3表示乏汽在冷凝器中的等温等压冷凝过程,放出的热量。
Pump水泵:3 –4表示冷凝水通过水泵由P3升压至P4的可逆绝热压缩过程,需要消耗的轴功。
把水看作是不可压缩流体,则Boiler锅炉:4 –1表示液体水在锅炉中被等压加热汽化成为过热蒸汽的过程。
工质在锅炉中吸收的热量。
2.制冷循环(单级制冷循环)能量分析(Energy Analysis) 1-2可逆绝热压缩过程:W s = H2-H1 kJ/kg2-4等压冷却、冷凝过程:q2 = H4 - H2 kJ/kg4-5节流膨胀过程:H5 = H45-1等压、等温蒸发过程:q0 = H1-H5 kJ/kg。

化工热力学总复习一.绪论1.化工热力学的研究内容:①测量关联与推算不同条件下物质的平衡性质熵焓,温度压强(纯物质),组成(混合物)②能量的计算建立在热力学第一,第二定律基础上③单元操作相应的相平衡组分逸度④物性及热力学性质状态方程2.热力学的研究方法:①微观热力学(统计热力学)②宏观热力学(经典热力学)研究体系达到平衡时的热力学性质,物系从一个状态到另一状态中间的变化。
无法研究速率问题二.流体的P-V-T关系1.几个概念①状态方程:描述流体P-V-T关系的函数式f(P.V.T)=0 称为状态方程②临界点:表示气液两相能共存的最高压力和温度的汽化线的另一个端点,称为临界点③超临界流体:高于临界压力和温度的区域内的流体车称为超临界流体(既不同于液体,又不同于气体,它的密度可以接近液体,但具有类似气体的体积可变性和传递性质。
可作为特殊的萃取溶剂和反应介质)2..状态方程的比较①.Van der Waals 方程:可用于气液两相,但是精度不高,实际应用较少。
常数随物质而异,由临界参数计算而得②.RK方程:适用于非极性和弱极性化合物,对多数强极性化合物的计算偏差较大。
能较成功的应用于气相,但对液相效果较差,不能用于气液相平衡的计算。
常数于流体特性有关,可由物质的临界参数计算③.SRK方程:计算精度比RK方程高,用于气液相平衡计算时精度较高,工程上应用广泛。
方程常数b与RK方程一致,但认为a不再是常数而是温度的函数④.PR方程:从SRK方程改进而来,精度更高,也是气液平衡工程计算的常用方程,预测液体摩尔体积的准确度较SRK明显提高。
方程参数利用纯物质的临界参数和偏心因子计算⑤.Virial方程:用于液相计算误差较大,不能用于气液相平衡计算。
其系数仅是温度的函数。
一般用普遍化方法估算。
目前尚未全部解决维里系数的数值⑥.M-H方程:方程准确度高,适用范围广,能用于包括非极性至强极性的化合物。
方程常数只需使用纯物质的临界参数及一点蒸汽压数据便可求得,是能从较少输入信息便可获得多种热力学性质的最优秀的状态方程之一3.Virial方程与virial系数①.从什么角度导出的维里方程?分子之间相互作用的受力②.维里方程为什么是纯理论方程?维里方程系用统计力学的方法推导而来,故而具有坚实的理论基础③.维里系数的确切的物理意义:第二维里系数是考虑到两个分子碰撞或相互作用导致的与理想行为的偏差,第三则是反映了三个分子碰撞所导致的非理想行为④.为什么维里方程可以截断?∵维里方程是无穷级数的形式,而实际应用时由于维里系数数据的缺乏,常使用近似成立的舍项形式,而多分子相互作用的概率很低,对Z的贡献逐项减小,∴可以截断⑤.什么时候截断误差大?什么时候使用二项截断式?压力越高,多分子碰撞的几率越大,引起的误差也越大;通常中,低压时取二项截断式⑥.维里系数取决于什么?对于一定物质而言,纯物质中维里系数仅取决于温度(混合物中取决于温度和各相组成)4.对比态原理及其应用①.对比态原理的对比态参数是什么意思?②.对比态有几个参数?哪几个?有三个;是对比温度Tr,对比压力Pr,和偏心因子ω③.偏心因子的概念?任一流体在Tr=0.7处的纵坐标lgP rS值与氩氪氙在同一条件下的lgPrS的差值④.什么时候ω=0?当流体是简单流体时,ω=0⑤.什么是简单流体?是惰性气体系球形分子的流体是简单流体5普遍化状态方程(由对比态原理推出的方程)①.状态方程的三个参数Tr Pr Vr②.两种普遍化计算方法维里系数法,普遍化压缩因子法③.Z0 Z1是谁的函数?是Pr ,Tr的复杂函数6.真实气体混合物的P-V-T关系①.混合物的P-V-T关系的状态方程的基本思路:利用纯物质的状态方程,推广应用到混合物,将A B等常数用混合物的常数代入(利用混合规则,即纯物质的性质及其组成来转化)②.混合维里系数中交叉项维里系数为什么会存在?不同的分子之间相互作用的影响③.维里系数下标的意义:B11,B22:纯物质的第二维里系数B12=B21:交叉第二维里系数,反映不同组分分子1,2之间的相互作用④.给出Σ公式进行展开,合并:B=ΣiΣjYiYjBij=y1y1B11+y1y2B12+y2y1B21+y2y2B227.液体的P-V-T性质①. 了解两个名词:修正的Rackett方程三.纯流体的热力学性质1.热力学性质间的关系①.两个概念:体积膨胀系数β等温压缩系数k②.剩余性质的定义:气体在真实状态下的热力学性质在同一温度,压力下当气体处于理想状态下热力学性质之间的差额③.计算剩余性质的目的:为了计算实际流体的热力学性质2.气体热力学性质的普遍化关系法①.计算剩余性质使用普遍化法时,把剩余性质变成谁的函数?Tr Pr Z PV=ZRT [Z:普遍化压缩因子]3.逸度和逸度系数①.为什么要引入逸度?为了修正什么?为了便于表达真实气体的自由焓,为了表征体系的逃逸趋势;为了修正压力②.什么是逸度系数?什么时候逸度系数=1?逸度系数是物质的逸度与其压力之比;[低压]理想气体时φi=1③.逸度系数的计算普遍化方法-----三参数(P V T)4.液体的逸度①.液体的逸度怎么定义?②.怎么计算液体逸度?通过液体饱和蒸汽压进行两次修正③.什么是Poynting因子?什么时候需要它?指数校正项称为Poynting因子;在高压下需要四.流体混合物的热力学性质1.化学位和偏摩尔性质①.偏摩尔体积的下标:(T,P,Nj) 混合后的偏摩尔体积与组成有关②.M Mi Mi 与Mt的名称③.摩尔与偏摩尔体积&性质之间的关系:M=Σ(XiMi)2.Gibbs-Duhem 方程x1dM1+x2dM2=0 从一个组分的偏摩尔性质推算另一个组分①.Gibbs-Duhem方程表示了谁与谁的关系:混合物性质M与混合物中各组分的偏摩尔性质Mi之间的依赖关系3.混合物的逸度和逸度系数①.两个区别:混合物的逸度-----混合物总压的修正混合物的组分逸度------对分压的修正②.混合物的组分逸度的定义:通过给出纯物质的逸度公式改写4.理想溶液和标准态①.什么是理想溶液?组成结构相似(同系物)②.如何计算理想溶液的逸度?(为了考试方便) Lewis-Randall定则5.活度与活度系数①.二者用来修正什么?用来修正摩尔浓度②.运用活度与活度系数可以说明什么?可以说明理想溶液(与真实溶液的区别?)6.超额性质①.超额性质的概念在相同的温度,压力和组成条件下真实溶液和理想溶液性质之差②.为什么只讲超额自由焓? ∵超额自由焓与活度系数一一对应③.引入超额性质的目的?为了计算活度系数④.超额自由焓的建模中为什么取消了压强?∵其研究对象是非理想液体溶液,而压强对液体的作用影响小,故而忽略了。



《化工热力学》课程综合复习资料一、乙腈(1)和乙醛(2)在87.0kPa ,80℃时混合形成等分子蒸汽混合物,已知B 11= - 2.619m 3/kmol ,B 22=- 0.633m 3/kmol ,δ12= - 4.060m 3/kmol 。
请计算混合物中组分1和2的逸度1ˆf 和2ˆf 。
解:由附录2查得,乙腈(1)和乙醛(2)的T c , p c ,按Kay 氏混合规则计算混合物的临界参数,即可得出T rp , p rp 的值, 查图2-14可知数据点位于曲线之上,故可采用普遍化第二维里系数法计算。
(也可以不判断使用范围))(ˆln 1222111δφy B RTp +==-0.1077 )(ˆln 1221222δφy B RTp +==-0.0488 ∴ 8979.0ˆ1=φ 9523.0ˆ2=φ 混合物中组分逸度为:kPa p y f 06.39ˆˆ111==φkPa p y f 43.41ˆˆ222==φ二、甲醇(1)和甲乙酮(2)在337.3K 和1.013×105Pa 下形成恒沸物,其恒沸组成x 1为0.842,并已知在337.3K 时甲醇和甲乙酮的饱和蒸气压分别为Pa p s 4110826.9⨯=,Pa p s 4210078.6⨯=。
如气相可视为理想气体,液相服从Van Laar 方程。
试计算(1) Van Laar 方程的方程参数。
(2)由纯组分混合形成1 mol 该溶液的ΔG 值。
解:(1) 由于汽相可视为理想气体,而液相为非理想溶液∴ s i i i i p x p y γ= 对恒沸点 s i i p p /=γ031.126.983.10111===s p p γ667.178.603.10122===s p p γ 计算Van Laar 方程的参数524.0ln ln 1ln 21122112=⎪⎪⎭⎫ ⎝⎛+='γγγx x A888.0ln ln 1ln 22211221=⎪⎪⎭⎫ ⎝⎛+='γγγx x A(2) 由纯组分混合形成1 mol 该溶液的ΔG 值: []111222()ln()ln()ln()i i i i i i G x G G RT x x RT x x x x γγγ∆=-==+∑∑= -925.1 J/mol三、在某T , p 下,测得某二元体系的活度系数值可用下列方程表示:122ln (20.5) x x γ=+,211ln (20.5) x x γ=+,i γ为基于Lewis -Randall 规则标准状态下的活度系数。
第一章绪论○ 什么是化工热力学?研究方法,内容是什么?与化工的关系是什么?第二章纯流体的PVT关系○ 通过纯物质的p –V –T 图、p –V 图和p –T 图,了解纯物质的p –V –T 关系。
○ 掌握维里方程的几种形式及维里系数的物理意义。
○ 熟练运用二阶舍项的维里方程进行pVT 计算。
○ 理解立方型状态方程的普遍特点。
○ 重点掌握RK 方程一般形式和迭代形式的使用。
熟练运用RK 方程进行气体的pV T计算。
○ 掌握RKS 和PR 方程。
并能运用RKS 和PR 方程进行纯流体的pVT 计算。
○ 掌握偏心因子的概念。
○ 理解对比态原理的基本概念和简单对比态原理。
○ 熟练掌握三参数的对应状态原理和压缩因子图的使用。
○ 熟练运用普遍化状态方程式解决实际流体的pVT 计算。
第三章单组份流体的热力学性质○ 熟练掌握热力学性质之间的关系。
并能运用热力学基本方程和麦克斯韦关系式进行各种变量的推导。
○ 掌握焓变与熵变的计算方法。
○ 熟练运用状态方程和普遍化关联式计算熵变焓变。
○ 熟悉蒸发焓与蒸发熵。
○ 学会使用热力学性质图表进行纯物质的热力学性质计算。
○ 掌握气体和液体纯组分逸度的计算,多组分体系中的组分逸度的计算。
第4章流体混合物的热力学性质○ 掌握偏摩尔量的概念。
○ 掌握偏摩尔量的计算。
○ 熟练掌握变组分系统的热力学关系式。
○ 掌握Gibbs-Duhem 方程及其应用。
○ 熟悉混合过程性质变化和计算方法。
○ 熟练掌握真实气体理想混合物中组元的逸度、真实气体混合物中组元的逸度、液体混合物中组元的逸度及其逸度系数的定义及其他们的计算。
○ 熟悉纯液体和纯固体的活度。
○ 掌握液体混合物中组元的活度、活度系数的概念和计算方法。
○ 熟练掌握超额性质的概念及其相关计算。
○ 熟悉液体混合物中组元活度系数的测定,了解溶液中溶剂和溶质的活度及其活度系数的测定。
○ 了解活度系数方程,斯格恰-希尔勃兰德方程、弗洛瑞-哈金斯方程、Redlish-Kister经验式、沃尔型方程。
《化工热力学》综合复习资料第2章 流体的p-V-T 关系一、试用Pitzer 三参数普遍化方法计算水蒸汽在107.9×105Pa 、593K 下的比容。
第3章 流体的热力学性质一、丙烷气体的始态为1.013×105Pa 、400K(可以视为理想气体),终态为3.013×105Pa 、500K 。
已知丙烷在理想气体状态下的摩尔热容为:T C ig p 1775.099.22+= (J/mol.K)试采用三参数普遍化关系式计算始态至终态的焓变与熵变。
二、用三参数普遍化方法计算1kmol 的1,3-丁二烯,从25atm 及130℃压缩至125atm 和280℃时的ΔH 、ΔS 、ΔU 和ΔV 。
已知理想气体状态下的定压热容(cal/mol.K)与温度(K)的函数关系为: 26310649.1710224.53432.5T T C ig p--⨯-⨯+=第5章 化工过程的能量分析一、1.57MPa 、484℃的过热水蒸气推动透平作功,并在0.0687MPa 下排出。
此透平既不绝热也不可逆,输出的轴功相当于可逆绝热膨胀功的85%。
由于隔热不好,每kg 的蒸汽有7.12kJ 的热量散失于20℃的环境中。
求此过程的理想功、损失功及热力学效率。
二、某炼厂有一台蒸汽透平,已知水蒸汽入口的温度为440℃,压力为40×105Pa ,流率为4000kg/h ,蒸汽排出的压力为7.0×105Pa 。
(1) 假定透平绝热可逆操作,试计算透平的功率;(2) 若透平绝热操作,输出的轴功等于绝热可逆轴功的82.65%。
则蒸汽的出口温度为多少?并计算过程的有效能(火用 )损失。
三、有一逆流式换热器,利用废气加热空气,空气由0.1MPa ,293K 被加热到398K ,空气流量为1.5kg.s –1;而废气从0.13MPa 、523K 冷却到368K 。
空气的等压热容为1.04kJ.kg –1.K –1,而废气的等压热容为0.84 kJ.kg –1.K –1,假定空气与废气通过换热器的压力与动能变化可忽略不计,而且换热器与环境无热量交换,环境状态为0.1MPa 、293K 。
1 绪论
热力学的分支、经典热力学、热力学研究方法、研究内容三要素
2 流体的pvt 关系
1超临界流体
2状态方程分为立方型和多参数状态方程
3普压法和普维法的基本式子(2-46,2-50,2-51,2-52)
4混合物PVT 关系中的虚拟临界参数法和Kay 规则应用的是对比态原理
3 纯流体的热力学性质
1四大微分方程、麦克斯韦关系式
2点函数、循环关系式、倒易规则
111P
T V
V V T V V P P T ∂β∂∂κ∂∂γ∂βκγ
⎛⎫=
⎪⎝⎭⎛⎫=- ⎪⎝⎭⎛⎫= ⎪⎝⎭=-体积(热)膨胀系数等温压缩系数热压力系数 3剩余性质:提出的意义、定义、普遍化方法计算(3-59—3-64,2-52) 4绝对H 的计算(讲义)
4 流体混合物的热力学性质
1 四个化学位,注意与偏摩尔性质的区别,逃逸倾向和变化的推动力
2 偏摩尔性质提出的原因、定义、三要素、实质、组分混合形成溶液体积变化情况、溶液摩尔性质M 和偏摩尔性质间的计算,G —D 方程
3 三种不同逸度的定义式、物理意义、混合物与各组分逸度、逸度系数的关系式
4 理想溶液模型、标准态逸度(如何选择标准态)、特征
5 活度和活度系数定义、正负偏差溶液与活度系数的关系
6 △M 的定义、混合自由焓的变化、理想溶液混合性质
7 超额性质的定义、超额性质与混合性质的关系、超额自由焓
8 正规溶液和无热溶液
例题4-1,4-2,4-6,4-7,4-11。
化工热力学一、重点1、临界点定义及表达式:维持气液平衡的最高温度和压力点。
c0T T p V、220cT T pV。
2、Virial 方程体积表达式:231pV B C D Z RT VVV压力表达式:231pV ZB pC pD pRT3、偏心因子的定义及表达式:各种物质在0.7rT 时,纯态流体对比蒸汽压对数值与Ar ,Kr ,Xe 的值的偏差,即0.7lg 1.00r s rT p。
物理意义:偏心因子表征物质的偏心度,即非球型分子偏离球对称的程度。
4、普遍化Virial 系数1c c Bp BBRT 011r r rrp p ZBB T T 01.614.20.4220.0830.1720.139rrB TBT 普遍化Virial 系数与普遍化压缩因子适用范围5、Prausnitz 混合规则0.5311331222cij ci cjijci cj cijcij cizjcijcij cij cijcijijT T T k V V V Z Z Z p Z RT V 6、熵的表达式的推导第一dS 方程当,SS T V 时,则有VTS S dSdTdVT V因VVVVQ T d S S C TT TT得V VC S TT 又TVS pVT 所以VVdT p dS C dVTT积分得到ln T V V T V Vp S S SC d TdVT第二dS 方程当,SS T p 时,则有pTS S dSdTdpTp因p pC S TTpTS V pT所以p pdT V dS C dpTT积分得到0ln T p p T p pV S S SC d TdpT第三dS 方程当,SS p V 时,则有pVS S dSdpdVpV因为V VVVVC S T S T p p T p T p p p p p C S T S T V V TV Tp V pV C C T T dSdpdVTpTV积分得到p V p V p V pVC C T T S S dpdVTpTV7、焓的表达式推导利用刚刚导出的三个dS 方程来得到三个dH 方程。