位置、结构和性质的关系
- 格式:doc
- 大小:28.50 KB
- 文档页数:2

化学物质的分子结构与性质关系化学是一门研究物质变化的科学,而物质的性质往往与其分子结构密切相关。
分子结构决定了物质的性质,不同的分子结构会导致不同的化学行为和性质表现。
本文将探讨化学物质的分子结构与性质之间的关系,并通过分子结构与性质的实例来加以说明。
一、分子结构对物质性质的影响分子结构是指化学物质中原子的排列方式和相互之间的连接方式。
在分子结构中,原子之间通过化学键连接在一起。
分子结构决定了物质的物理性质、化学性质以及一些特殊的性质表现。
1.1 物理性质物理性质是指在不改变物质的化学组成的情况下,可以通过外部条件改变的性质。
例如,分子的大小、形状以及分子之间的相互作用力会影响物质的密度、熔点、沸点等物理性质。
以水分子为例,它由一个氧原子和两个氢原子组成。
水分子呈V字型,氧原子与两个氢原子之间通过共价键连接。
这种分子结构使水分子带有极性,使得水分子之间产生氢键作用。
这种氢键作用导致水分子在室温下存在液态状态,同时具有相对较高的沸点和熔点,以及较大的表面张力。
1.2 化学性质化学性质是指物质在化学反应中表现出来的性质,包括与其他物质发生反应的性质。
分子结构直接影响着物质的化学反应途径、速率和产物。
以有机物甲烷为例,甲烷由一个碳原子和四个氢原子组成。
碳原子与四个氢原子之间通过共价键连接,形成平面结构。
这种分子结构使甲烷分子稳定,不容易发生化学反应。
甲烷可以参与氧气的燃烧反应,但是由于分子结构的稳定性,反应速率较慢。
1.3 特殊性质表现分子结构还可以导致一些特殊的性质表现。
例如,某些分子结构的物质具有发光性质、超导性质、磁性等等。
以蓝宝石为例,它是一种含有铝、氧和硅的酸性韧玉。
蓝宝石中的铝原子与氧原子和硅原子通过共价键连接在一起,形成了特殊的晶格结构。
这种晶格结构使得蓝宝石具有特殊的光学性质,可以发出蓝色的光。
这种发光性质使得蓝宝石在珠宝行业中有着重要的地位。
二、实例说明为了更好地理解分子结构与性质之间的关系,下面分别以水分子和乙醇分子为例加以说明。


物质的性质与结构物质是构成宇宙万物的基本单位,而它的性质和结构决定了物质在自然界中的表现和相互作用。
本文将介绍物质的性质和结构之间的关系,从宏观和微观两个方面探讨其本质和特点。
一、物质的性质物质的性质是指物质在特定条件下表现出来的特性和行为。
它包括物质的物理性质和化学性质两个方面。
1. 物理性质物理性质是物质不改变物质本身组成的情况下所具有的性质。
它包括颜色、形状、大小、质量、密度、热胀冷缩等。
这些性质是可以通过观察和测量来得到的,而且不会改变物质的化学组成。
2. 化学性质化学性质是物质在与其他物质反应或变化过程中所表现出来的性质。
它包括物质的燃烧性、氧化性、还原性、酸碱性等。
这些性质是物质内部原子或分子之间发生作用时所表现出来的特性,是物质的内在本质。
二、物质的结构物质的结构是指物质内部原子或分子之间的相对位置和组合方式。
它决定了物质的性质和行为。
1. 原子结构原子是构成物质的基本单位,它由质子、中子和电子组成。
原子的核心是由质子和中子组成的,而电子则围绕核心旋转。
原子的结构决定了物质的化学性质,如元素的原子序数和化合物的配位数等。
2. 分子结构分子是由原子通过化学键结合而成的一个电中性单位。
分子的结构决定了物质的物理性质和化学性质,如分子的极性、键长、键角等。
不同的分子结构会导致不同的化学性质和相互作用方式。
三、物质性质与结构的关系物质的性质与结构之间存在着密切的关系。
物质的结构决定了其性质和行为,而性质的变化又能反映物质结构发生的改变。
1. 结构决定性质物质结构的差异直接决定了物质的性质差异。
例如,水和氨分子的结构差异导致了它们具有不同的极性,进而决定了水和氨的物理性质和溶解能力的不同。
2. 性质反映结构物质的性质的变化可以反映其结构的变化。
例如,在化学反应中,当物质的化学键发生断裂或重新组合时,物质的性质会发生明显的变化。
这些性质的变化可以从微观层面解释为原子和分子结构的改变。
四、应用与展望对于物质的性质与结构之间的关系的深入研究,不仅有助于我们理解物质的本质和特性,还为物质的应用和改造提供了理论基础。

化学分子结构与物质性质的关系化学是研究物质的组成、性质、结构和变化规律的科学。
在化学中,分子结构与物质性质之间存在着密切的关系。
分子结构决定了物质的性质,而物质的性质又反映了其分子结构的特征。
本文将从分子结构对物质性质的影响、物质性质对分子结构的解释以及分子结构与物质性质的应用等方面进行探讨。
一、分子结构对物质性质的影响分子结构是物质性质的基础,不同的分子结构决定了物质的不同性质。
以下是几个常见的例子:1. 极性分子与非极性分子:分子中的原子通过共价键连接在一起,原子间的电子云分布不均匀会导致分子极性。
极性分子具有正负电荷分布不均匀的特点,如水分子(H2O),而非极性分子则没有明显的正负电荷分布,如甲烷(CH4)。
极性分子具有较强的极性键,能够与其他极性分子或离子发生氢键或离子键作用,而非极性分子则主要通过范德华力相互作用。
2. 分子大小与沸点:分子的大小与分子间的相互作用力有关,分子越大,分子间的相互作用力越强,沸点也越高。
例如,乙醇(C2H5OH)和甲烷(CH4)的分子量相近,但乙醇的沸点要高于甲烷,这是因为乙醇分子中含有氧原子,使得分子间的氢键作用增强。
3. 分子结构与溶解性:溶解性是物质在溶剂中溶解的能力。
分子结构的不同会影响物质的溶解性。
极性分子在极性溶剂中溶解度较高,而非极性分子在非极性溶剂中溶解度较高。
例如,氯仿(CHCl3)是一个极性分子,它在水中的溶解度较高;而正己烷(C6H14)是一个非极性分子,在水中的溶解度较低。
二、物质性质对分子结构的解释物质的性质可以通过分子结构来解释。
以下是几个例子:1. 酸碱性:酸和碱是化学反应中常见的概念。
酸的特点是能够释放出H+离子,而碱的特点是能够释放出OH-离子。
这种酸碱性质可以通过分子结构来解释。
酸分子通常含有可以释放H+离子的氢原子,如盐酸(HCl);碱分子通常含有可以释放OH-离子的氧原子,如氢氧化钠(NaOH)。
2. 氧化还原性:氧化还原反应是化学反应中重要的一类反应。
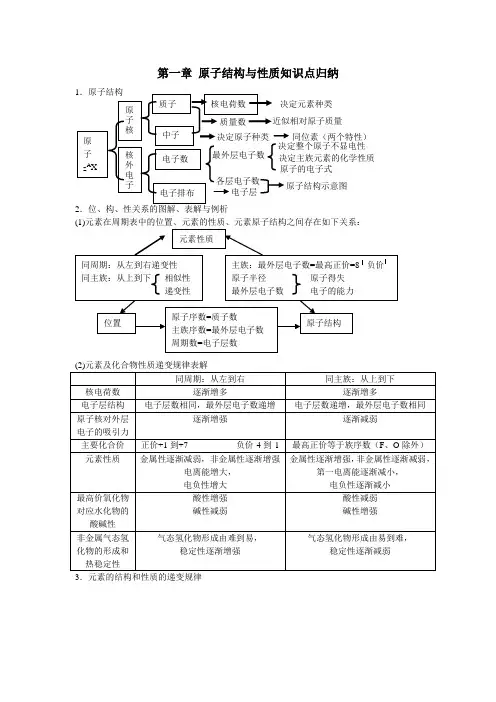
第一章 原子结构与性质知识点归纳2.位、构、性关系的图解、表解与例析3.元素的结构和性质的递变规律同位素(两个特性)4.核外电子构成原理(1)核外电子是分能层排布的,每个能层又分为不同的能级。
(2)核外电子排布遵循的三个原理:a .能量最低原理b .泡利原理c .洪特规则及洪特规则特例(3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法1.先推断元素在周期表中的位置。
2.一般说,族序数—2=本族非金属元素的种数(1 A 族 除外)。
3.若主族元素族序数为m ,周期数为n ,则: (1)m/n<1时为金属,m/n 值越小,金属性越强:(2)m/n>1时是非金属,m/n 越大,非金属性越强;(3)m/n=1时是两性元素。
随着原子序数递增① 原子结构呈周期性变化② 原子半径呈周期性变化③ 元素主要化合价呈周期性变化④ 元素的金属性与非金属形呈周期性变化⑤ 元素原子的第一电离能呈周期性变化⑥ 元素的电负性呈周期性变化元素周期律 排列原则① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个纵行周期 (7个 横行) ① 短周期(第一、二、三周期)② 长周期(第四、五、六周期)③ 不完全周期(第七周期)性质递变 原子半径主要化合价元 素 周期表族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结构第二章 分子结构与性质复习1.微粒间的相互作用(2)共价键的知识结构2.分子构型与物质性质(1)微粒间的相互作用σ键π键 按成键电子云 的重叠方式极性键 非极性键一般共价键 配位键离子键 共价键 金属键 按成键原子的电子转移方式 化学键 范德华力氢键 分子间作用力本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性σ键特征 电子云呈轴对称(如s —s σ键、 s —p σ键、p —p σ键)π键 特征电子云分布的界面对通过键轴的一个平面对称(如p —p π键)成键方式共价单键—σ键共价双键—1个σ键、1个π键共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定键长:键长越短,共价键越稳定键角:描述分子空间结构的重要参数用于衡量共价键的稳定性 键参数 共 价 键定义:原子形成分子时,能量相近的轨道混合重新组合成一组新轨道sp 杂化 sp 2杂化sp 3杂化 分类 构型解释: 杂化理论sp 杂化:直线型sp 2杂化:平面三角形sp 3杂化:四面体型杂化轨道理论 价电子理论 实验测定 理论推测 构型判断 分 子 构 型共价键的极性 分子空间构型决定因素由非极性键结合而成的分子时非极性分子(O 3除外),由极性键组成的非对称型分子一般是极性分子,由极性键组成的完全对称型分子为非极性分子。

物质的分子结构和性质的关系物质是由分子组成的,分子是由原子构成的,而原子又包含着质子、中子和电子等基本粒子。
物质的分子结构与其性质之间存在密切的关系,分子结构的不同可能会导致物质性质的差异。
本文将探讨物质的分子结构与性质之间的关系。
1. 分子结构与性质的基本概念物质的分子结构指的是分子中原子的排列方式和原子之间的连接方式。
分子结构的不同会影响到物质在化学反应中的行为以及物质的物理性质。
物质的性质包括物理性质和化学性质。
物理性质是描述物质在无任何化学变化下的特征,如密度、熔点、沸点等。
化学性质则是描述物质发生化学反应时的变化,如与其他物质发生反应的能力、氧化还原性等。
2. 分子结构对物质性质的影响2.1 极性与非极性分子的性质差异分子中原子之间的电子分布不均匀会导致分子具有极性。
极性分子中有正负电荷的分布差异,而非极性分子则没有电荷分布差异。
极性分子通常具有较强的极性间作用力,如氢键,使得极性分子具有较高的沸点和溶解度。
而非极性分子由于相互作用力较弱,故其沸点和溶解度较低。
举例来说,丙酮和透明液体石蜡都是有机物,但由于其分子结构不同,故它们的性质也有所不同。
丙酮是极性分子,具有较高的溶解度和较低的沸点,而石蜡是非极性分子,由于分子间作用力较弱,其溶解度和沸点都较低。
2.2 分子大小与物质的物理性质分子的大小也会影响到物质的物理性质,如熔点和沸点。
一般而言,较大分子的物质分子间作用力较强,需要较高的能量才能克服这些作用力而使其发生相变。
以碳氢化合物为例,分子量较小的烷烃(如甲烷、乙烷)由于分子间作用力较弱,故其沸点较低。
而随着分子量的增加,烷烃的沸点逐渐升高,因为较大的分子量意味着更多的原子之间可能存在的作用力。
2.3 分子结构与物质的化学性质物质的分子结构还能决定其化学性质,尤其是在发生化学反应时。
分子结构的不同可能导致不同的化学反应路径和反应速率。
以有机物为例,氯代烃的化学性质受碳氯键的影响。
当氯化碳的碳氯键数目越多,其反应性越高,与其他物质发生取代反应的可能性也更大。

化学思想方法1.微观角度,从物质的结构理解物质的性质。
2.反应原理角度氧化还原原理可以说是整个高中化学学习的核心。
化学反应速率和平衡是物质化学变化的核心3.实验和工业原理角度课本从来没有完整的讲解过工业和实验设计的逻辑和思路,但是实验是整个化学的核心包括上面所以的原理都是为工业生产服务。
4.细节性知识的记忆和理解。
化学有太多零碎的知识点,学习中一定要多积累多记。
化学学科思想方法一、现象与本质的思想方法这是化学学科重要的思想方法。
化学实验现象是物质发生变化的标志,其本质是物质发生了变化,包括物理变化和化学变化。
要透过现象抓住本质。
化学是以实验为基础的科学,离开了化学实验,一切的化学理论、原理就成了无本之木,无源之水,化学就无从谈起。
因此,我们就要从实验开始学习化学,要用化学实验研究、解决化学问题。
学会观察化学实验现象,并对其进行深入的分析,是学习、研究化学的不二法门。
首先是解决了一个认识问题。
有了这样的思想方法,我们再去学习化学实验,就不会觉得实验是可有可无的。
其次,要学会观察实验现象,用对比的方法,观察反应前、反应过程中、反应后,物质颜色、状态、声音、光、烟等方面的变化。
第三,要学会对实验现象的分析,就是通过实验现象去了解实验的原理,弄清发生了怎样的变化。
哪些现象是物理变化引起的,哪些现象是化学变化引起的,也就是要抓住本质特征,避免物理变化现象的干扰,找到发生的化学反应。
第四,要学会增加对比度的、或借助药品、仪器等办法,来提高对实验现象的观察效果,从而获得全面、准确的实验信息。
在学习中,我们会经常遇到物质推断问题,而这些问题都会涉及到实验和实验现象,而抓住物质的特征反应现象,正是解决这类问题的关键。
二、结构与性质的思想方法这是化学学科核心的思想方法。
这一思想贯穿化学学习与研究过程的始终,根据这一思想,与之相关的思想方法还有:1.结构与性质的关系是:结构决定性质、性质反映结构。
性质与用途的关系是:性质决定用途,用途反映性质。

元素“位,构,性”的关系及应用福建省漳州市邮编 363000摘要:元素推断题是历年高考的高频考点,主要以选择题形式出现,主要考查元素“位,构,性”的关系及利用物质结构和性质进行综合推断的能力,要求熟练掌握短周期所有元素的结构特点,在周期表中的位置以及它们的重要化合物的性质,在此基础上综合分析。
关键词:“位,构,性”在我国新课程改革的目标要求下,高中化学教师在开展教学活动时,不仅需要转变自己原先传统的教育教学方式,同时还需要对自己的课程教学目标、课程教学内容以及课程教学任务进行有效的转变,培养学生们的化学学科核心素养。
如元素推断综合题型,要培养学生“结构决定性质,性质决定应用”的观念,发展学生的宏观辨识和微观探析的能力。
其次,根据元素的结构和位置,利用元素的递变规律推出元素及其化合物的性质,发展学生的证据推理和模型认知能力。
一,正确推断元素类别的要点(1)结构与位置互推是解题的核心①掌握四个关系式:a.电子层数=周期数;b.质子数=原子序数;c.最外层电子数=主族序数;d.主族元素的最高正价=主族序数(O、F除外),负价=主族序数-8。
②熟练掌握周期表的结构及周期表中的一些特殊规律a.“凹”型结构的“三短四长,七主七副八零完”;b.各周期元素种类;c.稀有气体的原子序数及在周期表中的位置;d.同主族上下相邻元素原子序数的关系。
(2)性质与位置互推是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:①元素的金属性、非金属性;②气态氢化物的稳定性;③最高价氧化物对应水化物的酸碱性;④金属与水或酸反应置换H2的难易程度。
(3)结构和性质互推是解题的要素①电子层数和最外层电子数决定元素的金属性和非金属性;②同主族元素最外层电子数相同,化学性质相似;③正确推断原子半径和离子半径的大小及结构特点;④判断元素金属性和非金属性的强弱。
二,元素推断中常见的“题眼”1.元素之最:如地壳中含量最多的元素是氧元素;形成化合物种类最多的元素是碳元素,空气中含量最多的元素是氮元素等。

分子的结构与性质的关系分子的结构与性质的关系是化学学科的重要研究内容之一。
分子的结构指的是分子中各个原子之间的相互排列方式以及原子与原子之间的化学键的连接方式。
而分子的性质则是指分子在化学反应和物理过程中所表现出来的特性和行为。
分子的结构直接影响着分子的性质。
一方面,分子的结构可以决定分子之间的相互作用力,进而影响物质的物理性质,如沸点、熔点、溶解度等。
另一方面,分子的结构还可以决定分子在化学反应中的反应性质,如反应的速率、选择性等。
首先,分子的结构与物质的物理性质密切相关。
例如,取代基的种类和位置可以影响有机化合物的沸点和溶解度。
在有机化学中,当取代基的体积增大时,分子间的范德华力也会增加,导致沸点升高。
同时,相同的取代基在不同位置的影响也不同,如苯环上的取代基会改变苯环的电子密度分布,进而影响苯环与其他分子间的相互作用。
其次,分子的结构对于化学反应的速率和选择性也有重要影响。
以有机合成为例,分子中官能团的位置和取代基的选择往往能够决定反应路径和产物选择。
例如,当氢原子被氟取代时,反应中可以选择引入氟原子的位置,从而得到不同的产物。
此外,分子的手性结构对于光学异构体的形成和对映选择性反应也具有重要作用。
另外,分子的结构还决定了分子之间的相互作用力。
分子间的相互作用力对于物质的凝聚态性质至关重要。
例如,氢键是分子间最常见的相互作用力之一,在生物分子的结构稳定性和具体功能中起着重要的作用。
此外,分子间力的大小还可以影响到分子的溶解度、热稳定性等性质。
综上所述,分子的结构与分子的性质之间存在着密切的关系。
分子的结构决定了分子的物理性质、化学反应性质以及相互作用力。
在化学研究和应用中,理解和研究分子的结构与性质的关系对于探索新材料、药物研发和化学工艺等领域具有重要的意义。
(以上内容仅供参考,具体内容和篇幅可以根据需要进行调整。
)。

2019届高考化学过关知识点 5 “位—构—性"三者的关系及应用1、元素的“位—构—性”三者关系2。
“位”“构"“性"关系的应用(1)结构与位置互推注:①若一种阳离子与一种阴离子电子层数相同,则“阴前阳后”,阴离子在前一周期,阳离子在后一周期,阳离子的原子序数大。
②同周期元素的简单阳离子与阴离子相比,阴离子原子序数大。
③在短周期元素中,元素的原子序数与其主要化合价的数值在奇偶性上一般一致,“价奇序奇,价偶序偶”、(2)性质与位置互推熟悉元素周期表中同周期、同主族元素性质的递变规律,依照元素性质能够推知元素在周期表中的位置,依照元素在周期表中的位置能够推知元素性质、(3)结构与性质互推①最外层电子数是决定元素原子的氧化性和还原性的主要原因。
②原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质、③同主族元素最外层电子数相同,性质相似。
命题点1周期表位置片断推测结构与性质[对点训练1](2019·山东高考)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )A、原子半径:X<Y〈ZB、气态氢化物的稳定性:X>ZC、Z、W均可与Mg形成离子化合物D、最高价氧化物对应水化物的酸性:Y>WC[由X、Y、Z、W四种元素的相对位置关系和Y、W的原子序数之和是Z的3倍可推出:X是硅,Y是氮,Z是氧,W是氯。
A、原子半径:X>Y>Z。
B。
气态氢化物的稳定性:X<Z。
C、O、Cl分别与Mg形成MgO、MgCl2,它们均属于离子化合物、D。
非金属性:W(Cl)>Y(N),故最高价氧化物对应水化物的酸性:W>Y。
][对点训练2](2019·浙江高考)右表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。
下列说法正确的是( )A、X、WB、Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增C、YX2晶体熔化、液态WX3气化均需克服分子间作用力D。
化学化合物的结构与性质分析化学化合物是由两种或更多不同的元素组成的物质,具有独特的结构和性质。
了解和分析化合物的结构可以帮助我们更好地理解其性质和行为。
本文将介绍化合物的结构和性质的相关概念,分析不同类型的结构和性质,并举例说明其应用。
1.结构的概念结构是指分子中原子之间的相对位置和连接方式。
分子结构决定了化合物的物理和化学性质。
在分子中,我们可以通过连线图或空间结构图表示原子和化学键的相对位置。
化学键的类型包括共价键、离子键和金属键。
共价键是通过原子间共享电子而形成的。
它可以是单一、双重或三重的。
共价键通常表现为化学键的长度约为共享电子对的大小,以及共价键的刚度与键型有关。
离子键则是由带正电荷和带负电荷的离子之间的相互吸引力而形成的。
在离子化合物中,正离子和负离子之间的距离较小,而化学键的刚度较高。
金属键是金属原子在固态或液态中之间的相互作用。
这些原子以三维晶格相互堆积,共享自由电子以形成金属键。
金属键的长度和刚度都相对较小。
2.性质的概念性质是指化合物的物理和化学特征。
它们是由分子结构和原子之间的相对位置决定的。
化学化合物的性质还可以由分子和反应条件的化学和物理参数来控制。
例如,化合物的熔点、沸点、密度、折射率和电导率是物理性质。
化合物的酸碱性、还原性、氧化性和反应性是化学性质。
3.结构和性质之间的关系当我们了解化合物的结构和性质时,很容易发现它们之间的关系。
例如,有机化合物的手性会影响它们在反应中的活性。
这是因为它们的手性决定了它们与其他分子之间的相互作用方式。
在无机化合物中,分子的结构决定了其物理性质。
例如,金属离子的分子结构决定了它们的离子亲合力和氧化还原性。
4.结构和性质的应用化学化合物的结构和性质分析可以用于许多领域。
例如,有机化学家利用手性控制合成有机分子。
这些手性分子在医药和材料科学中具有广泛的应用。
无机化学家可以利用分子结构来控制催化剂的活性。
这些催化剂可应用于许多化学反应,如氧化作用和氢化作用。
元素的“位置结构性质”之间的关系规律及其应用元素的周期性性质与其位置有关。
元素周期表是按照元素的原子序数(即原子核中质子的个数)进行排列的,元素的位置决定了其一系列周期性性质。
例如,元素周期表上的水平行称为周期,一个周期中的元素具有相似的化学性质。
这是因为在同一周期中,元素的电子层结构相似,导致原子化学性质的相似性。
由周期性性质的规律可以推断出元素的性质。
元素的位置与其结构有关。
元素周期表中的每个元素都可以由原子结构来描述,包括原子核中的质子和中子,以及围绕核中运动的电子。
原子结构的不同会影响元素的性质。
例如,质子和电子数量都相等的元素被称为中性元素,而质子数量大于或小于电子数量的元素分别被称为带正电荷和带负电荷的离子。
这些结构差异直接决定了元素的化学性质。
元素的位置、结构、性质之间的关系规律还可以应用于各种实际场景中。
首先,元素周期表的组织可以帮助我们预测新元素的性质。
根据新元素的原子序数,可以推测其电子结构,并将其归类到适当的周期和族中,以便估计其可能的化学性质。
这对于新材料的研发和新反应的预测非常重要。
其次,元素周期表的规律也是解释化学反应的重要工具。
通过观察反应之前和之后所涉及的元素和其位置,我们可以确定反应中元素的氧化还原状态,以及可能发生的化学变化。
这些规律可以用于解释和预测各种化学反应,帮助化学家设计新的反应过程和材料。
此外,元素的位置、结构、性质之间的关系规律也为一些重要的应用提供了基础。
例如,周期表的基本结构被用于设计新材料,如电子、光电器件、催化剂等。
此外,根据元素的周期性性质,可以推测出元素的物理和化学性质,为合金设计和功能材料的开发提供指导。
总之,元素的“位置、结构、性质”之间的关系规律是理解化学世界的基石之一、通过理解和应用这一规律,我们可以预测元素的性质、解释化学反应,并在更广泛的范围内应用于新材料的设计和功能材料的开发。
有机化合物的结构与性质关系有机化合物是由碳元素组成的化合物,其结构与性质之间存在密切的关系。
有机化合物的结构决定了它的性质,包括物理性质和化学性质。
本文将探讨有机化合物结构与性质之间的关系,并介绍几个典型的示例。
一、碳骨架的结构有机化合物的碳骨架是其分子中碳原子的连续排列形成的结构。
碳原子有四个价电子,可以与其他原子或基团形成共价键,形成直链、支链、环状等多种结构。
碳骨架的结构对有机化合物的性质有重要影响。
1. 直链结构直链结构的有机化合物,如丙烷、戊烷等,具有较高的沸点和熔点。
直链结构的有机化合物分子之间的相互作用较强,需要克服较高的分子间力才能使其转变为气体或液体。
2. 支链结构支链结构的有机化合物,如异丙烷、异戊烷等,由于分子的流动性降低,其沸点和熔点较直链结构的有机化合物低,容易挥发。
支链结构还增加了分子之间的间隔,减弱了分子间作用力。
3. 环状结构环状结构的有机化合物,如环己烷、苯等,由于分子内部存在环相互作用力,使得分子比直链结构的有机化合物更加稳定。
环状结构还可带来共轭体系,增加了有机化合物的吸收光谱。
二、官能团的性质有机化合物的官能团是指分子中功能性的原子或基团,如羟基、羰基、氨基等。
官能团决定了有机化合物的性质和化学反应。
1. 羟基羟基(-OH)是氢原子被一个氧原子取代的官能团。
含有羟基的化合物具有较高的溶解度,易于形成氢键。
羟基的存在还能够使有机化合物具有酸碱性质,并参与酯化、醚化等化学反应。
2. 羰基羰基(C=O)是碳原子与氧原子形成的双键结构。
具有羰基的化合物,如醛和酮,具有较高的沸点和熔点。
羰基的存在使得有机化合物对亲电试剂具有较强的亲和力,容易进行加成反应和亲核取代反应。
3. 氨基氨基(-NH2)是氮原子与氢原子形成的官能团。
含有氨基的有机化合物具有碱性,并能与酸反应生成盐。
氨基还能够参与缩合反应、羟基化反应等多种化学反应。
三、取代基的影响有机化合物中的取代基(基团)是指将氢原子替换为其他原子或基团的官能团。
化学物质的结构与性质关系化学是研究物质组成、结构和性质之间关系的科学。
在化学中,物质的结构和性质之间存在密切的关系。
本文将探讨化学物质的结构如何影响其性质,并举例说明。
一、原子结构与物质性质物质的基本单位是原子,原子由质子、中子和电子组成。
原子的组成和排列方式决定了物质的性质。
以氢气和氧气为例,氢气由两个氢原子组成,而氧气由两个氧原子组成。
氢气具有较低的沸点和燃烧性,而氧气具有较高的沸点和促进燃烧的性质。
这是因为氢气的分子量较小,分子间作用力较弱,而氧气的分子量较大,分子间作用力较强。
二、分子结构与物质性质分子是由原子通过共价键结合而成的。
分子的结构决定了物质的化学和物理性质。
例如,甲烷和乙烯是两种碳氢化合物,它们的分子结构不同导致了不同的性质。
甲烷的分子由一个碳原子和四个氢原子组成,共有四个共价键。
由于甲烷分子中碳原子周围的氢原子取向是四面体形状,甲烷分子具有较高的稳定性和较低的反应性。
而乙烯的分子由两个碳原子和四个氢原子组成,两个碳原子之间的共价键形成了双键。
这使得乙烯分子具有较高的反应活性和较高的不稳定性。
三、晶体结构与物质性质某些化学物质具有晶体结构,晶体中的原子、离子或分子通过规则的排列方式组成晶格。
晶体的结构对物质的性质有着重要的影响。
以钠氯化合物为例,钠离子和氯离子通过离子键结合在一起,形成了六方晶体结构。
这种结构使得钠氯化合物具有高熔点、良好的电导性和极强的晶体稳定性。
四、功能团结构与物质性质在有机化学中,功能团是指分子中具有特定化学性质和反应特性的基团。
不同的功能团结构对物质的性质和用途有着显著的影响。
以羧酸为例,它是一类含有-COOH官能团的有机化合物。
羧酸具有酸性,可以与碱反应产生盐和水。
另一方面,羧酸可以通过酯化反应与醇反应,生成酯类化合物。
综上所述,化学物质的结构决定了它们的性质。
原子结构、分子结构、晶体结构和功能团结构等各种结构层次对物质的化学和物理性质产生重要影响。
微专题2 元素推断题突破方法元素周期表和元素周期律是高考考查的热点和重点,主要以选择题的形式考查元素在周期表中的位置、结构与性质的关系。
综合分析近几年高考在本章的考查,都是结合原子结构、元素周期表、元素及其化合物知识的综合推断。
一、依据元素原子结构推断元素将原子结构、核外电子排布特征作为元素推断的突破口,是元素推断题的重要类型之一,题目通常以文字叙述或图文结合的形式给出元素原子的核外电子排布、位置关系等关键信息。
解题时可结合短周期元素的原子结构及元素的特殊性质,对元素进行合理的推断。
1.根据核外电子排布的三大规律推断元素 (1)最外层电子数规律 最外层电子数(N ) 3≤N <8 N =1或2N >次外层电子数元素在周期表中的位置第ⅢA 族~第ⅦA 族第ⅠA 族、第ⅡA 族、第Ⅷ族、副族、0族元素氦第二周期(Li 、Be 除外)(2)“阴三、阳四”规律某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。
如S 2-、K +最外层电子数与次外层电子数相等,则S 位于第三周期,K 位于第四周期。
(3)“阴上、阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
如O 2-、F -、Na +、Mg 2+、Al 3+电子层结构相同,则Na 、Mg 、Al 位于O 、F 的下一周期。
2.依据“等电子”粒子进行推断(1)寻找“10电子”粒子和“18电子”粒子的方法 ①“10电子”粒子②“18电子”粒子(2)记忆其他等电子粒子①“14电子”粒子:Si、N2、CO、C2H2等。
②“16电子”粒子:S、O2、C2H4等。
(3)质子数和核外电子数分别相等的两种粒子关系①可以是两种原子,如同位素原子。
②可以是两种分子,如CH4、NH3。
③可以是两种带电荷数相同的阳离子,如N H4+、H3O+。
④可以是两种带电荷数相同的阴离子,如OH-、F-。
有机化合物的结构与性质关系有机化合物是由碳元素与氢元素及其他元素(如氧、氮、硫等)构成的化合物。
它们在自然界中广泛存在,是生命体的基本组成部分。
有机化合物的结构对其性质具有重要影响,本文将探讨有机化合物结构与性质之间的关系。
一、碳骨架结构的影响有机化合物的碳骨架结构是指碳原子通过共价键形成的连续结构,其中的取代基或官能团可以改变其性质。
碳骨架的长度、分支性、环状结构等都会对有机化合物的性质产生影响。
1.1 碳链长度的影响碳链长度是指有机化合物中碳原子形成的连续链的长度,它与化合物的物理性质和化学性质密切相关。
通常来说,碳链越长,有机化合物的沸点和熔点越高,溶解性越差。
这是因为长碳链增加了分子间的范德华力作用,使得分子间的相互作用增强。
而且,长碳链还使得分子的取向更加有序,增加了分子间的相互吸引力。
1.2 分支结构的影响分支结构是指碳骨架中分支的数量和位置。
分支结构会减小分子间的范德华力作用,使得有机化合物的沸点和熔点降低,溶解性增强。
这是因为分支结构使得有机分子变得更加扁平,分子间的接触面积减小,分子间的相互作用减弱。
1.3 环状结构的影响环状结构是指碳骨架形成环状的有机化合物。
环状结构会增加分子内的张力,降低化合物的稳定性。
此外,环状结构还增强了有机化合物的活性,使其更容易进行化学反应。
二、取代基的影响取代基是指替代有机化合物中的一个或多个氢原子的官能团或其他基团。
取代基的性质会对有机化合物的性质产生显著影响。
2.1 官能团的影响官能团是一种能决定有机化合物化学性质的化学结构。
常见的官能团有羟基(—OH)、卤原子(—Cl, —Br, —I)、氨基(—NH2)等。
不同的官能团赋予有机化合物不同的化学反应性质。
例如,含有羟基的化合物具有醇的性质,常见的醇有甲醇、乙醇等。
2.2 取代基位置的影响取代基的位置对有机化合物的性质影响很大。
同一种取代基可能在不同位置会导致化合物性质的差异。
例如,苯环上的取代基位置不同,其化合物的溶解度、稳定性等性质也会有所不同。
位置、结构和性质的关系
一、位置、结构和性质的关系:
元素的原子结构,即核外电子排布,主要是电子层数和最外层电子数,决定了元素在周期表的位置,也就决定的元素及其化合物的物理性质和化学性质以及性质的递变。
而元素及其化合物的物理性质和化学性质以及性质的递变,反映了元素在周期表的位置,也就反应了元素的原子结构,特别是反映了核外电子排布中的电子层数和最外层电子数的特征。
一句话,就是结构决定位置和性质,位置和性质反映结构,位置决定性质,性质反映位置。
二、元素金属性的比较方法
1、用失去电子的难易比较:金属原子失去电子越容易,金属元素的金属性就越强;金属
原子失去电子越不容易,金属元素的金属性就越弱。
例如:钠比镁更容易失去电子,钠金属性比镁强。
2、用与水反应产生氢气的能力比较:金属越容易和水反应产生氢气,金属性就越强;金
属越难和水反应产生氢气,金属性就越弱。
例如:钠可以与冷水剧烈反应,而镁要与热水才反应,铝与热水不反应,要在氢氧化钠溶液中才与水反应,说明金属性Na>Mg>Al
3、用与H+反应产生氢气的能力比较:金属与H+反应越容易,越剧烈,说明金属性越强。
金属与H+反应越难,越不反应,说明金属性越弱。
例如:镁、铝、锌和同浓度的盐酸反应,镁剧烈反应,铝比较缓慢,而锌就更缓慢,说明金属性Mg>Al>Zn
4、用同一周期或同一主族最高价氧化物的水化物的碱性进行比较:同一周期或同一主族
最高价氧化物的水化物碱性越强,该金属元素的金属性越强。
最高价氧化物的水化物碱性越弱,该金属元素的金属性越弱。
例如:碱性NaOH>Mg(OH)2>Al(OH)3说明金属性Na>Mg>Al
碱性Be(OH)2<Mg(OH)2<Ca(OH)2<Sr(OH)2<Ba(OH)2说明金属性Be<Mg<Ca<Sr<Ba
5、用原子结构特征进行比较:原子的核外电子排布中,电子层数越多,最外层电子数越
少,元素的金属性就越强。
例如:K有3层,最外层1个电子,铍有2层,最外层2个电子,金属性K>Be
6、通过元素周期表的位置进行比较:同一周期,自左而右,元素的金属性减弱;同一主
族,自上而下,元素的金属性依次增强。
例如:金属性K>Ca>Ga Rb>K>Na>Li
7、用彼此在水溶液中发生置换反应来比较:金属性强的金属能把金属性弱的金属从其可
溶性盐溶液中置换出来。
例如:Zn+CuSO4===ZnSO4+Cu 说明金属性Zn>Cu
8、用原电池的正负电极来比较:金属性越强的金属在构成原电池时作负极,发生氧化反
应,金属性越弱的金属在构成原电池时作正极,离子在它的表面发生还原反应。
例如:如果A、B两块金属,用导线连接后,放到稀硫酸中,B的表面有气泡产生,说明B作正极,金属性没有A强。
9、用电解池原理进行比较:用惰性电极电解等金属离子的盐溶液,越容易在阴极得到电
子被还原的,其金属性就越弱。
例如:电解硝酸银和硝酸铜的混合溶液,银先析出,说明金属性Cu>Ag
三、非金属性的比较方法:
1、用得到电子的难易比较:非金属原子得到电子越容易,非金属元素的非金属性就越强;
非金属原子得到电子越不容易,非金属元素的非金属性就越弱。
例如:氟比氯更容易得到电子,氟的非金属性比氯强。
2、单质与氢气反应产生氢化物的能力比较:非金属单质越容易和氢气反应产生氢化物,
非金属性就越强;非金属越难和氢气反应产生氢化物,非金属性就越弱。
例如:氟气在黑暗处可以与氢气剧烈反应,而氯气要在点燃条件下与氢气反应,溴蒸气要在加热的条件下与氢气反应,说明非金属性F>Cl>Br
3、用气态氢化物的稳定性进行比较:气态氢化物越稳定,非金属性就越强;气态氢化物
越稳定,非金属性就越强。
例如:稳定性HF>HCl>HBr>HI 说明非金属性F>Cl>Br>I
例如:稳定性CH4<NH3<H2O<HF 说明非金属性C<N<O<F
4、用同一周期或同一主族最高价氧化物的水化物的酸性进行比较:同一周期或同一主族
最高价氧化物的水化物酸性越强,该金属元素的非金属性越强。
最高价氧化物的水化物酸性越弱,该金属元素的非金属性越弱。
例如:酸性H4SiO4<H3PO4<H2SO4<HClO4说明非金属性Si<P<S<Cl
酸性HClO4>HBrO4>HIO4说明非金属性Cl>Br>I
5、用原子结构特征进行比较:原子的核外电子排布中,电子层数越少,最外层电子数越
多但又没有排满,元素的非金属性就越强。
例如:As有4层,最外层5个电子,Cl有3层,最外层7个电子,非金属性Cl>As 6、通过元素周期表的位置进行比较:同一周期,自左而右,元素的非金属性增强;同一
主族,自上而下,元素的金属性依次减弱。
例如:非金属性Si<P<S<Cl F>Cl>Br>I
7、用彼此在水溶液中发生置换反应来比较:非金属性强的非金属单质能把非金属性弱的
非金属单质从其可溶性盐溶液中置换出来。
例如:Br2+2KI===2KBr+I2说明非金属性Br>I
8、可以用气体氢化物的还原性进行比较:气态氢化物的还原性越强,非金属元素的非金
属性就越弱;气态氢化物的还原性越弱,非金属元素的非金属性就越。
例如:稳定性HF<HCl<HBr<HI 说明非金属性F>Cl>Br>I
例如:稳定性CH4>NH3>H2O>HF 说明非金属性C<N<O<F
9、可以通过阴离子的还原性进行比较:阴离子的还原性越强,其单质的氧化性就越强,
非金属性就越强。
例如:还原性:F-<Cl-<Br-<I-说明非金属性F>Cl>Br>I。