高考化学一轮复习 排查落实练八 硫、氮及其化合物
- 格式:ppt
- 大小:493.00 KB
- 文档页数:16

高考化学一轮复习氮及其化合物 知识归纳总结及答案一、选择题1.如图所示,将相同条件下的m 体积NO 和n 体积O 2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留m2体积的气体,该气体与空气接触后立即变为红棕色。
则m 与n 的比值为( )A .3∶2B .2∶3C .8∶3D .3∶8【答案】C 【详解】在一定条件下,将m 体积NO 和n 体积O 2同时通入倒立于水中且盛满水的容器中内,充分反应, NO 和O 2全部溶于水时按照下列反应进行,化学方程式为:4NO + 3O 2+ 2H 2O = 4HNO 3,由于气体与空气接触后立即变为红棕色,所以容器内残留气体为NO ,那么与O 2反应的NO 气体为m-m 2=m2,NO 和O 2按照4:3混合溶于水恰好全部溶解所以mn 2: =4 :3,所以m :n=8:3; 故选C 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确C .①③正确D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。


非金属硅、硫、氮及其化合物1.下列说法正确的是A.因为HF与SiO2反应,故用氢氟酸在玻璃器皿上刻蚀标记B.下列转化在一定条件下能够实现:SiO2SiCl4SiC.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物D.Si和SiO2都用于制造光导纤维【答案】A【解析】A 、HF与SiO2反应生成SiF4气体,会腐蚀玻璃,A 正确;B、SiO2与HCI不反应,B错误;C、SiO2只能与HF反应,不与其他酸反应,故不是两性氧化物,C错误;D、Si不能用于制造光导纤维,D错误。
故选A;2.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键个数之比为1∶2【答案】D【解析】二氧化硅晶体中,1个Si原子连接4个O原子,1个O原子连接2个Si原子,晶体中Si原子与Si—O键个数之比为1∶4。
3.如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是A.SiO2属于两性氧化物B.盛放Na2CO3溶液的试剂瓶用玻璃塞C.硅胶吸水后可重复再生D.图中所示的转化都是氧化还原反应【解析】SiO 2是酸性氧化物,A 错误;Na 2CO 3溶液呈碱性,试剂瓶不能用玻璃塞,B 错误;题图中有的转化不是氧化还原反应,例如SiO 2与NaOH 溶液的反应,D 错误。
4.标准状况下,将3.36 L CO 2气体通入200 mL 1.00 mol ·L -1 NaOH 溶液中,充分反应后溶液中c (CO 32-)与c (HCO 3-)的比值为(不考虑CO 32-、HCO 3-的水解)A .1∶1B .1∶2C .2∶1D .1∶3 【答案】B【解析】设CO 32-、HCO 3-的物质的量分别为x 、y ,则有⎩⎪⎨⎪⎧ x +y =0.15 mol ,2x +y =0.2 mol ,解得x =0.05 mol ,y =0.1 mol 。

氮及其化合物【练习题】1.判断下列描述的正误(正确的打“√”,错误的打“×”)(1)用向上排空气法收集铜粉与稀硝酸反应产生的NO( )(2)密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A ( )(3)燃料的脱硫脱氮、SO 2的回收利用和NO x 的催化转化都是减少酸雨产生的措施( )(4)制取NO 2时,用水或NaOH 溶液吸收尾气( )(5)标准状况下,6.72 L NO 2与水充分反应转移的电子数目为0.1N A ( )(6)常温常压下,92 g 的NO 2和N 2O 4混合气体含有的原子数为6N A ( )(7)因为NH 4HCO 3受热易分解,故可用作氮肥( )(8)下列物质间的转化能够实现N 2――→H 2高温、高压、催化剂NH 3――→HCl (aq )NH 4Cl(aq) ( )(9) NH 4Cl 溶液与Ca(OH)2溶液混合的离子方程式为H ++OH -===H 2O( )(10)用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH 3为碱性气体( )(11)检验溶液中是否含有NH +4:取少量试液于试管中,加入NaOH 溶液并加热,用湿润的红色石蕊试纸检验产生的气体( )(12)加热盛有NH 4Cl 的试管,试管底部有固体消失,试管口有晶体凝结,说明NH 4Cl 固体可以升华( )(13)实验室制取氨( ) (14)施肥时,草木灰(有效成分为K 2CO 3)不能与NH 4Cl 混合使用,是因为K 2CO 3与NH 4Cl 反应生成氨气会降低肥效( )(15)可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气( )(16)加热NH 4Cl 和Ca(OH)2混合物,并将产生的气体通入酚酞溶液中,酚酞溶液变成红色( )(17) 1 mol Fe 溶于过量硝酸,电子转移数为2N A ( )(18)将铜丝插入稀硝酸中:Cu +4H ++2NO -3===Cu 2++2NO 2↑+H 2O( )(19)将铁屑放入稀HNO 3中证明Fe 比H 2活泼( )(20)向稀HNO 3中滴加Na 2SO 3溶液:SO 2-3+2H +===SO 2↑+H 2O( )(21) SO 2和SO 3混合气体通入Ba(NO 3)2溶液可得到BaSO 3和BaSO 4( )(22)实验室里用锌粒与稀硝酸反应制取H 2( )(23)将可调高度的铜丝伸入稀HNO 3中,溶液变蓝,说明铜与稀HNO 3发生置换反应( )(24)稀硝酸可除去试管内壁的银镜( )2.如右图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。

高考化学一轮复习氮及其化合物知识归纳总结及答案一、选择题1.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是()选项气体a b cA NH3浓氨水生石灰碱石灰B SO270%的浓H2SO4Na2SO3固体98%的浓H2SO4C NO稀HNO3铜屑H2OD NO2浓HNO3铜屑NaOH溶液A.A B.B C.C D.D【答案】B【详解】A. 因NH3的密度比空气的小,不能用图示装置收集,收集方法不合理,故A错误;B. Na2SO3与70%的浓硫酸反应生成SO2,SO2中混有的H2O用98%的浓H2SO4除去,收集装置合理,故B正确;C. NO与空气中的氧气反应,则不能用图示装置收集NO,应利用排水法收集,故C错误;D. NO2被NaOH溶液吸收,收集不到NO2,故D错误;故选B。
2.如图是产生和收集气体的实验装置示意图,该装置适合于()A.用浓硝酸和Cu制取NO2B.用H2O2溶液和MnO2制取O2C.用浓盐酸和MnO2制取Cl2D .用NH 4Cl 溶液和Ca(OH)2制取NH 3 【答案】B 【详解】A .二氧化氮会与水发生反应,不能用排水法收集,故A 不合适;B .分液漏斗中盛放双氧水,圆底烧瓶中为二氧化锰,二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,故B 合适;C .浓盐酸和二氧化锰制取氯气需要在加热条件下反应,故C 不合适;D .氨气极易溶于水,不能用排水法收集,且氢氧化钙与溶于水时放出的热量较少,无法蒸出氨气,故D 不合适; 故答案为B 。
3.下列叙述与氮的固定无关的是 A .工业合成氨B .工业上将氨转化为硝酸和其他含氮化合物C .豆科植物的根瘤菌把空气中的氮气转化为含氮化合物D .电闪雷鸣的雨天,空气中的氮气会与氧气发生反应并最终转化为硝酸盐被植物吸收 【答案】B 【分析】氮的固定是指将空气中游离态的氮转化为含氮化合物的过程。


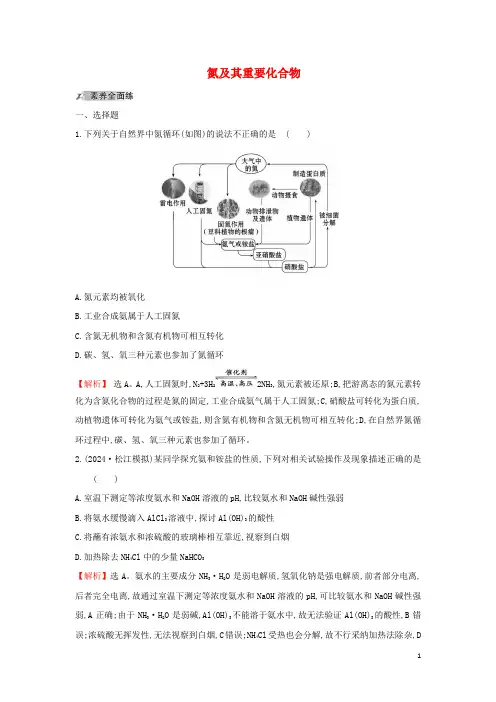
氮及其重要化合物一、选择题1.下列关于自然界中氮循环(如图)的说法不正确的是( )A.氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D.碳、氢、氧三种元素也参加了氮循环【解析】选A。
A,人工固氮时,N2+3H22NH3,氮元素被还原;B,把游离态的氮元素转化为含氮化合物的过程是氮的固定,工业合成氨气属于人工固氮;C,硝酸盐可转化为蛋白质,动植物遗体可转化为氨气或铵盐,则含氮有机物和含氮无机物可相互转化;D,在自然界氮循环过程中,碳、氢、氧三种元素也参加了循环。
2.(2024·松江模拟)某同学探究氨和铵盐的性质,下列对相关试验操作及现象描述正确的是( )A.室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱B.将氨水缓慢滴入AlCl3溶液中,探讨Al(OH)3的酸性C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,视察到白烟D.加热除去NH4Cl中的少量NaHCO3【解析】选A。
氨水的主要成分NH3·H2O是弱电解质,氢氧化钠是强电解质,前者部分电离,后者完全电离,故通过室温下测定等浓度氨水和NaOH溶液的pH,可比较氨水和NaOH碱性强弱,A正确;由于NH3·H2O是弱碱,Al(OH)3不能溶于氨水中,故无法验证Al(OH)3的酸性,B错误;浓硫酸无挥发性,无法视察到白烟,C错误;NH4Cl受热也会分解,故不行采纳加热法除杂,D错误。
3.某试验过程如图所示,则图中③试管的现象是( )A.无明显现象,因稀硫酸不与铜反应B.铜片溶解,产生无色气体,该气体遇到空气不变色C.铜片溶解,放出红棕色有刺激性气味的气体D.铜片溶解,产生无色气体,该气体在试管口变为红棕色【解析】选D。
生成的Cu(NO3)2在H2SO4的酸性条件下相当于又有了HNO3,铜片会接着溶解生成NO。
4.(2024·黄冈模拟)向盛有100 mL HNO3溶液的烧杯中加入肯定量的Cu、Al合金(还原产物为NO),充分反应后向溶液中加入1 mol·L-1的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如图所示。

高考化学一轮复习氮及其化合物(讲义及答案)一、选择题1.按图进行实验,试管内装有12mL NO ,然后间歇而缓慢地通入8 mLO 2,下面有关实验最终状态的描述正确的是( )A .试管内气体呈红棕色B .试管内气体无色,是NOC .试管内气体无色,是O 2D .试管内液面高度不变 【答案】B 【详解】试管内装有12mLNO ,然后间歇而缓慢地通入8mL 氧气,依据反应定量关系分析,当一氧化氮和氧气恰好反应生成硝酸发生的反应为:4NO+3O 2+2H 2O=4HNO 3,结合一氧化氮和氧气按照4:3全部溶于水,试管内装有12mL NO ,然后间歇而缓慢地通入8mLO 2,反应后剩余一氧化氮12ml-8×4/3mL=4/3mL 。
故选B 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确C .①③正确D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。

完整版高考化学一轮复习氮及其化合物知识点及练习题一、选择题1.下列每步转化不能通过一步反应就实现的是A.NH3→NO→NO2→HNO3B.Al→Al2O3→Al(OH)3→NaAlO2C.S→SO2→H2SO4→MgSO4D.Fe→FeCl2→Fe(OH)2→Fe(OH)3【答案】B【详解】A.氨气发生催化氧化生成NO,NO与氧气反应生成NO2,NO2溶于水生成硝酸,A正确;B.铝与氧气反应生成氧化铝,氧化铝不溶于水,不能直接转化为氢氧化铝,B错误;C.S燃烧生成SO2,SO2被氯水氧化可以转化为硫酸,硫酸与镁等反应可以生成硫酸镁,C 正确;D.铁与盐酸反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化转化为氢氧化铁,D正确;答案选B。
2.对于硫酸和硝酸的比较中,下列叙述不正确的是()A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装B.稀硫酸和稀硝酸都具有氧化性C.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性D.硫酸和硝酸都是重要的化工原料【答案】C【详解】A. 铝、铁与冷的浓硫酸和浓硝酸发生的钝化,因此冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装,故A正确;B. 稀硫酸和稀硝酸都具有氧化性,稀硫酸和金属反应生成氢气,表现氧化性,稀硝酸和金属反应生成硝酸盐和一氧化氮表现氧化性,故B正确;C. 浓硫酸和浓硝酸都具有很强的腐蚀性,浓硫酸具有脱水性,浓硝酸不具有,故C错误;D. 化工生产中用硝酸、硫酸生产化肥、农药、炸药、燃料,金属加工前的酸洗等,故D正确。
综上所述,答案为C。
3.取三张蓝色石蕊试纸放在玻璃棒上,然后按顺序分别滴加65%的浓HNO3、98.3%的浓H2SO4和新制氯水,三张试纸最后的颜色为A.红、红、红B.白、黑、白C.红、黑、红D.红、黑、白【答案】B【详解】硝酸具有强氧化性,将试纸中的有色物质氧化成无色,最后试纸呈现白色;浓硫酸具有脱水性,试纸和其中的有色物质都是有机物,浓硫酸夺取其中的H、O,只剩下黑色的碳,最后试纸呈黑色;新制氯水具有漂白性,将试纸漂白,最后试纸呈白色;即三张试纸最后呈现的颜色依次为白、黑、白;答案选B。

高考化学一轮复习氮及其化合物 知识点及练习题及答案(1)一、选择题1.下列每步转化不能通过一步反应就实现的是 A .NH 3→NO→NO 2→HNO 3 B .Al→Al 2O 3→Al(OH)3→NaAlO 2 C .S→SO 2→H 2SO 4→MgSO 4 D .Fe→FeCl 2→Fe(OH)2→Fe(OH)3 【答案】B 【详解】A .氨气发生催化氧化生成NO ,NO 与氧气反应生成NO 2,NO 2溶于水生成硝酸,A 正确;B .铝与氧气反应生成氧化铝,氧化铝不溶于水,不能直接转化为氢氧化铝,B 错误;C .S 燃烧生成SO 2,SO 2被氯水氧化可以转化为硫酸,硫酸与镁等反应可以生成硫酸镁,C 正确;D .铁与盐酸反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化转化为氢氧化铁,D 正确; 答案选B 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确 C .①③正确 D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
高考化学一轮复习氮及其化合物知识点总结及答案一、选择题1.一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z反应又生成X,则X是()A.(NH4)2SO4B.NH4NO3C.NH4Cl D.NH4HCO3【答案】B【详解】一种盐与烧碱混合共热,可放出无色气体Y,则Y为NH3,氨气经一系列氧化后的产物再溶于水可得Z溶液,Z溶液为HNO3溶液,Y和Z溶液反应又可生成X,则盐X是硝酸铵,故选B。
2.浅绿色的Fe(NO3)2溶液中逐渐加入少量稀盐酸时,溶液的颜色变化应该是A.颜色变浅B.变为红色C.没有改变D.变为黄色【答案】D【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,三价铁离子为棕黄色;故选:D。
3.起固定氮作用的化学反应是A.雷雨时空气中的 NO转化为NO2B.N2与H2在一定条件下反应生成NH3 C.用NaOH吸收NO2和NO D.工厂用NH3催化氧化制NO【答案】B【详解】A.NO转化为NO2不是固氮作用的反应,选项A错误;B.N2与H2在一定条件下反应生成NH3,是由单质氮气转化为氨气,符合氮的固定的定义,选项B正确;C.用NaOH吸收NO2和NO不是固氮作用的反应,选项C错误;D.用氨气转化为NO不是固氮作用的反应,选项D错误;答案选B。
4.下列气体中,不能用浓硫酸干燥的是()A.CO2B.N2C.SO2D.NH3【答案】D【详解】A. 浓硫酸不和二氧化碳反应,因此可以干燥,A不符合题意,A不选;B. 浓硫酸不和氮气反应,因此可以干燥,B不符合题意,B不选;C. 浓硫酸具有强氧化性,不可以干燥室温下能和浓硫酸发生氧化还原反应的气体例如硫化氢、碘化氢等,但二氧化硫和浓硫酸不能反应,故浓硫酸能干燥二氧化硫,C不选;D. 浓硫酸具有酸性,不可以干燥碱性气体氨气,D符合题意,D选;答案选D。
高考化学一轮复习氮及其化合物知识点及练习题及答案(1)一、选择题1.下列叙述不正确的是A.洒落的汞可用硫粉处理B.浓硫酸可用铁制容器装C.可用氨水清洗试管壁上的氧化铝D.可用稀硝酸清洗试管壁上的银【答案】C【详解】A.汞有毒,常温下能够与硫反应生成硫化汞,撒落的汞可用硫粉处理,故A正确;B.浓硫酸具有强氧化性,常温下能够使铁钝化,所以浓硫酸可用铁制容器装,故B正确;C.氨水为弱碱,不能与氧化铝反应,不能用氨水清洗试管壁上的氧化铝,故C错误;D.硝酸具有强的氧化性,能够氧化单质银,所以可用稀硝酸清洗试管壁上的银,故D正确;故选C。
2.对于硫酸和硝酸的比较中,下列叙述不正确的是()A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装B.稀硫酸和稀硝酸都具有氧化性C.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性D.硫酸和硝酸都是重要的化工原料【答案】C【详解】A. 铝、铁与冷的浓硫酸和浓硝酸发生的钝化,因此冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装,故A正确;B. 稀硫酸和稀硝酸都具有氧化性,稀硫酸和金属反应生成氢气,表现氧化性,稀硝酸和金属反应生成硝酸盐和一氧化氮表现氧化性,故B正确;C. 浓硫酸和浓硝酸都具有很强的腐蚀性,浓硫酸具有脱水性,浓硝酸不具有,故C错误;D. 化工生产中用硝酸、硫酸生产化肥、农药、炸药、燃料,金属加工前的酸洗等,故D正确。
综上所述,答案为C。
3.除去铝制品表面的铜镀层,宜选用的试剂是()A.稀盐酸B.氯化钠溶液C.水D.浓硝酸【答案】D【详解】室温下,铜和浓硝酸反应生成硝酸铜而溶解,铝在冷的浓硝酸中钝化而不溶解,因此除去铝制品表面的铜镀层,宜选用的试剂是浓硝酸,故D正确;答案选D。
4.如图所示,集气瓶内充满某混合气体,将集气瓶置于光亮处,然后挤压胶头滴管使胶头滴管内的水进入集气瓶,发现烧杯中的水会倒吸进入集气瓶,则集气瓶内的混合气体可能是( )CO ①、2O 3NH ②、2O 2NO ③、2O 2N ④、2HA .①②B .②④C .③④D .②③【答案】D 【详解】①一氧化碳与氧气在点燃条件下反应,在光照条件下不反应,且一氧化碳不溶于水,氧气难溶于水,压强几乎不变化,烧杯中的水不会进入,故①不符合题意;②氨气和氧气在光照条件下不反应,但氨气易溶于水,将滴管内的水挤入集气瓶后,集气瓶内压强减小,烧杯中的水进入集气瓶,故②符合题意;③二氧化氮和氧气与水反应生成硝酸,将滴管内的水挤入集气瓶后,集气瓶内压强减小,烧杯中的水进入集气瓶,故③符合题意;④氮气与氢气在催化剂、加热条件下反应,在光照条件下不反应,且氮气与氢气都难溶于水,压强不变化,烧杯中的水不会进入,故④不符合题意; 答案选D 。
完整版高考化学一轮复习氮及其化合物 (讲义及答案)及答案一、选择题1.已知氨气极易溶于水,而难溶于有机溶剂CCl4.下列装置中不适宜做氨气的尾气吸收的是( )A.B.C.D.【答案】C【详解】A.水的密度比四氯化碳小,四氯化碳不能和氨气反应,也不溶解氨气,该装置可以防止倒吸,可用于吸收氨气,故A不合题意;B.使用倒置的漏斗,可以防止倒吸,可用于吸收氨气尾气,故B不合题意;C.氨气极易溶于水,玻璃管插入水中会产生倒吸,故C符合题意;D.球形漏斗可以防止倒吸,可用于吸收氨气尾气,故D不合题意;故选C。
2.有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为( )A.1∶4B.2∶3C.1∶3D.4∶1【答案】B【详解】设NO的体积为amL,则NO2的体积为(10-a)mL,倒置于盛有水的水槽中,发生3NO2+H2O=2HNO3+NO,根据反应方程式,生成NO的体积为10a3-mL,充分反应后,6mL气体为NO,因此有a+10a3-=6,解得a=4,NO和NO2的体积比为4mL:(10-4)mL=4:6=2:3,答案选B。
3.自然界的氮循环如下图所示,下列说法不正确的是()A .①中N 2与O 2反应生成NOB .②中合成氨属于人工固氮C .③中氮元素只被氧化D .氧元素参与了氮循环 【答案】C 【详解】A. N 2和O 2在放电作用下化合,生成NO ,NO 被氧化生成NO 2,NO 2溶于水生成硝酸,故A 正确;B. 氮的固定是指氮元素由游离态变为化合态的过程,大气中氮气转化成氮肥属于人工固氮,故B 正确;C. ③中细菌还原硝酸根中正五价的氮,生成无污染的0价的氮气,所以③中氮元素被还原,而不是被氧化,故C 错误;D. 如N 2在放电条件下与O 2直接化合生成无色且不溶于水的一氧化氮气体,氧元素参与,二氧化氮易与水反应生成硝酸(HNO 3)和一氧化氮,3NO 2+H 2O =2HNO 3+NO ,氧元素参加,故D 正确;题目要求选不正确的,故选C 。
魁夺市安身阳光实验学校排查落实练八 硫、氮及其化合物一、重要方程式的书写 1. 硫及其化合物(1)知识网络构建 (2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
①S 溶于热的烧碱溶液生成两种钠盐3S +6OH -=====△2S 2-+SO 2-3+3H 2O ;②把H 2S 气体通入CuSO 4溶液中 H 2S +Cu 2+===CuS↓+2H +; ③Na 2S 溶液在空气中放置变浑浊 2S 2-+O 2+2H 2O===2S↓+4OH -;④铜丝在硫蒸气中燃烧2Cu +S 点燃,Cu 2S ; ⑤将SO 2气体通入到氢硫酸中 SO 2+2H 2S===3S↓+2H 2O ;⑥把H 2S 气体通入到FeCl 3溶液中 H 2S +2Fe 3+===S↓+2Fe 2++2H +;⑦SO 2通入足量的澄清石灰水SO 2+Ca 2++2OH -===CaSO 3↓+H 2O ; ⑧SO 2通入溴水中,使溴水褪色 SO 2+Br 2+2H 2O===SO 2-4+2Br -+4H +; ⑨用足量氨水吸收SO 2尾气2NH 3·H 2O +SO 2===2NH +4+SO 2-3+H 2O ; ○10Cu 和浓硫酸的反应 Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O ;⑪C 和浓硫酸反应C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O ; ⑫把浓H 2SO 4滴到Na 2SO 3固体上H 2SO 4(浓)+Na 2SO 3===Na 2SO 4+H 2O +SO 2↑。
2. 氮及其化合物(1)知识网络构建 (2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
①N 2和H 2的反应N 2+3H 2高温、高压催化剂2NH 3;②把NH 3通入水中 NH 3+H 2ONH 3·H 2ONH +4+OH -;③实验室利用NH 4Cl 固体、Ca(OH)2固体混合加热制备NH 3 2NH 4Cl +Ca(OH)2=====△2NH 3↑+2H 2O +CaCl 2;④NH 3的催化氧化4NH 3+5O 2=====催化剂△4NO +6H 2O ;⑤NH 4HCO 3溶液中加入过量稀NaOH 溶液 NH +4+HCO -3+2OH -===NH 3·H 2O +CO 2-3+H 2O ; ⑥NO 2溶于水3NO 2+H 2O===2H ++2NO -3+NO ; ⑦NO 2被烧碱溶液吸收生成两种钠盐 2NO 2+2OH -===NO -3+NO -2+H 2O ;⑧物质的量之比为1∶1的NO 和NO 2混合气体恰好被烧碱溶液吸收生成一种钠盐NO +NO 2+2OH -===2NO -2+H 2O ; ⑨Cu 和稀HNO 3的反应3Cu +8H ++2NO -3===3Cu 2++2NO↑+4H 2O ; ⑩Cu 和浓HNO 3的反应Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O ; ⑪Fe 和过量稀HNO 3的反应Fe +4H ++NO -3===Fe 3++NO↑+2H 2O ; ⑫C 和浓HNO 3的反应C +4H ++4NO -3=====△CO 2↑+4NO 2↑+2H 2O ;⑬浓硝酸见光分解(化学方程式) 4HNO 3(浓)=====光照4NO 2↑+O 2↑+2H 2O 。
排查落实练八硫、氮及其化合物一、硫及其化合物1. 知识网络构建2. 重要反应必练写出下列反应的方程式,是离子反应的写出离子方程式。
(1)硫粉和铁粉共热:_____________________________(2)将H2S气体通入CuSO4溶液中:______________________(3)将H2S气体通入FeCl3溶液中:________________________(4)H2S气体在空气中充分燃烧:____________________(5)S与热NaOH溶液的反应:_______________________(6)FeS与稀H2SO4的反应:____________________________(7)FeS与稀HNO3反应:______________________________(8)将H2S气体通入亚硫酸中:______________________(9)SO2通入Br2水中:_____________________________(10)SO2通入酸性KMnO4溶液中:__________________(11)SO2通入FeCl3溶液中:________________________(12)将H2SO4、Na2SO3、Na2S三种溶液混合:______________(13)Cu和浓H2SO4反应:___________________________(14)碳和浓H2SO4反应:________________________(15)FeS2在沸腾炉中的反应:_______________________(16)SO2与O2在催化剂作用下反应:______________________(17)将少量NaHSO4滴到Ba(OH)2溶液中:_______________(18)将Ba(OH)2滴加到NaHSO4溶液中至中性:_______________________________________________答案:(1)S +Fe=====△FeS(2)H 2S +Cu 2+===CuS↓+2H +(3)H 2S +2Fe 3+===2Fe 2++2H ++S↓(4)2H 2S +3O 2=====点燃2SO 2+2H 2O(5)3S +6OH -=====△SO 2-3+2S 2-+3H 2O(6)FeS +2H +===Fe 2++H 2S↑(7)FeS +4H ++NO -3===Fe 3++S↓+NO↑+2H 2O(8)2H 2S +H 2SO 3===3S↓+3H 2O(9)SO 2+Br 2+2H 2O===SO 2-4+2Br -+4H +(10)5SO 2+2MnO -4+2H 2O===5SO 2-4+2Mn 2++4H +(11)SO 2+2Fe 3++2H 2O===SO 2-4+2Fe 2++4H +(12)2S 2-+SO 2-3+6H +===3S↓+3H 2O(13)Cu +2H 2SO 4(浓)=====△Cu 2++SO 2-4+SO 2↑+2H 2O(14)C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O(15)4FeS 2+11O 2=====高温2Fe 2O 3+8SO 2(16)2SO 2+O 2催化剂△2SO 3(17)H ++SO 2-4+Ba 2++OH -===BaSO 4↓+H 2O(18)Ba 2++2OH -+SO 2-4+2H +===BaSO 4↓+2H 2O3. 实验现象强化记忆(1)硫在纯O 2中燃烧的现象_____________________________。