课题2原子的构成
- 格式:ppt
- 大小:563.50 KB
- 文档页数:15

课题2 原子的构成【课程目标导航】1.知道原子是由质子、中子和电子构成的。
2.理解原子不显电性的原因。
3.初步了解相对原子质量的概念,学会查相对原子质量表。
(重点)4.核电荷数、核内质子数和核外电子数的关系,相对原子质量概念的形成。
(难点)5.知道原子核外的电子是分层排布的,知道原子结构的表示方法,会画1-18号元素的原子结构示意图。
6.知道原子结构与元素化学性质的关系。
(重难点)7.知道离子的形成过程,会用离子符号正确的表示离子。
(重点)【课堂评价方案】1.通过展示小组讨论结果检测目标2.通过提问检测目标【课前预习方案】1.分子与原子的本质区别是什么?2.原子是不是在任何情况下都是不可分割的实心小球呢?如果不是,那你想象中的原子是什么样的呢?3.构成物质的粒子有、、。
如铁、水、食盐。
4.原子的结构是怎样的?为什么整个原子不显电性。
5.叙述原子和分子、原子和元素的联系与区别。
【自主探究方案】阅读:课本第53页原子的构成一段文字1.同桌互相描述一下原子的结构。
(提示:可从位置、电性、所占体积等不同角度描述。
)2.分子、原子都在不断地运动着,想象一下,构成原子的原子核和电子是如何运动的呢?观察:教师播放的动画:原子内部的运动,概括原子的结构。
分析思考:分析教材第53页表3—1思考并回答下列问题:1.构成原子的三种粒子的电性、质量如何?整个原子的质量主要集中在哪部分?2.原子中有带电的粒子,那么整个原子是否带电?为什么?3.是否所有原子核内都有中子?4.同种原子核内的质子数和中子数有何特点?5.不同种类原子的内部结构有何不同?阅读:课本54—55图文,思考下列问题:1.核外电子是排布的。
2.画出钠原子的原子结构示意图,并说明各部分表示的含义:①圆圈表示、②圆圈内+表示、③数字表示、④弧线表示、⑤弧线上的数字表示。
(原子结构示意图中有五个要素)3.仔细研究1—18号元素原子结构示意图,我们发现原子核外电子的排布特点是:第一层最多排个电子,第二层最多排个电子,第一层后排第二层,第二层后排第三层;最外层最多排个电子。

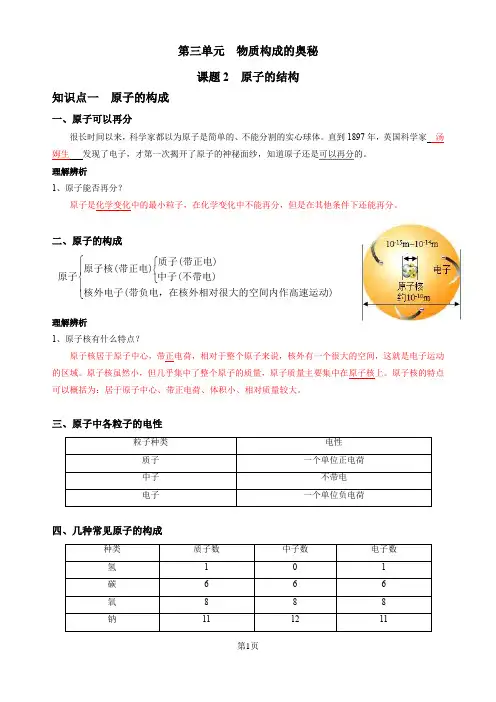
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。
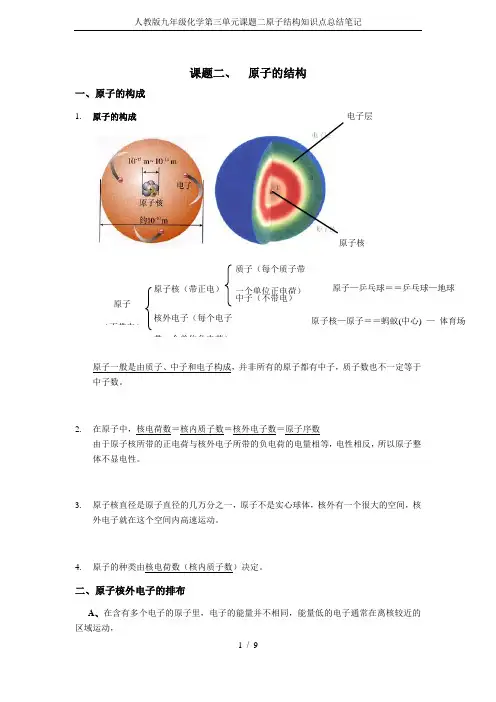
课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。


课题一原子的组成教材内容:新课标人教版教材初三化学(上)第四单元物质组成的神秘。
课题一原子的组成,内容主要包含两个部分:研究原子的组成和学习相关相对原子质量的相关知识。
课标要求:标准活动与研究建议知道原子是由原子核和核外电子写科普小论文:我想象中组成的。
的原子构造。
初步认识相对原子质量的看法,并会查相对原子质量表。
教课目的1.知识与技术:(1)认识原子是由质子、中子和电子组成的;(2)初步认识相对原子质量的看法,并会查相对原子质量表。
2.过程与方法:(1)能充足利用教材供给的图、表等资料,借助模型、多媒体等教课手段,化抽象为直观,初步学会运用类比、想像、归纳、归纳等方法对获取的信息进行加工。
(2)经过议论与沟通,启示学生的思想,逐渐养成优秀的学习习惯和学习方法。
3.感情、态度与价值观:(1)、激发学生对微观世界的研究欲和学习化学的兴趣。
(2)、对学生进行世界的物质性、物质的可分性的辩证唯心主义看法的教育。
教材剖析与设计思想教材剖析物质组成的神秘是初中化学的重要内容之一 ,也是学生此后学习化学的重要理论基础与必不行少的工具。
而原子的组成又是学习物质构造理论和认识元素的基础。
所以,原子的组成是本单元以致整个初中化学学习的要点。
本课题是在学生学习分子、原子的看法的基础上深入研究原子的内部组成及原子不显电性的原由,并介绍相对原子质量。
教材还介绍了为相对原子质量的测定作出优秀贡献的我国科学院院士张青莲教授。
对学生进行爱国主义教育,学情剖析学生在前方学到的微观知识有限,累积的感性知识不充足,而原子的组成内容抽象、远离学生的生活经验,教材语言以结论性的表达型语言为主,这成为本节教课的难点。
教课策略剖析因为本课题教材的特色是内容较抽象,远离学生的生活经验,故教材编排简短简要,内容浅易,并且许多地穿插了图、表等资料,既加强了直观性,了如指掌,又便于进行类比、剖析,启示学生的想像。
还能够初步培育对获取的信息进行加工的能力、训练学生的表达能力。



课题2 原子的结构一、原子的构成⒈构成原子的粒子 质子:一个质子带一个单位的正电荷原子核原子 中子:不带电电子:一个电子带一个单位的负电荷⑴原子核所带电量数称为核电荷数,由于原子核所带电量和核外电子的电量相等,但电性相反,因此原子不显电性。
核电荷数=质子数=核外电子数⑵原子核内的质子数不一定等于中子数,普通的氢原子的原子核内无中子。
⑶原子的种类是由质子数决定的。
⑷原子核只占原子体积的很小一部分,原子内相对有一个很大的空间,电子在这个空间里作高速运动。
二、原子核外电子的排布1、原子中电子的运动是分层运动的,在含多电子的原子里,电子的能量不同能量低的,通常在离核近的区域运动。
能量高的,通常在离核远的区域运动。
为了便于说明问题,通常就用电子层来表明运动着的电子离核远近的不同。
把能量最低、离核最近的叫第一层,能量稍高、离核稍远的叫第二层,由里往外依次类推,叫三、四、五、六、七层(也可分别叫K L M N O P Q 层)。
电子的这种分层运动是没有固定轨道的。
2、原子结构示意图的认识(1)1~20号元素,第一层最多能排2个,其它层最多能排8个,不足的,是几个就排几个。
各层电子数之和等于质子数,原子最外层电子数决定了元素的化学性质!(2)稀有气体元素最外层一般为8个(氦为2),为相对稳定的结构。
(3)非金属元素最外层一般多于4个,在化学反应中易得到电子,形成阴离子,从而达到相对稳定的结构。
(4)金属元素最外层一般少于4个,在化学反应中易失去电子,形成阳离子,从而达到相对稳定的结构。
三、离子1、定义:带电荷的原子(或原子团)。
2、离子符号表示的意义:表示离子(或一个离子),如:Mg 2+——表示镁离子(一个镁离子)2+ 表示每个镁离子带两个单位的正电荷表示两个镁离子⑴离子符号前面的化学计量数(系数)表示离子的个数;⑵离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。


课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。