大鼠睾酮(T)说明书
- 格式:pdf
- 大小:144.57 KB
- 文档页数:3

睾丸酮定量检测试剂盒(酶联免疫法)说明书目录●产品名称●包装规格●预期用途●检验原理●主要组成成分●储存条件及有效期●适用仪器●样本要求●检验方法●参考值(参考范围)●检验结果的解释●检验方法的局限性●产品性能指标●注意事项●参考文献●生产企业●医疗器械生产企业许可证编号●医疗器械注册证书编号●产品标准编号●说明书批准及修改日期产品名称通用名:睾丸酮定量检测试剂盒(酶联免疫法)英文名称:Testosterone ELISA包装规格96人份/盒预期用途定量检测样品血清或血浆中睾丸酮激素(T)的浓度。
睾丸激素(17β-hydroxy-4-androstene-3-one)是C19类固醇,C-4和C-5不饱和结合,C-3酮和C-17羟基在β的位置。
分子量为288.47。
睾丸激素是血液中非常重要的男性激素,由睾丸莱迪希细胞分泌;女性睾丸激素大约50%来自外围雄烯二酮的交换,约25%来自卵巢,约25%来自肾上腺。
睾丸激素维系男性第二性特征,测量这个激素对检查性腺机能非常重要。
对于女性来说,男性型多毛症、男性化、肾上腺肥大、多囊卵巢等都可以导致睾丸激素水平增高;对于男性来说,下丘脑垂体病变,睾丸瘤,先天性肾上腺增生和前列腺疾病等都可导致睾丸激素升高。
睾丸激素水平低则由于垂体机能减退,Klinefelter综合症,睾丸切除术和隐睾病,酶缺陷及自体免疫疾病等引起。
检验原理特异的T抗体包被在每个微孔表面。
样本中的T在微孔中与特异的单克隆抗体、酶结合物(抗-T抗血清结合辣根过氧化物)一起孵育,形成“三明治”夹心。
孵育过后洗脱未结合的物质。
结合的辣根过氧化与样本中睾丸激素的浓度成反比。
添加底物溶液,血清T浓度与显色强度成反比。
主要组成成分1.单克隆抗体包被的可拆卸的96(12×8)孔微孔板1块2.T标准品(0、0.2、0.5、1、2、6、16ng/ml)1ml/瓶7瓶3.酶结合物25ml1瓶4.底物溶液25ml1瓶5.终止液14ml1瓶6.洗液(40X浓缩)30ml1瓶7.说明书1份注:a)不同批号的试剂盒各组份不可以互换使用。
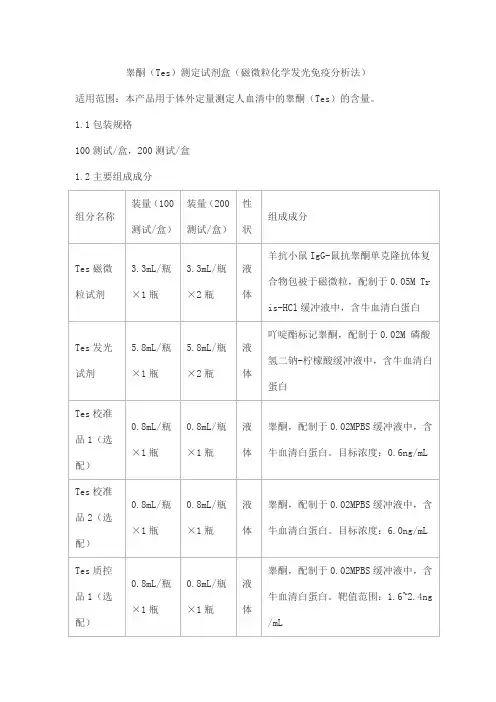
睾酮(Tes)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清中的睾酮(Tes)的含量。
1.1包装规格100测试/盒,200测试/盒1.2主要组成成分注:1.不同批号试剂盒中各组分不可以互换使用。
2. 校准品和质控品具有批特异性,具体浓度见瓶签。
2.1外观试剂盒各组分应齐全、完整、液体无渗漏;磁微粒试剂摇匀后为棕色含固体微粒的均匀悬浊液,无明显凝集;其他液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
2.2 装量各组分装量应不得低于标示体积。
2.3溯源性根据GB/T21415-2008及有关规定,提供试剂盒内校准品的来源、赋值过程以及测量不确定度等内容,溯源至企业一级校准品,一级校准品用纯品质量赋值,与已上市产品比对验证。
2.4线性在[0.2,20.0 ]ng/mL范围内,相关系数r应不低于0.9900。
2.5空白限应不高于0.1 ng/mL。
2.6准确度回收率应在85.0%~115.0%范围内。
2.7重复性变异系数(CV)应不大于8.0%。
2.8质控品的测定值质控品的测定结果均应在规定的质控范围内。
2.9特异性2.9.1 与孕酮(Prog)浓度不低于100 ng/mL的Prog在本试剂盒上的测定结果应不高于0.25 ng/mL。
2.9.2 双氢睾酮浓度不低于10 ng/mL的双氢睾酮在本试剂盒上的测定结果应不高于0.25 ng/mL。
)2.9.3 与雌二醇(E2浓度不低于10 ng/mL的E在本试剂盒上的测定结果应不高于0.25 ng/mL。
22.10批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.0%。
2.11稳定性试剂盒在2~8℃保存,有效期为12个月,在有效期结束的前后两个月内,检测试剂盒的线性、空白限、准确度、重复性、质控品的测定值,应符合相应的规定。
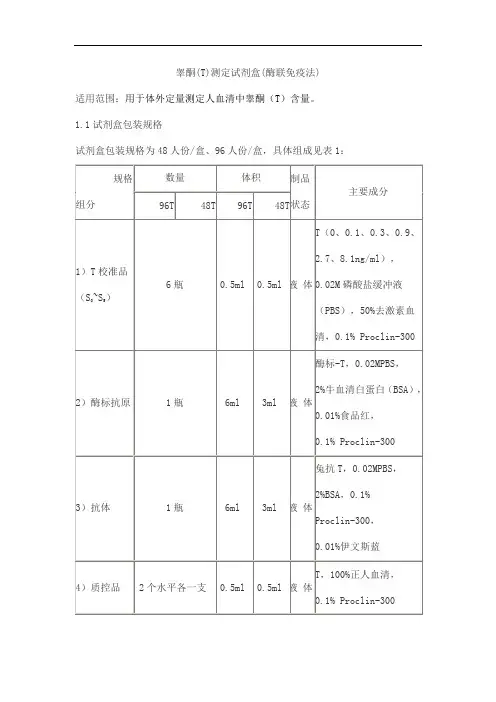
睾酮(T)测定试剂盒(酶联免疫法)
适用范围:用于体外定量测定人血清中睾酮(T)含量。
1.1试剂盒包装规格
试剂盒包装规格为48人份/盒、96人份/盒,具体组成见表1:
2.1外观和物理检查
液体组分应澄清,无沉淀或絮状物;所有组分应无包装破损。
各组分装量不少于表1中要求。
2.2 准确性
在人血清中添加高、中、低三个浓度的睾酮制成样品,以试剂盒校准品进行分析测定,用百分结合率对数(Logit-ln)拟合,要求回收率在85.0%~115.0%之间。
2.3线性
用Logit-ln数学模型拟合,在0.1~8.1ng/ml范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4 精密度
2.4.1批内精密度(CV%)应不高于15.0%。
2.4.2批间精密度(CV%)应不高于15.0%。
2.5 最低检出限
试剂盒最低检出限应不大于0.1ng/ml。
2.6 质控血清测定值
每次检测结果均应在允许范围之内。
2.7 特异性
)没有显著交叉反应。
配制高浓度与孕酮(P)、双氢睾酮(DHT)、雌二醇(E
2
的溶液,测量结果应符合下表。
P 、DHT、E
2
表2 与其它激素的交叉反应数据
2.8 稳定性
2.8.1 37℃放置7天,测定结果应符合上述2.1~2.7项要求。
2.8.2 2~8℃放置12个月后,测定结果应符合上述2.1~2.7项要求。

睾酮说明书睾酮,西药名。
常用剂型为贴剂。
为雄激素类药物。
适用于男性性腺机能减退的睾酮替代治疗,如睾丸切除后、无睾症、睾丸炎、克氏综合征、垂体功能低下、内分泌性阳痿;中老年男子部分性雄激素缺乏综合征等。
药品类型西药、处方药、非医保主要成分本品主要成分为睾酮。
性状睾酮贴剂:无色粘胶体涂布于白色背寸膜上的贴剂。
适应病症本品用于男性性腺机能减退的睾酮替代治疗,如睾丸切除后、无睾症、睾丸炎、克氏综合征、垂体功能低下、内分泌性阳痿;中老年男子部分性雄激素缺乏综合征等。
规格睾酮贴剂:16.3mg(3.3cm×3.03cm)。
用法用量本品不同剂型、不同规格的用法用量可能存在差异,请阅读具体药物说明书使用,或遵医嘱。
睾酮贴剂:1、每晚大约10点在相同时间使用。
揭掉贴剂保护膜后,应立即贴敷于背部、腹部、上臂或双股的清洁、干燥、无外伤的皮肤上,并用手掌压大约十秒钟以保证良好的接触,尤其是边缘。
2、本品用量一日一次,一次4贴,贴用24小时更换。
3、为确保适宜的给药剂量,应定期监测清晨血清睾酮浓度。
使用给药系统一周后,应测定清晨血清睾酮浓度。
如果血清睾酮浓度在正常范围以外,经确认后,需增加或降低日给药剂量。
4、为避免或减少局部皮肤刺激反应,每日更换用药部位。
不良反应1、在一项随机双盲、安慰剂平行对照的多中心临床试验中,有69例患者使用本品治疗达八周时间,不良事件发生率为23.19%。
临床研究显示,本品耐受性好,未发生严重不良事件。
发生频率最高的不良事件为:局部皮肤的刺激反应。
2、69例接受本品治疗八周,发生率超过1%的不良反应:(1)局部用药反应13.04%。
(2)皮疹1.45%。
(3)脓疱性疹1.45%。
(4)睾丸痛1.45%。
(5)盗汗1.45%。
(6)下肢痛1.45%。
(7)听力损伤1.45%。
(8)上呼吸道感染1.45%。
(9)合计23.19%。
3、用药后在用药部位使用氢化可的松软膏可改善轻度的皮肤刺激。
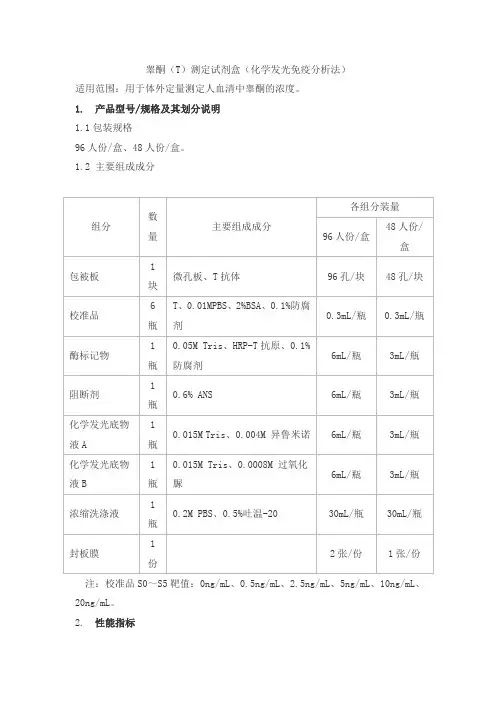
睾酮(T)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中睾酮的浓度。
1. 产品型号/规格及其划分说明1.1包装规格96人份/盒、48人份/盒。
1.2 主要组成成分注:校准品S0~S5靶值:0ng/mL、0.5ng/mL、2.5ng/mL、5ng/mL、10ng/mL、20ng/mL。
2. 性能指标2.1 外观所有液体组分应齐全、澄清,无沉淀或絮状物;包被抗体微孔板的真空袋,应无破损漏气现象;包装完好,液体无渗漏;中文包装标签清晰,无磨损。
2.2 准确度将已知浓度的睾酮加入到正常血清中,其回收率应在85%~115%之间。
2.3 最低检测限最低检测限应不大于0.2ng/mL。
2.4 线性在[0.5,20]ng/mL浓度范围内,相关系数(r)绝对值应不小于0.990。
2.5 重复性用高低两个浓度的样本,各重复检测10次,变异系数(CV)应不大于12.0%。
2.6 批间差用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.7 特异性特异性符合如下要求:a)含浓度不低于50ng/mL的孕酮的零浓度T样本,检测结果不高于0.4ng/mL;b)含浓度不低于10000pg/mL的雌二醇的零浓度T样本,检测结果不高于0.4ng/mL。
2.8 稳定性2℃~8℃放置8个月后,测定结果应符合2.1~2.5各项要求。
2.9 校准品溯源性本产品校准品依照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求进行溯源,本产品校准品溯源至企业校准品,该校准品通过雅培检测系统比对赋值。

睾酮定量分析酶联免疫检测试剂盒- 仅供科学研究使用 -- For reseach use only -1.简介睾酮(17 Hydroxy-4-Androstene-3-on)是C19类固醇激素,分子量288,是哺乳动物最重要的雄性激素之一。
雄性体内的睾酮主要由睾丸合成;雌性由卵巢和肾皮质合成。
在血浆中的睾酮由β球蛋白负责运输,称为性激素结合球蛋白(SHBG)。
在循环系统中,有多达98%的睾酮以结合形式存在,游离睾酮在靶组织中,通过酶降解形成具有生理学活性的二氢睾酮。
睾酮与雄性第二性征的产生有关,测定其浓度对判断性腺发育不全很有意义。
在雌性,睾酮水平增高多见于多毛症,在人类女性中,睾酮水平增高表现女性男性化,多囊卵巢,卵巢癌,肾上腺肿瘤和肾上腺增生。
在人类男性中,睾酮水平增高与下丘脑垂体病变,睾丸肿瘤,先天性肾上腺增生和前列腺癌有关。
低睾酮水平可见于下列疾病:垂体功能减退、先天性睾丸发育不全、睾丸女性化、睾丸切除术、隐睾病、酶缺陷和一些自身免疫性疾病。
2.检测原理睾酮试剂盒采用竞争法检测原理。
在酶标板预包被了高特异性识别睾酮的抗体,同时加入样本和HRP连接的睾酮结合物,样本中睾酮与睾酮结合物竞争性结合酶标板中包被的抗体。
洗去游离的未结合的睾酮与睾酮结合物,加入TMB底物,与抗体结合的睾酮结合物上带的HRP就会催化底物TMB反应,颜色显蓝色,中止后显黄色。
如果样本中睾酮含量越多,则与包被的抗体结合的睾酮结合物则越少,颜色则越浅,即颜色与样本中的浓度成反比。
本试剂盒主要用于定量检测哺乳动物血清、血浆及细胞上清中的睾酮含量3.试剂盒组成3.1、预包被板 12条/6条(96T/48T);3.2、标准品6管,每管0.5ml/0.25ml(96T/48T),浓度如下表:Standard A B C D E Fng/ml 0.2 0.5 1 2 6 163.3、样本稀释液,1瓶16ml/8ml(96T/48T);标准曲线中0浓度标准品以样本稀释液直接加入。
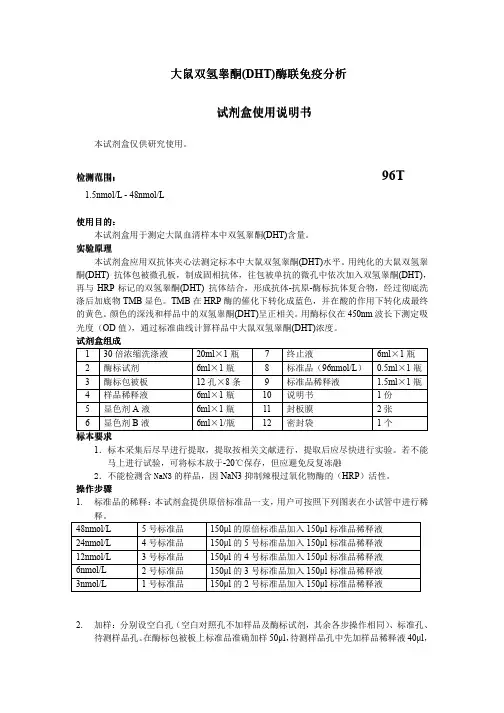
大鼠双氢睾大鼠双氢睾酮酮(DHT)酶联免疫酶联免疫分析分析分析试剂试剂盒使用说明书盒使用说明书盒使用说明书本试剂盒仅供研究使用。
检测范围检测范围:: 96T1.5nmol/L - 48nmol/L使用目的使用目的::本试剂盒用于测定大鼠血清样本中双氢睾酮(DHT)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中大鼠双氢睾酮(DHT)水平。
用纯化的大鼠双氢睾酮(DHT) 抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入双氢睾酮(DHT),再与HRP 标记的双氢睾酮(DHT) 抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的双氢睾酮(DHT)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中大鼠双氢睾酮(DHT)浓度。
试剂盒组成 1 30倍浓缩洗涤液 20ml ×1瓶 7 终止液 6ml ×1瓶 2 酶标试剂 6ml ×1瓶 8 标准品(96nmol/L ) 0.5ml ×1瓶3 酶标包被板 12孔×8条 9 标准品稀释液 1.5ml ×1瓶4 样品稀释液 6ml ×1瓶 10 说明书 1份5 显色剂A 液 6ml ×1瓶 11 封板膜 2张 6显色剂B 液6ml ×1/瓶12密封袋1个标本标本要求要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP )活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
48nmol/L 5号标准品 150µl 的原倍标准品加入150µl 标准品稀释液 24nmol/L 4号标准品 150µl 的5号标准品加入150µl 标准品稀释液 12nmol/L 3号标准品 150µl 的4号标准品加入150µl 标准品稀释液 6nmol/L 2号标准品 150µl 的3号标准品加入150µl 标准品稀释液 3nmol/L1号标准品150µl 的2号标准品加入150µl 标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。

大鼠(Rat)性激素结合球蛋白(SHBG)什么是性激素结合球蛋白?性激素结合球蛋白(Sex hormone-binding globulin,SHBG)是一种存在于血液中的糖蛋白,主要功能是与性激素(如睾酮和雌激素)结合,从而调节它们在体内的生物活性。
SHBG是由肝脏细胞合成的,并通过血液进入到其他组织中。
SHBG的浓度水平在生理和病理过程中都有重要的意义。
大鼠(Rat)SHBG的基本结构大鼠(Rat)SHBG是一种糖基化蛋白,具有两个结构域:N末端的N-亲水性区(N-terminal N-hydrophilic region)和C-末端的C-疏水性区(C-terminal C-hydrophobic region)。
N-亲水性区含有两个亲水性区域和两个端粘合区域;C-疏水性区富含β转角和α螺旋。
大鼠(Rat)SHBG的合成和调节在大鼠(Rat)体内,SHBG的合成主要由肝脏细胞完成。
SHBG的合成和分泌受到多种因素的调节,如雄激素、雌激素、孕激素、卵泡刺激素和睾酮等。
大鼠(Rat)SHBG在生殖系统中的作用SHBG可以结合睾酮和雌激素,通过维持性激素的稳定,对生殖系统具有重要的作用。
SHBG的变化与多种性激素相关性疾病有关,如多囊卵巢综合症、早发性卵巢衰竭和乳腺癌等。
大鼠(Rat)SHBG在其他生理和病理过程中的作用除了在生殖系统中的作用外,SHBG也参与了其他生理和病理过程中。
研究表明,SHBG与类型2糖尿病、肥胖症、心血管疾病和骨代谢疾病等有关。
大鼠(Rat)SHBG作为一种重要的性激素调控蛋白,对生殖系统和其他生理和病理过程都有重要作用。
深入研究SHBG的生物学特性和调节机制,对于进一步认识其在生理和病理过程中的作用,并为性激素相关性疾病的诊断和治疗提供理论依据。

2018年8月研究原著摘要:目的检测SD 雄性大鼠不同月龄相关性激素水平变化及规律,探讨影响性激素的因素,为今后雄性激素相关实验提供正常参考值。
方法取20只1月龄雄性SD 大鼠(体重80~121g ),相同饲养条件下,每5只1笼饲养,所有大鼠均从1月龄(幼年)一直养到实验结束。
分别在1、4、24月龄检测20只雄性SD 大鼠的促卵泡刺激素(FSH )、促黄体生成素(LH )、睾酮(T )水平,每只均测定2次,比较1、4、24月龄大鼠的性激素水平。
结果经检测,1月龄(幼年)、4月龄(成年)、24月龄(老年)SD 雄性大鼠的血清FSH 、T 水平比较,差异有统计学意义(P <0.05);1月龄(幼年)、4月龄(成年)、24月龄(老年)SD 雄性大鼠的血清LH 水平比较,差异无统计学意义(P >0.05)。
结论随着SD 大鼠月龄的增加,FSH 水平逐渐降低,LH 处于低水平且变化不明显,T 水平随着年龄的增长先由低逐渐升高,进入成年期后逐渐降低。
关键词:SD 雄性大鼠;促卵泡刺激素(FSH );促黄体生成素(LH );睾酮(T )中图分类号:R 332文献标志码:A 文章编号:2096-1413(2018)23-0004-02Associated sex hormone levels in different age of SD male ratsZHANG Guo-fei,WU Yue,DENG Wei,CHEN An-long,DING Xing-wang,SHI Jing(Urology Surgery Department,the Sixth Affiliated Hospital of Xinjiang Medical University,Urumqi 830002,China)ABSTRACT:Objective To detect the changes and regularity of sex hormones in SD male rats at different ages,and to explore the factors affecting sex hormones,and provides normal reference values for male hormone related experiments in the future.Methods Twenty male SD rats of 1month old were selected(body weight 80-121g),every 5rats were kept in one cage under the same feeding conditions,and all rats were raised from 1month old (young age)to the end of the experiment.The follicle stimulating hormone (FSH),luteinizing hormone (LH)and testosterone (T)levels of 20SD rats were detected at 1,4and 24months,each data was measured 2times,and the levels of sex hormones of rats at 1,4and 24months were compared.Results The levels of serum FSH and T in the SD male rats of 1month old (young),4months old (adult)and 24months old (old)were significantly different after detection (P <0.05).There were no significant differences in the levels of serum LH between the SD male rats of 1month old (young),4months old (adult)and 24months old (old)(P >0.05).Conclusion With the increase of the age of SD rats,the level of FSH gradually decreased,LH was at a low level and the change was not obvious,and the level of T increased gradually from low to high and gradually decreased after entering adulthood.KEYWORDS:SD male rats;follicle stimulating hormone (FSH);luteinizing hormone (LH);testosterone (T)DOI :10.19347/ki.2096-1413.201823002基金项目:新疆维吾尔自治区自然科学基金(No.2015211C183)。

睾酮对雄性性行为调控机制研究进展摘要:就近年来睾酮与雄性行为关系的研究作一综述,着重论述了睾酮对性行为调节可能存在的机制,其中包括睾丸代谢的芳香化假说,雌雄激素受体的作用,性行为调节的快速机制,睾酮、一氧化氮和多巴胺三者对性行为调节的关系以及睾酮可能起作用的脑区。
关键词:睾酮性行为雌二醇受体睾酮(T)是主要的男性性激素,主要由的睾丸间质细胞分泌。
早期的研究发现,雄性大鼠阉割后插入延时在阉割不久后开始延长,且射精前插入次数在阉割后急剧减少。
阉割后性行为的消失依据严格的顺序:首先射精停止,然后插入停止,最后是骑跨消失。
而T注射按照相反的顺序恢复性行为,这说明了T能调节雄性性行为。
所以,T对调节性行为的机制一直是研究热点,本文就这一方面的研究作一综述。
一、睾酮代谢对性行为的调节1.睾酮调节的芳香化假说T一方面,可由芳香化酶P450转化为17β雌二醇(E2);另一方面,可由5α-还原酶转化为二氢睾酮(DHT),然后分别通过雌激素受体α、β(ERα、ERβ)和雄激素受体(AR)调控雄性个体的性行为。
早期的研究表明,在大鼠中E2能够恢复阉割大鼠大多数的交配反应。
此外,皮下注射芳香化酶抑制剂和ER抑制剂能够抑制T对阉割雄鼠的性行为的恢复。
相反,DHT和不能芳香化的雄激素methyltrienolone不能恢复或维持阉割雄鼠的交配行为。
由此在20世纪70年代提出了睾酮对性行为调节的芳香化假说:睾酮主要通过芳香化转化为雌二醇来调节雄性个体性行为。
但是,E2并不足以维持所有的性行为。
与T处理或E2+DHT 处理的阉割大鼠相比,E2处理的阉割大鼠不能射精或射精次数很少。
此外,AR 拮抗剂flutamide抑制T在阉割大鼠中恢复交配行为的能力。
因此性行为的完全表现需要雌激素和雄激素的共同参与。
2.雌激素受体和芳香化酶的基因研究ERα基因敲除(ERαKO)小鼠骑跨正常,但插入减少,而射精几乎消失;而阉割ERαKO小鼠用T处理或用高于正常剂量的DHT处理显示骑跨能力的部分恢复,但为未出现射精。

睾酮定量分析酶联免疫检测试剂盒- 仅供科学研究使用 -- For reseach use only -1.简介睾酮(17 Hydroxy-4-Androstene-3-on)是C19类固醇激素,分子量288,是哺乳动物最重要的雄性激素之一。
雄性体内的睾酮主要由睾丸合成;雌性由卵巢和肾皮质合成。
在血浆中的睾酮由β球蛋白负责运输,称为性激素结合球蛋白(SHBG)。
在循环系统中,有多达98%的睾酮以结合形式存在,游离睾酮在靶组织中,通过酶降解形成具有生理学活性的二氢睾酮。
睾酮与雄性第二性征的产生有关,测定其浓度对判断性腺发育不全很有意义。
在雌性,睾酮水平增高多见于多毛症,在人类女性中,睾酮水平增高表现女性男性化,多囊卵巢,卵巢癌,肾上腺肿瘤和肾上腺增生。
在人类男性中,睾酮水平增高与下丘脑垂体病变,睾丸肿瘤,先天性肾上腺增生和前列腺癌有关。
低睾酮水平可见于下列疾病:垂体功能减退、先天性睾丸发育不全、睾丸女性化、睾丸切除术、隐睾病、酶缺陷和一些自身免疫性疾病。
2.检测原理睾酮试剂盒采用竞争法检测原理。
在酶标板预包被了高特异性识别睾酮的抗体,同时加入样本和HRP连接的睾酮结合物,样本中睾酮与睾酮结合物竞争性结合酶标板中包被的抗体。
洗去游离的未结合的睾酮与睾酮结合物,加入TMB底物,与抗体结合的睾酮结合物上带的HRP就会催化底物TMB反应,颜色显蓝色,中止后显黄色。
如果样本中睾酮含量越多,则与包被的抗体结合的睾酮结合物则越少,颜色则越浅,即颜色与样本中的浓度成反比。
本试剂盒主要用于定量检测哺乳动物血清、血浆及细胞上清中的睾酮含量3.试剂盒组成3.1、预包被板 12条/6条(96T/48T);3.2、标准品6管,每管0.5ml/0.25ml(96T/48T),浓度如下表:Standard A B C D E Fng/ml 0.2 0.5 1 2 6 163.3、样本稀释液,1瓶16ml/8ml(96T/48T);标准曲线中0浓度标准品以样本稀释液直接加入。
小鼠睾酮(T)酶联免疫吸附测定试剂盒使用说明书本试剂盒仅供研究使用检测范围:0.1ng/ml-25.6ng/ml特异性:本试剂盒可同时检测天然或重组的睾酮,且与其他相关蛋白基本无交叉反应。
有效期:6个月(2-8℃避光保存)预期应用:ELISA法定量测定小鼠血清,血浆及其它相关生物液体中睾酮含量。
说明1.浓洗涤液低温保存会有盐析出,稀释时可在水浴中加温助溶。
2.刚开启的酶联板孔中可能会含有少许水样物质,此为正常现象,不会对实验结果造成任何影响。
实验原理采用竞争酶联免疫法法检测睾酮含量。
首先用一株单抗体包被微孔板,制备成固相抗体,然后加入待测标本及辣根过氧化物酶标记的另一株单抗,使之形成包被抗体-睾酮-酶标记抗体的复合物。
经显色后在酶标仪测定吸光值(OD值),通过计算机或作图拟合浓度-吸光度曲线,反算出待测标本中睾酮含量。
试剂盒组成及试剂配制1.酶联板(Assay plate):一块(96孔)。
2.标准品(Standard):5瓶(冻干品)。
标准品为冻干品,使用前分别用0.5ml蒸馏水溶解,溶解后浓度分别为:Standard1Standard2Standard3Standard4Standard50.1ng/ml0.4ng/ml1.6ng/ml6.4ng/ml25.6ng/ml3.酶结合物(HRP-conjugated antibody):1×6ml/瓶。
4.显色剂A(Substrate A):1×7ml/瓶。
5.显色剂B(Substrate B):1×7ml/瓶。
6.浓洗涤液(Wash Buffer):1×15ml/瓶,使用时每瓶用蒸馏水稀释20倍。
7.终止液(Stop Solution):1×7ml/瓶需要而未提供的试剂和器材1.标准规格酶标仪2.高速离心机3.电热恒温培养箱4.干净的试管和Eppendof管5.系列可调节移液器及吸头,一次检测样品较多时,最好用多通道移液器6.蒸馏水,容量瓶等标本的采集及保存1.血清:全血标本请于室温放置2小时或4℃过夜后于1000x g离心20分钟,取上清即可检测,或将标本放于-20℃或-80℃保存,但应避免反复冻融。
睾酮对雄性性行为调控机制研究进展作者:汪明明来源:《中国校外教育·理论》2010年第12期摘要:就近年来睾酮与雄性行为关系的研究作一综述,着重论述了睾酮对性行为调节可能存在的机制,其中包括睾丸代谢的芳香化假说,雌雄激素受体的作用,性行为调节的快速机制,睾酮、一氧化氮和多巴胺三者对性行为调节的关系以及睾酮可能起作用的脑区。
关键词:睾酮性行为雌二醇受体睾酮(T)是主要的男性性激素,主要由的睾丸间质细胞分泌。
早期的研究发现,雄性大鼠阉割后插入延时在阉割不久后开始延长,且射精前插入次数在阉割后急剧减少。
阉割后性行为的消失依据严格的顺序:首先射精停止,然后插入停止,最后是骑跨消失。
而T注射按照相反的顺序恢复性行为,这说明了T能调节雄性性行为。
所以,T对调节性行为的机制一直是研究热点,本文就这一方面的研究作一综述。
一、睾酮代谢对性行为的调节1.睾酮调节的芳香化假说T一方面,可由芳香化酶P450转化为17β雌二醇(E2);另一方面,可由5α-还原酶转化为二氢睾酮(DHT),然后分别通过雌激素受体α、β(ERα、ERβ)和雄激素受体(AR)调控雄性个体的性行为。
早期的研究表明,在大鼠中E2能够恢复阉割大鼠大多数的交配反应。
此外,皮下注射芳香化酶抑制剂和ER抑制剂能够抑制T对阉割雄鼠的性行为的恢复。
相反,DHT和不能芳香化的雄激素methyltrienolone不能恢复或维持阉割雄鼠的交配行为。
由此在20世纪70年代提出了睾酮对性行为调节的芳香化假说:睾酮主要通过芳香化转化为雌二醇来调节雄性个体性行为。
但是,E2并不足以维持所有的性行为。
与T处理或E2+DHT处理的阉割大鼠相比,E2处理的阉割大鼠不能射精或射精次数很少。
此外,AR拮抗剂flutamide抑制T 在阉割大鼠中恢复交配行为的能力。
因此性行为的完全表现需要雌激素和雄激素的共同参与。
2.雌激素受体和芳香化酶的基因研究ERα基因敲除(ERαKO)小鼠骑跨正常,但插入减少,而射精几乎消失;而阉割ERαKO 小鼠用T处理或用高于正常剂量的DHT处理显示骑跨能力的部分恢复,但为未出现射精。
Rat Free Testosterone(F-TESTO) ELISA KitCatalog Number: MBS704301For the quantitative determination of endogenic rat free testosterone (F-TESTO) concentrations in serum, plasma.This package insert must be read in its entirety before using this product.PRINCIPLE OF THE ASSAYThis assay employs the competitive inhibition enzyme immunoassay technique. The microtiter plate provided in this kit has been pre-coated with goat-anti-rabbit antibody. Standards or samples are added to the appropriate microtiter plate wells with an antibody specific for Testosterone and Horseradish Peroxidase (HRP) conjugated Testosterone. The competitive inhibition reaction is launched between with HRP labeled Testosterone and unlabeled Testosterone with the antibody. Asubstrate solution is added to the wells and the color develops in opposite to the amount of F-TESTO in the sample. The color development is stopped and the intensity of the color is measured. DETECTION RANGE 0.3 pg/ml-60 pg/ml. SENSITIVITYThe minimum detectable dose of rat F-TESTO is typically less than 0.15 pg/ml.The sensitivity of this assay, or Lower Limit of Detection (LLD) was defined as the lowest rat F-TESTO concentration that could be differentiated from zero. SPECIFICITYThis assay has high sensitivity and excellent specificity for detection of rat F-TESTO. No significant cross-reactivity or interference between rat F-TESTO and analogues was observed.Note: Limited by current skills and knowledge, it is impossible for us to complete the cross-reactivity detection between rat F-TESTO and all the analogues, therefore, cross reaction may still exist.PRECISIONIntra-assay Precision (Precision within an assay): CV%<15%Three samples of known concentration were tested twenty times on one plate to assess. Inter-assay Precision (Precision between assays): CV%<15%Three samples of known concentration were tested in twenty assays to assess. LIMITATIONS OF THE PROCEDURE● FOR RESEARCH USE ONLY. NOT FOR USE IN DIAGNOSTIC PROCEDURES. ● The kit should not be used beyond the expiration date on the kit label. ● Do not mix or substitute reagents with those from other lots or sources.● If samples generate values higher than the highest standard, dilute the samples and repeat the assay.●Any variation in operator, pipetting technique, washing technique, incubation time or temperature, and kit age can cause variation in binding.●This assay is designed to eliminate interference by soluble receptors, binding proteins, and other factors present in biological samples. Until all factors have been tested in the Immunoassay, the possibility of interference cannot be excluded.My B io S o ur ceMATERIALS PROVIDED Reagents Quantity Assay plate 1(96 wells) Standard 6 x 0.5 ml Antibody1 x 6 ml HRP-conjugate1 x 6 ml Wash Buffer (20 x concentrate) 1 x 15 ml Substrate A 1 x 7 ml Substrate B 1 x 7 ml Stop Solution1 x 7 ml Adhesive Strip (For 96 wells) 4 Instruction manual1STANDARD CONCENTRATIONStandard S0 S1 S2 S3 S4 S5 Concentration(pg/ml) 00.31.24.81560STORAGE Unopened kit Store at 2 - 8°C. Do not use the kit beyond the expiration date.Opened kitMay be stored for up to one month at 2 - 8° C.*Provided this is within the expiration date of the kit. OTHER SUPPLIES REQUIREDMicroplate reader capable of measuring absorbance at 450 nm, with the correction wavelength set at 600 nm - 630 nm.An incubator which can provide stable incubation conditions up to 37°C±0.5°C. Squirt bottle, manifold dispenser, or automated microplate washer. Absorbent paper for blotting the microtiter plate. 100 mL and 500 mL graduated cylinders. Deionized or distilled water. Pipettes and pipette tips.Test tubes for dilution.PRECAUTIONSThe Stop Solution provided with this kit is an acid solution. Wear eye, hand, face, and clothing protection when using this material.SAMPLE COLLECTION AND STORAGE●Serum Use a serum separator tube (SST) and allow samples to clot for two hours at room temperature or overnight at 4°C before centrifugation for 15 minutes at 1000 ×g. Remove serum and assay immediately or aliquot and store samples at -20°C or -80°C. Avoid repeated freeze-thaw cycles.●Plasma Collect plasma using EDTA, or heparin as an anticoagulant. Centrifuge for 15 minutes at 1000 ×g at 2-8°C within 30 minutes of collection. Assay immediately or aliquot and store samples at -20°C or -80°C. Avoid repeated freeze-thaw cycles.Note:1. The supplier is only responsible for the kit itself, but not for the samples consumed during the assay. The user shouldcalculate the possible amount of the samples used in the whole test. Please reserve sufficient samples in advance. 2.Samples to be used within 5 days may be stored at 2-8°C, otherwise samples must be stored at -20°C (≤1month) or -80°C (≤2month) to avoid loss of bioactivity and contamination.My B io S o ur ce3. Grossly hemolyzed samples are not suitable for use in this assay.4. If the samples are not indicated in the manual, a preliminary experiment to determine the validity of the kit is necessary.5. Please predict the concentration before assaying. If values for these are not within the range of the standard curve, users must determine the optimal sample dilutions for their particular experiments.6. Tissue or cell extraction samples prepared by chemical lysis buffer may cause unexpected ELISA results due to the impacts of certain chemicals.7.Owing to the possibility of mismatching between antigen from other resource and antibody used in our kits (e.g., antibody targets conformational epitope rather than linear epitope), some native or recombinant proteins from other manufacturers may not be recognized by our products.8. Influenced by the factors including cell viability, cell number and also sampling time, samples from cell culture supernatant may not be detected by the kit.9.Fresh samples without long time storage are recommended for the test. Otherwise, protein degradation and denaturalization may occur in those samples and finally lead to wrong results.REAGENT PREPARATIONNote:● Kindly use graduated containers to prepare the reagent.● Bring all reagents to room temperature (18-25°C) before use for 30min. ●Distilled water is recommended to be used to make the preparation for reagents. Contaminated water or container forreagent preparation will influence the detection result.● Wash Buffer(1x)- If crystals have formed in the concentrate, warm up to room temperature and mix gently until the crystals have completely dissolved. Dilute 15 ml of Wash Buffer Concentrate (20 x) into deionized or distilled water to prepare 300 ml of Wash Buffer (1 x).ASSAY PROCEDUREBring all reagents and samples to room temperature before use. Centrifuge the sample again after thawing before the assay. It is recommended that all samples and standards be assayed in duplicate.1. Prepare all reagents and samples as directed in the previous sections.2. Determine the number of wells to be used and put any remaining wells and the desiccant back into the pouch and sealthe ziploc, store unused wells at 4°C. 3.Set a Blank well without any solution.4. Add 50μl of Standard or Sample per well. Standard need test in duplicate.5. Add 50μl of HRP-conjugate to each well (not to Blank well), then 50μl Antibody to each well. Mix well and thenincubate for 1 hour at 37°C.6. Aspirate each well and wash, repeating the process two times for a total of three washes. Wash by filling each wellwith Wash Buffer (200μl) using a squirt bottle, multi-channel pipette, manifold dispenser, or autowasher, and let it stand for 10 seconds, complete removal of liquid at each step is essential to good performance. After the last wash, remove any remaining Wash Buffer by aspirating or decanting. Invert the plate and blot it against clean paper towels. 7. Add 50μl of Substrate A and 50μl of Substrate B to each well, mix well. Incubate for 15 minutes at 37°C. Keeping theplate away from drafts and other temperature fluctuations in the dark.8. Add 50μl of Stop Solution to each well, gently tap the plate to ensure thorough mixing.9. Determine the optical density of each well within 10 minutes, using a microplate reader set to 450 nm.Note:1. The final experimental results will be closely related to validity of the products, operation skills of the end users and theexperimental environments.My B io S o ur ce2. Samples or reagents addition: Please carefully add samples to wells and mix gently to avoid foaming. Do not touch the well wall as possible. For each step in the procedure, total dispensing time for addition of reagents or samples to the assay plate should not exceed 10 minutes. This will ensure equal elapsed time for each pipetting step, without interruption. Duplication of all standards and specimens, although not required, is recommended. To avoid cross-contamination, change pipette tips between additions of each standard level, between sample additions, and between reagent additions. Also, use separate reservoirs for each reagent.3. Incubation: To ensure accurate results, proper adhesion of plate sealers during incubation steps is necessary. Do not allow wells to sit uncovered for extended periods between incubation steps. Once reagents have been added to the well strips, DO NOT let the strips DRY at any time during the assay. Incubation time and temperature must be observed.4.Washing: The wash procedure is critical. Complete removal of liquid at each step is essential to good performance. After the last wash, remove any remaining Wash Solution by aspirating or decanting and remove any drop of water and fingerprint on the bottom of the plate. Insufficient washing will result in poor precision and falsely elevated absorbance reading. When using an automated plate washer, adding a 10 second soak period following the addition of wash buffer, and/or rotating the plate 180 degrees between wash steps may improve assay precision.5. Controlling of reaction time: Observe the change of color after adding Substrates (e.g. observation once every 10 minutes). Substrates should change from colorless or light blue to gradations of blue. If the color is too deep, add Stop Solution in advance to avoid excessively strong reaction which will result in inaccurate absorbance reading.6. Substrates are easily contaminated. Substrates should remain colorless or light blue until added to the plate. Please protect it from light.7.Stop Solution should be added to the plate in the same order as the Substrates. The color developed in the wells will turn from blue to yellow upon addition of the Stop Solution. Wells that are green in color indicate that the Stop Solution has not mixed thoroughly with the Substrates.ASSAY PROCEDURE SUMMARYCALCULATION OF RESULTSUsing the professional soft "Curve Expert" to make a standard curve is recommended, which can be downloaded from our web.Average the duplicate readings for each standard and sample and subtract the average optical density of Blank.Create a standard curve by reducing the data using computer software capable of generating a four parameter logistic (4-PL) curve-fit. As an alternative, construct a standard curve by plotting the mean absorbance for each standard on the x-axis against the concentration on the y-axis and draw a best fit curve through the points on the graph. The data may be linearized by plotting the log of the F-TESTO concentrations versus the log of the O.D. and the best fit line can be determined by regression analysis. This procedure will produce an adequate but less precise fit of the data.If samples have been diluted, the concentration read from the standard curve must be multiplied by the dilution factor.My B io S o ur ce。