碳酸钠的性质与应用(优秀版)
- 格式:ppt
- 大小:812.00 KB
- 文档页数:22


碳酸钠的性质及应用(教案)第一章:碳酸钠的基本概念1.1 物质的名称和化学式1.2 碳酸钠的分类和性质1.3 碳酸钠的制备方法第二章:碳酸钠的物理性质2.1 溶解性2.2 熔点与沸点2.3 密度和热导率第三章:碳酸钠的化学性质3.1 与酸的反应3.2 与碱的反应3.3 氧化还原反应第四章:碳酸钠的应用4.1 玻璃制造4.2 洗涤剂和清洁剂4.3 纺织工业第五章:碳酸钠的安全性和环保性5.1 碳酸钠的毒性5.2 安全操作指南5.3 环保要求和废弃物处理碳酸钠的性质及应用(教案)第六章:碳酸钠在食品工业中的应用6.1 作为食用碱剂的用途6.2 在面包制作中的作用6.3 在肉类加工中的应用第七章:碳酸钠在制药工业中的应用7.1 作为缓冲剂和溶剂的用途7.2 在制药过程中的净化和干燥7.3 作为药物释放系统的成分第八章:碳酸钠在皮革工业中的应用8.1 在鞣革过程中的作用8.2 改善皮革的柔软度和透气性8.3 在染色和涂饰中的应用第九章:碳酸钠在其他工业中的应用9.1 在造纸工业中的作用9.2 在陶瓷和搪瓷工业中的应用9.3 在水处理中的用途第十章:碳酸钠的研究和未来发展10.1 碳酸钠的合成和改性研究10.2 碳酸钠在新能源材料中的应用10.3 碳酸钠的可持续发展和环保前景碳酸钠的性质及应用(教案)第十一章:碳酸钠的工业生产与经济价值11.1 碳酸钠的主要生产方法11.2 工业生产中的技术要求和条件11.3 碳酸钠的经济价值和市场分析第十二章:碳酸钠的实验方法和分析技术12.1 碳酸钠的制备实验12.2 碳酸钠的性质分析实验12.3 碳酸钠应用产品的质量检验第十三章:碳酸钠的环境影响与治理措施13.1 碳酸钠生产过程的环境问题13.2 碳酸钠废水处理和资源化13.3 碳酸钠废气的处理和减排第十四章:碳酸钠的替代品与新产品开发14.1 碳酸钠的替代品研究14.2 碳酸钠新产品开发的方向14.3 碳酸钠衍生物的研究与应用第十五章:碳酸钠的案例分析与教学实践15.1 碳酸钠典型应用案例分析15.2 教学实践中的碳酸钠实验设计15.3 碳酸钠知识在实际教学中的应用讨论重点和难点解析本教案主要介绍了碳酸钠的基本概念、物理性质、化学性质、应用领域以及相关的环保和安全问题。

第1篇一、实验目的1. 了解碳酸钠的物理性质和化学性质;2. 探究碳酸钠在日常生活中的应用;3. 培养学生动手操作能力和实验观察、分析能力。
二、实验原理碳酸钠(Na2CO3),俗称纯碱,是一种白色固体,易溶于水,水溶液呈碱性。
碳酸钠具有以下性质:1. 与酸反应:碳酸钠与酸反应生成二氧化碳气体、水和相应的盐;2. 与金属离子反应:碳酸钠与某些金属离子反应生成沉淀;3. 与有机物反应:碳酸钠与某些有机物反应,可使其发生水解、皂化等反应。
三、实验器材1. 碳酸钠粉末;2. 稀盐酸;3. 氢氧化钙溶液;4. 酚酞试液;5. 烧杯;6. 试管;7. 胶头滴管;8. 玻璃棒;9. 量筒;10. 滤纸;11. 滤液;12. 滤渣。
四、实验步骤1. 取少量碳酸钠粉末放入烧杯中,加入适量水溶解,观察溶液颜色变化;2. 取一支试管,加入少量碳酸钠溶液,滴加几滴酚酞试液,观察溶液颜色变化;3. 取一支试管,加入少量碳酸钠溶液,滴加稀盐酸,观察气泡产生;4. 取一支试管,加入少量碳酸钠溶液,滴加氢氧化钙溶液,观察沉淀生成;5. 将上述实验中产生的沉淀过滤,观察沉淀颜色和溶解性;6. 取一支试管,加入少量碳酸钠溶液,滴加酚酞试液,观察溶液颜色变化;7. 将上述实验中产生的沉淀过滤,观察沉淀颜色和溶解性;8. 将碳酸钠溶液加入含有有机物的溶液中,观察有机物变化。
五、实验现象及结果1. 碳酸钠溶解后,溶液呈无色;2. 加入酚酞试液后,溶液呈红色;3. 加入稀盐酸后,产生大量气泡;4. 加入氢氧化钙溶液后,产生白色沉淀;5. 过滤后,沉淀为白色,不溶于水;6. 再次加入酚酞试液后,溶液呈红色;7. 过滤后,沉淀为白色,不溶于水;8. 将碳酸钠溶液加入含有有机物的溶液中,有机物发生水解、皂化等反应。
六、实验讨论与分析1. 碳酸钠溶解后,溶液呈无色,说明碳酸钠是一种无色固体;2. 加入酚酞试液后,溶液呈红色,说明碳酸钠水溶液呈碱性;3. 加入稀盐酸后,产生大量气泡,说明碳酸钠与酸反应生成二氧化碳气体;4. 加入氢氧化钙溶液后,产生白色沉淀,说明碳酸钠与氢氧化钙反应生成碳酸钙沉淀;5. 过滤后,沉淀为白色,不溶于水,说明碳酸钙是一种不溶于水的白色固体;6. 再次加入酚酞试液后,溶液呈红色,说明碳酸钠水溶液呈碱性;7. 过滤后,沉淀为白色,不溶于水,说明碳酸钙是一种不溶于水的白色固体;8. 将碳酸钠溶液加入含有有机物的溶液中,有机物发生水解、皂化等反应,说明碳酸钠具有催化作用。



碳酸钠的性质和用途说课碳酸钠是一种化学化合物,其化学式为Na2CO3。
它具有多种性质和广泛的用途。
以下是关于碳酸钠性质和用途的详细讲解。
性质:1. 物理性质:- 碳酸钠为无色结晶或白色颗粒,具有碱性。
- 它的相对密度为2.54 g/cm3,熔点为851。
在高温下熔化,形成无色的烧碱液体。
- 在自然界中,碳酸钠以较稀的镁和钠盐的形式存在,如纯碱石、纯碱矿、水合碱石等。
2. 化学性质:- 碳酸钠可溶于水,产生碱性溶液。
溶解度随温度升高而增加。
- 在空气中加热转化为烧碱并释放出二氧化碳气体。
- 它能被强酸(如硫酸)中和生成相应的钠盐,如硫酸钠。
- 碳酸钠也能和酸类产生中和反应,并释放出二氧化碳气体。
例如,碳酸钠和醋酸反应生成乙酸钠、水和二氧化碳气体。
用途:1. 工业用途:- 碳酸钠是纺织工业中最常用的碱性剂。
它用于去除棉纤维和染料中的酸性杂质,并用作染色、绷平和漂白工艺中的中性化剂。
- 它也被广泛应用于玻璃制造过程中,用作玻璃原料和玻璃液的成分。
- 碳酸钠可用于制备肥皂和合成洗涤剂。
- 在皮革工业中,碳酸钠可以用作鞣制过程中的中性化剂。
- 碳酸钠还被用作金属铸造中的熔剂、酸性气体(如二氧化硫和二氧化氮)的中和剂,以及水处理剂。
2. 日常用途:- 碳酸钠被广泛用于烹饪和烘焙中作为酸剂。
它可以促使面团膨胀,增加食物的体积和松软度。
同时,在烘焙过程中,碳酸钠会和酸性成分(如醋、酸奶)反应产生二氧化碳,促使面团发酵膨胀。
- 由于碳酸钠能中和酸性物质,因此它也可以用作胃酸过多引起的消化不良的缓解剂。
- 碳酸钠可以用于清洁和除臭。
它可以去除银器上的黑斑、食物残渣以及常见的油脂和污渍。
- 在池塘或水池的pH调节剂中,碳酸钠可以改善水质并维持适宜的水中生物生长环境。
3. 医疗用途:- 碳酸钠可以在医疗领域用作抗酸治疗剂,如处理胃酸过多引起的酸中毒。
- 它还可以用于治疗某些药物过量引起的酸中毒。
- 碳酸钠还常用于洗眼液和洗剂的配制中,用于清洁和消毒。


碳酸钠物理化学性质及应用碳酸钠(Na2CO3),也被称为碱式碳酸盐,是一种白色结晶性固体。
下面将介绍碳酸钠的物理化学性质及其在各个领域的应用。
1. 物理性质:- 外观:碳酸钠为无色或白色结晶,可溶于水,呈碱性溶液。
- 熔点:862C- 沸点:溶于水时不会发生沸腾。
- 密度:2.54 g/cm³- 溶解性:在室温下,碳酸钠可溶于水,溶液呈碱性;在醇和醚溶剂中也可溶,而在酒精中不溶。
2. 化学性质:- 碱性:碳酸钠是碱性物质,在水中溶解后会产生碳酸根离子(CO3^2-)和氢氧根离子(OH^-),有中和酸性的作用。
- 反应性:碳酸钠能和酸反应,产生二氧化碳气体和对应的盐。
例如,和盐酸反应产生氯化钠盐和二氧化碳气体的反应方程式为:2NaHCO3 + 2HCl -> 2NaCl + CO2 + H2O。
- 腐蚀性:碳酸钠具有一定的腐蚀性,能够腐蚀金属,特别是铝等活泼金属。
- 加热分解:在高温下,碳酸钠会分解,产生二氧化碳和氧化钠。
反应方程式为:2Na2CO3 -> 2Na2O + 3CO2。
3. 应用:- 玻璃工业:碳酸钠是玻璃制造中不可或缺的原料,它能够降低玻璃的熔点,改善玻璃的柔软性和透明度。
- 化学工业:碳酸钠广泛应用于化学工业中,用作酸中和剂、脱硫剂、洗涤剂等。
它能够中和酸性溶液并稳定其酸碱度,也可作为一种浮选剂和沉降剂。
- 污水处理:碳酸钠可用于污水处理,通过调节pH值,降低污水中重金属离子的溶解度,从而使其更易于去除。
- 食品工业:碳酸钠是烘焙食品中常用的发酵剂,能够与酸反应产生二氧化碳气体,使面粉膨胀,增加面团的松软度。
- 清洁用品:碳酸钠可用作清洁剂和漂白剂,在洗衣粉、皂液和洗洁精中常作为主要成分。
它能够中和酸性物质并去除污渍。
- 医药工业:碳酸钠具有一定的碱性,常用于制备不同种类的药物和药剂,比如抗酸药物和抗酸剂。
综上所述,碳酸钠是一种重要的化学物质,具有一系列的物理化学性质。


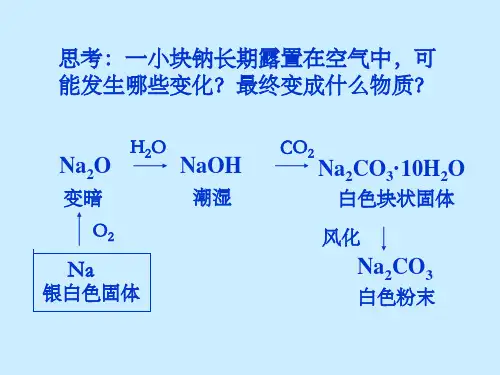
碳酸钠的性质与应用班级 姓名一、知识梳理1.碳酸钠的物理性质:Na 2CO 3俗称纯碱或苏打,是一种白色固体粉末,易溶于水,熔点较高,其晶体含有结晶水,化学式为:Na 2CO 3﹒10H 2O 。
Na 2CO 3+10H 2O Na 2CO 3﹒10H 2O ,该变化是化学变化。
2.碳酸钠的化学性质:(1)碳酸钠与酸反应:Na 2CO 3 +2HCl(2)碳酸钠与某些碱溶液反应:Na 2CO 3 +Ca(OH)2=(3)碳酸钠与某些盐溶液反应:Na 2CO 3 +CaCl 2=(4)碳酸钠与二氧化碳反应:向碳酸钠溶液中通入二氧化碳可以生成碳酸氢钠:碳酸氢钠固体受热易分解得到碳酸钠:(1) 鉴别(2) 除杂① Na 2CO 3(少量NaHCO 3杂质):NaHCO 3(少量Na 2CO 3杂质):5.碳酸钠和碳酸氢钠的用途:(1)碳酸钠在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有广泛应用,也可以用于制造其他钠的化合物。
(2)碳酸氢钠是焙制糕点所用的发酵粉主要成分之一;医疗上可以治疗胃酸过多。
6.侯氏制碱法(又称为联合制碱法)(1)将CO2通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出: 潮解 风化CO2+NaCl+NH3+H2O=NaHCO3↓+NH4Cl(2)过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠。
(3)在过滤后的母液中加入氯化钠粉末,通入氨气,搅拌,经降温后结晶析出产品氯化铵。
练习:一.单选题:1.下列有关碳酸氢钠和碳酸钠性质比较中,正确的是()A.热稳定性:Na2CO3< NaHCO3B.常温时水溶液中的溶解度:Na2CO3< NaHCO3C.等浓度的两种溶液与稀盐酸反应产生气体的快慢:Na2CO3< NaHCO3D.物质的量相同时,消耗盐酸:Na2CO3< NaHCO32.关于NaHCO3的性质,下列说法正确的是()A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少B.相同温度下溶解度比Na2CO3要大C.热稳定性比Na2CO3强D.NaHCO3只能和酸作用不能和碱作用3、下列说法中不正确的是()A、Na2CO3比NaHCO3易溶于水B、Na2CO3比NaHCO3稳定C、石灰水能与Na2CO3反应,而不能与NaHCO3反应D、与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要多4、不能用来鉴别碳酸钠和碳酸氢钠两种白色固体的实验操作是()A、分别加热这两种固体物质,并将生成的气体通入澄清石灰水中B、分别在这两种物质的溶液中,加入氯化钙溶液C、分别在这两种固体中,加入同浓度的稀盐酸D、分别在这两种物质的溶液中,加入少量澄清石灰水5、加热纯碱和小苏打的混合物20g,至质量不再变化时,冷却后称量其固体质量是13.8g,求原混合物中纯碱的质量分数。
碳酸钠性质及应用教案碳酸钠(Na2CO3)是一种无机化合物,其化学式表示为Na2CO3。
以下是关于碳酸钠的性质及应用的教案。
一、碳酸钠的性质1. 化学性质- 碳酸钠是一种白色结晶固体,在高温下可以融化。
它具有较高的溶解度,可以在水中溶解。
- 碳酸钠水溶液呈碱性,可以与酸进行中和反应。
- 碳酸钠可以和其他金属离子反应,形成相应的碳酸盐沉淀物。
- 碳酸钠还可以和酸性溶液中的氢离子反应,产生二氧化碳气体。
2. 物理性质- 碳酸钠的熔点约为854。
- 碳酸钠的密度约为2.54 g/cm³。
- 碳酸钠可以吸湿,易于从空气中吸收水分。
二、碳酸钠的应用1. 环境保护- 碳酸钠被广泛应用于水处理过程中,可用于调节水的pH值。
它可以中和水溶液中的酸性物质,减少水体的酸碱度。
- 碳酸钠可用于气候调节过程中,用于控制大气中的二氧化碳浓度。
- 碳酸钠还用于烟气脱硫过程中,可用于清除烟气中的二氧化硫。
2. 工业应用- 碳酸钠是一种重要的化学原料,在玻璃制造和瓷器制造过程中广泛应用。
它可以降低玻璃和瓷器的熔点,促进熔融过程。
- 碳酸钠也被用作纺织品的碱性调节剂,可用于调节纺织品的pH值,改善纺织品的染色和整理性能。
3. 食品加工- 碳酸钠在食品加工中被广泛使用,例如制作面包和糕点过程中,可以作为发酵剂,产生二氧化碳气泡,使面团膨胀。
- 碳酸钠还用作食品饮料中的酸中和剂,可以中和酸性物质,调节饮料的味道。
4. 医药应用- 碳酸钠被用作医药中的缓冲剂,可用于调节体内的酸碱平衡。
- 碳酸钠还可以作为抗酸药物的主要成分之一,用于缓解胃酸反流引起的胃灼热和不适感。
5. 日常应用- 碳酸钠可作为清洁剂使用,可用于清洁砧板、油烟机等油腻表面。
- 碳酸钠也可用作口腔护理产品中的成分,如牙膏、嘴炮等。
通过教学内容的讲解,学生可以了解碳酸钠的基本性质和广泛应用。
他们可以了解到碳酸钠的化学性质,以及在环境保护、工业、食品加工、医药和日常生活中的应用。