人教版化学选修四第2章 第2节 第2课时 温度催化剂对化学反应速率的影响
- 格式:doc
- 大小:86.72 KB
- 文档页数:6

前言我们分析每年考上清华北大的北京考生的成绩,发现能够考上清北的学生化学的平均分都在95分以上,先开始我们认为,学习能力强的孩子化学一定学得好。
可是在分析没有考上清北的学生的成绩的时候发现,很多与清北失之交臂的学生,化学的平均分要略低,数学物理的分数却不相上下。
我们仔细讨论其中的缘由,通过对学生的调查研究发现一个令人惊讶的结论:化学学的好的学生更容易在理综上考得高分!这是因为化学学的好的学生,能够用更快的速度在理综考试中解决100分的分值,之后孩子可以用更多的时间去处理没有见过的物理难题。
物理的难题在充分的时间中得到更多考虑的空间,使得考生在理综总分上能够有所突破。
所以想上好大学,化学必须学好,化学的使命就是在高考当中帮助考生提速提分。
因此这份资料提供给大家使用,主要包含有一些课件和习题教案。
后序中有提到一些关于学习的建议。
第2课时温度、催化剂对化学反应速率的影响[目标要求] 1.知道温度对化学反应速率影响的结论和理论解释。
2.知道催化剂对化学反应速率影响的结论和理论解释。
1.温度对反应速率的影响(1)影响其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减慢。
(2)原因其他条件相同时,升高温度,提高了活化分子的百分数和较高能量的分子间的碰撞频率,使分子间有效碰撞的几率提高,反应速率增大。
2.催化剂对反应速率的影响(1)影响:使用催化剂可加快反应速率。
(2)原因:催化剂改变了反应的路径,降低了反应所需的活化能,提高了反应体系中活化分子的百分数,使有效碰撞的几率提高,反应速率加快。
(3)根据图象填空。
如图所示,使用催化剂使反应速率加快其中途径Ⅰ表示没使用催化剂。
途径Ⅱ表示使用了催化剂。
使用了催化剂,反应的活化能降低。
图中E1、E2都是该反应的活化能,但E2<E1是因为使用了催化剂,与不使用催化剂相比,反应的活化能由E1变为E2,活化分子的百分数增多。
知识点一温度对化学反应速率的影响1.对于反应:M+N―→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81 min,将温度提高到30℃时,完成反应的10%需要的时间为( )A.9 min B.27 min C.13.5 min D.3 min答案 A解析温度由10℃升高到30℃时,反应速率提高到原来的32倍,设当提高到30℃时,完成反应的10%需要的时间为t min,则32t=81 min,故t=9 min。

第二章化学反应速率和化学平衡第二节影响化学反应速率的因素学习目标1.初步运用有效碰撞理论和活化分子等知识解释外界条件对化学反应速率的影响。
难点2.理解外界条件浓度、温度、压强、催化剂等对化学反应速率的影响。
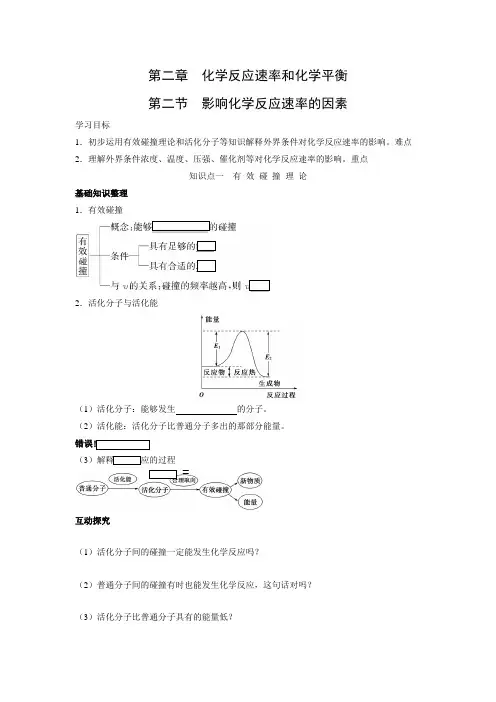
重点知识点一有效碰撞理论基础知识整理1.有效碰撞2.活化分子与活化能(1)活化分子:能够发生的分子。
(2)活化能:活化分子比普通分子多出的那部分能量。
错误!(3)解释化学反应的过程=互动探究(1)活化分子间的碰撞一定能发生化学反应吗?(2)普通分子间的碰撞有时也能发生化学反应,这句话对吗?(3)活化分子比普通分子具有的能量低?(4)化学反应的实质是分子的重新组合?归纳总结1.活化分子与有效碰撞的关系能够发生有效碰撞的一定是活化分子,但是活化分子不一定发生有效碰撞。
并不是反应物分子之间的任何一次直接碰撞都能发生反应,只有那些能量相当高的分子之间的直接碰撞才能发生反应。
2.单位体积内的活化分子数与活化分子百分数单位体积内的活化分子数就是指单位体积内能量达到一定要求的活化分子的总数;而活化分子百分数是活化分子数与总分子数的比值,总分子数包含:活化分子数以及普通分子的个数。
3.活化能与化学反应速率的关系活化能大小主要是由反应物自身的性质决定的改变外界条件也可以改变反应的活化能,如加入催化剂,即反应物自身的性质影响着化学反应所需的活化能,从而影响化学反应速率的大小。
例如:活化能小→普通分子容易变成活化分子→活化分子百分数大→单位体积内活化分子数多→单位时间、单位体积内有效碰撞次数多→化学反应速率大内因对化学反应速率的影响。
即时训练1.有效碰撞是指A.反应物分子间的碰撞B.反应物活化分子间的碰撞C.反应物分子发生合适取向的碰撞D.活化分子之间发生合适取向的碰撞2.下列说法正确的是①活化分子间的碰撞一定能发生化学反应;②普通分子间的碰撞有时也能发生化学反应;③反应物活化能越大,反应越快;④化学反应的实质是原子的重新组合;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程;⑥化学反应的实质是活化分子有合适取向时的有效碰撞。


《选修四第二章第二节温度、催化剂对化学反应速率的影响》导学案(第2课时)高二班第组姓名组内评价教师评价【课标要求】1、掌握温度和催化剂对化学反应速率的影响2、会分析有关速率图像的问题。
【难点重点】1、温度和催化剂等条件对化学反应速率的影响。
2、会分析看懂有关速率图像的问题。
【新课导学】三、温度对反应速率的影响探究3:观察实验2-3,得出温度对化学反应速率是如何影响的?并用有效碰撞模型解释?结论:当其它条件不变时,升高温度,反应的速率;降低温度,反应的速率。
解释:升高温度,活化分子百分数,有效碰撞的频率,导致反应速率增大。
注意:对于可逆反应来说,升高体系的温度,反应物和生成物中的活化分子数都增加,所以,正反应的速率和逆反应的速率都增大。
例2.在10℃时某化学反应速率为0.1 mol·l-1·S-1,若温度每升高10℃,反应速率增加到原来的2倍,为了把该反应速率提高到1.6mol·l-1·S-1则该反应需在什么温度下进行( )A 30℃B 40℃C 50℃D 60℃三、催化剂对反应速率的影响探究4:观察实验2-4,得出催化剂对化学反应速率是如何影响的?并用有效碰撞模型解释?结论:当其它条件不变时,使用应催化剂,反应的速率。
解释:当温度和反应物浓度一定时,使用催化剂可使反应途径发生改变,从而了反应的活化能,使得活化分子的百分比,因此活化分子的数目,有效碰撞频率,故化学反应速率加大。
注意:1.催化剂改变化学反应速率的原因仅仅是改变始态到终态的途径,不改变反应的结果。
例:(1)在加热条件下: 2Cu + O2 == 2CuO 2CuO +2 CH3CH2OH == 2Cu +2 CH3CHO + 2H2O (2)氮的氧化物破坏臭氧: NO + O3 == NO2 + O2 NO2 + O ==NO + O22. 能加快反应速率的催化剂叫正催化剂;能减慢化学反应速率的催化剂叫负催化剂。


(人教版选修4)第二章《化学反应速率和化学平衡》教学设计第二节影响化学反应速率的因素(第二课时温度、催化剂对化学反应速率的影响)【科学探究】已知4H++4I―+O2 == 2I2 +2H2O ,现有1 mol/L KI溶液、0.1 mol/L H2SO4溶液和淀粉溶液,请探究溶液出现蓝色的时间与温度的关系。
【交流】试剂种类及用量 2 mL KI溶液、2滴淀粉溶液、2 mL 稀硫酸实验温度①室温②冰水混合物试剂加入顺序及理由分别向2 mL KI溶液滴加2滴淀粉溶液后,再分别加入2 mL 稀硫酸。
因为在不加酸的情况下,O2不能氧化I―实验现象①室温的一组溶液快出现蓝色结论其他条件相同时,升高温度反应速率加快,降低温度反应速率减慢【问题讨论1】对吸热反应和放热反应,温度对反应速率的影响规律是否相同?【交流】其他条件不变时,升高温度,不管是吸热反应还是放热反应,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子(如图所示)→活化分子百分数增加→有效碰撞次数增多→反应速率增大。
因此,升高温度均可以增大反应速率。
反之,降低温度均可以降低反应速率。
如图:【问题讨论2】通常情况下,你认为温度、浓度、压强对反应速率的影响谁更强一些呢?在日常生活中有哪些应用?【交流1】一般而言,温度对化学反应速率的影响比浓度、压强等对化学反应速率的影响要大,【交流】当其他条件不变时,使用催化剂,化学反应速率增大。
【问题讨论2】请从微观角度对上述规律作出解释。
【交流】使用催化剂→改变了反应的路径(如下图),反应的活化能降低→活化分子的百分数增大→单位时间内有效碰撞几率增加→反应速率加快。
如下图所示:【小组讨论1】我们在讨论催化剂对化学反应速率的影响时,还应注意哪些问题?【交流1】催化剂有正、负之分,一般情况下的催化剂是指正催化剂。
【交流2】催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
【小组讨论2】根据催化剂对化学反应速率的影响实质,分析催化剂对可逆反应中的正、逆反应速率的影响是否相同?【交流】因催化剂对化学反应速率的影响是降低反应的活化能,增加有效碰撞次数,对正、逆反应的影响是相同的,所以催化剂对正、逆反应速率的影响相同。



《影响化学反应速率的因素》教学设计一、教材分析《影响化学反应速率的因素》是人教版高中化学选修四《化学反应原理》第2章《化学反应速率和化学平衡》第2节的教学内容,主要学习影响化学反应速率的外界因素及其影响规律和理论解释。
本节内容是对化学2中已经介化学反应速率的知识的提升,重点介绍的是影响浓度、温度对影响化学反应速率的影响规律及理论解释。
二、教学目标1、知识目标:①理解浓度、压强、温度和催化剂对化学反应速率的影响;②能初步运用有效碰撞和活化分子等知识来解释浓度、压强、温度和催化剂等条件对化学反应速率的影响;③初步学会设计“对照实验”比较条件的改变对反应速率快慢的影响。
2、能力目标:在学习中,在仔细、全面、准确观察实验现象的基础上,要积极将感性认识上升到理性认识,也就是培养自己透过现象看本质的能力。
3.情感、态度和价值观目标:(1)通过对实验的操作,培养学生勇于实践的科学精神和科学态度。
(2)通过科学探究,激发学生的学习热情,进一步加深他们对知识的理解。
三、教学重点难点重点:浓度、温度对化学反应速率的影响难点:浓度、温度对化学反应速率影响的原因四、学情分析我们的学生学习有机知识是在高一下学期,距今已经半年之久,所以对已学过的化学反应速率知识已经大多忘却,仍然必须重点复习,另外要帮助学生回忆本书绪论所学的有效碰撞理论知识,以便用于解释影响规律,进一步来帮助理解应用规律。
五、教学方法1.实验法:实验2-2 、实验2-3、实验2-4分组实验。
2.学案导学:见后面的学案。
3.新授课教学基本环节:预习检查、总结疑惑→情境导入、展示目标→合作探究、精讲点拨→反思总结、当堂检测→发导学案、布置预习六、课前准备1.学生的学习准备:预习教材内容,初步把握基本知识,并填写课前预习学案2.教师的教学准备:,课前预习学案,课内探究学案,课后延伸拓展学案。
3.教学环境的设计和布置:两人一组,实验室内教学。
课前打开实验室门窗通风,课前准备实验用品。

第2课时温度、催化剂对化学反应速率的影响课后篇巩固提升基础巩固1.在影响化学反应速率的因素中,决定化学反应速率的主要因素是()①温度②浓度③催化剂④压强⑤反应物本身的性质A.①②③④⑤B.⑤D.①②③C. ①②③④解析影响化学反应速率的因素有内因和外因,内因(即反应物本身的性质)是主要因素。
答案 B2.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是()①增大反应物的浓度②升高温度③增大压强④移去生成物⑤加入催化剂A.①③⑤B.②③⑤C.②⑤D.①③④解析增大反应物的浓度和增大压强,只能增大单位体积内的活化分子数,不能增大活化分子百分数,而②和⑤既能增大单位体积内的活化分子数,又能增大活化分子百分数。
答案 C2C(g)在一恒容密闭容器中进行,当改变下列条件之一时,一定能增大反应速率3.反应A(s)+2B(g)) 的是( A.增加A物质的量降低温度B. C.使用催化剂物质D.消耗掉部分B物质使A,A 解析是固体增加物质的量不能增大化学反应速率;降温使反应速率减小消耗掉部分B; 反应速率减小。
使用催化剂可增大反应速率。
C答案.4.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()A.Cu能与浓硝酸反应,而不与浓盐酸反应B.Cu与浓硝酸反应比与稀硝酸反应快C.N与O在常温、常压下不反应,放电时可反应22D.Cu与浓硫酸能反应,而不与稀硫酸反应解析要想说明反应物本身的性质是影响化学反应速率的决定性因素,则该实验事实应区别在反应物本身而不是外界因素如浓度、压强、温度、催化剂等。
其中选项B、D为浓度不同对反应速率的影响,选项C为反应条件不同对反应速率的影响,只有选项A是因浓硝酸与浓盐酸本身性质不同对反应速率的影响。
答案 A①升高反应:,现进行如下操作ΔH>0,达到平衡状态2CO(g)5.一定条件下,可逆反应C(s)+CO(g)2的量。
上述措施中一CO;④减少体系中②增加反应物C的用量;③缩小反应体系的体积体系的温度;) (定能使反应的正反应速率显著增大的是 B. ①③A.①②③④①②③ D.①③④C.;,反应速率不变,增加反应物C的用量解析①升高反应体系的温度正逆反应速率均增大;②碳是固体然后,的量CO,正反应速率瞬间不变,压强增大,反应速率增大;④减少体系中③缩小反应体系的体积逐渐减小。
第2课时温度、催化剂对化学反应速率的影响[目标要求] 1.知道温度对化学反应速率影响的结论和理论解释。
2.知道催化剂对化学反应速率影响的结论和理论解释。
1.温度对反应速率的影响(1)影响其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减慢。
(2)原因其他条件相同时,升高温度,提高了活化分子的百分数和较高能量的分子间的碰撞频率,使分子间有效碰撞的几率提高,反应速率增大。
2.催化剂对反应速率的影响(1)影响:使用催化剂可加快反应速率。
(2)原因:催化剂改变了反应的路径,降低了反应所需的活化能,提高了反应体系中活化分子的百分数,使有效碰撞的几率提高,反应速率加快。
(3)根据图象填空。
如图所示,使用催化剂使反应速率加快其中途径Ⅰ表示没使用催化剂。
途径Ⅱ表示使用了催化剂。
使用了催化剂,反应的活化能降低。
图中E1、E2都是该反应的活化能,但E2<E1是因为使用了催化剂,与不使用催化剂相比,反应的活化能由E1变为E2,活化分子的百分数增多。
知识点一温度对化学反应速率的影响1.对于反应:M+N―→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81 min,将温度提高到30℃时,完成反应的10%需要的时间为( )A.9 min B.27 min C.13.5 min D.3 min答案 A解析温度由10℃升高到30℃时,反应速率提高到原来的32倍,设当提高到30℃时,完成反应的10%需要的时间为t min,则32t=81 min,故t=9 min。
2.已知硫代硫酸钠溶液与稀H2SO4反应可析出单质硫沉淀:Na2S2O3+H2SO4===Na2SO4+S↓+SO2+H2O,某同学答案第解析反应物的浓度越大,反应温度越高,反应速率越快。
由编号1和3可以看出,两种反应物的浓度相同,但编号3的温度高于1,故编号3先出现浑浊。
再将编号3和2比较,3的浓度、温度均比2高,故最先出现浑浊的应为第3组。
第二章第二节影响化学反应速率的因素第2课时温度、催化剂对化学反应速率的影响【学习目标】1.掌握温度对化学反应速率影响的结论和理论解释。
2.掌握催化剂对化学反应速率影响的结论和理论解释。
【学习重、难点】理解外界条件(温度、催化剂)对化学反应速率的影响。
导学流程【知识回顾】改变压强一定会影响化学反应速率吗?【基础感知】阅读教材21 -24 页,回答下列问题1.温度(1)影响其他条件相同时,升高温度,反应速率;降低温度,反应速率。
(2)原因升高温度→活化分子百分数增加→有效碰撞次数增多→化学反应速率增大。
(3)注意:①温度对反应速率的影响规律,对吸热、放热反应都适用,且不受反应物状态的限制。
升温时,化学反应速率增大;降温时,化学反应速率减小。
②对于可逆反应来说,升高温度,正、逆反应速率都增大,但吸热反应方向反应速率增大的程度更大;降低温度,正、逆反应速率都减小,但吸热反应方向反应速率减小的程度更大。
③实验测定,温度每升高10℃,反应速率增大至原来的2—4倍。
z意[来t2.催化剂(1)影响:催化剂能加快反应速率。
(2)原因:催化剂改变了反应的路径,降低了反应所需的活化能,提高了反应体系中活化分子的百分数,使有效碰撞的几率提高,反应速率加快。
(3)图象(4)注意:①使用催化剂能同等程度地改变(加快或减慢)化学反应的正逆反应速率。
②在使用催化剂时应防止催化剂中毒。
3.影响化学反应速率的其他因素其他因素如光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨、反应物固体颗粒的大小等,也会对化学反应的速率产生影响。
【合作探究】一、温度对反应速率的影响二、催化剂对反应速率的影响实验一 实验原理:2H 2O 2=====MnO 22H 2O +O 2↑ 实验过程实验二 1.在两支试管中各加入2mL3%22H O 溶液,再向22H O 溶液中分别滴入30.1mol/LFeCl 和4CuSO 溶液各1mL ,摇匀,比较22H O 的分解速率。
温度、催化剂对化学反应速率的影响〖教材分析〗“影响化学反应速率的因素”是教材选修④《化学反应原理》中第二章化学反应速率和化学平衡第二节的内容。
本内容既是前一节“化学反应速率”的延续,也为下一节“化学平衡”内容作铺垫,在知识体系中起着承上启下的作用。
本节的主要内容是对影响化学反应速率的内部因素与外部因素进行探讨,其中外部因素主要从浓度、温度、压强、催化剂等角度进行研究。
除此之外,本节内容与前言中介绍的碰撞理论遥相呼应,碰撞理论可以从微观的角度较好地解释这些外部因素是如何影响化学反应速率的。
〖教学目标〗知识与技能1、了解影响化学反应速率的主要因素。
2、了解比较快慢的简便方法。
3、通过实验认识影响化学反应速率的几种主要因素,并能以粒子的观点和有效碰撞理论初步解释。
过程与方法1、设计简单的实验探究影响化学反应速率的因素。
2、利用有效碰撞模型对影响化学反应速率因素进行分析。
情感态度与价值观1、通过学习,初步学会从化学视角去观察生活、生产和社会中有关化学反应速率问题。
2、能体会到实验是化学学习的重要手段,培养科学探究意识和实事求是的科学精神。
〖教学重点〗温度、催化剂对化学反应速率的影响。
〖教学难点〗运用有效碰撞理论解释温度对化学反应速率的影响。
〖教学过程〗一、温故知新,引出课题【提问】影响化学反应速率的因素有许多,包括内部因素(物质本身的性质)和外部因素(外界条件)。
影响化学反应速率的外部因素有浓度、压强、温度、催化剂等,其中:1、浓度:增大反应物浓度,即增加单位体积内活化分子数,加快化学反应速率。
2、压强:增大压强,减小体积,即增大反应物浓度,增加单位体积内活化分子数,加快化学反应速率。
那温度、催化剂是如何影响反应速率的呢?有哪些规律?二、实验探究——温度对化学反应速率的影响三、理论解释——温度为什么能影响化学反应速率【回顾】在前言中,我们介绍了有效碰撞,我们一起来回顾一下。
⑴、化学反应的实质是:旧的化学键断裂,新的化学键形成⑵、化学反应发生的先决条件:反应物分子相互接触和碰撞注意:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。
高中化学学习材料金戈铁骑整理制作第二节影响化学反应速率的因素名师导航知识梳理1.有效碰撞和活化分子化学反应的实质是反应物分子中________,生成物分子中________的过程。
即反应物分子中的原子重新组合成生成物分子的过程,而反应物分子发生碰撞时并不都能发生反应,有的碰撞能发生化学反应,有的不能。
化学反应速率与分子间的________频率有关,因此所有能够改变________、________,以及________的外界条件,都可以用来________、________反应的速率。
________、________、________等都可以改变反应速率。
2.影响化学反应速率的因素影响化学反应速率的因素分为内因和外因两个方面。
内因是指反应物本身的性质,如金属钠与冷水剧烈反应,而镁和沸水仅能微弱反应。
影响化学反应速率的决定因素是内因。
外因是指外界条件如________、________、________、________等。
改变了这些条件,可以改变化学反应速率,其根本原因是改变了单位体积内________的数目,也就改变了分子间发生________的机会,从而改变了化学反应速率。
其他条件:除上述四种常见的反应条件外,还有光、超声波、激光、放射线、电磁波等均可改变化学反应速率。
3.浓度对反应速率的影响分析实验2-2的数据,表明______________________________________。
结论:在其他条件相同时,增大反应物的浓度,化学反应速率________;减小反应物浓度,化学反应速率________。
在其他条件不变时,活化分子在反应物分子中所占的百分数是一定的,因此单位体积内活化分子的数目与单位体积内反应物分子的总数成正比,也就是与反应物的浓度成正比。
当反应物浓度增大时,单位体积内分子总数________,活化分子数也相应________,单位时间内有效碰撞次数________,化学反应速率加快。
第2课时温度、催化剂对化学反应速率的影响[目标要求] 1.知道温度对化学反应速率影响的结论和理论解释。
2.知道催化剂对化学反应速率影响的结论和理论解释。
1.温度对反应速率的影响(1)影响其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减慢。
(2)原因其他条件相同时,升高温度,提高了活化分子的百分数和较高能量的分子间的碰撞频率,使分子间有效碰撞的几率提高,反应速率增大。
2.催化剂对反应速率的影响(1)影响:使用催化剂可加快反应速率。
(2)原因:催化剂改变了反应的路径,降低了反应所需的活化能,提高了反应体系中活化分子的百分数,使有效碰撞的几率提高,反应速率加快。
(3)根据图象填空。
如图所示,使用催化剂使反应速率加快其中途径Ⅰ表示没使用催化剂。
途径Ⅱ表示使用了催化剂。
使用了催化剂,反应的活化能降低。
图中E1、E2都是该反应的活化能,但E2<E1是因为使用了催化剂,与不使用催化剂相比,反应的活化能由E1变为E2,活化分子的百分数增多。
知识点一温度对化学反应速率的影响1.对于反应:M+N―→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81 min,将温度提高到30℃时,完成反应的10%需要的时间为()A.9 min B.27 min C.13.5 min D.3 min答案 A解析温度由10℃升高到30℃时,反应速率提高到原来的32倍,设当提高到30℃时,完成反应的10%需要的时间为t min,则32t=81 min,故t=9 min。
2.已知硫代硫酸钠溶液与稀H2SO4反应可析出单质硫沉淀:Na2S2O3+H2SO4===Na2SO4+S解析反应物的浓度越大,反应温度越高,反应速率越快。
由编号1和3可以看出,两种反应物的浓度相同,但编号3的温度高于1,故编号3先出现浑浊。
再将编号3和2比较,3的浓度、温度均比2高,故最先出现浑浊的应为第3组。
知识点二催化剂对化学反应速率的影响3.下列关于催化剂的说法,正确的是()A.催化剂能使不起反应的物质发生反应B.催化剂在化学反应前后,化学性质和质量都不变C.催化剂不能改变化学反应速率D.任何化学反应都需要催化剂答案 B4.亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。
第2课时温度、催化剂对化学反应速率的影响课后篇巩固提升基础巩固1.在影响化学反应速率的因素中,决定化学反应速率的主要因素是()①温度②浓度③催化剂④压强⑤反应物本身的性质A.①②③④⑤B.⑤D.①②③C. ①②③④解析影响化学反应速率的因素有内因和外因,内因(即反应物本身的性质)是主要因素。
答案 B2.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是()①增大反应物的浓度②升高温度③增大压强④移去生成物⑤加入催化剂A.①③⑤B.②③⑤C.②⑤D.①③④解析增大反应物的浓度和增大压强,只能增大单位体积内的活化分子数,不能增大活化分子百分数,而②和⑤既能增大单位体积内的活化分子数,又能增大活化分子百分数。
答案 C2C(g)在一恒容密闭容器中进行,当改变下列条件之一时,一定能增大反应速率3.反应A(s)+2B(g)) 的是( A.增加A物质的量降低温度B. C.使用催化剂物质D.消耗掉部分B物质使A,A 解析是固体增加物质的量不能增大化学反应速率;降温使反应速率减小消耗掉部分B; 反应速率减小。
使用催化剂可增大反应速率。
C答案.4.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()A.Cu能与浓硝酸反应,而不与浓盐酸反应B.Cu与浓硝酸反应比与稀硝酸反应快C.N与O在常温、常压下不反应,放电时可反应22D.Cu与浓硫酸能反应,而不与稀硫酸反应解析要想说明反应物本身的性质是影响化学反应速率的决定性因素,则该实验事实应区别在反应物本身而不是外界因素如浓度、压强、温度、催化剂等。
其中选项B、D为浓度不同对反应速率的影响,选项C为反应条件不同对反应速率的影响,只有选项A是因浓硝酸与浓盐酸本身性质不同对反应速率的影响。
答案 A①升高反应:,现进行如下操作ΔH>0,达到平衡状态2CO(g)5.一定条件下,可逆反应C(s)+CO(g)2的量。
上述措施中一CO;④减少体系中②增加反应物C的用量;③缩小反应体系的体积体系的温度;) (定能使反应的正反应速率显著增大的是 B. ①③A.①②③④①②③ D.①③④C.;,反应速率不变,增加反应物C的用量解析①升高反应体系的温度正逆反应速率均增大;②碳是固体然后,的量CO,正反应速率瞬间不变,压强增大,反应速率增大;④减少体系中③缩小反应体系的体积逐渐减小。
B答案℃④在20 B两种反应物进行以下五个实验,其中①~C6.A、B在溶液中发生反应:A+B。
现将A、) ,反应速率由大到小的顺序正确的是(℃时进行时进行,⑤在40 ,实验刚开始时-1-1 B A+20 mL 0.2 mol·L①20 mL 0.2 mol·L-1-1 B A+50 mL 0.5 mol·②50 mL 0.5 mol·LL-1-1O 10 mL 1 mol·L B+30 mL H A+10 mL 1 mol·L③2-1-1 B L A+60 mL 0.4 mol·20 mL 1 mol·④L-1-1 B A+30 mL 0.6 mol·L⑤30 mL 0.6 mol·LA.②④⑤①③B.⑤④②③①C.④②⑤①③③⑤④②①D.-1;第②组A0.1 mol·L、B物质的量浓度均、解析由提供数据可算出第①组AB物质的量浓度均为-1-1-1,BL物质的量浓度为0.25 mol·;第④组第③组A、B物质的量浓度均为0.2 mol·LL为0.25 mol·A;-1-1且温度最高,因此其反应速B物质的量浓度均为0.3 mol·L物质的量浓度为0.3 mol·LA;第⑤组、率由大到小的顺序为⑤④②③①。
答案 B7.某反应过程中能量变化如图所示(图中E表示正反应的活化能,E表示逆反应的活化能)。
下列有21关叙述正确的是()该反应为放热反应A. 催化剂能改变该反应的焓变B. 催化剂能降低该反应的活化能C. 逆反应的活化能大于正反应的活化能D.但不会改变反应,,使化学反应速率增大解析使用催化剂可降低反应的活化能,增加活化分子百分数的焓变。
C答案-1) 的稀硫酸反应制取氢气时,下列措施不能使氢气生成速率增大的是8.用铁片与1mol·L( A.对该反应体系加热的硫酸,改用98%B.不用稀硫酸-1 SOH加入2 mol·L溶液的C.42 ,改用铁粉D.不用铁片。
浓硫酸能使铁片钝化不产生H解析2答案 B9.下列表格中的各种情况,可以用下面对应选项中的图像表示的是()CO其他条件相同,H浓度越大反应反应更快,A项不正确;B项,解析Na、K分别与水反应,K更活泼,422速率越快,乙中反应速率更快,B项不正确;C项,相同浓度下,温度越高反应速率越快,随着反应的进行,反应物的浓度减小,反应速率减小,C项正确;D项,使用催化剂的反应速率更快,乙速率比甲的快,D项不正确。
答案 C-1 HSO溶液的烧杯中500 mL 0.5 mol·的铝片投入盛有L,该铝片与硫酸反应10.将一块质量为5.0 g42产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:(1)曲线O→a段不产生氢气的原因是,有关反应的化学。
方程式为。
(2)曲线a→b段产生氢气的速率较慢的原因是。
(3)曲线b→c段产生氢气的速率增加较快的主要原因是(4)曲线c点以后产生氢气的速率逐渐下降的主要原因是。
答案(1)铝片表面有AlO,硫酸首先与AlO反应AlO+3HSOAl(SO)+3HO232342322324 ,氧化膜未完全反应掉(2)铝与硫酸接触的表面积较小反应放出的热量使溶液的温度升高而加快反应速率(3).(4)随着反应的进行,HSO溶液的浓度下降42能力提升(B)=0.3 v℃时,反应速率B两种物质在不同温度下进行反应:A+3B3C。
10 11.当浓度恒定时,A、1--1-1-1s·n反应速率增至原来的10 ℃·s,。
若该反应温度升高;50 ℃时,反应速率v mol·L(A)=25.6 mol·L) (n倍,则值为D.2.5C.3.5A.4B.3-1-1-1-1,℃温度升高40 至50 ℃v(A)=0.1 mol·Ls·,。
由时解析在10 ℃,v(B)=0.3 mol·L10 ·s℃,等效于4-14-1-1-1 =4。
=256,解得L:·s n L则0.1 mol·,·s即×nn=25.6 mol· A答案的量来增大反应速率。
为了研究CuSO与稀硫酸反应来制取氢气,常加少量CuSO12.实验室用Zn44分别加将表中所给的试剂按一定体积混合后,某同学设计了实验方案(见下表),对H生成速率的影响,2并记录收集收集产生的气体,)中,片(过量)的反应容器(甲、乙、丙、丁入到四个盛有相同大小的Zn相同体积的气体所需的时间。
实验乙丙丁甲试剂-1V V4 mol·L20 HSO/mL V322142.5CuSO饱和溶液/mL100V44V HO/mL08V625 /s收集气体所需时间t tt t4312) 下列说法正确的是(=10 =B. t==A.tt=tVV543412<20<<=7.5C.VD.VVV3216解析本实验是研究CuSO的量对生成H速率的影响,所以应控制HSO的浓度不变,即硫酸体积、4224CuSO溶液体积及HO的体积之和应等于30 mL,所以甲中V=10;乙中V=20,V=7.5;丙中62541V=20,V=2;丁中V=20,C项正确。
324答案 C13.以天然气为原料合成尿素的生产中,主要反应之一为:CH(g)+HO(g)CO(g)+3H(g)ΔH>0242:请根据题目要求回答下列问题.0.01 ,20 s时有放入容积为2 L的密闭容器中,将0.05 mol CH和0.10 mol HO(g)(1)在一定条件下24。
H的化学反应速率为mol CO生成,则2在);”,下同”“减小”或“不变,则逆反应速率(填“增大在其他条件不变的情况下降低温度(2)。
,则正反应速率其他条件不变的情况下升高温度01mol.0--4-1s mol·L v20 s时有0.01 mol CO生成,所以(CO)==2.5×10·解析(1)由题意可知L20s×2-11-1-4升高温;,降低温度使正、逆反应速率都减小。
(2)10)=3v(CO)=7.5×其他条件不变时mol·,v(HL·s2度使正、逆反应速率都增大。
-1-1-4·mol·Ls答案(1)7.5×10 增大减小(2)22----I-来度t,3I的反应速率可以用+S OI与加入的淀粉溶液显蓝色的时间+2S O14.“碘钟”实验中24833:℃时进行实验,得到的数据如下表20 量,t越小,反应速率越大。
某探究性学习小组在①②③实验编号④⑤-1-0.120)/(mol·L0.080)0.0400.0800.160c(I2--10.0400.0200.0800.0400.040)/(mol·)O L c(S28t t/s44.022.044.088.01回答下列问题:(1)该实验的目的是。
(2)表中t=1显色时℃下进行编号③对应浓度的实验,(3)温度对该反应的反应速率的影响符合一般规律,若在40(填字母)。
的范围为间t2 A.<22.0 sB.22.0~44.0 sC.>44.0 s,D.数据不足无法判断。
(4)通过分析比较上表数据,得到的结论是-2-)数值成反比,利用①⑤两组数据,,可以得出显色时间与c(I(S)·cO可知两组实分析所给数据解析(2)28188.0s2--①=29.3 s,的即。
所用显色时间是因此倍的是)c,)Oc验中(S相同而(I⑤①3,⑤28 33。
A则显色时间越短。
故选,反应速率越大,温度越高,在反应物起始浓度相同的条件下(3).-2-的浓度对反应速率的影响O(1)研究反应物I与S答案28(2)29.3(3)A)或显色时间与反应物起始浓度乘积成反比(反应速率与反应物起始浓度乘积成正比(4).。