预习交流3
工业硝酸中因溶有NO2而显黄色,你知道NO2是如何产生的?你又有什么方法 能除去黄色?
答案:原因:4HNO3 2H2O+4NO2↑+O2↑ 措施:通入O2,NO2与O2和H2O又会重新反应生成HNO3。
2019/9/2
5
问题导学 即时检测
探究HNO3的化学性质
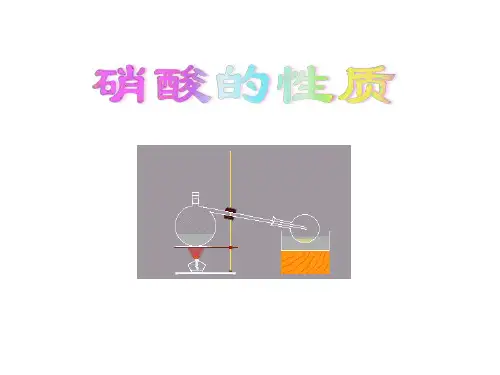
活动与探究 [实验1]取一瓶浓硝酸,打开瓶盖,小心地扇闻浓硝酸的气味。 [实验2]在两支试管中各放入一小块铜片,分别加入少量稀硝酸(4 mol·L-1)和浓 硝酸(14 mol·L-1),立即用蘸有浓NaOH溶液的棉花封住试管口,观察试管中发生 的现象。
(2)硝酸与非金属的反应:C与浓硝酸反应,化学方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O。
预习交流2
浓硝酸与Cu、C的反应,表现的性质是否相同?
答案:不完全相同,与C反应只表现强氧化性,与Cu反应既表现强氧化性,又表现
酸性。
2019/9/2
4
目标导航 预习导引 1 2
(3)不稳定性:HNO3在常温下见光或受热就会发生分解: 4HNO3 2H2O+4NO2↑+O2↑ 因此,硝酸应贮存在避光、低温处。 (4)浓硝酸可以使Fe、Al等金属发生钝化。
(5)在利用HNO3的酸性时,要注意考虑它的强氧化性。如FeO与稀硝酸反应时 的化学方程式应是3FeO+10HNO3(稀) 3Fe(NO3)3+NO↑+5H2O,而不是 FeO+2HNO3(稀) Fe(NO3)2+H2O。
2019/9/2
Байду номын сангаас
9
问题导学 即时检测 1 2 3 4



![化学必修一 硝酸的性质 PPT-苏教版 [苏教版]PPT教学课件](https://uimg.taocdn.com/9fc39e1776eeaeaad0f33007.webp)




