多电子原子轨道能级顺序
- 格式:docx
- 大小:36.58 KB
- 文档页数:1



电子结构与原子的能级分布原子是构成物质的基本单位,而电子结构则是决定原子性质的关键因素之一。
电子结构不仅决定着原子的化学性质,也对于原子的能级分布产生重要影响。
本文将探讨电子结构与原子的能级分布之间的关系,并探讨一些与此相关的重要概念和理论。
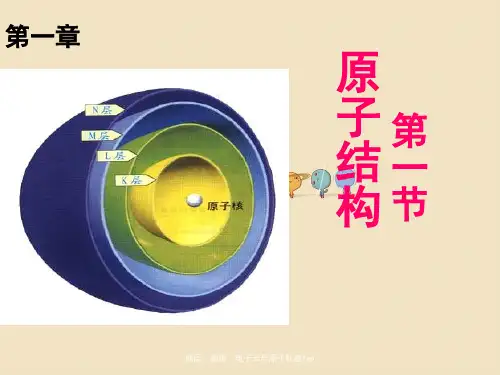
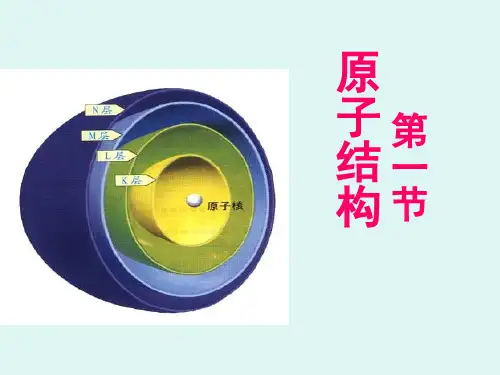
一、原子结构原子由质子、中子和电子组成,其中质子和中子位于原子核内部,而电子则分布在原子核外围的轨道中。
原子的质量主要由质子和中子贡献,而原子的化学性质则主要由电子决定。
二、电子的能级及分布电子在原子中沿着不同的轨道运动,每个轨道都对应不同的能级。
能级越高,电子的能量越大。
根据量子力学理论,每个轨道最多容纳一定数量的电子,这个数量由一条著名的规则所决定,即泡利不相容原理。
泡利不相容原理指出,在同一个原子中,每个轨道最多只能容纳两个自旋方向相反的电子。
这意味着一个轨道中只能同时存在两个电子。
如果一个轨道中已经存在两个电子,我们称之为“满层”。
满层的特点是非常稳定,不容易发生反应。
三、壳层和亚层为了更好地描述电子的分布,我们引入了壳层和亚层的概念。
壳层代表着电子轨道的主要能级,通常用字母来表示,如K、L、M等;而亚层则代表了壳层下的更精细的能级划分,通常用字母加上数字(s、p、d、f)来表示,如2s、2p、3d等。
亚层的容量规则如下:- s亚层最多容纳2个电子- p亚层最多容纳6个电子- d亚层最多容纳10个电子- f亚层最多容纳14个电子壳层和亚层的容量规则使得我们可以清晰地描述原子中电子的分布情况。
四、电子排布的规则电子在原子中的排布遵循一系列的规则,主要有:1. 能级顺序规则:电子首先填充能级最低的轨道,然后逐渐向能级较高的轨道填充。
这意味着2s轨道会先于2p轨道被填充。
2. 能量最低规则:在同一个亚层中,s轨道的能级最低,p轨道次之,d轨道再次之,f轨道最高。
所以在填充电子时,会按照先填充s轨道,再填充p轨道,以此类推。
3. 泡利不相容原理规则:每个轨道最多容纳两个自旋方向相反的电子。
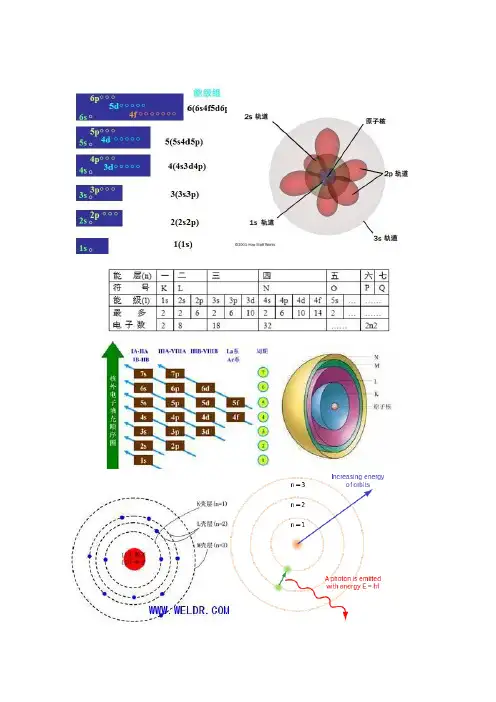
原子轨道近似能级图编辑美国化学家Pauling经过计算,将原子轨道分为七个能级组。
第一组:1s第二组:2s2p第三组:3s3p第四组:4s3d4p第亓组:5s4d5p第六组:6s4f5d6p第七组:7s5f6d7p特点:1、能级能量由低到高。
2、组与组之间能量差大,组内各轨道间能量差小,随n逐渐增大,这两种能量差逐渐减小。
3、第一能级组只有1s一个轨道,其余均有两个或两个以上,且以ns开始np结束。
4、能级组与元素周期相对应。
如题:最近有人问我XPS元素的右下角数字的含义。
这是我个人的理解,请大家多多指教。
1、四个量子数的物理意义:n为主量子数;l为角量子数;m为磁量子数;s为自旋量子数。
n=1,2,3,4…,但不等于0,并且以K(n=1),L(n=2),M(n=3),N(n=4),…表示。
l=0,1,2,3…。
并且以s(l=0),p(l=1),d(l=2),f(l=3),…表示。
s=1/2m=0,±1, ±2,…, ±l2、自旋-轨道分裂我们知道原子中的电子既有轨道运动又有自旋运动。
量子力学的理论和光谱试验的结果都已经证实电子的轨道运动和自旋运动之间存在着电磁相互作用。
自旋-轨道耦合的结果使其能级发生分裂,这种分裂可以用总量子数j来表示,其数值为:j=l+s, l+s-1,…,|l-s|由上式可以知道:s轨道:当l=0,s=1/2时,j只有一个数值,即j=1/2;p轨道:当l=1,s=1/2时,j=1/2,3/2d轨道:当l=2,s=1/2时,j=3/2,5/2f轨道当l=3,s=1/2时,j=5/2,7/23、原子和分子轨道的符号表示原子中内层电子的运动状态可以用以描述单个电子运动状态的四个量子数来表征。
电子能谱试验通常是在无外磁场作用下进行的,磁量子数m是简并的,所以在电子能谱研究中通常用n,l,j三个量子数来表征内层电子的运动状态。
价电子用分子轨道符号来表示。

绪论一.是非题:1.化学变化有新物质产生,而物理变化无新物质产生.2.化学变化是由于构成分子的原子外层电子运动状态的改变而引起的、原子核不变的一类变化3.元素的变化为物理变化而非化学变化.4.化学变化的特点是原子核不变分子组成或原子间结合方式发生变化.5.化学反应常伴有发光现象,但并非所有的发光现象都属于化学反应.二.选择题:1.化学研究的对象是具有宏观实体的物质,它不包括A.希有气体B:混合物C.电子流或γ──射线D.地球外的物质2.纯的无机物不包括A.碳元素B.碳化合物C.二者都对D.二者都错3.下列哪一过程不存在化学变化A.氨溶于水B.蔗糖溶在水中C.电解质溶液导电D.照相底片感光第一章原子结构和元素周期系一.是非题1.电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s电子总比2s电子更靠近原子核, 因为E2s > E1s.2.原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道.3.氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中,2s与2p 轨道不是简并轨道, 2p x,2p y,2p z为简并轨道,简并度为3.4.从原子轨道能级图上可知,任何原子在相同主量子数的轨道上,能量高低的顺序总是f > d > p > s;在不同主量子数的轨道上,总是(n-1)p > (n-2)f > (n-1)d > ns.5.在元素周期表中, 每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数.6.所有非金属元素(H,He除外)都在p区,但p区所有元素并非都是非金属元素.7.就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的.8.铬原子的电子排布为Cr[Ar]4s13d5,由此得出: 洪特规则在与能量最低原理出现矛盾时,首先应服从洪特规则.9.s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子.10.在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素.二.选择题1.玻尔在他的原子理论中A.证明了电子在核外圆形轨道上运动;B.推导出原子半径与量子数平方成反比;C.应用了量子力学的概念和方法;D.解决了氢原子光谱和电子能量之间的关系问题.2.波函数和原子轨道二者之间的关系是A.波函数是函数式,原子轨道是电子轨迹;B.波函数和原子轨道是同义词;C.只有轨道波函数与原子轨道才是同义的;D.以上三种说法都不对.3.多电子原子的原子轨道能级顺序随着原子序数的增加A.轨道能量逐渐降低,但能级顺序不变;B.轨道能量基本不变,但能级顺序改变;C.轨道能量逐渐增加,能级顺序不变;D.轨道能量逐渐降低,能级顺序也会改变.4.周期表中各周期元素数目是由什么决定的A.2n2(n为主量子数);B.相应能级组中所含轨道总数;C.相应能级组中所含电子总数D. n + 0.7规则5.下列电子构型中,电离能最低的是A.ns2np3B.ns2np4C.ns2np5D.ns2np66.下列元素中,第一电离能最大的是A.BB.CC.AlD.Si7.原子光谱中存在着不连续的线谱,证明了A.在原子中仅有某些电子能够被激发B. 一个原子中的电子只可能有某些特定的能量状态C.原子发射的光,在性质上不同于普通的白光D.白光是由许许多多单色光组成.8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指A.亲合能B.电能C.势能D.动能9.下列哪一原子的原子轨道能量与角量子数无关?A.NaB.NeC.FD.H10.下列哪一种元素性质的周期规律最不明显A.电子亲合能B.电负性C.电离能D.原子体积11.用来表示核外某电子运动状态的下列各组量子数(n l m ms)中哪一组是合理的?A.(2,1,-1,-1/2)B.(0,0,0,+1/2)C.(3,1,2,+1/2)D.(2,1,0,0)12.元素和单质相比较时,正确的说法是A.元素由单质构成;B.元素可分解为单质;C.元素的质量比单质的质量重;D.单质是元素存在的一种形式.13.核素和同位素的相同点是A.它们中的质子数均大于中子数;B.它们中的质子数均小于中子数;C.它们中的质子数和中子数相等;D.它们各自含有相同的质子数.14.关于核素的正确说法是A.具有一定数目的核电荷的一种原子;B.具有一定数目的质子的一种原子;C.具有一定数目的中子的一种原子;D.具有一定数目的中子和一定数目的质子的一种原子.15.测定原子量最直接的方法是A.质谱法B.化合量法C.气体密度法D.α─粒子散射法三.填空题:1.宏观物体的运动可用方程F=ma 描述,但微观物体的运动要用量子力学中的( )描述. 它是一个偏微分方程式.2主量子数为4 的一个电子,它的角量子数的可能取值有( )种,它的磁量子数的可能取值有( )种.3.在氢原子中,4s和3d轨道的能量高低为( ),而在19 号元素K 和26 号元素Fe中, 4s和34轨道的能量高低顺序分别为( )和( ).4.填上合理的量子数:n=2,l=( ),m=( ),ms=+1/2.5.+3价离子的电子层结构与S2-离子相同的元素是( ).6.微观粒子运动与宏观物质相比具有两大特征,它们是( )和( ),说明微观粒子运动特点的两个重要实验是( ).7.ψn,l,m是( ),当n,l,m,一定时,处于ψn,l,m状态的一个电子的( ), ( ),( )可以确定.n,l,m可以确定一个( ).8.氢原子的电子能级由( )决定,而钠原子的电子能级由( )决定.9.Mn原子的价电子构型为( ),用四个量子数分别表示每个价电子的一定状态,是( ).10.在电子构型 a.1s22s2, b.1s22s22p54s1, c.1s22s12p13d13s1, d.1s22s22p63s13d1, e.1s22p2, f.1s22s32p1,g.1s12s22p13d1中,属于原子基态的是( ),属于原子激发态的是( ),纯属错误的是( ).11.用元素符号填空:(均以天然存在为准)原子半径最大的元素是( ), 第一电离能最大的元素是( ),原子中3d半充满的元素是( ),原子中4p半充满的元素是( ),电负性差最大的两个元素是( ), 化学性质最不活泼的元素是( ).四.简答题1.第114号元素属于第几周期? 第几族?2.为什么碳(6C)的外围电子构型是2s22p2, 而不是2s12p3,而铜(29Cu)的外围电子构型是3d104s1,而不是3d94s2?3、气体常数R是否只在气体中使用?五.综合题1.某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答:(1).该元素的原子序数,符号,所处周期和族;(2).写出表示全部价电子运动状态的四个量子数;(3).该元素最高价氧化物水合物的分子式及酸碱性.2.某元素原子序数为33,试问:(1).此元素原子的电子总数是多少?有多少个未成对电子?(2).它有多少个电子层?多少个能级?最高能级组中的电子数是多少?(3).它的价电子数是多少?它属于第几周期?第几族?是金属还是非金属?最高化合价是几?3.写出原子序数为24的元素的名称,符号及其基态原子的电子排布式,并用四个量子数分别表示每个价电子的运动状态.第二章分子结构一.是非题:1、两原子间可以形成多重键,但两个以上的原子间不可能形成多重键。



绪论一.是非题:1.化学变化有新物质产生,而物理变化无新物质产生.2.化学变化是由于构成分子的原子外层电子运动状态的改变而引起的、原子核不变的一类变化3.元素的变化为物理变化而非化学变化.4.化学变化的特点是原子核不变分子组成或原子间结合方式发生变化.5.化学反响常伴有发光现象,但并非所有的发光现象都属于化学反响.二.选择题:1.化学研究的对象是具有宏观实体的物质,它不包括A.希有气体B:混合物C.电子流或γ──射线D.地球外的物质2.纯的无机物不包括A.碳元素B.碳化合物C.二者都对D.二者都错3.以下哪一过程不存在化学变化A.氨溶于水B.蔗糖溶在水中C.电解质溶液导电D.照相底片感光第一章原子构造和元素周期系一.是非题1.电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s电子总比2s电子更靠近原子核, 因为E2s > E1s.2.原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道.3.氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中,2s与2p 轨道不是简并轨道, 2p x,2p y,2p z为简并轨道,简并度为3.4.从原子轨道能级图上可知,任何原子在一样主量子数的轨道上,能量上下的顺序总是f > d > p > s;在不同主量子数的轨道上,总是(n-1)p > (n-2)f > (n-1)d > ns.5.在元素周期表中, 每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数.6.所有非金属元素(H,He除外)都在p区,但p区所有元素并非都是非金属元素.7.就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的.8.铬原子的电子排布为Cr[Ar]4s13d5,由此得出: 洪特规那么在与能量最低原理出现矛盾时,首先应服从洪特规那么.9.s区元素原子丧失最外层的s电子得到相应的离子,d区元素的原子丧失处于最高能级的d电子而得到相应的离子.10.在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素.二.选择题1.玻尔在他的原子理论中A.证明了电子在核外圆形轨道上运动;B.推导出原子半径与量子数平方成反比;C.应用了量子力学的概念和方法;D.解决了氢原子光谱和电子能量之间的关系问题.2.波函数和原子轨道二者之间的关系是A.波函数是函数式,原子轨道是电子轨迹;B.波函数和原子轨道是同义词;C.只有轨道波函数与原子轨道才是同义的;D.以上三种说法都不对.3.多电子原子的原子轨道能级顺序随着原子序数的增加A.轨道能量逐渐降低,但能级顺序不变;B.轨道能量根本不变,但能级顺序改变;C.轨道能量逐渐增加,能级顺序不变;D.轨道能量逐渐降低,能级顺序也会改变.4.周期表中各周期元素数目是由什么决定的A.2n2(n为主量子数);B.相应能级组中所含轨道总数;C.相应能级组中所含电子总数D. n + 0.7规那么5.以下电子构型中,电离能最低的是A.ns2np3B.ns2np4C.ns2np5D.ns2np66.以下元素中,第一电离能最大的是A.BB.CC.AlD.Si7.原子光谱中存在着不连续的线谱,证明了A.在原子中仅有某些电子能够被激发B. 一个原子中的电子只可能有某些特定的能量状态C.原子发射的光,在性质上不同于普通的白光D.白光是由许许多多单色光组成.8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指A.亲合能B.电能C.势能D.动能9.以下哪一原子的原子轨道能量与角量子数无关?A.NaB.NeC.FD.H10.以下哪一种元素性质的周期规律最不明显A.电子亲合能B.电负性C.电离能D.原子体积11.用来表示核外某电子运动状态的以下各组量子数(n l m ms)中哪一组是合理的?A.(2,1,-1,-1/2)B.(0,0,0,+1/2)C.(3,1,2,+1/2)D.(2,1,0,0)12.元素和单质相比拟时,正确的说法是A.元素由单质构成;B.元素可分解为单质;C.元素的质量比单质的质量重;D.单质是元素存在的一种形式.13.核素和同位素的一样点是A.它们中的质子数均大于中子数;B.它们中的质子数均小于中子数;C.它们中的质子数和中子数相等;D.它们各自含有一样的质子数.14.关于核素的正确说法是A.具有一定数目的核电荷的一种原子;B.具有一定数目的质子的一种原子;C.具有一定数目的中子的一种原子;D.具有一定数目的中子和一定数目的质子的一种原子.15.测定原子量最直接的方法是A.质谱法B.化合量法C.气体密度法D.α─粒子散射法三.填空题:1.宏观物体的运动可用方程F=ma 描述,但微观物体的运动要用量子力学中的( )描述. 它是一个偏微分方程式.2主量子数为4 的一个电子,它的角量子数的可能取值有( )种,它的磁量子数的可能取值有( )种.3.在氢原子中,4s和3d轨道的能量上下为( ),而在19 号元素K 和26 号元素Fe中, 4s和34轨道的能量上下顺序分别为( )和( ).4.填上合理的量子数:n=2,l=( ),m=( ),ms=+1/2.5.+3价离子的电子层构造与S2-离子一样的元素是( ).6.微观粒子运动与宏观物质相比具有两大特征,它们是( )和( ),说明微观粒子运动特点的两个重要实验是( ).7.ψn,l,m是( ),当n,l,m,一定时,处于ψn,l,m状态的一个电子的( ), ( ),( )可以确定.n,l,m可以确定一个( ).8.氢原子的电子能级由( )决定,而钠原子的电子能级由( )决定.9.Mn原子的价电子构型为( ),用四个量子数分别表示每个价电子的一定状态,是( ).10.在电子构型 a.1s22s2, b.1s22s22p54s1, c.1s22s12p13d13s1, d.1s22s22p63s13d1, e.1s22p2, f.1s22s32p1,g.1s12s22p13d1中,属于原子基态的是( ),属于原子激发态的是( ),纯属错误的选项是( ).11.用元素符号填空:(均以天然存在为准)原子半径最大的元素是( ), 第一电离能最大的元素是( ),原子中3d半充满的元素是( ),原子中4p半充满的元素是( ),电负性差最大的两个元素是( ), 化学性质最不活泼的元素是( ).四.简答题1.第114号元素属于第几周期? 第几族?2.为什么碳(6C)的外围电子构型是2s22p2, 而不是2s12p3,而铜(29Cu)的外围电子构型是3d104s1,而不是3d94s2?3、气体常数R是否只在气体中使用?五.综合题1.某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试答复:(1).该元素的原子序数,符号,所处周期和族;(2).写出表示全部价电子运动状态的四个量子数;(3).该元素最高价氧化物水合物的分子式及酸碱性.2.某元素原子序数为33,试问:(1).此元素原子的电子总数是多少?有多少个未成对电子?(2).它有多少个电子层?多少个能级?最高能级组中的电子数是多少?(3).它的价电子数是多少?它属于第几周期?第几族?是金属还是非金属?最高化合价是几?3.写出原子序数为24的元素的名称,符号及其基态原子的电子排布式,并用四个量子数分别表示每个价电子的运动状态.第二章分子构造一.是非题:1、两原子间可以形成多重键,但两个以上的原子间不可能形成多重键。

(一)构造原理的科学表达构造原理指的是:设想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多数是按照图1-2所示的规律填充的,填满一个能级再填一个能级,这种规律叫做构造原理。
这是人教课本对于构造原理的描述。
说人话就是:电子填入轨道的顺序规则。
(二)能量最低原理的科学表达能量最低原理在人教课本上的描述是:现代物质结构理论证实,原子的电子排布遵循构造原理,能使整个原子的能量处于最低状态,简称能量最低原理。
这句话也许就是题主所说的广义的能量最低原理:按照构造原理排电子能使原子能量最低。
按照教材的意思就是说,按照构造原理排出来的电子组态就是该原子能量最低的状态。
于是就有题主做题时遇到的:违反构造原理的一定违反能量最低原理。
然而,人教选修三课本所表达的能量最低原理是不完整的,根据北京大学出版社周公度老师的《结构化学基础》(化学系学生本科会开一门课程叫结构化学,使用的就是这本教材,大学无机化学中给出的概念与之类似),其中对于能量最低原理是这样表述的:在不违背泡利原理的条件下,电子优先占据能级较低的原子轨道,使整个原子体系能量处于最低。
要点有三个:1、满足泡利原理。
2、电子优先占据能级较低的原子轨道(而不是能量较低的原子轨道,比如,优先占据3d而不是4s。
于是就引出了屏蔽效应和能级交错的阐述。
)3、原子整体能量最低。
而我个人比较认可百度给出的能量最低原理:多电子原子在基态时,核外电子总是尽可能地先占据能量最低的轨道,然后按原子轨道近似能级图中的顺序依次向能量较高的能级上分布,称为能量最低原理。
说人话就是:电子优先排在能量低的轨道上。
(三)构造原理、能量最低原理、洪特规则的关系通过这样的比较,你可能就比较清楚了,构造原理包括三个点:能级顺序是基础,在某些特定的情况下会出现能级交错,最后,半满、全满状态对电子排布方式有影响(洪特规则,洪特规则可以看做是构造原理在解释电子填充顺序时的一个补充)。
洪特规则德国人洪特(F.Hund )根据大量光谱实验数据总结出一个规律,据总结出一个规律,即分子分布到能量简并即分子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道,占据不同的轨道,因为这种排布方式原子的因为这种排布方式原子的总能量最低。
所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。
子尽可能自旋平行地多占不同的轨道。
例如例如碳原子核外有6个电子,个电子,按能量最低原理和按能量最低原理和泡利不相容原理,泡利不相容原理,首先有首先有2个电子排布到第一层的1s 轨道中,另外2个电子填入第二层的2s 轨道中,剩余2个电子排布在2个p 轨道上,具有相同的自旋方向,而不是两个电子集中在一个p 轨道,自旋方向相反。
1适用范围该定则只适用于LS 耦合的情况。
有少数例外是由于组态相互作用或偏离LS 耦合引起的。
的。
该定则可用量子力学理论和泡利不相容该定则可用量子力学理论和泡利不相容原理来解释。
原理来解释。
该定则对确定自由原子或离子该定则对确定自由原子或离子的基态十分有用。
2洪特规则前提洪特规则前提:对于基态原子来说在能量相等的轨道上,在能量相等的轨道上,自旋平行的电子数目自旋平行的电子数目最多时,原子的能量最低。
所以在能量相等的轨道上,的轨道上,电子尽可能自旋平行地多占不同电子尽可能自旋平行地多占不同的轨道。
例如碳原子核外有6个电子,按能量最低原理和泡利不相容原理,量最低原理和泡利不相容原理,首先有首先有2个电子排布到第一层的1s 轨道中,另外2个电子填入第二层的2s 轨道中,剩余2个电子排布在2个不同的2p 轨道上,具有相同的自旋方向,而不是两个电子集中在一个p 轨道,自旋方向相反。
作为洪特规则的补充,能量相等的轨道全充满、能量相等的轨道全充满、半满或全空的状态半满或全空的状态比较稳定。
比较稳定。
根据以上原则,电子在原子轨道中填充排布的顺序为1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…。
无机化学习题与答案绪论一.是非题:1.化学变化有新物质产生,而物理变化无新物质产生.2.化学变化是由于构成分子的原子外层电子运动状态的改变而引起的、原子核不变的一类变化3.元素的变化为物理变化而非化学变化.4.化学变化的特点是原子核不变分子组成或原子间结合方式发生变化.5.化学反应常伴有发光现象,但并非所有的发光现象都属于化学反应.二.选择题:1.化学研究的对象是具有宏观实体的物质,它不包括A.希有气体B:混合物C.电子流或γ──射线D.地球外的物质2.纯的无机物不包括A.碳元素B.碳化合物C.二者都对D.二者都错3.下列哪一过程不存在化学变化A.氨溶于水B.蔗糖溶在水中C.电解质溶液导电D.照相底片感光第一章原子结构和元素周期系一.是非题1.电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s电子总比2s电子更靠近原子核, 因为E2s > E1s.2.原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道.3.氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中,2s 与2p 轨道不是简并轨道, 2p x,2p y,2p z为简并轨道,简并度为3.4.从原子轨道能级图上可知,任何原子在相同主量子数的轨道上,能量高低的顺序总是f > d > p > s;在不同主量子数的轨道上,总是(n-1)p > (n-2)f > (n-1)d > ns.5.在元素周期表中, 每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数.6.所有非金属元素(H,He除外)都在p区,但p区所有元素并非都是非金属元素.7.就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的.8.铬原子的电子排布为Cr[Ar]4s13d5,由此得出: 洪特规则在与能量最低原理出现矛盾时,首先应服从洪特规则.9.s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子.10.在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素.二.选择题1.玻尔在他的原子理论中A.证明了电子在核外圆形轨道上运动;B.推导出原子半径与量子数平方成反比;C.应用了量子力学的概念和方法;D.解决了氢原子光谱和电子能量之间的关系问题.2.波函数和原子轨道二者之间的关系是A.波函数是函数式,原子轨道是电子轨迹;B.波函数和原子轨道是同义词;C.只有轨道波函数与原子轨道才是同义的;D.以上三种说法都不对.3.多电子原子的原子轨道能级顺序随着原子序数的增加A.轨道能量逐渐降低,但能级顺序不变;B.轨道能量基本不变,但能级顺序改变;C.轨道能量逐渐增加,能级顺序不变;D.轨道能量逐渐降低,能级顺序也会改变.4.周期表中各周期元素数目是由什么决定的A.2n2(n为主量子数);B.相应能级组中所含轨道总数;C.相应能级组中所含电子总数D. n + 0.7规则5.下列电子构型中,电离能最低的是A.ns2np3B.ns2np4C.ns2np5D.ns2np66.下列元素中,第一电离能最大的是A.BB.CC.AlD.Si7.原子光谱中存在着不连续的线谱,证明了A.在原子中仅有某些电子能够被激发B. 一个原子中的电子只可能有某些特定的能量状态C.原子发射的光,在性质上不同于普通的白光D.白光是由许许多多单色光组成.8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指A.亲合能B.电能C.势能D.动能9.下列哪一原子的原子轨道能量与角量子数无关?A.NaB.NeC.FD.H10.下列哪一种元素性质的周期规律最不明显A.电子亲合能B.电负性C.电离能D.原子体积11.用来表示核外某电子运动状态的下列各组量子数(n l m ms)中哪一组是合理的?A.(2,1,-1,-1/2)B.(0,0,0,+1/2)C.(3,1,2,+1/2)D.(2,1,0,0)12.元素和单质相比较时,正确的说法是A.元素由单质构成;B.元素可分解为单质;C.元素的质量比单质的质量重;D.单质是元素存在的一种形式.13.核素和同位素的相同点是A.它们中的质子数均大于中子数;B.它们中的质子数均小于中子数;C.它们中的质子数和中子数相等;D.它们各自含有相同的质子数.14.关于核素的正确说法是A.具有一定数目的核电荷的一种原子;B.具有一定数目的质子的一种原子;C.具有一定数目的中子的一种原子;D.具有一定数目的中子和一定数目的质子的一种原子.15.测定原子量最直接的方法是A.质谱法B.化合量法C.气体密度法D.α─粒子散射法三.填空题:1.宏观物体的运动可用方程F=ma 描述,但微观物体的运动要用量子力学中的( )描述. 它是一个偏微分方程式.2主量子数为4 的一个电子,它的角量子数的可能取值有( )种,它的磁量子数的可能取值有( )种.3.在氢原子中,4s和3d轨道的能量高低为( ),而在19 号元素K 和26 号元素Fe中, 4s和34轨道的能量高低顺序分别为( )和( ).4.填上合理的量子数:n=2,l=( ),m=( ),ms=+1/2.5.+3价离子的电子层结构与S2-离子相同的元素是( ).6.微观粒子运动与宏观物质相比具有两大特征,它们是( )和( ),说明微观粒子运动特点的两个重要实验是( ).7.ψn,l,m是( ),当n,l,m,一定时,处于ψn,l,m状态的一个电子的( ), ( ),( )可以确定.n,l,m可以确定一个( ).8.氢原子的电子能级由( )决定,而钠原子的电子能级由( )决定.9.Mn原子的价电子构型为( ),用四个量子数分别表示每个价电子的一定状态,是( ).10.在电子构型 a.1s22s2, b.1s22s22p54s1, c.1s22s12p13d13s1,d.1s22s22p63s13d1,e.1s22p2,f.1s22s32p1,g.1s12s22p13d1中,属于原子基态的是( ),属于原子激发态的是( ),纯属错误的是( ).11.用元素符号填空:(均以天然存在为准)原子半径最大的元素是( ), 第一电离能最大的元素是( ),原子中3d半充满的元素是( ),原子中4p半充满的元素是( ),电负性差最大的两个元素是( ), 化学性质最不活泼的元素是( ).四.简答题1.第114号元素属于第几周期? 第几族?2.为什么碳(6C)的外围电子构型是2s22p2, 而不是2s12p3,而铜(29Cu)的外围电子构型是3d104s1,而不是3d94s2?3、气体常数R是否只在气体中使用?五.综合题1.某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答:(1).该元素的原子序数,符号,所处周期和族;(2).写出表示全部价电子运动状态的四个量子数;(3).该元素最高价氧化物水合物的分子式及酸碱性.2.某元素原子序数为33,试问:(1).此元素原子的电子总数是多少?有多少个未成对电子?(2).它有多少个电子层?多少个能级?最高能级组中的电子数是多少?(3).它的价电子数是多少?它属于第几周期?第几族?是金属还是非金属?最高化合价是几?3.写出原子序数为24的元素的名称,符号及其基态原子的电子排布式,并用四个量子数分别表示每个价电子的运动状态.第二章分子结构一.是非题:1、两原子间可以形成多重键,但两个以上的原子间不可能形成多重键。
第3课时 原子核外电子排布规则[目标定位] 知道原子核外电子排布的“两原理一规则”,会正确书写原子的电子排布式和电子排布图。
一、基态原子核外电子的排布原则 1.能量最低原理原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s →2s →2p →3s →3p →4s →3d →4p ”这一顺序)。
2.泡利原理(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这一原理被称为泡利原理。
(2)因为每个原子轨道最多只能容纳 2个电子且自旋方向相反,所以从能层、能级、原子轨道、自旋方向四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。
如氟原子的电子排布可表示为1s 22s 22p 2x 2p 2y 2p 1z ,由于各原子轨道中的电子自旋方向相反,所以9个电子的运动状态互不相同。
3.洪特规则(1)在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,这就是洪特规则。
(2)通俗地说,洪特规则可以表述为电子总是尽量自旋平行地分占不同的轨道。
如碳原子的电子排布图是,而不是。
(3)洪特规则的特例在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较大的稳定性。
相对稳定的状态⎩⎪⎨⎪⎧全充满:p 6、d 10、f 14全空:p 0、d 0、f 0半充满:p 3、d 5、f 7如24Cr 的电子排布式为1s 22s 22p 63s 23p 63d 54s 1,为半充满状态,易错写为1s 22s 22p 63s 23p 63d 44s 2。
原子核外电子排布“两原理一规则”(1)能量最低原理:电子在原子轨道上的分布要尽可能地使原子的能量最低。
(2)泡利原理:每个原子轨道最多容纳两个电子且自旋方向必须相反。
(3)洪特规则:当电子排布在同一能级(能量相同)的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。
多电子原子轨道能级顺序
随着互联网技术的发展,人们越来越了解多电子原子的轨道能级顺序。
多电子原子的轨道能级顺序是根据原子电子的层数、电子总数和原子质量等构成的。
原子轨道能级顺序是根据基态能量来定义的,基态能量通常是由原子总能量通过发射光子而释放的,其顺序是从低到高依次分别排列。
原子的轨道能级顺序是由外层电子向内层移动的,从最外层的K能级开始,然后K、L、M、N四级能级依次向内排列,再然后依次是O、P、Q、R五级能级最后到达原子中心。
原子内部由原子质量构成,原子质量越大,原子轨道能级顺序也会相应变得更复杂。
特别地,由于原子质量至少为十二以上,它们的能级顺序将需要更多的电子层依次排列,而每一层中可能存在多个电子。
另外,根据四率定律,当原子能够发射分子,它将会释放出一个更高的能级,以及更多的光子来作为分子的“礼物”。
以上是关于多电子原子的轨道能级顺序的介绍,根据原子电子的层数、电子总数和原子质量等特点,多电子原子的轨道能级顺序由低到高依次排列,而且随着原子质量的增加,轨道能级也变得更加复杂。
因此,了解多电子原子轨道能级顺序对于研究原子性质有重要意义。