常见元素与原子团的化合价
- 格式:doc
- 大小:47.50 KB
- 文档页数:2

34个元素化合价1. 氢(H)的化合价为+1。
氢是宇宙中最丰富的元素之一,常见于水和氢气等化合物中。
2. 氦(He)是一种惰性气体,不与其他元素形成化学键,因此其化合价为0。
3. 锂(Li)的化合价为+1。
锂是一种轻金属,常与氧、氟等元素形成化合物。
4. 铍(Be)的化合价为+2。
铍是一种硬而脆的金属,常与氧、硅等元素形成化合物。
5. 硼(B)的化合价为+3。
硼是一种非金属元素,常见于硼酸和硼砂等化合物中。
6. 碳(C)的化合价可以是+4或-4。
碳是生命的基础,常见于有机化合物中。
7. 氮(N)的化合价可以是+3、+4或-3。
氮是大气中最主要的成分之一,常见于氨、硝酸等化合物中。
8. 氧(O)的化合价为-2。
氧是地壳中最丰富的元素之一,常见于水、氧化物等化合物中。
9. 氟(F)的化合价为-1。
氟是最活泼的非金属元素,常见于氟化物等化合物中。
10. 氖(Ne)是一种惰性气体,其化合价为0。
11. 钠(Na)的化合价为+1。
钠是一种常见的金属元素,常与氯、氧等元素形成化合物。
12. 镁(Mg)的化合价为+2。
镁是一种轻金属,常见于氧化镁等化合物中。
13. 铝(Al)的化合价为+3。
铝是地壳中丰富的元素之一,常见于氧化铝等化合物中。
14. 硅(Si)的化合价可以是+4或-4。
硅是地壳中第二丰富的元素,常见于硅酸盐等化合物中。
15. 磷(P)的化合价可以是+3或-3。
磷是生命中必不可少的元素,常见于磷酸盐等化合物中。
16. 硫(S)的化合价可以是+2、+4或-2。
硫是地壳中丰富的元素之一,常见于硫酸盐等化合物中。
17. 氯(Cl)的化合价为-1。
氯是一种常见的非金属元素,常见于氯化物等化合物中。
18. 钾(K)的化合价为+1。
钾是一种重要的金属元素,常见于氯化钾等化合物中。
19. 钙(Ca)的化合价可以是+2。
钙是地壳中丰富的元素之一,常见于碳酸钙等化合物中。
20. 钛(Ti)的化合价可以是+2、+3或+4。

常见的原子团化合价【最新版】目录1.原子团的概念及化合价的定义2.常见原子团的化合价规律3.特殊原子团和常见原子团化合价举例4.初中常见原子团化合价口诀5.常见原子团的化合价及其应用正文一、原子团的概念及化合价的定义在化学反应中,作为一个整体参加反应的原子集团称为原子团。
原子团内各原子的化合价的代数和等于原子团所带的电荷数。
化合价是元素在化合物中的价态,表示元素与其他元素结合时所表现出的化学价值。
二、常见原子团的化合价规律1.氢氧根:氢的化合价为 +1,氧的化合价为 -2,氢氧根的化合价为-1。
2.硫酸根:硫的化合价为 +6,氧的化合价为 -2,硫酸根的化合价为-2。
3.亚硫酸根:硫的化合价为 +4,氧的化合价为 -2,亚硫酸根的化合价为 -2。
4.硝酸根:氮的化合价为 +5,氧的化合价为 -2,硝酸根的化合价为-1。
5.碳酸根:碳的化合价为 +4,氧的化合价为 -2,碳酸根的化合价为-2。
6.碳酸氢根:碳的化合价为 +4,氢的化合价为 +1,氧的化合价为 -2,碳酸氢根的化合价为 -1。
7.高锰酸根:锰的化合价为 +7,氧的化合价为 -2,高锰酸根的化合价为 -1。
8.锰酸根:锰的化合价为 +6,氧的化合价为 -2,锰酸根的化合价为-2。
9.磷酸根:磷的化合价为 +5,氧的化合价为 -2,磷酸根的化合价为-3。
10.乙酸根:碳的化合价为 +2,氧的化合价为 -2,乙酸根的化合价为 -1。
三、特殊原子团和常见原子团化合价举例1.scn:硫氰根,化合价为 -1。
:氰根,化合价为 -1。
3.mno4:高锰酸根,化合价为 -1。
4.mn:锰酸根,化合价为 -2。
5.po4:磷酸根,化合价为 -3。
四、初中常见原子团化合价口诀“一价元素用最频,氯溴碘氢钠钾银;记住二价别怕累,氧镁铜铁钙锌钡;三价元素很好写,氮硼铝磷铁;四价元素很少见,锰硫硅碳氮;五价元素更少见,常见只有氯磷氮;二三铁,二四碳,二四六硫锰常见;铁有二三要分清,毋忘单质都是零;负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根。
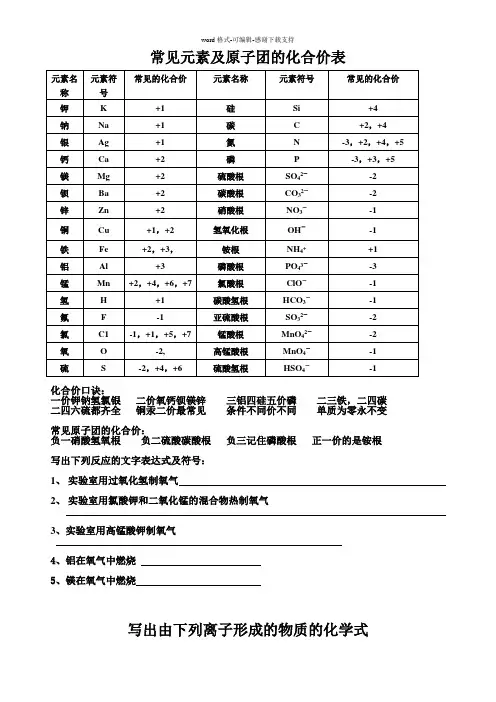
常见元素及原子团的化合价表
化合价口诀:
一价钾钠氢氯银二价氧钙钡镁锌三铝四硅五价磷二三铁,二四碳二四六硫都齐全铜汞二价最常见条件不同价不同单质为零永不变常见原子团的化合价:
负一硝酸氢氧根负二硫酸碳酸根负三记住磷酸根正一价的是铵根写出下列反应的文字表达式及符号:
1、实验室用过氧化氢制氧气
2、实验室用氯酸钾和二氧化锰的混合物热制氧气
3、实验室用高锰酸钾制氧气
4、铝在氧气中燃烧
5、镁在氧气中燃烧
写出由下列离子形成的物质的化学式。
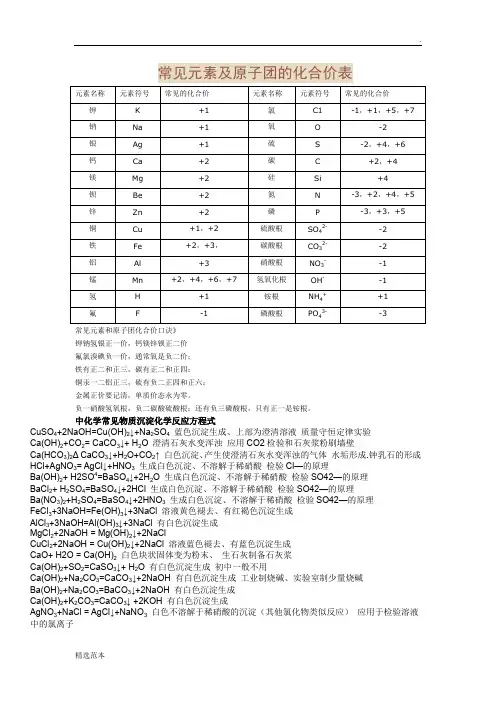
常见元素及原子团的化合价表CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成HCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成AgNO3+NaCl = AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子初中常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰 6 、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打中化学常见物质的颜色(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、红褐色沉淀:氢氧化铁6、白色沉淀(6种):碳酸钙,碳酸钡,碳酸银;氢氧化镁;硫酸钡,氯化银。

常见元素及原子团的化合价表
“常见元素及原子团的化合价表”是一种物理学术语,用于描述某些元素和原子团在不同条件下的化合价。
它们通常表示为数值,并且可以用来表明这些元素或原子团之间的相互作用。
化合价表的内容可以根据某些特定要求而异。
一般情况下,化合价表会列出常见元素和原子团的原子序数、化学式、多重性、极性、单体电荷、气体态(摩尔)等信息。
此外,化合价表还会列出每种元素和原子团在不同条件下的化合价,以及它们的反应特性。
化合价表中的化合价是指某种元素或原子团在不同条件下的组成能力。
它们可以用来表示某种元素或原子团在反应中的活性程度。
例如,氢原子的化合价为1,意味着氢原子在反应中非常活跃,它可以与一个氧原子结合形成水分子,这也是水分子的形成原因。
另一方面,化合价表还可以用来表示某种元素或原子团在不同温度、压力和溶液浓度条件下的结合能力。
例如,硫酸钠的溶液中,氯离子的化合价随着温度的升高而降低,而氢离子的化合价随着温度的升高而升高。
这就意味着,当温度升高时,氯离子很容易结合,但氢离子很难结合。
总的来说,“常见元素及原子团的化合价表”是一种重要的物理学术语,它用来描述某些元素或原子团在不同条件下的化合价,以及它们的反应特性。
它们在研究反应机理和计算反应速率方面具有重要的意义,是化学反应中必不可少的研究工具。

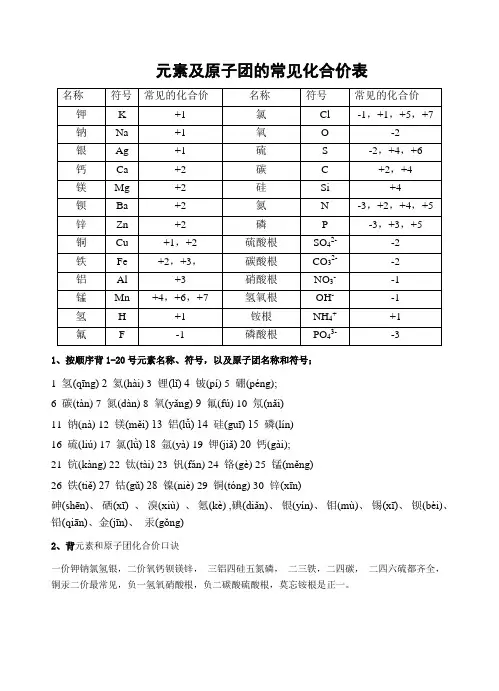

常见元素及原子团的化合价表元素名称元素符号常见的化合价元素名称元素符号常见的化合价钾K +1 氯C1 -1,+1,+5,+7 钠Na +1 氧O -2银Ag +1 硫S -2,+4,+6 钙Ca +2 碳 C +2,+4 镁Mg +2 硅Si +4钡Be +2 氮N -3,+2,+4,+5 锌Zn +2 磷P -3,+3,+5 铜Cu +1,+2 硫酸根SO42--2铁Fe +2,+3,碳酸根CO32--2铝Al +3 硝酸根NO3--1锰Mn +2,+4,+6,+7 氢氧化根OH--1氢H +1 铵根NH4++1氟 F -1 磷酸根PO43--3 常见元素和原子团化合价口诀》钾钠氢银正一价,钙镁锌钡正二价氟氯溴碘负一价,通常氧是负二价;铁有正二和正三,碳有正二和正四;铜汞一二铝正三,硫有负二正四和正六;金属正价要记清,单质价态永为零。
负一硝酸氢氧根,负二碳酸硫酸根;还有负三磷酸根,只有正一是铵根。
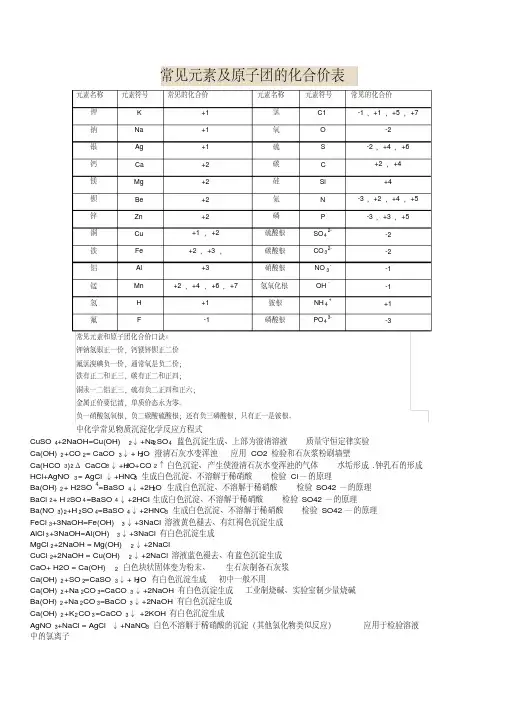
中化学常见物质沉淀化学反应方程式CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成HCl+AgNO3= AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成AgNO3+NaCl = AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子精品文库初中常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰 6 、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打中化学常见物质的颜色(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、红褐色沉淀:氢氧化铁6、白色沉淀(6种):碳酸钙,碳酸钡,碳酸银;氢氧化镁;硫酸钡,氯化银。

常见元素的化合价
纳钾银氢正一价,氟氯溴碘负一价;镁钙锌钡正二价,氧为负二最常见;铝价常显正三价,以上价态需记牢。
碳硅正二和正四,负三正五氮和磷;硫有正价二四六,氯有正价一五七;锰有正价二四六,最高价态也是七;亚铜正一铜正二,亚铁正二铁正三;过氧化物氧负一,单质为零永不变。
常见原子团的化合价
负一硝酸氢氧根,高锰酸根氯酸根;负二硫酸碳酸根,还有负二锰酸根;负三常见磷酸根,正一价的是铵根;最后记住化合物,正负价态和为零。

常见得元素和原子团化合阶第一篇范文常见元素和原子团化合阶探究化学,作为研究物质性质、组成和变化的科学,对于常见元素及其化合物的认识至关重要。
在化学的世界里,元素和原子团化合阶的研究一直是核心议题。
本文将围绕这一主题,尊重事实,条理清晰地展开论述。
一、常见元素的化合阶1. 主族元素的化合阶主族元素是周期表中的主要成员,它们的化合价通常与其族序数相等。
例如,第一主族元素(碱金属)的化合价为+1,第二主族元素(碱土金属)的化合价为+2。
然而,随着元素周期的变化,化合价也会发生变化。
如第三周期的硼(B)和铝(Al),它们的化合价分别为+3和+3或+5。
2. 过渡元素的化合阶过渡元素在化合物中的化合价较为复杂,通常有多种化合价。
例如,铁(Fe)的常见化合价有+2和+3,铜(Cu)的常见化合价有+1和+2。
过渡元素的化合价取决于其电子排布和配位数。
二、原子团的化合阶原子团是多个原子组成的集团,它们在化合物中以固定的组合出现。
原子团的化合价通常为负价,与它们所结合的阳离子形成稳定的化合物。
1. 阴离子的化合阶阴离子是带负电的原子团,它们的化合价通常等于其电荷数。
例如,氯离子(Cl-)的化合价为-1,硫酸根离子(SO4^2-)的化合价为-2。
2. 有机分子的化合阶有机分子中的原子团通常具有固定的化合价。
例如,甲烷(CH4)中的碳原子团具有-4的化合价,乙烯(C2H4)中的碳原子团具有-2的化合价。
三、化合阶的规律与特点1. 氧化态规律在化合物中,氧化态规律指出:一个元素在化合物中的氧化态越高,其化合价也越高。
例如,铁(Fe)的最高氧化态为+3,对应化合价为+3。
2. 八隅体规律八隅体规律适用于主族元素和部分过渡元素。
根据这一规律,元素的化合价通常使其价电子层达到8个电子的稳定结构。
例如,氯(Cl)的化合价为-1,因为它只需要获得一个电子即可达到八隅体结构。
3. 电负性规律电负性规律指出,在化合物中,电负性较高的元素倾向于呈现负化合价。
常见元素化合价化学根本知识归纳整理一、常见元素化合价口诀与原那么一价氢氯钾钠银二价氧钙镁钡锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心。
所有单质中元素化合价为零,化合物中各元素化合价代数和为零。
二、常见原子团的化合价+1价:铵根离子〔NH4+〕;-1价:氢氧根离子〔OH-〕硝酸根离子〔NO3-〕碳酸氢根离子〔HCO3-〕硫酸氢根离子〔HSO4-〕高猛酸根离子〔MnO4-〕氯酸根离子〔ClO3-〕次氯酸根离子〔ClO-〕醋酸根离子〔CH3COO-〕偏铝酸根离子〔AIO2-〕-2价:碳酸根离子〔CO32-〕硫酸根离子〔SO42-〕亚硫酸根离子〔SO32-)三、常见物质的化学式非金属单质:氢气碳氮气氧气磷硫氯气H2CN2O2PSCl2金属单质:镁铝钾钙铁锌铜钡钨汞Na Mg Al K Ga Fe Zn CuWHg常见氧化物:水一氧化碳二氧化碳五氧化二磷氧化钠二氧化氮二氧化硅H2OCOCO2P2O5Na2ONO2SiO2二氧化硫三氧化硫一氧化氮氧化镁氧化铜氧化钡氧化亚铜SO2SO3NOMgOCuOBaOCu2O氧化亚铁三氧化二铁〔氧化铁或铁红〕四氧化三铁三氧化二铝三氧化钨FeOFe2O3Al2O3WO3氧化银氧化铅二氧化锰Ag2OPbOMnO2氯化物、盐酸盐:氯化钾氯化钠(食盐)氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KClNaClCaCl2CuCl2ZnCl2BaCl2AlCl3氯化亚铁氯化铁氯化银FeCl2FeCl3AgCl常见的酸:硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸HClHNO3H3PO4H2SHBrH2CO3常见的盐:硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4BaSO4CaSO4K2SO4FeSO4Fe2(SO4)3硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3 NaHSO4 KHSO4Na2SO3 NaNO3 KNO3 AgNO3硝酸镁硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁Mg(NO3)2Cu(NO3)2Ca(NO3)2NaNO2Na2CO3CaCO3MgCO3常见的碱:氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOHCa(OH)2Ba(OH)2Mg(OH)2Cu(OH)2 KOHAl(OH)3氢氧化铁氢氧化亚铁Fe(OH)3Fe(OH)2常见有机物:甲烷乙炔甲醇乙醇乙酸(醋酸)CH4C2H2CH3OHC2H5OHCH3COOH常见结晶水合物:碱式碳酸铜石膏熟石膏明矾Cu2(OH)2CO3CaSO4•2H2O2CaSO4•H2OKAl(SO4)2•12H2O绿矾蓝矾碳酸钠晶体常见化肥:FeSO4•7H2OCuSO4•5H2ONa2CO3•10H2O尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾CO(NH2)2NH4NO3(NH4)2SO4NH4HCO3KH2PO4四、常见物质中重点元素的化合价H:HClNaHCaH2。
初中常见化学式一、常见元素原子团化合价口诀元素化合价: 原子团化合价:一价氢氯钾钠银二价氧钙钡镁锌负一硝酸氢氧根三铝四硅五价磷二三铁,二四碳负二硫酸碳酸根二四六硫都齐全铜汞二价最常见负三记住磷酸根条件不同价不同单质为零永不变! 正一价的是铵根常见离子符号:H+ (氢离子)、Na+ (钠离子)、K+ (钾离子) 、Ag+ (银离子)Ca2+ (钙离子)、Mg2+ (镁离子)、Ba2+ (钡离子)、Zn2+ (锌离子)、Cu2+ (铜离子) Fe2+ (亚铁离子)、Fe3+ (铁离子)、Al3+ (铝离子)、NH4+(铵根离子)、NO3-(硝酸根离子)、OH-(氢氧根离子)CO32-(碳酸根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO42-(硫酸根离子)、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)二、常见单质三、化合物1、氧化物2、其他化合物3、常见有机化合物初中常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O 2 2P 2O 52、氢气在空气中燃烧生成水:2H 2 + O 2 2H 2O3、硫磺在空气(或氧气)中燃烧:S + O 2 SO 24、镁条在空气(或氧气)中燃烧:2Mg + O 2 2MgO5、铁丝在氧气中燃烧:3Fe + 2O 2 Fe 3O 46、木炭在空气(或氧气)中完全燃烧:C + O 2 CO 27、木炭不充分燃烧:2C + O 2 2CO8、一氧化碳燃烧:2CO + O 2 2CO 29、二氧化碳和水反应生成碳酸:CO 2 + H 2O == H 2CO 3 10、二氧化碳通过灼热的炭层:CO 2 + C 2CO 11、生石灰作为干燥剂:CaO + H 2O == Ca(OH)2二、分解反应11、高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 12、氯酸钾制氧气:2KClO 3 2KCl + 3O 2↑ 13、双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 14、电解水:2H 2O 2H 2↑+ O 2↑15、碳酸分解:H 2CO 3 H 2O + CO 2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO 3 CaO +CO 2↑点燃点燃点燃 点燃 点燃 点燃高温 △MnO 2 △MnO 2 通电高温 点燃 点燃三、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2 18、铁和硫酸铜溶液反应:Fe + CuSO 4 == Cu + FeSO 4 19、锌和硫酸反应制取氢气:Zn + H 2SO 4 == ZnSO 4 + H 2↑ 20、铝和稀硫酸反应:2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑ 21、木炭还原氧化铁:3C + 2Fe 2O 3 4Fe + 3CO 2↑木炭还原氧化铜:C + 2CuO2Cu + CO 2↑ 木炭还原四氧化三铁:2C + Fe 3O 4 3Fe +2CO 2↑ 氢气还原氧化铜:H 2 + CuO Cu + H 2O四、复分解反应(一)酸 + 碱 → 盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H 2O 23、氢氧化钠与硫酸反应:2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O 24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl 3 + 3H 2O 25、氢氧化镁与硫酸反应:Mg(OH)2 + H 2SO 4 == MgSO 4 + 2H 2O(二)酸 + 盐 → 新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl + AgNO 3 == AgCl ↓+ HNO 327、氯化钡溶液与硫酸溶液反应:BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl 28、碳酸钠与稀盐酸:Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2↑ 碳酸氢钠与稀盐酸:NaHCO 3 + HCl == NaCl+ H 2O + CO 2↑ 29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO 3+2HCl = CaCl 2+H 2O+CO 2↑(三)碱 + 盐 → 另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓ 31、氯化铁溶液和氢氧化钠溶液反应:FeCl 3+3NaOH==Fe(OH)3↓+3NaCl高温 高温 高温(四)盐 + 盐 → 两种新盐32、硝酸银溶液与氯化钠溶液反应:AgNO 3 + NaCl == AgCl↓+ NaNO 3 33、氯化钡溶液与碳酸钠溶液反应:BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaCl(五)金属氧化物 + 酸 → 盐 + 水34、稀盐酸清洗铁锈:6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O 35、氧化铜与稀硫酸反应:CuO + H 2SO 4== CuSO 4+ H 2O 五、非金属氧化物 + 碱 → 盐 + 水36、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O 37、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O 38、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O 39、氢氧化钠溶液吸收三氧化硫:SO 3 + 2NaOH ==Na 2SO 4+ H 2O六、其他反应类型40、一氧化碳还原氧化铜:CO + CuO Cu + CO 2 41、一氧化碳还原氧化铁:3CO + Fe 2O 3 2Fe + 3CO 2 42、一氧化碳还原四氧化三铁:4CO + Fe 3O 4 3Fe + 4CO 2 43、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O 44、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃点燃 高温 高温附表1 一些常见元素的名称、符号和相对原子质量附表2 一些常见元素、根的化合价和离子符号。
初中化学整理一、常见元素化合价钾钠银氢+1价,钙镁钡锌+2价,一、二铜,二、三铁;氟氯溴碘-1价,氧硫通常-2价,单质化合价为零二、常见原子团化合价四、化学式的书写1、单质:(1)由原子直接构成(元素符号):a.金属:钾K、钙Ca、钠Na、镁Mg、铝Al、锌Zn、铁Fe、锡Sn、铅Pb、氢H、铜Cu、汞Hg、银Ag、铂Pt、金Au 钡Ba、钨Wb.稀有气体:氦He、氖Ne、氩Ar、氪Kr、氙Xe、氡Rnc.部分固态非金属:金刚石/石墨/碳C、硅Si、磷P、硫S(2)双原子分子:a.固体:碘I2;b.常见气体:氢气H2、氮气N2、氧气O2、氯气Cl2、氟气F2;c.液态:溴Br2(3)三原子分子:臭氧O32、化合物:按照化合价,利用化合价交叉法进行书写(1)氧化物:由两种元素组成,其中一种为氧元素的化合物a.非金属氧化物:水H2O、一氧化碳CO、二氧化碳CO2、二氧化硫SO2、三氧化硫SO3、二氧化硅SiO2、一氧化氮NO、二氧化氮NO2、五氧化二磷P2O5b.金属氧化物:氧化钾K2O、氧化钠Na2O、氧化银Ag2O、氧化亚铜Cu2O、氧化钙CaO、氧化镁MgO、氧化钡BaO、氧化锌ZnO、氧化铜CuO、氧化亚铁FeO、三氧化二铁(氧化铁)Fe2O3、四氧化三铁Fe3O4、三氧化二铝Al2O3、二氧化锰MnO2、三氧化钨WO3、氧化铅PbO(2)常见的酸(阳离子只有H+的化合物):硫酸H2SO4、盐酸HCl、硝酸HNO3、磷酸H3PO4、硫化氢H2S、碳酸H2CO3、醋酸CH3COOH(3)常见的碱(阴离子只有OH¯的化合物):氢氧化钾KOH、氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化镁Mg(OH)2、氢氧化钡Ba(OH)2、氢氧化锌Zn(OH) 2、氢氧化铜Cu(OH) 2、氢氧化亚铁Fe(OH) 2、氢氧化铁Fe(OH) 3、氢氧化铝Al(OH) 3(4)盐:由金属阳离子(或铵根离子)和酸根离子构成的化合物a.氯化物/盐酸盐:氯化钾KCl、氯化钠(食盐)NaCl、氯化银AgCl、氯化钙CaCl2、氯化镁MgCl2、氯化钡BaCl2、氯化锌ZnCl2、氯化铜CuCl2、氯化亚铁FeCl2、氯化铁FeCl3、氯化铝AlCl3b.硝酸盐:硝酸钾KNO3、硝酸钠NaNO3、硝酸银AgNO3、硝酸钙Ca(NO3)2、硝酸镁Mg(NO3)2、硝酸钡Ba(NO3)2、硝酸锌Zn(NO3)2、硝酸铜Cu(NO3)2、硝酸亚铁Fe(NO3)2、硝酸铁Fe(NO3)3、硝酸铝Al(NO3)3c.硫酸盐:硫酸钾K2SO4、硫酸钠Na2SO4、硫酸银Ag2SO4、硫酸钙CaSO4、硫酸镁MgSO4、硫酸钡BaSO4、硫酸锌ZnSO4、硫酸铜CuSO4、硫酸亚铁FeSO4、硫酸铁Fe2 (SO4) 3、硫酸铝Al2 (SO4) 3d.碳酸盐:碳酸钾K2CO3、碳酸钠Na2CO3、碳酸银Ag2CO3、碳酸钙CaCO3、碳酸镁MgCO3、碳酸钡BaCO3、碳酸锌ZnCO3、碳酸铜Cu CO3、碳酸亚铁Fe CO3、e.铵盐:氯化铵NH4Cl、硝酸铵NH4NO3、碳酸铵(NH4)2CO3、硫酸铵(NH4)2SO4、磷酸铵(NH4)3PO4、碳酸氢铵NH4HCO3f.其他:高锰酸钾KMnO4、锰酸钾K2MnO4、氯酸钾KClO3、氨气NH3、过氧化氢H2O2g.常见化肥:尿素CO(NH2)2(N%=46.7%)、硝酸铵NH4NO3(N%=35%)、硫酸铵(NH4)2SO4(N%=21.2%)、碳酸氢铵NH4HCO3(N%=17.7%)、硫酸钾K2SO4、氯化钾KCl(5)有机物(含碳化合物):甲烷CH4、乙炔C2H2、乙醇(酒精)C2H5OH、乙酸CH3COOH、葡萄糖C6H12O6(6)常见结晶水合物:五水硫酸铜CuSO4·H2O、明矾KAl(SO4) 2•12H2O、碳酸钠晶体Na2CO3•10H2O3、常见沉淀及其颜色:白色:CaCO3、CaSO4(微溶)、BaCO3、BaSO4、AgCO3、AgCl、AgOH、Fe(OH) 2、Mg(OH) 2红色:Cu、Fe(OH) 3(红褐色)、Fe2O3蓝色:Cu(OH)2(絮状)黑色:MnO2、CuO、Fe、C、Fe3O4、FeSO4五、溶解性表:OH¯:铵、钾、钠、钡、钙(微);NO3¯:全溶;Cl¯:AgCl(白色沉淀);SO42-:BaSO4(白色沉淀);CO32-:铵、钾、钠六、共存问题1、OH¯+H+→H2O2、OH¯+部分金属离子→碱↓3、Ba2++SO42—→BaSO44、Ag++Cl—→AgCl5、CO32—+部分金属离子→盐↓6、H++CO32—→H2O+CO2↑7、NH4++ OH¯→NH3↑+ H2O8、HCO3—+ H+→H2O+CO2↑9、无色:Fe2+(淡绿)、Fe3+(黄)、Cu2+(蓝)七、化合反应:两种或两种以上物质反应生成另一种物质。
常见元素及原子团的化合价常见元素及原子团的化合价:
1. 氢(H)的化合价为1。
2. 氧(O)的化合价通常为2。
3. 氮(N)的化合价可以是3或5。
4. 碳(C)的化合价可以是2或4。
5. 硫(S)的化合价可以是2、4或6。
6. 氯(Cl)的化合价通常为1。
7. 钠(Na)的化合价通常是1。
8. 铁(Fe)的化合价可以是2或3。
9. 铝(Al)的化合价通常为3。
10. 氟(F)的化合价通常为1。
11. 磷(P)的化合价可以是3或5。
12. 铜(Cu)的化合价可以是1或2。
13. 硼(B)的化合价可以是3或4。
14. 氦(He)的化合价通常是0。
15. 锂(Li)的化合价通常是1。
16. 氮气(N2)的化合价是0。
17. 氯气(Cl2)的化合价是0。
18. 二氧化碳(CO2)的化合价是0。
19. 水(H2O)中氧(O)的化合价是2,氢(H)的化合价是1。
20. 硫酸(H2SO4)中氢(H)的化合价是1,氧(O)的化合价是-2,硫(S)的化合价是6。
请注意,以上化合价仅代表常见情况,具体化合价还会受到其他因素的影响,并不是绝对的。
常见元素及原子团化合价首先,我们需要明确一些基本概念。
元素是由一种类型的原子组成的物质,而原子是构成物质的最基本单位。
元素的化合价是指元素在化合物中与其他元素结合时所具有的价值或电荷。
化合价的确定是通过物质的结构与化学键进行分析的。
化学键是原子之间的相互吸引力,可以通过共享或转移电子来形成。
化学键的形成使得原子能够达到更稳定的电子结构。
对于常见元素的化合价,我们可以从主要的族(或称主族元素)开始讨论。
主族元素是指周期表中位于IA到VIII A族(或称1A到8A族)的元素,它们的原子数目相同且具有相似的化学性质。
首先,让我们从IA族开始讨论。
IA族元素包括氢(H)和铷(Rb)在内。
氢只有一个电子,因此只能形成1价阳离子H+或1价阴离子H-。
铷有一个价电子,因此也可以形成1价阳离子Rb+。
接下来是IIA族元素,如镁(Mg)和锶(Sr)。
它们有两个价电子,可以形成2价阳离子Mg2+和Sr2+。
然后是IIIA族元素,如硼(B)和铝(Al)。
它们有三个价电子,可以形成3价阳离子B3+和Al3+。
接下来是IVA族元素,如碳(C)和锗(Ge)。
它们有四个价电子,可以形成4价阳离子C4+和Ge4+。
接下来是VA族元素,如氮(N)和磷(P)。
它们有五个价电子,可以形成3价阴离子N3-和5价阳离子P5+。
然后是VIA族元素,如氧(O)和硫(S)。
它们有六个价电子,可以形成2价阴离子O2-和6价阳离子S6+。
接下来是VIIA族元素,如氟(F)和氯(Cl)。
它们有七个价电子,可以形成1价阴离子F-和Cl-。
最后是VIIIA族元素,如氦(He)和氖(Ne)。
这些元素属于稀有气体,在化合物中不常见,因此不具有常见的化合价。
除了主族元素,还有过渡金属元素和内过渡金属元素等其他元素。
这些元素的化合价比主族元素要复杂一些,因为它们的外层电子结构不太规律。
在这些元素中,通常需要考虑d电子和f电子的参与。
总结起来,常见元素的化合价是根据元素的电子数目和其在化合物中的化学行为来确定的。
常见元素与原子团的化合价
原子团的化合价
元素化合价价口诀: 原子团化合价口诀: +1一价氢氯钾钠银-1氢氧硝酸碳酸氢,+2二价钙镁氧钡锌-2碳酸硫酸亚硫酸,三铝四硅五氮磷-3负三只有磷酸根。
二三铁,二四碳还有正一是铵根
二四六硫价齐全
铜汞二价较常见
化合价要记清
莫忘单质价为0
1.金属
原子构成 2.固态非金属(例如:碘,硫,碳,磷,砷,硅等)
3.稀有气体
1.大多数非金属单质(例如:O
2,H, S, P等)
分子构成
2.共价化合物:非金属+非金属=化合物(例如:H2O, NH4等)
离子构成:金属+非金属(原子团)=化合物(例如:NaCl, KSO等)
纯净物:由一种物质构成(单质,同种分子,同种原子,)一种分子的性子,
可用化学式表示。
混合物:2种或2种以上物质,是由几种分子组成的性质,不可用化学式
表示。
化合物:2种元素构成
单质:1种元素构成
氢元素
氧化物:2H2O
氧元素。