焓变与反应热(高三复习)
- 格式:doc
- 大小:216.00 KB
- 文档页数:7

焓变的影响因素是什么化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。
在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ3.单位:kJ·mol-14.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.焓变与反应热的关系焓变包含于反应热包含于热效应,就相当于热效应是最大的集合。
焓是与内能有关的物理量,反应在一定条件下是吸热还是放热由生成物和反应物的焓值差即焓变(△H)决定。
等压条件下的反应热等于焓变。
焓变与反应热的含义焓变即物体焓的变化量。
焓是物体的一个热力学能状态函数,即热函,一个系统中的热力作用,等于该系统内能加上其体积与外界作用于该系统的压强的乘积的总和。
反应热是指当一个化学反应在恒压以及不作非膨胀功的情况下发生后,若使生成物的温度回到反应物的起始温度,这时体系所放出或吸收的热量称为反应热。
焓变与反应热的区别当系统发生了化学反应之后,使反应产物的温度回到反应前始态的温度,系统放出或吸收的热量就称为该反应的热效应,简称反应热,用Q表示。
Q与过程有关,不是状态函数,即使始末状态相同,只要过程不同(如等压过程和等容过程),Q值就不同。
焓是热力学中表示物质系统能量的一个状态函数,用符号H表示,H=U+pV。
焓的变化是系统在等压可逆过程中所吸收的热量的度量。
焓是状态函数,它的值只与状态有关而与过程无关。
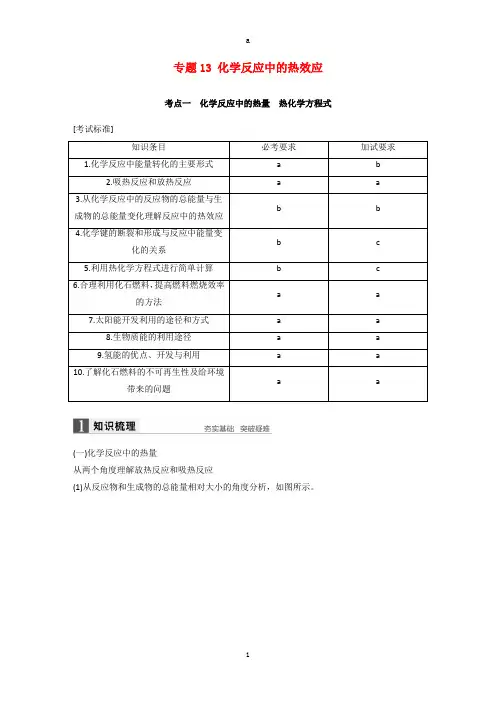
专题13 化学反应中的热效应考点一化学反应中的热量热化学方程式[考试标准]知识条目必考要求加试要求1.化学反应中能量转化的主要形式a b2.吸热反应和放热反应a a3.从化学反应中的反应物的总能量与生b b成物的总能量变化理解反应中的热效应4.化学键的断裂和形成与反应中能量变b c化的关系5.利用热化学方程式进行简单计算b c6.合理利用化石燃料,提高燃料燃烧效率a a的方法7.太阳能开发利用的途径和方式a a8.生物质能的利用途径a a9.氢能的优点、开发与利用a a10.了解化石燃料的不可再生性及给环境a a带来的问题(一)化学反应中的热量从两个角度理解放热反应和吸热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
(2)从反应热的量化参数——键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐类的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl 反应;④碳和水蒸气、C和CO2的反应等。
(二)热化学方程式的书写1.注明反应条件反应热与测定条件(温度、压强等)有关。
绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。
2.注明物质状态常用s、l、g、aq分别表示固体、液体、气体、溶液。
3.注意符号单位ΔH应包括“+”或“-”(“+”可省略)、数字和单位(kJ·mol-1)。
4.注意守恒关系(1)原子守恒和得失电子守恒;(2)能量守恒。
5.区别于普通方程式一般不标注“↑”、“↓”以及“点燃”、“加热”等。
6.注意热化学方程式的化学计量数热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。
且化学计量数必须与ΔH 相对应,如果化学计量数加倍,则ΔH 也要加倍。
正误辨析正误判断,正确的打“√”,错误的打“×” (1)物质发生化学变化都伴有能量的变化(√) (2)放热反应不需要加热就能发生,吸热反应不加热不能发生 (×) (3)伴有能量变化的物质变化都是化学变化 (×) (4)化学反应中的能量变化不是单一的(√) (5)化学键断裂要吸收热量,也必定发生化学变化(×) (6)书写热化学方程式时,任何情况下都没必要注明反应条件 (×) (7)C(石墨,s)===C(金刚石,s) ΔH >0说明石墨比金刚石稳定(√)(8)已知:500 ℃、30 MPa 下,N 2(g)+3H 2(g)高温高压催化剂2NH 3(g) ΔH =-92.4 kJ·mol -1,将1.5 mol H 2和过量的N 2在此条件下充分反应,放出热量46.2 kJ(×)题组一 全面认识化学反应中的能量变化1.(2016·浙江乐清市芙蓉中学高一5月月考)下列反应属于吸热反应的是( ) A .稀硫酸与氢氧化钾溶液反应 B .碳与二氧化碳的反应 C .锌与稀硫酸的反应 D .生石灰变成熟石灰的反应 答案 B2.(2016·宁波市北仑中学高一期中)图为反应2H 2(g)+O 2(g)===2H 2O(g)的能量变化示意图。

第26讲反应热[课程标准] 1.了解反应热,焓变的概念,知道化学反应热效应与反应的焓变之间的关系。
2.知道常见的吸热反应和放热反应,能从多角度分析化学反应中能量变化的原因。
3.了解热化学方程式的含义,能正确书写热化学方程式。
考点一反应热、焓变1.化学反应中的能量变化(1)化学反应中的两大变化:物质变化和能量变化。
(2)化学反应中的两大守恒:质量守恒和能量守恒。
(3)化学反应中的能量转化形式:热能、光能、电能等。
通常主要表现为热量的变化。
2.焓变、反应热(1)焓(H):用于描述物质所具有能量的物理量。
(2)焓变(ΔH):ΔH=H(生成物)-H(反应物),单位kJ·mol-1。
(3)反应热:指当化学反应在一定压强下进行时,反应所放出或吸收的热量,通常用符号Q表示,单位kJ·mol-1。
(4)焓变与反应热的关系:对于恒压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能,则有:ΔH=Q p。
3.吸热反应与放热反应(1)从能量高低角度理解(2)从化学键角度理解[正误辨析](1)所有的燃烧反应都是放热反应,所以不需要加热就能进行()(2)反应物的总能量低于生成物的总能量时,一定不能发生反应()(3)一个反应的焓变因反应物的用量和反应条件的改变而发生改变()(4)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关()(5)碳在空气中燃烧生成CO2,该反应中化学能全部转化为热能()(6)反应2SO 2(g)+O2(g)2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量()(7)活化能越大,表明化学反应吸收的能量越大()(8)C和H2O(g)、C和CO2、N2和O2的反应均为吸热反应()(9)Na2CO3溶于水,NaHCO3溶于水均放出热量()答案:(1)×(2)×(3)×(4)√(5)×(6)×(7)×(8)×(9)×一、反应热与能量变化关系图1.根据如图所示的反应,回答下列问题:(1)该反应是放热反应还是吸热反应?__________。




高中化学(必修一)第一章 反应热与焓变 练习题(含答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.强酸与强碱的稀溶液发生中和反应时:H +(aq) +OH - (aq) =H 2O(l) △H= -57.3kJ/mol 。
向1 L0.5 mol/L 的NaOH 溶液中分别加入下列物质至恰好完全反应:△稀醋酸△浓硫酸△稀硝酸。
下列说法正确的是 A .三者放出的热量均为28. 65kJ B .浓硫酸反应放出的热量小于28. 65kJ C .稀硝酸反应放出的热量为28.65kJD .稀醋酸放出的热量大于28. 65kJ2.C 、CO 、4CH 和25C H OH 是常用的燃料,1 mol 上述物质分别完全燃烧生成()2CO g 及()2H O l 时,放出的热量依次为393.5 kJ 、283.0 kJ 、890.3 kJ 和1366.8 kJ 。
相同质量的这4种燃料完全燃烧,放出热量最多的是。
A .CB .COC .4CHD .25C H OH3.下列反应属于吸热反应的是 A .KOH+HF=KF+H 2O B .NH 4Cl+NaOH ΔNH 3+H 2O+NaCl C .CaO+H 2O=Ca(OH)2D .C+O 2ΔCO 24.肼(H 2N -NH 2)燃烧涉及的共价键的键能与热化学方程式信息见下表:则2N(g)→N 2(g)+Q ,Q 为A .1882kJB .941kJC .483kJD .241.5kJ5.N 2(g)与H 2(g)化合生成NH 3(g)的能量变化如图,下列说法正确的是A.N2与H2的键能数值总和为1080B.N2(g)+3H2(g)2NH3(g)+46 kJC.1 mol H2(g)的能量比2 mol H(g)的能量低D.若使用催化剂会改变反应的热效应6.MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):已知:离子电荷相同时,半径越小,离子键越强。



反应热与焓变知识点
1. 嘿,你知道吗,反应热可重要啦!就像冬天里的一杯热奶茶,能给你带来温暖的感觉。
比如碳燃烧会放出热量,这就是反应热在起作用啊!
2. 哎呀呀,焓变就像是化学反应中的小秘密呢!好比一场比赛中决定胜负的关键因素。
氢气和氧气反应生成水,这个过程中焓变可有着大作用呢!
3. 喂喂喂,要清楚哦,反应热的大小能反映反应的剧烈程度呀!这就好像跑步的速度一样。
碳酸钙受热分解,反应热的情况就能告诉你这个反应进行得怎么样啦!
4. 嘿呀嘿呀,焓变会影响化学反应的方向呢!就如同指南针指引方向一样重要。
氨气合成的反应,焓变就在默默指挥着呢!
5. 哇塞,反应热和焓变有时候就像一对好搭档!好比你和你的好朋友,相互配合。
酸碱中和反应,反应热和焓变可不就一起工作啦!
6. 哎哟,焓变可不是固定不变的哦,它会随着条件改变呢!就像人的心情会因为不同事情而变化。
甲烷燃烧的焓变,在不同环境下可能就不一样哟!
7. 你想想看,反应热和焓变对于理解化学反应多关键啊!简直就是打开化学大门的钥匙嘛。
铁和硫酸铜的反应,没有它们你能完全搞清楚吗?
我的观点结论就是:反应热和焓变是化学中超级重要的知识点,必须得好好掌握呀!。
第38讲反应热热化学方程式[复习目标] 1.知道常见的吸热反应和放热反应,了解反应热、焓变的概念以及反应热产生的原因。
2.了解热化学方程式的含义,能正确书写热化学方程式。
3.了解燃烧热的含义和能源及能源利用的意义。
考点一反应热焓变1.反应热和焓变(1)反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量。
(2)焓变①焓(H):与内能有关的物理量。
②焓变(ΔH):生成物的焓与反应物的焓之差。
③焓变与反应热的关系等压条件下的反应热等于反应的焓变,常用ΔH表示反应热,常用单位:kJ·mol-1。
2.常见的吸热反应和放热反应吸热反应(ΔH>0)放热反应(ΔH<0)①Ba(OH)2·8H2O与NH4Cl的反应②大多数的分解反应③弱电解质的电离④盐类水解⑤C和H2O(g)、C和CO2的反应①中和反应②燃烧反应③金属与酸或氧气的反应④铝热反应⑤酸性氧化物或碱性氧化物与水的反应⑥大多数的化合反应3.吸热、放热的原因分析(1)从能量图分析物质能量变化与焓变的关系:ΔH=E(生成物的总能量)-E(反应物的总能量)。
(2)从化学键变化分析总结利用键能计算焓变(ΔH),通过ΔH的正、负轻松判断化学反应是吸热还是放热。
ΔH=反应物键能之和-生成物键能之和。
1.放热反应不需要加热就能发生,吸热反应不加热就不能发生()2.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关()3.吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总能量() 4.活化能越大,表明化学反应吸收的能量越多()答案 1.× 2.√ 3.√ 4.×一、对反应过程能量图的理解1.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如图。
回答下列问题:(1)从状态Ⅰ到状态Ⅲ为 (填“吸热”或“放热”)反应。
(2)从状态Ⅰ到状态Ⅱ需要 (填“吸收”或“释放”)能量,CO 分子 (填“是”或“否”)需要断键形成C 和O 。
焓变与反应热(高三一轮复习)设计说明:本节基本内容位于选修四第一章第一节《化学反应与能量变化》,在必修二第二章第一节《化学能与热能》中也有体现。
本节课在学生已有化学能与热能相互转变知识的基础上,进一步体现知识点在习题中的应用。
教学中通过“知识梳理”进行知识点的复习与重现,通过“深度思考”加强对基础知识的理解与体会,通过“练一练”进行知识点的初步应用,通过“走进高考”实现理论与解题的突破和飞跃,通过“作业”进一步熟悉和熟练,从而达到从本质上解决问题的目的,提高复习效率,收到较好的复习效果。
教学设计:【教学目标】1、知识与技能(1)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(2)了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
2、过程与方法学会有关反应热的图形分析及反应热的计算方法。
3、情感态度价值观培养学生辩证分析化学反应与能量的关系,培养实事求是的科学态度。
【教学重点】反应热的图形分析及反应热的计算方法。
【教学设计】教学过程教师活动学生活动设计意图一、高考题引入肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。
已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N —N为154,则断裂1 mol N—H键所需的能量(kJ)是( )A.194 B.391 C.516 D.658 【引入】同学们分析此题考到的知识点有哪些?【思考】【回答】键能与反应热的关系、ΔH的相关计算从高考题引入,分析基础知识在考题中的实际应用,使后续的复习更有针对性二、知识梳理1.化学反应中的能量变化(1)化学反应中的两大变化:变化和变化。
(2)化学反应中的两大守恒:守恒和守恒。
(3)化学反应中的能量转化形式:、光能、电能等。
通常主要表现为的变化。
【布置任务】快速完成基础填空【思考、回答】(1)物质、能量(2)质量、能量(3)热能、热量熟记基础,为后续解题做好铺垫2.焓变(反应热)(1)定义:在条件下进行的反应的。
焓变与反应热(高三一轮复习)
设计说明:
本节基本内容位于选修四第一章第一节《化学反应与能量变化》,在必修二第二章第一节《化学能与热能》中也有体现。
本节课在学生已有化学能与热能相互转变知识的基础上,进一步体现知识点在习题中的应用。
教学中通过“知识梳理”进行知识点的复习与重现,通过“深度思考”加强对基础知识的理解与体会,通过“练一练”进行知识点的初步应用,通过“走进高考”实现理论与解题的突破和飞跃,通过“作业”进一步熟悉和熟练,从而达到从本质上解决问题的目的,提高复习效率,收到较好的复习效果。
教学设计:
【教学目标】
1、知识与技能
(1)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(2)了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
2、过程与方法
学会有关反应热的图形分析及反应热的计算方法。
3、情感态度价值观
培养学生辩证分析化学反应与能量的关系,培养实事求是的科学态度。
【教学重点】
反应热的图形分析及反应热的计算方法。
教学过程教师活动学生活动设计意图一、高考题引入
肼(H
2NNH
2
)是一种高能燃料,有关
化学反应的能量变化如下图所示。
已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N—N为154,则断裂1 mol N—H 键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658 【引入】同学
们分析此题考
到的知识点有
哪些?
【思考】
【回答】
键能与反应热的关
系、
ΔH的相关计算
从高考题
引入,分
析基础知
识在考题
中的实际
应用,使
后续的复
习更有针
对性
二、知识梳理
1.化学反应中的能量变化
(1)化学反应中的两大变化:变化和变化。
(2)化学反应中的两大守恒:
守恒和守恒。
(3)化学反应中的能量转化形式:、光能、电能等。
通常主要表现为的变化。
【布置任务】
快速完成基础
填空
【思考、回答】
(1)物质、能量
(2)质量、能量
(3)热能、热量
熟记基
础,为后
续解题做
好铺垫
2.焓变(反应热)
(1)定义:在条件下进行的反应的。
(2)符号:。
(3)单位:。
【布置任务】
快速完成基础
填空
【思考、回答】
(1)恒压、热效应
(2)ΔH
(3)kJ/mol
熟记基
础,为后
续解题做
好铺垫
3.吸热反应和放热反应
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
【提问】图示所表示的意义是什么?应该如何进行图形分析?【思考、回答】反应
是吸热或放热过程。
分析时应该注意图形
的横、纵坐标及变化
趋势。
熟记基
础,为后
续解题做
好铺垫
(2)从反应热的量化参数——键能的角度分析
【讲解】从键能角度分析反应是吸热或放热
【提问】计算反应ΔH的方法【结论】
ΔH=生成物的总能量-
反应物的总能量
ΔH=反应物的总键能
之和-生成物的总键能
之和
培养学生
分析问
题、理解
规律的能
力
(3)归纳常见的放热反应和吸热反应【提问】哪些
反应是常见的
吸热反应和放
热反应?
【回答】
放热反应
①可燃物的燃烧;
②酸碱中和反应;
③大多数化合反应;
④金属跟酸的置换反
应;
⑤物质的缓慢氧化。
吸热反应
①大多数分解反应;
②盐的水解
③弱电解质的电离;
④Ba(OH)
2
·8H
2
O与
NH
4
Cl反应;
⑤碳和水蒸气
⑥C和CO
2
的反应。
回顾基
础,为后
续学习做
好铺垫
三、深度思考
判断正误,正确的划“√”,错误的划“×”
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应
( )
(2)物质发生化学变化都伴有能量的变化( )
(3)伴有能量变化的物质变化都是化学变化( )
(4)吸热反应在任何条件都不能发生( )
(5)水蒸气变为液态水时放出的能量就是该变化的反应热( ) 【提出要求】
判断正误并说
明原因
【思考、回答】
(1)×、加热是引发
反应的外界条件,反
应的吸、放热由反应
物、生成物的总能量
或总键能决定。
(2)√
(3)×、物质三态的
变化伴随了能量的变
化,但属于物理变
化。
(4)×、ΔH>0,Δ
S>0时,高温下反应能
发生
(5)×、该变化是物
理变化。
基础知识
考查,进
一步熟
悉、熟
练。
四、练一练
1.某反应过程中体系的能量变化如图所示,下列说法错误的是( )
A.反应过程可表示为
B.E
1
为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为ΔH=E
1
-
E
2
<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E
1-E
2
<0,所以逆反应为放热反应2.通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。
键能的大小可以衡量化学键的强
弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
下面列举了一些化学键的键能【布置任务】
分析问题并解
决
【思考、讨论、回
答】
D、
该图表示的正反应放
热,逆反应吸热。
ΔH=4×360+2×436-2
×176-4×431
基础知识
的简单应
用,为后
续解决高
考原题做
好铺垫
数据,供计算使用。
Si—O:460kJ/mol,Si—Cl:
360kJ/mol,H—H:
436kJ/mol,H—Cl:
431kJ/mol,Si—Si:
176kJ/mol,Si—C:347kJ/mol。
工业上的高纯硅可通过下列反应制
取:SiCl
4(g)+2H
2
(g)===Si(s)+
4HCl(g),该反应的反应热(ΔH)为__________。
3.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。
下表列出了一些化学键的键能E,回答问题:
(1)如图表示某反应的能量变化关系,则此反应为____(填“吸热”或“放热”)反应,其中ΔH=
________
(用含有a、b的关系式表示)。
(2)若图示中表示反应
H 2(g)+ O
2
(g)==H
2
O(g)
ΔH=-241.8 kJ·mol-1,则b =________kJ·mol-1,x=
______。
=+236kJ/mol
(1)放热、
反应物总能量大于生成物总能量
ΔH=-(b-a)
kJ/mol放热反应,ΔH 为负值
(2)926、
b为逆反应的活化能。
496.4、
键能计算反应热
五、走进高考
1、(2012·大纲全国卷,9)反应 A +B―→C(ΔH<0)分两步进行:①A+B―→X (ΔH >0),②X―→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是( )
【布置任务】分析、思考【思考、讨论、回
答】
D、
根据两步反应的ΔH的
大小
用高考原
题,检验
学生在解
决实际问
题时应用
知识的能
力,举一
反三。
2、(2012·重庆理综,12)肼
(H
2NNH
2
)是一种高能燃料,有关化
学反应的能量变化如下图所示。
已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、
N—N为154,则断裂1 mol N—H 键所需的能量(kJ)是( ) A.194 B.391
C.516 D.658 【布置任务】
分析、思考
【思考、讨论、回
答】
B、
ΔH
3
=4(N—H)+(N—
N)+(O==O)
=+2218kJ/mol
用高考原
题,检验
学生在解
决实际问
题时应用
知识的能
力,举一
反三。
六、作业
乌鲁木齐市“高效课堂教学设计与展示”
课题:焓变与反应热(高三一轮复习)学校:乌鲁木齐市实验学校
姓名:吴未希。