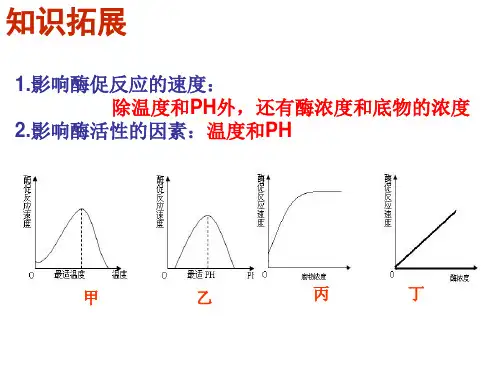
影响酶活性的因素
- 格式:ppt
- 大小:457.50 KB
- 文档页数:14


酶的影响因素作用机理酶活性的影响因素及作用机理:1、pH:pH值的变化影响酶的活性,高于或低于最佳pH值时,酶的活性会降低。
一般而言,酶的活性随着pH值的升高而提高,达到一定程度后,再升高pH值,酶的活性反而会降低,这称之为“pH钝化”。
此外,不同酶在不同pH值中的活性也有差异,表明酶对pH值有特定的要求。
2、水溶性离子的作用:水溶性离子的活度与酶的活性有关。
一般而言,高浓度的水溶性离子会降低酶的活性,而加入合适的离子能够增加酶活性,在已知的酶的活性阻碍,例如热力降解或PH钝化,水溶性离子的添加也可以恢复酶活性。
3、温度的作用:温度是影响酶反应速率的重要因素,一般来说,随着温度升高,酶的反应速率会逐渐增加,直到某一特定温度,此时,酶反应速率达到最大,再高于这一温度,酶会受到热力学钝化而导致活性下降。
4、氧化还原性物质:氧化还原性物质可以影响酶的活性,这些物质的氧化还原反应是使酶的活性衰减的关键因素之一。
如果氧化还原性物质的分子结构中存在可扭转的氧化还原反应,其在氧化还原反应中持续出现的电子会影响其与酶的相互作用,从而降低酶活性。
5、酰胺功能:酰胺功能可以通过特定的反应影响酶的活性,它们可以与酶分子上的氨基映射出,并通过氢键和酰胺水解反应直接降低酶活性。
6、有机溶剂的作用:有机溶剂有助于溶解有机物质,如有机酸、糖、脂肪和黏液等,从而增加对酶活性的影响,而这些有机溶剂的浓度不能过高,否则会对酶活性产生不利影响。
7、抑制剂的作用:也可以通过抑制酶的反应活性而影响酶活性,抑制剂通常是介质溶液中存在的有机物质,它们可以通过难溶性化合物、氢键或竞争反应交互作用而抑制酶活性,其中,最具有危害性的是细胞色素P450,它可以抑制我们期望促进重要生物催化反应的重要参与者。

酶活性下降的因素
1. 温度:酶活性受温度影响较大,过高或过低的温度会使酶蛋白变性,使酶活性降低甚至失效。
2. pH值:酶对不同pH值的适应能力不同,过高或过低的pH值也会使酶失去催化活性。
3. 底物浓度:当底物浓度过高时,底物与酶蛋白竞争吸附在反应活性位点上,使酶反应速率降低。
4. 抑制剂:一些物质可以通过反应活性位点、非竞争性抑制或竞争性抑制等机制影响酶催化活性,从而使酶活性降低。
例如,氰化物可与酶中的铁离子结合,阻止酶催化作用。
5. 酶蛋白结构变化:酶蛋白结构的变化可能由于氧化、还原、水解等作用而发生。
此时,酶的结构和性质发生改变,酶活性下降。
6. 缺乏辅因子:某些酶需要辅因子才能发挥催化作用。
如果辅因子缺乏,则酶无法正常催化反应。
7. 物种差异:不同物种的酶结构和催化机制不同,因此对环境因素的适应性也不同,会导致酶活性差异。
8. 原始酶活性:所有的酶都是通过自发变异、天然选择等过程演变而来,原始酶活性可能不够优异,随着时间的推移,其活性可能会降低。

实验探究影响酶活性的因素
原理:淀粉遇碘后,形成蓝色的复合物。
淀粉酶可以可以使淀粉水解成麦芽糖,麦芽糖遇碘后,不形成蓝色的复合物。
1、材料:新配置的淀粉酶溶液,新鲜肝脏研磨液,可溶性淀粉溶液,过氧化氢溶液等。
2、步骤:
(1)探究温度对酶活性的影响
温度对酶活性的影响
在温度对酶活性的影响的实验中,三支试管的条件,除温度外均相同。
3号试管处在60℃的温度条件下,酶活性最大,试管中的淀粉被分解,滴入碘液后不会变蓝。
2号试管的温度条件是100℃,这样高温度条件下,淀粉酶已失去活性,1号试管的温度条件是O℃,低温抑制淀粉酶的活性。
所以2号和1号试管中的淀粉都没有被分解,滴上碘液后都会变蓝,此实验可以证明;酶的催化作用需要适宜的温度条件,温度过高和过低都将影响酶的活性。
(2)探究pH对酶活性的影响
实验1 过氧化氢(H2O2)在过氧化氢酶的催化作用下,可以分解成水和氧气,可以放入带火星的木条,看能否复燃来检测是否有氧气产生。
2号试管内加入了盐酸,溶液的pH较低,3号试管内加入了氢氧化钠,溶液的pH较高,在过低或过高pH环境中,过氧化氢酶失去活性,不能使过氧化氢分解,没有氧气产生而1号试管没有加入酸或碱,溶液近似中性,过氧化氢酶将过氧化氢分解成水和氧气,使木条复燃。

影响酶活性的因素文献综述酶是一种活性蛋白质。
因此,一切对蛋白质活性有影响的因素都影响酶的活性。
酶具有蛋白质样的一级、二级、三级、四级结构, 可由温度、离子发射、氧化剂、还原剂、光、酸、碱和有机溶剂, 生物作用等因素对其变性和降解, 酶的变性会引起其催化活性(即在特定的系统和条件下的反应速度) 的丧失, 现代分子学认为变性就是对蛋白质的二、三级结构的破坏, 下面从十一个方面说明影响酶活性的因素。
团,这时,酶与底物结合最容易;当偏高或偏低时,其活动中心只带有一种电荷,就会使酶与底物的结合能力降低。
值是酶催化反应的重要环境条件, 酶是两性化合物, 其上分布着许多梭基和氨基等酸性、碱性基团, 对酸碱度极为敏感, 最适值因酶、底物的不同而异, 过酸和过碱时均会引起酶变性,从而降低酶活性, 导致反应速度下降, 酶反应速度最大的值是最适值,此时酶的活性最大。
、酶的浓度和底物浓度酶与底物浓度的关系,一般来说,当酶的浓度较小,底物浓度大大高于酶,则酶的浓度与反应速度成正比;当底物浓度一定时,酶的浓度继续增加到一定值以后,其反应速度并不加快。
由于上述关系,过大的增加用曲量是不能收到预期效果的。
、金属离子某些金属离子对酶起着活化剂的作用,例如 , ,等离子通常可以显著增加一葡萄糖异构酶的活性, 相反地, 金属离子对酶也可能起抑制作用, 例如同样对葡萄糖异构酶, , , , , 均有不同程度的抑制催化活性的作用, 重金属离子如 , 等,对蛋白质具有变性作用, 故在酶洗液中应竭力避免铜、铁、铝等重金属离子进入, 应尽量在生产中避免使用铜器等设备, 或用赘和剂封锁, 但钾、钠、镁等重金属离子对酶影响不大。
、物理因素许多物理因素和紫外线, 放射线, 超声波等都可能引起酶的失活。
酶在存放中易失活, 一般酶最宜储存温度为。
℃至℃ , 一年内失活率, 冷冻干燥是保存酶制剂的一个好方法, 但也有一些酶经不起冷冻, 如梭肤酶。
在生产操作时, 尤其是搅拌酶溶液时形成的大量泡松散差,性。

2022年高考生物总复习:影响酶活性的因素方法1 用“试剂检测法”鉴定酶的本质可采用“试剂检测法”或“蛋白酶水解法”确认酶的化学本质——若酶为蛋白质,则遇双缩脲试剂可呈紫色,并且用蛋白酶处理可失活。
同理若为RNA ,则遇吡罗红呈红色,且用蛋白酶处理仍具生物活性,而用RNA 水解酶处理会丧失活性。
方法2 用“对比实验法”探究或验证酶的高效性、专一性及影响酶活性的因素 (1)验证酶的高效性 ①设计思路验证酶高效性的方法是“对比法”,实验变量为不同类型催化剂,因变量为底物的反应速率进行比较。
②设计方案(2)酶的专一性的实验探究方法——对比法①设计思路:常见的方案有两种,即底物相同但酶不同或底物不同但酶相同,最后通过观察酶促反应能否进行得出结论。
②设计方案方案一⎩⎪⎨⎪⎧实验组:底物+相应酶液――→检测底物被分解对照组:另一底物+相同酶液――→检测底物不被分解方案二⎩⎪⎨⎪⎧实验组:底物+相应酶液――→检测底物被分解对照组:相同底物+另一种酶液――→检测底物 不被分解③结果分析:根据底物性质选用相应试剂检测,若实验组底物被分解,对照组底物不被分解,则证明酶具专一性。
④实验成功关键点若选择淀粉、蔗糖、淀粉酶做酶的专一性实验,最好选用斐林试剂检测反应物是否被分解,一般不选用碘液,因其无法检测蔗糖是否被分解。
方法3用“梯度法”探究影响酶活性的因素(温度或pH)(1)设计思路:设计实验时需设置一系列不同温度(或pH)的实验组进行相互对照,最后根据实验现象得出结论。
酶促反应所需时间最短的一组对应的温度(或pH)最接近最适温度(或pH)。
相邻组间的差值(即梯度值)越小,测定的最适温度(或pH)就越精确。
(2)设计方案【典例1】(2016·全国课标卷Ⅰ,3)若除酶外所有试剂已预保温,则在测定酶活力的试验中,下列操作顺序合理的是()A.加入酶→加入底物→加入缓冲液→保温并计时→一段时间后检测产物的量B.加入底物→加入酶→计时→加入缓冲液→保温→一段时间后检测产物的量C.加入缓冲液→加入底物→加入酶→保温并计时→一段时间后检测产物的量D.加入底物→计时→加入酶→加入缓冲液→保温→一段时间后检测产物的量解析测定酶活力影响因素时,在改变被探究因素之前,务必防止酶与底物混合,故只有C选项所述操作顺序正确。

实验报告影响酶活性的因素实验报告影响酶活性的因素酶是一类生物催化剂,能够加速化学反应的速率。
在生物体内,酶参与了许多重要的生化过程,如新陈代谢、消化和免疫等。
了解酶活性的影响因素对于理解生物体的正常功能以及疾病的发生机制具有重要意义。
本文将从温度、pH值、底物浓度和酶浓度四个方面来探讨实验报告对酶活性的影响。
一、温度对酶活性的影响温度是影响酶活性的重要因素之一。
在适宜的温度范围内,酶活性会随温度的升高而增加,因为高温能够提高酶分子的动力学能量,使其与底物发生更多的碰撞。
然而,当温度超过酶的适宜范围时,酶的活性会迅速下降,甚至失活。
这是因为高温会破坏酶分子的三维结构,使其失去催化功能。
因此,在实验报告中,我们需要控制好温度,以保证酶活性的准确测定。
二、pH值对酶活性的影响pH值是指溶液的酸碱程度,也是影响酶活性的重要因素之一。
不同的酶对pH值的要求不同,有些酶在酸性环境中活性较高,而有些酶则在碱性环境中活性更高。
这是因为酶的活性与其分子结构密切相关,而pH值能够改变酶分子的电荷状态,从而影响其催化活性。
在实验报告中,我们需要在不同的pH值条件下测定酶的活性,以确定其最适宜的工作条件。
三、底物浓度对酶活性的影响底物浓度是指在酶催化反应中底物的浓度,也是影响酶活性的重要因素之一。
在一定范围内,底物浓度的增加会使酶活性逐渐增加,因为更多的底物能够与酶分子发生碰撞,从而增加反应速率。
然而,当底物浓度超过一定限制时,酶活性将不再增加,因为酶的活性受到底物浓度的饱和限制。
在实验报告中,我们需要确定底物浓度与酶活性之间的关系,以了解酶催化反应的动力学特性。
四、酶浓度对酶活性的影响酶浓度是指在酶催化反应中酶的浓度,也是影响酶活性的重要因素之一。
一般来说,酶浓度的增加会使酶活性逐渐增加,因为更多的酶分子能够与底物发生碰撞。
然而,当酶浓度超过一定限制时,酶活性将不再增加,因为酶的活性受到酶浓度的饱和限制。
在实验报告中,我们需要确定酶浓度与酶活性之间的关系,以了解酶催化反应的动力学特性。

影响酶活性的因素文献综述酶活性是生物体内许多生化反应的关键因素之一、酶活性的调节受到多种因素的影响,包括温度、pH值、金属离子、底物浓度和抑制剂等。
本文综述了这些因素对酶活性的影响以及其机制。
温度是影响酶活性的重要因素之一、一般来说,酶活性随着温度的升高而增加,因为温度的升高会增加分子的运动速度和碰撞频率。
然而,当温度超过一些临界值时,酶活性会开始下降。
这是因为过高的温度会破坏酶分子的三维结构,使其失去功能。
pH值也是影响酶活性的重要因素。
酶具有最适pH值,即在该pH值下其活性最高。
这是因为酶的活性与其所在环境的酸碱度有关,对于不同的酶来说,最适pH值会有所不同。
在酶活性最适pH值之外,酶的活性会显著下降。
金属离子是酶活性的重要辅助因素。
许多酶需要金属离子的辅助才能发挥活性。
金属离子可以与酶分子结合,形成活性位点,促进底物与酶的结合以及反应的进行。
一些金属离子,如锌、镁和铁等,对于酶活性的维持和调节起到了重要的作用。
底物浓度也是影响酶活性的因素之一、一般来说,随着底物浓度的增加,酶的活性会增加,因为有更多的底物分子与酶分子发生反应。
然而,当底物浓度超过一定临界值时,酶的活性会趋于饱和,无法再进一步提高。
抑制剂是影响酶活性的重要因素之一、抑制剂可以以可逆和不可逆的方式抑制酶的活性。
可逆抑制剂与酶结合后可以解离,而不可逆抑制剂与酶结合后无法解离。
抑制剂可以通过与酶结合阻碍底物与酶的结合,或者破坏酶分子的活性位点来抑制酶的活性。
总之,温度、pH值、金属离子、底物浓度和抑制剂等因素都可以对酶活性产生重要影响。
了解这些影响因素的机制可以为酶的应用和调节提供基础。
此外,不同酶对这些因素的响应也有所不同,因此对于具体的酶来说,需要进一步研究其相关影响因素以获得更深入的了解。


实验报告-不同因素对酶的影响实验目的:研究不同因素对酶活性的影响,比较各因素对酶的影响程度,了解酶的稳定性和适应性。
实验材料:1. 酶溶液2. 受控温度环境3. 不同浓度的底物溶液4. pH调节液5. 不同浓度的抑制剂溶液6. 酶催化试剂实验步骤:1. 温度对酶活性的影响:a. 分别取一定浓度的酶溶液,分成几份放入不同的温度环境中,如20°C、30°C、40°C等。
b. 在每一个温度下,加入相同浓度的底物溶液。
c. 观察底物转化速率,记录反应速率与温度的关系。
2. pH值对酶活性的影响:a. 分别取一定浓度的酶溶液,调节不同的pH值,如pH 3、pH 5、pH 7等。
b. 在每一个pH值下,加入相同浓度的底物溶液。
c. 观察底物转化速率,记录反应速率与pH值的关系。
3. 底物浓度对酶活性的影响:a. 取一定浓度的酶溶液,分成几份。
b. 在每一个酶溶液中,分别加入不同浓度的底物溶液,如0.1M、0.2M、0.3M等。
c. 观察底物转化速率,记录反应速率与底物浓度的关系。
4. 抑制剂对酶活性的影响:a. 分别取一定浓度的酶溶液,加入相同浓度的底物溶液。
b. 在一部分试管中,加入不同浓度的抑制剂溶液。
c. 观察底物转化速率,记录反应速率与抑制剂浓度的关系。
实验结果与分析:1. 温度对酶活性的影响:结果显示,酶活性随温度的升高而增加,但超过一定温度时,酶活性开始下降,可能是由于酶受热变性。
2. pH值对酶活性的影响:结果显示,在一定范围内,酶活性随pH值的变化而变化,但当超过酶的最适pH值时,酶活性显著降低。
3. 底物浓度对酶活性的影响:结果显示,酶活性随底物浓度的增加而增加,但当底物浓度过高时,酶活性趋于饱和,不再增加。
4. 抑制剂对酶活性的影响:结果显示,抑制剂的加入会显著降低酶活性,而且抑制剂的浓度越高,酶活性的降低越明显。
结论:通过本实验的观察与分析,我们得出如下结论:1. 温度、pH值和底物浓度都对酶活性有显著影响,但超过一定范围会降低酶的活性。
影响酶活性的因素a.温度:温度(temperature)对酶促反应速度的影响很大,表现为双重作用:(1)与非酶的化学反应相同,当温度升高,活化分子数增多,酶促反应速度加快,对许多酶来说,温度系数(temperature coefficient)Q10多为1~2,也就是说每增高反应温度10℃,酶反应速度增加1~2倍。
(2)由于酶是蛋白质,随着温度升高而使酶逐步变性,即通过酶活力的减少而降低酶的反应速度。
以温度(T)为横坐标,酶促反应速度(V)为纵坐标作图,所得曲线为稍有倾斜的钟罩形。
曲线顶峰处对应的温度,称为最适温度(optimum temperature).最适温度是上述温度对酶反应的双重影响的结果,在低于最适温度时,前一种效应为主,在高于最适温度时,后一种效应为主,因而酶活性迅速丧失,反应速度很快下降。
动物体内的酶最适温度一般在35~45℃,植物体内的酶最适温度为40~55℃。
大部分酶在60℃以上即变性失活,少数酶能耐受较高的温度,如细菌淀粉酶在93℃下活力最高,又如牛胰核糖核酸酶加热到100℃仍不失活。
最适温度不是酶的特征性常数,它不是一个固定值,与酶作用时间的长短有关,酶可以在短时间内耐受较高的温度,然而当酶反应时间较长时,最适温度向温度降低的方向移动。
因此,严格地讲,仅仅在酶反应时间已经规定了的情况下,才有最适温度。
在实际应用中,将根据酶促反应作用时间的长短,选定不同的最适温度。
如果反应时间比较短暂,反应温度可选定的略高一些,这样,反应可迅速完成;若反应进行的时间很长,反应温度就要略低一点,低温下,酶可长时间发挥作用。
各种酶在最适温度范围内,酶活性最强,酶促反应速度最大.在适宜的温度范围内,温度每升高10℃,酶促反应速度可以相应提高1~2倍。
不同生物体内酶的最适温度不同。
如,动物组织中各种酶的最适温度为37~40℃;微生物体内各种酶的最适温度为25~60℃,但也有例外,如黑曲糖化酶的最适温度为62~64℃;巨大芽孢杆菌、短乳酸杆菌、产气杆菌等体内的葡萄糖异构酶的最适温度为80℃;枯草杆菌的液化型淀粉酶的最适温度为85~94℃。