四川省成都市第七中学实验学校2018届高三上学期入学考试化学试题 Word版含解析
- 格式:doc
- 大小:435.42 KB
- 文档页数:21

1. H2与HCl的反应分①②两步进行,其能量曲线如下图所示,下列有关说法错误的是()A. 反应①、反应②均为放热反应B. 反应①、反应②均为氧化还原反应C. 反应①比反应②的速率慢.与相应正反应的活化能无关D. 反应①、反应②的焓变之和为△H=-218kJ/mol【答案】C【解析】试题分析:A.根据图像可知,反应①和反应②中反应物总能量都大于生成物,则反应①、反应②均为放热反应,A正确;B.反应①中氢气参与反应,反应产物中都是化合物,则一定存在化合价变化,反应②中反应物都是化合物,生成物中有碘单质生成,则也一定存在化合价变化,所以反应①②均为氧化还原反应,B正确;C.反应①比反应②的速率慢,说明反应①中正反应的活化能较小,反应②中正反应的活化能较大,C错误;D.反应①、反应②总的能量变化为218kJ,根据盖斯定律可知,反应①、反应②的焓变之和为△H=-218kJ•mol-1,D正确;答案选C。
【考点定位】本题考查了化学反应与能量变化【名师点晴】该题难度不大,明确反应热与反应物、生成物总能量的关系为解答关键,注意掌握盖斯定律的内容及应用方法以及反应速率与活化能的关系,试题培养了学生的分析能力及灵活应用能力。
2. 常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是A. 432 kJ /mol>E(H—Br)>298kJ/molB. 表中最稳定的共价键是 H—F键C. H2(g)→2H(g) △H=+436kJ/molD. 1/2H2(g)+l/2F2(g)=HF(g) △H=-25kJ/mol【答案】D点睛:本题考查了化学反应能量变化和键能的关系分析判断,掌握焓变计算方法是解题关键,注意反应热与键能的关系。
3. 下面4种燃料电电的工作原理示意图,其中正极的反应物为水的是()A. AB. BC. CD. D【答案】C【解析】A、电解质为能够传导氧离子的固体氧化物,正极氧气得电子生成氧离子,A错误;B、电解质溶液是氢氧化钾,正极上氧气得电子生成氢氧根离子,B错误;C、电解质溶液是酸,氢离子向正极移动,正极上氧气和氢离子反应生成水,C正确;D、电解质为熔融碳酸盐,正极氧气得电子结合二氧化碳生成碳酸根离子,D错误;答案选C。
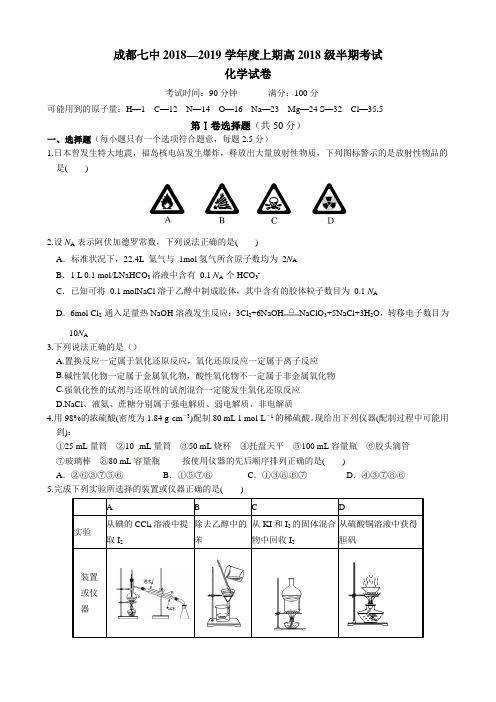
成都七中2018—2019学年度上期高2018级半期考试化学试卷考试时间:90分钟 满分:100分可能用到的原子量:H —1 C —12 N —14 O —16 Na —23 Mg —24 S —32 Cl —35.5第Ⅰ卷选择题(共50分)一、选择题(每小题只有一个选项符合题意,每题2.5分)1.日本曾发生特大地震,福岛核电站发生爆炸,释放出大量放射性物质,下列图标警示的是放射性物品的是()2.设N A 表示阿伏加德罗常数,下列说法正确的是( ) A .标准状况下,22.4L 氦气与 1mol 氢气所含原子数均为 2N A B .1 L 0.1 mol/LNaHCO 3溶液中含有 0.1 N A 个HCO 3-C .已知可将 0.1 molNaCl 溶于乙醇中制成胶体,其中含有的胶体粒子数目为 0.1 N AD .6mol Cl 2 通入足量热NaOH 溶液发生反应:3Cl 2+6NaOH NaClO 3+5NaCl+3H 2O ,转移电子数目为10N A3.下列说法正确的是()A.置换反应一定属于氧化还原反应,氧化还原反应一定属于离子反应B.碱性氧化物一定属于金属氧化物,酸性氧化物不一定属于非金属氧化物C.强氧化性的试剂与还原性的试剂混合一定能发生氧化还原反应D.NaCl 、液氨、蔗糖分别属于强电解质、弱电解质、非电解质 4.用98%的浓硫酸(密度为1.84 g·cm -3)配制80 mL 1 mol·L-1的稀硫酸。
现给出下列仪器(配制过程中可能用到):①25 mL 量筒 ②10 mL 量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒 ⑧80 mL 容量瓶 按使用仪器的先后顺序排列正确的是( )A .②⑥③⑦⑤⑥B .①⑤⑦⑥C .①③⑧⑥⑦D .④③⑦⑧⑥ 5.完成下列实验所选择的装置或仪器正确的是( )6.配制100mL 0.1 mol/L的NaOH溶液,下列说法或操作正确的是()A. 用托盘天平称量NaOH固体时左盘和右盘均应使用称量纸B. 在100mL容量瓶中溶解NaOH固体,冷却至室温才能进行定容C.称量所取的NaOH样品中有KOH杂质,其他操作正确,配好的NaOH溶液浓度偏低D. 摇匀后见液面低于刻度线,应及时加水至刻度线7.下列氧化还原反应方程式,所标电子转移方向与数目错误的是()A.B.C.D.8.某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是 ( )A.肯定含有的离子是②③⑥B.该实验无法确定是否含有③C.可能含有的离子是①③⑦D.肯定没有的离子是④⑤,可能含有的离子是②9. 常温下,下列各组离子在指定溶液中能大量共存的是()A.碳酸氢钠溶液中:Cl-、NO3-、Na+、OH-B.澄清透明的溶液中:Cu2+、K+、SO42-、Br-C.酚酞呈红色的溶液中:SO42-、K+、Cl-、Al3+D.饱和食盐水中:Fe3+、I-、SO32-、K+10.同温同压下,质量相同的CO2、O2、CH4三种气体,下列说法错误的是( )A.所占的体积由大到小的顺序是:CH4>O2>CO2B.所含分子数由多到少的顺序是:CH4>O2>CO2C.密度由大到小的顺序是:CO2>O2>CH4D.所含的电子数由多到少是:CO2>CH4>O211. 如右图所示,室温下的两个连通刚性容器用活塞分开,左右两室体积相同,左室充入一定量NO ,右室充入一定量O 2,且恰好使两容器内气体密度相同。

好教育云平台 名校精编卷 第1页(共8页) 好教育云平台 名校精编卷 第2页(共8页)2018届四川成都七中(高新校区)高三理科综合化学测试(八)试卷化学注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
一、单选题1.“一带一路”贸易使国外的特色产品走入百姓的日常生活,下列商品的主要成分所对应的材料类型不正确...的是( )泰国银饰埃及棉制品捷克水晶饰品土耳其彩瓷 2.下列关于有机物的说法正确的是( ) A . 乙醇、乙酸均能与NaOH 溶液反应B . 糖类、油脂、蛋白质都是有C 、H 、O 三种元素组成的C . C 5H 9BrO 2的同分异构体中,能与NaHCO 3反应产生CO 2的有10种D . 塑料、合成橡胶、合成纤维都主要是以石油、煤、天然气为原料生产的3.下列实验操作、现象和结论均正确的是( )FeCl 3+3KSCNFe(SCN)3 +3KCl 平衡向逆反应方向移动4.我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )A . 与乙醇发生酯化反应生成产物的分子式为C 8H 18O 4B . 能发生加成反应,不能发生取代反应C . 在铜的催化下与氧气反应的产物可以发生银镜反应D . 标准状况下1mol 该有机物可以与足量金属钠反应产生22.4LH 25.某KCl 样品中含有少量K 2CO 3、K 2SO 4和不溶于水的杂质,为了提纯KCl ,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。

成都七中实验学校2018--2018年上期高2018级期中考试化学试题时间:100分钟 分值:100分 Ⅰ卷 (50分)一. 选择题:(请将正确选项用2B 铅笔填涂到机读卡上. 每题2分,共50分, 每题只有一个正确选项)1.下列关于电子云的说法中,正确的是 A .电子云表示电子在原子核外运动的轨迹B .电子云表示电子在核外单位体积的空间出现机会的多少C .电子云界面图中的小黑点密表示该核外空间的电子多D .电子云可表示电子在核外运动的方向2.下列化合物中含有手性碳原子的是 A .CCl 2F 2 B .CH —OH ∣CH 2—OH ∣CH 2—OHC .CH 3CH 2OHD .CH 3—CH ∣OH —COOH3. 下列说法正确的是A. HF 、HCl 、HBr 、HI 的熔点沸点依次升高。
B. H 2O 的熔点、沸点大于H 2S 的是由于H 2O 分子之间存在氢键。
C. 乙醇易溶于水, 是因为乙醇分子与水分子之间只存在范德华力。
D. 氯的各种含氧酸的酸性由强到弱排列为HClO >HClO 2>HClO 3>HClO 44.氯化硼的熔点为-118℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是A.氯化硼液态时能导电而固态时不导电 B.硼原子以sp 杂化 C.氯化硼遇水蒸气会产生白雾 D.氯化硼分子属极性分子5.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。
下列对此现象说法正确的是A .反应后溶液中不存在任何沉淀,所以反应前后Cu 2+的浓度不变B .在[Cu(NH 3)4] 2+离子中,Cu 2+给出孤对电子,NH 3提供空轨道 C .向反应后的溶液加入乙醇,溶液没有发生变化D .沉淀溶解后,将生成深蓝色的配合离子[Cu(NH 3)4] 2+6.现有四种元素的基态原子的电子排布式如下:① 1s 22s 22p 63s 23p 4; ②1s 22s 22p 63s 23p 3;③1s 22s 22p 5。

成都七中高2017 届 2017-2018 学年度(上)期中考试理科综合能力测试可能用到的相对原子质量:H— 1 Li—7 B—11 C—12 N—14 O—16Cu — 64第Ⅰ卷(选择题共126 分)本卷共21 小题,每题 6 分,共126 分。
一、选择题:本大题共13 小题,每题 6 分。
在每题给出的四个选项中,只有一项为哪一项吻合题目要求的。
7.化学与科学、技术、社会、环境都亲近相关,以下说法不正确的选项是A.祖先利用明矾溶液的酸性来冲刷青铜器上的铜锈B.人体摄入合适的油脂有利于促进维生素的吸取C.《肘后备急方》中记录“青蒿一握,以水二升渍,绞取汁” ,所述过程不涉及化学变化D.手机外壳上贴的碳纤维外膜是一种新式的有机高分子资料8.柠檬烯是一种食用香料,其结构简式为:相关柠檬烯的解析正确的选项是A .分子式为C10H14B .必然条件下,柠檬烯可以发生加成、取代、氧化、还原反应C .柠檬烯有属于苯的同系物的同分异构体D .柠檬烯的分子中全部碳原子可能处在同一个平面上9.设N A为阿伏伽德罗常数的值。
以下说法正确的选项是A . 1 mol羟基与 1 mol氢氧根离子所含的电子数均为9N AB .常温下,44 g N2OCO2组成的混杂气体,所含原子数为3N A和C . 0.1 mol/L的 NaClO 溶液,含有的阴离子数为0.1N AD .常温下,将 1 mol Fe投入过分浓硝酸中,转移的电子数为3N A10.以下实验能达到预期目的是11.W、X、 Y、 Z 均为原子序数依次增大的短周期主族元素,W、X、 Y 处于同一周期,W元素形成的化合物种类最多,W和 Y 族序数之和为X族序数的 2 倍, Z 的最高价氧化物对应的水化物既能溶于酸又能溶于碱,以下说法中正确的选项是A .简单气态氢化物沸点Y>X>WB .原子半径Z>Y>X>WC . Y 元素可能位于第二周期第Ⅶ A 族D . Y 元素与其余三种元素均可形成多种化合物12.锂空气电池比锂离子电池拥有更高的能量密度,远景特别广阔,其结构及工作原理以下图(固体电解液只赞同Li +经过),以下相关说法不正确的选项是A.电池工作时,正极反应式:22--O + 2H O + 4e= 4OHB.去掉固体电解液和有机电解质,电池反应发生改变C .充电时,生成14 g Li,空气极质量增加16 g D.充电时,专用充电电极可以有效防范空气极腐化和劣化13.常温下向-1CH3COONa溶液中,不断通入HCl 后, CHCOO与 CHCOOH浓-度10 mL 0.1 mol · L33的变化趋势以以下列图所示( 不考虑溶液体积变化) ,以下说法不正确的选项是A. M点溶液中水的电离程度比原溶液小B .在 M点时, c(H +) - c(OH- )=(100a - 5.0 ×10-2 ) mol/LC .随着 HCl 的通入,值不断减小D .当 n(HCl)=1.0 × 10-3mol 时,溶液中+)=c(Cl--+-)c(Na)>c(CHCOO)>c(H )>c(OH26. ( 14 分)某兴趣小组欲经过实验方法考据Fe2+的某些性质。

成都七中2018 届高三入学考试化学试卷考试时间: 50 分钟总分: 100 分本卷可能用到的相对原子质量:H 1 C 12O 16Na 23 S 32Fe 56 Ba 137一、选择题(本题包括7 个小题,每题 6 分,共 42 分)1.下列有关环境问题的做法错误的是A.生活污水使用明矾杀菌消毒B.向燃煤中加入适量石灰石“固硫”C.推广使用可降解塑料防止白色污染D.提倡公交出行可减少氮氧化物排放2.下列说法正确的是H·-A. NH 4 Cl 的电子式: [H N H] +Cl·HB.对硝基甲苯的结构简式:NO 2-- CH3C.向碳酸氢钙溶液中加入少量烧碱溶液的离子方程式:2++2HCO3-+2OH-= CaCO332 -+H2OCa↓+ COD.澄清透明的溶液中:2++2--一定能大量共存Cu、 K、 SO4、 Cl3.设 N A为阿伏加德罗常数的值。
下列说法正确的是A.标准状况下, 11.2 L CCl 4中含有的分子数为0.5N AB.在 Na2O2与水的反应中,每生成 1 mol O 2,转移电子的数为2N A C.常温常压下, 7.8 g 苯中含有双键的数目为0.3N A-1NH NO溶液中含有的铵根离子数为0.1ND. 25℃时, 0.1 mol L·43A4.短周期主族元素 X 、Y、Z、W 的原子序数依次增大。
X 原子最外层比次外层多 3 个电子; Y、Z 均为金属,Y 是同周期中原子半径最大的元素,Z 的简单离子半径在同周期元素中最小;W 的最高价氧化物在无机含氧酸中酸性最强。
下列说法正确的是A. X 的气态氢化物的热稳定性比O(氧 )的强B.元素 Z、 W 的简单离子具有相同的电子层结构C. Y、Z、 W 的最高价氧化物对应的水化物之间能相互反应D.等质量的 Y 和 Z 单质分别与足量稀盐酸反应,前者产生的氢气多5.用下列实验装置进行相应实验,能达到实验目的的是浓硫酸木炭与NH 3Cl 2(HCl)浓硫酸饱和澄清食盐水石灰水H2OCCl 4100 mL20 ℃图甲图乙图丙图丁A.用图甲所示装置验证反应产物二氧化碳B.用图乙装置吸收氨气并防止倒吸-D.用图丁装置除去氯气中的氯化氢C.图甲装置配制 100 mL 1 mol L·1的硫酸6. 2016 年 8 月,联合国开发计划署在中国的首个“氢经济示范城市 ”在江苏如皋落户。
四川成都七中(高新校区)高2018届高三理科综合化学测试(八)试卷1.1.“一带一路”贸易使国外的特色产品走入百姓的日常生活,下列商品的主要成分所对应的材料类型不正确...的是()A. AB. BC. CD. D【答案】C【解析】A. 银为金属单质,所以银饰品属于金属材料,故A正确;B. 棉制品的主要成分是纤维素,纤维素是天然的有机高分子化合物,故B正确;C. 水晶的主要成分是二氧化硅,不是合成高分子材料,故C错误;D. 陶瓷是硅酸盐产品,属于无机非金属材料,故D正确;答案选C。
2.2.下列关于有机物的说法正确的是A. 乙醇、乙酸均能与NaOH溶液反应B. 糖类、油脂、蛋白质都是有C、H、O三种元素组成的C. C5H9BrO2的同分异构体中,能与NaHCO3反应产生CO2的有10种D. 塑料、合成橡胶、合成纤维都主要是以石油、煤、天然气为原料生产的【答案】D【解析】【分析】A.乙醇不具有酸性;B.蛋白质中除了含有C、H、O元素外,还含有N、S、P等元素;C. 能与NaHCO3反应产生CO2,说明含有羧基,同时含有溴原子,可看成丁烷的二元取代产物;D. 以煤、石油、天然气等化石燃料为主要原料,可制造塑料、合成橡胶、合成纤维等化工产品。
【详解】A.乙醇不具有酸性,与氢氧化钠溶液不反应,乙酸可与氢氧化钠溶液反应,故A错误;B.蛋白质中除了含有C、H、O元素外,还含有N、S、P等元素,糖类和油脂均由C、H、O三种元素组成,故B错误;C.分子式为C5H9BrO2的有机物能与NaHCO3反应产生CO2,说明含有羧基,同时含有溴原子,所以可看成丁烷的二元取代产物,主链有4个碳原子时,二元取代产物有:HOOCCHBrCH2CH2CH3、HOOCCH2CHBrCH2CH3、HOOCCH2CH2CHBrCH3、HOOCCH2CH2CH2CH2Br、CH2BrCH(COOH)CH2CH3、CH3CBr(COOH)CH2CH3、CH3CH(COOH)CHBrCH3、CH3CH(COOH)CH2CH2Br,共8种,主链有3个碳原子时,二元取代产物有:HOOCCHBrCH(CH3)2、HOOCCH2CBr(CH3)2、HOOCCH2CH(CH2Br)CH3、CH2BrC(COOH)(CH3)2,共4种,所以符合条件的同分异构体为12种,故C错误;D. 塑料、合成橡胶和合成纤维这三大合成材料都主要是以石油、煤和天然气为原料生产的,故D正确,答案选D。
- 1 - 化学参考答案1.A 2.D 3.B 4.C 5.B 6.B 7.B8. (共11分,(3)小题3分,其余每空2分)(1)S +2H 2SO 4(浓)=====△3SO 2↑+ 2H 2O(2)驱赶出ClO 2,确保其被充分吸收(3)2ClO 2+2OH -+H 2O 2===2ClO -2+O 2+2H 2O(4)①分液漏斗②2Na 2O 2+2SO 2===2Na 2SO 3+O 29.(共17分,最后一空3分,其余每空2分)(4)较高温度下双氧水发生分解(5)n (KMnO 4)=0.4000 mol·L -1×20 mL×10-3L·mL -1=8.000×10-3 moln (Fe 2+)=5×8.000×10-3 mol =0.0400 mol根据发盐的化学式可知在久置的发盐中:n (Al 3+)=2×[0.0400mol+n (Fe 3+)] 加入氨水后生成的干燥固体粉末中:n (Al 2O 3)=0.0400mol+n (Fe 3+)n (Fe 2O 3)= 12×[0.0400mol+n (Fe 3+)] 102 g·mol -1×[0.0400mol+n (Fe 3+)]+160 g·mol -1×12×[0.0400mol+n (Fe 3+)]=9.100g n (Fe 3+)=0.0100moln (Al 3+)=2×[0.0400mol+n (Fe 3+)]=0.1000moln (SO 2-4)=2n (Al 3+)=0.2000mol久置发盐中的阳离子所带电荷总数:3n (Al 3+)+2n (Fe 2+)+3n (Fe 3+)=0.4100mol而已知的阴离子所带电荷总数:2n (SO 2-4)=0.4000mol <0.4100mol由于发盐在空气中被氧化,故其中还可能存在0.0100molOH -(或0.0050molCO 2-3)。
7.化学与科学、技术、社会、环境都密切相关,下列说法不正确的是A.古人利用明矾溶液的酸性来清洗青铜器上的铜锈B.人体摄入适量的油腻有利于促进维生素的吸收C.《肘后备急方》中记载:“青蒿一捏,以水二升渍,绞其汁”,所述过程不涉及化学变化D.手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料【答案】D【解析】试题分析:A.明矾溶液中铝离子水解,溶液显酸性,可以用来清洗青铜器上的铜锈,故A正确;B.油脂的摄入有利于脂溶性维生素的吸收,故B正确;C.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化,类似于过滤,故C正确;D.碳纤维是一种新型的无机非金属材料,不是高分子材料,故D错误;故选D。
考点:考查了化学与社会生活的相关知识。
8.柠檬烯是一种食用香料,其结构简式为:A.分子式为C10H14B.一定条件下,柠檬烯可发生加成、取代、氧化、还原反应C.柠檬烯有属于苯的同系物的同分异构体D.柠檬烯的分子中所有碳原子可能处在同一平面上【答案】B【解析】【考点定位】考查有机物的结构与性质【名师点晴】本题考查有机物的结构与性质,为高考常见题型,注意把握有机物中的官能团及性质的关系,选项C为解答的难点。
该有机物中含2个C=C,不含苯环,由结构简式可确定分子式,结合烯烃的性质来解答。
9.设NA为阿伏伽德罗常数的值,下列说法正确的是A.1mol羟基与1mol氢氧根离子所含的电子数均为9NAB.常温下,44g N2O和CO2组成的混合气体,所含原子数为3NAC.0.1mol/L的NaClO溶液,含有的阴离子数为0.1NAD.常温下,将1molFe投入过量浓硝酸中,转移的电子数为3NA【答案】B【解析】【考点定位】有关阿伏加德罗常数值的判断【名师点晴】本题考查阿伏加德罗常数的有关计算和判断,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力;该类试题的解题思路是:①只给出物质的体积,而不指明物质的状态,或者标准状况下物质的状态不为气体。
四川成都七中(高新校区)高2018届高三理科综合化学测试(八)试卷1.1.“一带一路”贸易使国外的特色产品走入百姓的日常生活,下列商品的主要成分所对应的材料类型不正确...的是()A. AB. BC. CD. D【答案】C【解析】A. 银为金属单质,所以银饰品属于金属材料,故A正确;B. 棉制品的主要成分是纤维素,纤维素是天然的有机高分子化合物,故B正确;C. 水晶的主要成分是二氧化硅,不是合成高分子材料,故C错误;D. 陶瓷是硅酸盐产品,属于无机非金属材料,故D正确;答案选C。
2.2.下列关于有机物的说法正确的是A. 乙醇、乙酸均能与NaOH溶液反应B. 糖类、油脂、蛋白质都是有C、H、O三种元素组成的C. C5H9BrO2的同分异构体中,能与NaHCO3反应产生CO2的有10种D. 塑料、合成橡胶、合成纤维都主要是以石油、煤、天然气为原料生产的【答案】D【解析】【分析】A.乙醇不具有酸性;B.蛋白质中除了含有C、H、O元素外,还含有N、S、P等元素;C. 能与NaHCO3反应产生CO2,说明含有羧基,同时含有溴原子,可看成丁烷的二元取代产物;D. 以煤、石油、天然气等化石燃料为主要原料,可制造塑料、合成橡胶、合成纤维等化工产品。
【详解】A.乙醇不具有酸性,与氢氧化钠溶液不反应,乙酸可与氢氧化钠溶液反应,故A错误;B.蛋白质中除了含有C、H、O元素外,还含有N、S、P等元素,糖类和油脂均由C、H、O三种元素组成,故B错误;C.分子式为C5H9BrO2的有机物能与NaHCO3反应产生CO2,说明含有羧基,同时含有溴原子,所以可看成丁烷的二元取代产物,主链有4个碳原子时,二元取代产物有:HOOCCHBrCH2CH2CH3、HOOCCH2CHBrCH2CH3、HOOCCH2CH2CHBrCH3、HOOCCH2CH2CH2CH2Br、CH2BrCH(COOH)CH2CH3、CH3CBr(COOH)CH2CH3、CH3CH(COOH)CHBrCH3、CH3CH(COOH)CH2CH2Br,共8种,主链有3个碳原子时,二元取代产物有:HOOCCHBrCH(CH3)2、HOOCCH2CBr(CH3)2、HOOCCH2CH(CH2Br)CH3、CH2BrC(COOH)(CH3)2,共4种,所以符合条件的同分异构体为12种,故C错误;D. 塑料、合成橡胶和合成纤维这三大合成材料都主要是以石油、煤和天然气为原料生产的,故D正确,答案选D。
四川省成都七中实验学校2018届高三上学期入学考试化学试题考试时间90分钟 100分命题人:万永红审题人:魏鑫原子量表: H 1 C 12 O 16 Na 23 Mg 24 Al 27 Cu 64一、选择题(1~25小题每小题只有一个正确选项,每题2分;共50分)1. 生活处处有化学。
下列与化学有关的说法,不正确的是()A. 油条用的膨松剂中含有一种对人体危害很大的铝元素B. 用米汤检验加碘食盐中的碘酸钾(KIO3)C. 甲醇、多元醇、醛类、羧酸、酯类、酸类等也是组成酒的有机物D. 医学上用氢氧化铝用作胃酸中和剂,其主要原因在于它对肠胃温和不刺激【答案】A【解析】试题分析:A.油条用的膨松剂中含有铝,对人体危害很大,故A正确;B.加碘食盐中的碘酸钾(KIO3)不是碘的单质,不能用米汤中含有的淀粉检验,故B错误;C.酒是多种有机物形成的混合物,其中含有甲醇、多元醇、醛类、羧酸、酯类、酸类等,故C正确;D.氢氧化铝是两性氢氧化物,可用作胃酸中和剂,且对肠胃温和不刺激,故D正确;故选B。
考点:考查了化学与生活的相关知识。
2. 科学家制造出一种使用固体电解质的燃料电池,其效率更高.一个电极通入空气,另一电极通入汽油蒸汽,其中电池的电解质是掺杂了Y2O3(Y为钇)的ZrO2(Zr为为锆)晶体,它在高温下能传导O2﹣离子.若以丁烷(C4H10)代表汽油,总反应为2C4H10+13O2=8CO2+10H2O.有关该电池说法错误的是()A. 该电池负极的电极反应式为:2C4H10+26O2﹣﹣52e﹣=8CO2+10H2OB. O2﹣向负极移动C. 该电池正极的电极反应式为:O2+4e﹣+2H2O=4OH﹣D. 丁烷在放电时发生氧化反应【答案】C【解析】试题分析:A、丁烷失电子发生氧化反应,电极反应为:C4H10-26e-+13O2-=4CO2+5H2O,故A正确;B、O2-定向移向负极,故B正确;C、正极上通入空气,氧气得电子发生还原反应:O2-4e-=2O2-,故C错误;D、丁烷在负极放电时发生氧化反应,故D正确;故选C。
考点:考查了化学电源新型电池的相关知识。
3. 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是()A. AB. BC. CD. D【答案】B【解析】试题分析:根据图知,该装置有外接电源,所以属于电解池,根据电子流向知,c是负极、d是正极、a是阴极、b是阳极,电解时,电解质溶液中阳离子向阴极移动、阴离子向阳极移动,则Q是阳离子、P是阴离子,故选B。
考点:考查了电解原理的相关知识。
4. 现有A、B、C三种化合物,各取40g相混合,完全反应后,得18gB、49gC、还有D生成.现将20gA和11gB反应,能生成0.25mol D,则D的相对分子质量为()A. 424B. 212C. 116.6D. 106【答案】D【解析】试题分析:40gA完全反应,参加反应的B的质量为40g-18g=22g,生成的C的质量为49g-40g=9g,根据质量守恒定律可知,生成的D的质量为40g+22g-9g=53g,11gB完全反应需要A的质量为40g×=20g,小于22g,故22gA和11gB反应,B完全反应,故生成D的质量为53g×=26.5g,故D的摩尔质量为=106g/mol,摩尔质量在数值上与相对分子质量相等,故D的相对分子质量为106,故选D。
考点:考查了相对分子质量的相关计算的相关知识。
5. 为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包含有碳氢化合物(当然这仅仅是探索的第一步)。
科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。
这个实验不能用普通盐酸,其理由是()A. 普通盐酸酸性太强B. 普通盐酸有强挥发性C. 普通盐酸与月球岩石中的碳化物无法反应D. 无法区别月球岩石中原来含有的是碳化物,还是碳氢化合物【答案】D【解析】试题分析:氘盐酸(DCl)与普通的盐酸都是氢元素与氯元素形成的化合物,已知同位素及其构成的化合物的化学性质基本相同,所以氘盐酸(DCl)与普通的盐酸化学性质基本相同,所以A、B、C项不正确,普通的盐酸中含有普通氢原子,无法区别岩石中原来含有的是含碳而不含普通氢的化合物,还是含碳和普通氢的化合物,故D正确;故选D。
【考点定位】考查核素;同位素及其应用【名师点晴】本题考查了同位素及其构成的化合物的化学性质的关系,明确同位素及其构成的化合物的化学性质基本相同是解题的关键。
同位素及其构成的化合物的化学性质基本相似分析,普通盐酸中含有普通氢原子会对岩石中氢原子的检验产生干扰。
6. 有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成(忽体积的变化):①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3;下列各项排序正确的是()A. pH:②>③>④>①B. c(CH3COO-):②>④>③>①C. 溶液中c(H+):①>③>②>④D. C(CH3COOH):①>④>③>②【答案】B【解析】试题分析:A.①CH3COONa与HCl等浓度混合生成醋酸和氯化钠,溶液的pH<7,②中有强碱氢氧化钠,溶液pH最大,③④都因盐的水解而显碱性,且④中次氯酸钠的水解程度大于醋酸钠,溶液的pH④③,所以各混合液中的pH大小为:②>④>③>①,故A错误;B.因②中碱中的OH-抑制CH3COO-水解,则c(CH3COO-)最大,④中两种盐相互抑制水解,③中只有水解,而①中CH3COO-与酸结合生成弱电解质,则c(CH3COO-)最小,即c(CH3COO-)的大小顺序为:②>④>③>①,故B正确;C.酸性越强,则溶液中C(H+)越大,pH越小,则四种混合液中的pH大小顺序为:②>④>③>①,c(H+)大小为:①>③>④>②,故C错误;D.因水解程度越大,则生成的CH3COOH就多,则c(CH3COOH)③>④>②,而①中CH3COO-与酸结合生成弱电解质CH3COOH,则c(CH3COOH)最大,即c(CH3COOH)①>③>④>②,故D 错误。
故选B。
考点:考查离子浓度大小比较【名师点睛】本题考查溶液中粒子浓度大小比较、盐的水解原理及其应用,题目难度中等。
试题较好的训练学生的守恒思想和综合分析能力,明确混合溶液中酸碱性分析的规律及盐类水解、水解的相互影响等因素是解答的关键。
根据溶液的溶质来分析酸碱性,一般酸与盐的溶液显酸性,碱与盐的溶液显碱性,则①中显酸性,②中显碱性,③中只有CH3COONa水解显碱性,④中两种物质都水解显碱性;溶液酸性越强,溶液pH越小,碱性越强,溶液的pH越大,然后根据盐的水解程度、溶液的酸碱性对选项进行分析解答。
7. 下列各项叙述正确的是()A. 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态B. 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是S区元素C. 所有原子任一能层的S电子云轮廓图都是球形,但球的半径大小不同D. 24Cr原子的电子排布式是:1s22s22p63s23p63d44s2【答案】C..................8. 有下列离子晶体空间结构示意图:●为阳离子,○为阴离子.以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为()A. B. C. D.【答案】B【解析】试题分析:A、阳离子位于顶点和面心,晶胞中总共含有阳离子数目为8×+6×=4,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为4:1,化学式为M4N,故A错误;B、有4个阳离子位于顶点,晶胞中平均含有阳离子数目为4×=,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为:1=1:2,化学式为MN2,故B正确;C、有3个阳离子位于顶点,晶胞中平均含有阳离子数目为3×=,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为:1=3:8,化学式为M3N8,故C错误;D、有8个阳离子位于顶点,晶胞中平均含有阳离子数目为8×=1,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为1:1,化学式为MN,故D错误;故选B。
考点:考查了晶胞的计算的相关知识。
9. 将相同物质的量的甲烷和氯气混合后,在光照下充分反应,生成物中物质的量最大的是()A. CH3ClB. CH2Cl2C. CCl4D. HCl【答案】D【解析】甲烷和氯气混合光照后能发生的反应有:CH4+Cl2CH3Cl+HCl、CH4+2Cl2CH2Cl2+2HCl、CH4+3Cl2CHCl3+3HCl、CH4+4Cl2CCl4+4HCl,生成物中物质的量最大的是HCl,答案选D。
10. 在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )A. -488.3 kJ/molB. +488.3 kJ/molC. -191 kJ/molD. +191 kJ/mol【答案】A【解析】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、670.3 kJ/mol,①C(s)+O2(g)═CO2(g)△H=-393.5kJ·mol-1;②H2(g)+1/2O2(g)═H2O(l)△H=-285.8kJ·mol-1;③CH3COOH(l)+5/2O2(g)═3H2O(l)+2CO2(g)△H=-670.3kJ·mol-1;根据盖斯定律③-(①+②×2)得CH4(g)=C(s)+2H2(g),△H=(-670.3KJ·mol-1)-[(-393.5KJ·mol-1)+(-285.8kJ·mol-1)×2]=-688.3KJ·mol-1;故选A。
11. 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。
它的部分性质见下图,下列说法错误的是()A. 上图所涉及到的化学反应都是氧化还原反应B. N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键C. NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2OD. 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)【答案】A【解析】试题分析:A.有电子转移的化学反应为氧化还原反应,其特征是有元素化合价升降,亚硝酸钠和氯化铵的反应中没有元素化合价升降,所以不属于氧化还原反应,故A错误;B.氢键导致物质的溶解度增大,肼和水分子之间能形成氢键,所以促进肼溶解,则肼极易溶于水,故B正确;C.亚硝酸钠和肼反应生成叠氮化钠和水,该反应中N元素化合价由+3价、-2价变为-价,转移电子数为,结合原子守恒配平方程式为NaNO2+N2H4=NaN3+2H2O,故C正确;D.根据转化关系知,亚硝酸钠能和KI反应生成碘单质,碘与淀粉试液变蓝色,氯化钠和KI不反应,所以用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2),故D正确;故选A。