化学-蒲纯-原子结构模型的演变
- 格式:doc
- 大小:18.00 KB
- 文档页数:4

原子结构模型发展历程古希腊哲学家提出的原子理论是原子结构模型的起源,公元前5世纪的苏格拉底、柏拉图和亚里士多德都曾提到原子的概念。
根据他们的理论,物质由不可再分的粒子组成,这些粒子被称为原子。
然而,由于当时缺乏实验证据,这个模型一直停留在哲学的层面上。
到了19世纪,科学家开始通过实验方法探索原子结构。
1803年,约翰·道尔顿提出了道尔顿原子理论,认为物质由不可再分的小球体组成,每种元素都有自己独特的原子。
虽然这个模型成功解释了许多化学现象,但它没有考虑到原子内部的结构。
接下来的几十年里,科学家通过一系列的实验,逐渐发现了原子内部的复杂结构。
1897年,英国物理学家汤姆孙发现了电子,提出了第一个原子内部结构模型,“西瓜糖葫芦模型”。
他将原子想象成一个正电荷均匀分布的球体,电子则像西瓜籽一样分散在球体内。
1909年,欧内斯特·卢瑟福进行了著名的金箔散射实验,发现了原子的绝大部分质量集中在中心的一个小区域。
这证实了原子具有集中的正电荷,同时也揭示了原子内部有一个巨大的空间。
为了解释这些实验结果,卢瑟福提出了“卢瑟福模型”,也被称为“行星模型”。
他认为,原子由一个带正电荷的核心和绕核心运动的电子组成,电子的轨道类似于行星围绕着太阳运动。
尽管卢瑟福模型得到了广泛的认可,但它无法解决一些问题,比如无法解释电子为什么不会坠落到核心。
1926年,奥地利物理学家艾尔温·薛定谔提出了量子力学的基本原理,并建立了薛定谔方程,为原子结构模型的发展提供了新的思路。
根据量子力学,电子不能简单地看作在固定轨道上移动,而是存在于由概率波函数描述的一个特定能级上。
随后,一批科学家对薛定谔方程进行了研究,并提出了各种原子结构模型,如“轨道模型”、“轨道云模型”、“分子轨道模型”等。
这些模型通过对电子在原子内部的行为和特性进行描述,为理解电子轨道、能级和化学键等提供了重要的理论基础。
20世纪中叶以后,随着计算机技术的飞速发展,原子结构模型的研究进入了计算科学的时代。


原子结构模型的主要演变过程1、思考“大物质与小物质”的关系公元前 400 多年,古希腊哲学家德谟克利特, 提出万物由原子构成的思想,认为原子是不能再分的实心小球。
2、小物质到底是什么?有什么特点?19 世纪初,道尔顿对小物质的思考,创立了原子学说,基本观点包括:①一切物质都是由不可见的,不可再分的原子组成,原子不能自生自灭;②同种类的原子具有相同的性质,不同的原子性质不同;③每一种物质都由特定的原子组成。
原子学说成为19 世纪初化学理论的基础,推动了19 世纪化学的迅速发展。
3.神秘的绿色荧光------电子的发现,产生“葡萄干布丁模型”汤姆逊对“阴极射线管”的研究,得出结论:原子并不是物质可分性的最后极限,从原子中可以进一步分出电子。
提出“葡萄干布丁模型”----原子含有一个均匀的阳电球,若干阴性电子在这个球体内运行。
这个模型,电子分布在球体中很有点像葡萄干点缀在一块蛋糕里,称为“葡萄干蛋糕模型”或“葡萄干布丁模型”。
从此,人们打开了神秘的原子世界的大门,进入了微观世界的新纪元。
汤姆逊的实验设计得很巧妙,然而其物理思想其实很简单:如果射线是带负电的,它们不仅能被磁铁偏转,也应该在电场中偏转。
汤姆逊制作了一个类似于赫兹实验用的克鲁克斯管,把偏转金属板放在放电管内,金属板上加一个电压形成电场,当阴极射线通过电场时,没有观察到任何持续而稳定的偏转。
但细心的汤姆逊没有放过实验中出现的非常细微的异常现象。
他发现在金属板上外加电压的瞬间阴极射线出现短暂的偏转,然后很快地回到管壁标尺的中点。
汤姆逊抓住这瞬间的异常,分析出现这种现象的可能原因。
他认为,当阴极射线穿过气体时会使气体变成导电体,射线将被导电体包围起来,屏蔽了电的作用力,就像金属罩把验电器屏蔽起来一样,使它不受外部的电作用。
由此,汤姆逊利用了当时最先进的真空技术,将放电管内的空气一直抽到只剩下极小量的空气时,终于排除了电离气体的屏蔽作用,使阴极射线在电场中发生了稳定的电偏转,偏转的方向表明射线带的是负电荷,取得了前人没有得到的新的物理测量结果。


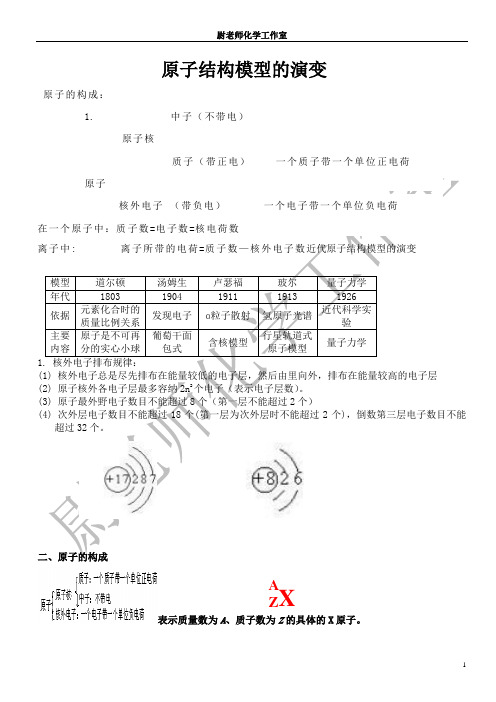
原子结构模型的演变原子的构成:32个。
表示质量数为A 、质子数为Z 的具体的X 原子。
Z XA)A.72B.113C.185D.257二、填空题8.用符号A:质子数;B:中子数;C:核外电子数;D:最外层电子数;E:电子层数,填写下列各空。
(1)原子种类由________决定。
(2)元素种类由________决定。
(3)相对原子质量由________决定。
(4)元素的原子半径由________决定。
(5)元素的化合价主要由________决定。
(6)元素的化学性质主要由________决定。
(7)核电荷数由________决定。
9.核外电子分层排布的一般规律是:各电子层最多容纳的电子数为________个,最外层电子数目不超过________个,次外层电子数目不超过________个,倒数第三层电子数目不超过________个,核外电子总是尽先排布在能量________的电子层里,然后由里往外,依次排布在能量逐步________的电子层里。
三、推断题10.有A 、B 、C 、D 四种元素,已知A 元素原子的K 层和M 层电子数相同;B 元素原子的L 层比K 层电子数多5个;C 元素的+3价阳离子和氖原子具有相同的电子数;D 元素的原子核外有4个电子层,K 层与L 层电子数之和等于M 层与N 层电子数之和。
写出:(1)元素符号:A________,B________,C________,D________。
(2)A 的原子结构示意图________,B 的阴离子结构示意图________,C 的阳离子结构示意图________,D 的原子结构示意图________。
人类对原子结构的认识练习题一、选择题1. H 、D 、T 、H +可以用来表示( ) A .同一种原子 B .化学性质不同的氢原子 C .氢元素 D .氢的四种核素2. (2005年高考辽宁文理综合)在下列分子中,电子总数最少的是( )A H 2SB O 2C COD NO 3. 电子数相等的微粒叫等电子体,下列各组微粒属于等电子体的是( )A. N 2O 4和NO 2B. CH 4 和NH 4+C. Al 3+ 和 OH -D. NO 和CO4. 已知元素R 有某种同位素的氯化物RCl X ,该氯化物中R 微粒核内中子数为Y ,核外电子数为Z ,该同位素的符号为 ( )A.Z Y RB.Z Y ZR + C.X Z Y ZR ++ D.X Z X Y ZR +++5. (2005年高考辽宁文理综合)关于同一种元素的原子或离子,下列叙述正确的是A 原子半径比阴离子半径小B 原子半径比阴离子半径大C 原子半径比阳离子半径小D 带正电荷多的阳离子半径比带正电荷少的阳离子半径大6. (2005年高考上海卷)下列离子中,电子数大于质子数且质子数大于中子数的是 A .D 3O + B .Li + C .OD — D .OH —7. 在恒定温度下,向100克饱和Ba(OH)2溶液中加入1.55克由18O 组成的氧化钡粉未,充分反应后静置,在溶液下部有白色固体出现,下列叙述正确的是( )A.溶液质量与白色固体的质量均保持不变B.溶液浓度和PH 值均保持不变,溶液下部是1.73克氢氧化钡固体C. 溶液中钡离子与氢氧根离子的数目均保持不变,18O 存在于溶液和固体中,固体质量大于1.73克D.溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,18O 存在于溶液和固体中,固体质量小于1.73克8. 钛(Ti )金属常被称为未来钢铁。
原子结构的发展历程及玻尔模型原子是构成物质的基本单位,它的结构与性质的研究一直是化学和物理学的核心内容之一。
随着科学技术的进步,原子结构的研究逐渐深入,人们对原子的认识也发生了很大的变化。
本文将从原子结构的发展历程和玻尔模型两个方面,为读者呈现出原子结构的演变过程。
一、原子结构的发展历程1. 原子的概念提出古代的希腊哲学家们提出了“原子”这个概念,认为物质是由不可再分的微小粒子组成的。
然而,直到19世纪末,人们对原子的认识依然停留在理论层面,缺乏实验证据的支持。
2. 实验揭示原子的真实面貌19世纪末,通过一系列的实验,科学家终于得以揭示原子的真实面貌。
其中,道尔顿的原子理论提出了原子是不可分割的基本粒子,并且具有不同元素特有的质量。
此外,康普顿的散射实验进一步证实了电子的存在,为后来玻尔模型的发展奠定了基础。
3. 集体核模型的提出经过实验证据的积累和理论的推演,人们逐渐认识到原子中不仅有电子,而且还包含了质子和中子。
拉瑟福的金箔散射实验揭示了原子中正电荷集中在核心的事实,这一发现奠定了集体核模型的基础,为原子核的研究铺平了道路。
4. 量子理论的诞生20世纪初,量子理论的诞生彻底改变了人们对原子结构的认识。
普朗克和爱因斯坦的研究表明,能量具有量子化特性,电子也表现出波粒二象性。
狄拉克的量子力学理论实现了对原子内部运动规律的描述,奠定了现代原子结构理论的基础。
二、玻尔模型玻尔模型是原子结构的重要里程碑,它于1913年由丹麦科学家尼尔斯·玻尔提出。
玻尔模型基于下面几个基本假设:1. 电子只能在特定的能级上存在,这些能级被称为电子壳。
2. 电子在能级之间跃迁时会吸收或释放特定能量的光子。
3. 电子绕原子核作圆周轨道运动,且能级越高,轨道半径越大。
玻尔模型成功解释了氢原子谱线的规律,进一步验证了量子理论的正确性。
它的提出极大地推动了原子结构研究的进展,也为后来量子力学的发展奠定了基础。
总结起来,原子结构的发展历程经历了从古代哲学观念到实验证实、从经典物理到量子理论的演变。
第三单元第一课时原子结构模型的演变
[教学目标]
知识与技能:通过原子结构模型演变的学习,了解原子结构模型演变的历史;
过程与方法:熟悉书写原子意图结构示意图和离子结构示意图,掌握核外电子排布规律,知道原子结构与元素性质之间的关系;
情感态度与价值观:体会科学家探索原子结构的艰辛。
[教学重难点]
重点:原子结构示意图、离子结构示意图
难点:核外电子排布规律
[教具准备]
多媒体
[教学过程]
[导入]
上节课我们把原子结构内容开了一个小头,今天我们继续往后学习。
这节课我们需要解决以下几个问题:1、原子结构模型演变的历史是怎样的;2、如何正确书写原子结构示意图;3、我们一起探寻原子核外电子排布规律;4、原子结构与元素性质有怎样的关系。
[板书设计]
一、原子结构模型演变
[讲解]
课本P.27-28“交流与讨论”中的内容,大家已经阅读过了,下
面我们用一个表格来概括梳理下。
[投影展示&讲解]
①最早是公元前5世纪,古希腊哲学家德谟克利特提出古代原子学说,他认为万物都是由不可分割的原子构成的。
②1803年,英国科学家道尔顿在德谟克利特的基础上作了进一步的完善,提出了近代原子学说。
他补充了两点,说原子不能被创造也不能被毁灭;原子在化学变化中保持本性不变。
这就是道尔顿模型,又叫“原子球模型”。
③1904年,J.J.Thomson提出原子中还存在着电子,为保持原子呈电中性,原子中不可避免应该是分布着带正电的微粒,电子镶嵌其中。
我们形象得称之为“葡萄干面包式”或“枣糕模型”。
④1911年,卢瑟福做了著名的α粒子散射实验。
大家把学案翻到P.14看13题,也可以对照着这张图。
简单得说,α粒子就相当于一个氦的原子核,当它轰击金箔时,有三种情况:A.大多数的粒子畅通无阻得通过了,说明原子核周围有大量的空间存在。
B.极少数粒子发生偏转,同性相斥,证明原子核带正电。
C.还有的是笔直得弹回,说明原子核的质量很大。
所以说,卢瑟福的成就很伟大,他被称为近代原子核物理学之父。
他还特别愿意分享,他的学生或者助手中获得诺贝尔奖的是最多的。
⑤波尔就是他的学生之一。
波尔虽然是师从于卢瑟福,但是他敢于质疑,他被称为量子力学之父。
所以说同学们在学习的过程中也要敢于质疑,老师授课过程中可能也有疏漏,同学们千万不要把老师当
作权威,要多思考。
波尔认为,原子核外电子在一系列的轨道上运动,这个关于电子分层的概念至今我们仍然使用。
[板书设计]
二、原子结构示意图
[投影&讲解]
根据波尔的原子轨道,老师画出了几种原子的核外电子排布。
最中间的圈代表原子核,外面的圈代表电子层,圈上的点代表电子。
我们可以用原子结构示意图来简单得表示它们的核外电子排布。
比如:P元素,我们用一个圈表示原子核,它的核电荷数是15,“+”不能漏掉。
第一层排了2个电子,第二层排了8个电子,第三层排了5个电子。
电子层由内向外依次又叫K、L、M、N、O、P、Q,目前我们发现至第七层。
请注意,它的能量是依次升高的。
下面我们就来练练手。
请大家写出1-20号元素的原子结构示意图。
刚开始允许你们翻阅化学书,但是课后请记忆前20号元素的原子序数,也就是核电荷数。
吃饭前背两个可以增进食欲哦。
[板书设计]
三、核外电子排布规律
[投影&讲解]
都写完了吧,先校对一下答案。
我们都知道,化学反应中,原子的核电荷数是不改变的,变的只有核外电子。
下面我们就着重来看看这些元素的核外电子排布有什么规律。
请大家观察老师写的稀有气体元素He、Ne、Ar、Kr、Xe、Rn。
[学生答]
[投影展示]
①电子总是先排布在能量最低的电子层里,然后由里往外,依次排在能量逐渐升高的电子层里(能量最低原理)先排K层,排满K层后再排L层,排满L层后再排M层,依此类推
②每个电子层最多只能容纳2n2个电子
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个)倒数第三层最多只能容纳32个电子
[板书设计]
四、原子结构与元素性质
化学反应的本质是物质由不稳定转向稳定。
稳定结构是什么意思?不稳定结构又是什么意思呢?
[投影展示]
(1)稳定结构:最外电子层上为8(只有一个电子层时为2)个电子
(2)不稳定结构:原子容易失去电子转化或容易得到电子转化最外电子层上为8(只有一个电子层时为2)个电子的稳定结构。
[练习]P.13例1。