乙炔的危险特性及安全技术表
- 格式:docx
- 大小:18.53 KB
- 文档页数:4
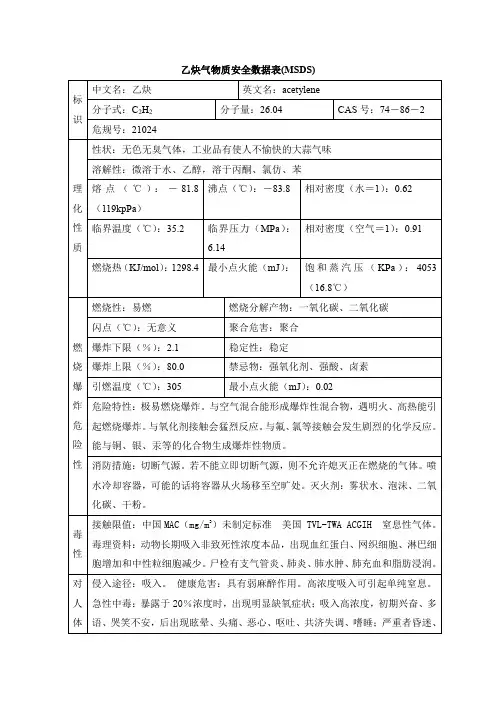
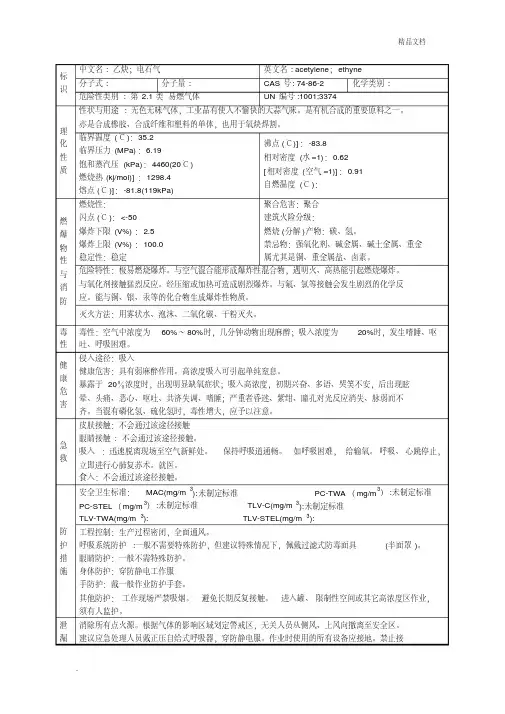
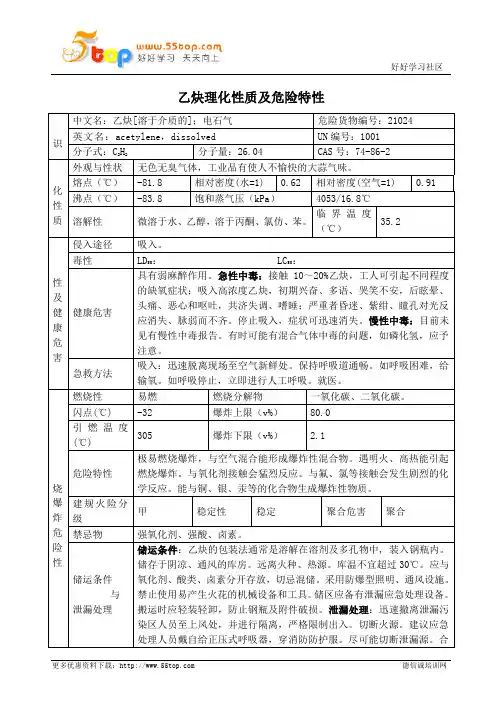
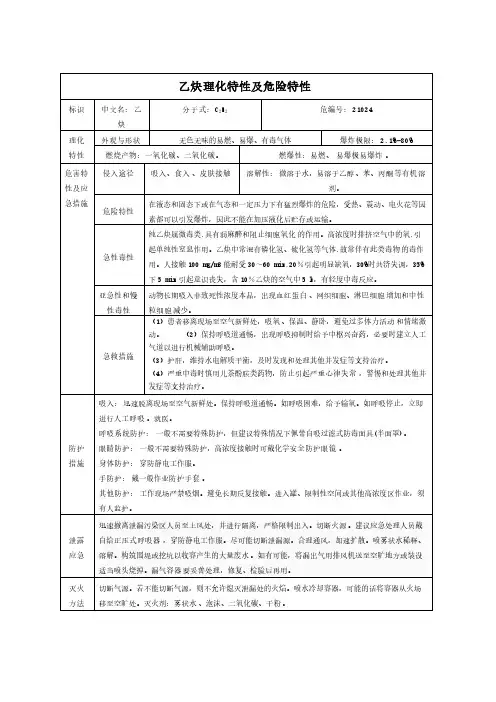
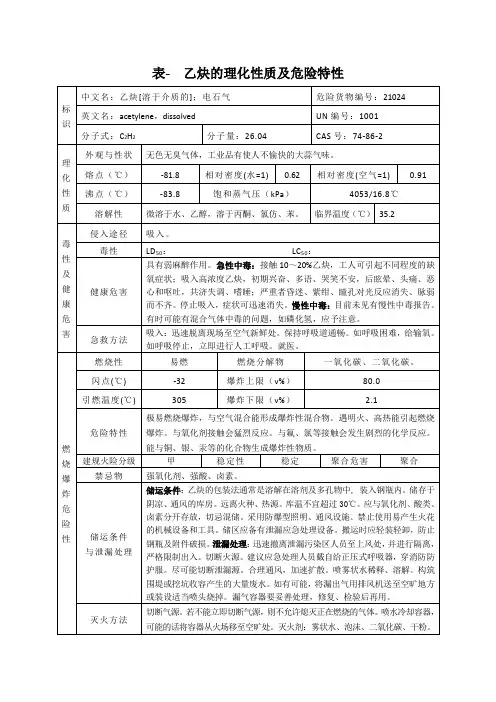
乙炔理化性质及危险特性识中文名:乙炔[溶于介质的];电石气危险货物编号:21024 英文名:acetylene,dissolved UN编号:1001分子式:C2H2分子量:26.04 CAS号:74-86-2化性质外观与性状无色无臭气体,工业品有使人不愉快的大蒜气味。
熔点(℃)-81.8 相对密度(水=1) 0.62 相对密度(空气=1) 0.91 沸点(℃)-83.8 饱和蒸气压(kPa)4053/16.8℃溶解性微溶于水、乙醇,溶于丙酮、氯仿、苯。
临界温度(℃)35.2性及健康危害侵入途径吸入。
毒性LD50: LC50:健康危害具有弱麻醉作用。
急性中毒:接触10~20%乙炔,工人可引起不同程度的缺氧症状;吸入高浓度乙炔,初期兴奋、多语、哭笑不安,后眩晕、头痛、恶心和呕吐,共济失调、嗜睡;严重者昏迷、紫绀、瞳孔对光反应消失、脉弱而不齐。
停止吸入,症状可迅速消失。
慢性中毒:目前未见有慢性中毒报告。
有时可能有混合气体中毒的问题,如磷化氢,应予注意。
急救方法吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
烧爆炸危险性燃烧性易燃燃烧分解物一氧化碳、二氧化碳。
闪点(℃) -32 爆炸上限(v%)80.0引燃温度(℃)305 爆炸下限(v%) 2.1危险特性极易燃烧爆炸,与空气混合能形成爆炸性混合物。
遇明火、高热能引起燃烧爆炸。
与氧化剂接触会猛烈反应。
与氟、氯等接触会发生剧烈的化学反应。
能与铜、银、汞等的化合物生成爆炸性物质。
建规火险分级甲稳定性稳定聚合危害聚合禁忌物强氧化剂、强酸、卤素。
储运条件与泄漏处理储运条件:乙炔的包装法通常是溶解在溶剂及多孔物中, 装入钢瓶内。
储存于阴凉、通风的库房。
远离火种、热源。
库温不宜超过30℃。
应与氧化剂、酸类、卤素分开存放,切忌混储。
采用防爆型照明、通风设施。
禁止使用易产生火花的机械设备和工具。
储区应备有泄漏应急处理设备。
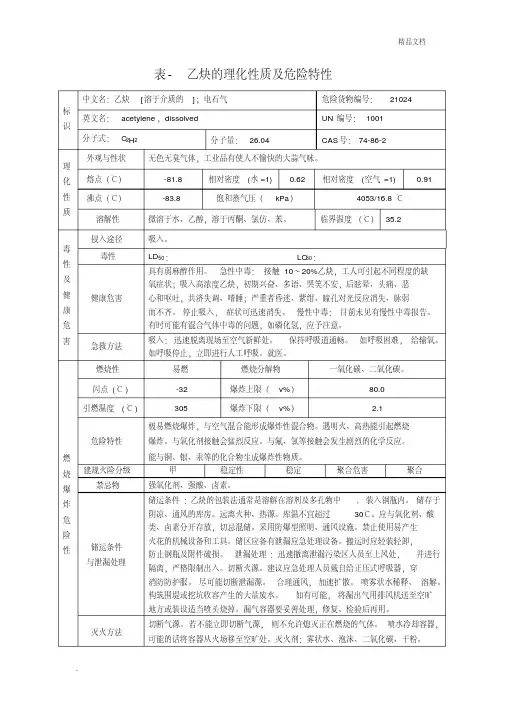

乙炔的危险特性
乙炔CH≡CH26.0 Acetylene dissolvel 2.1类别易燃气体,CNNO.21024,UNNO.1001。
物化性质:无色,略带乙醚气味,大多数商业产品都含有磷化氢、硫化氢和氨等杂质,而有蒜样臭气。
相对密度1.175,凝点-81.8℃,
蒸气密度0.9,微溶于水,溶于乙醇,易溶于丙酮。
化学性质很活泼,能起加成反应和聚合反应。
危险特性:极易着火、爆炸,闪点-32℃,自燃点305℃,气体能
与空气形成爆炸性混合物,爆炸极限2.8%~81%;乙炔必须溶解在丙酮和二甲基甲酰胺中,才能在高压下保持稳定,否则容易分解成氢和碳,产生爆炸。
乙炔能与铜、银、汞等化合物生成爆炸性混合物。
受撞击、摩擦或干状态下升温可导致强裂分解,并能与氟、氯发生爆炸性反应,遇热、明火和氧气化剂有着火、爆炸危险;有毒、麻醉作用,甚至引
起昏迷,人吸入10%,轻度中毒反应,吸入20%显著缺氧、昏睡、发绀,吸入30%,动作不协调,步态蹒跚。
确定事故类型:火灾、爆炸、中毒。

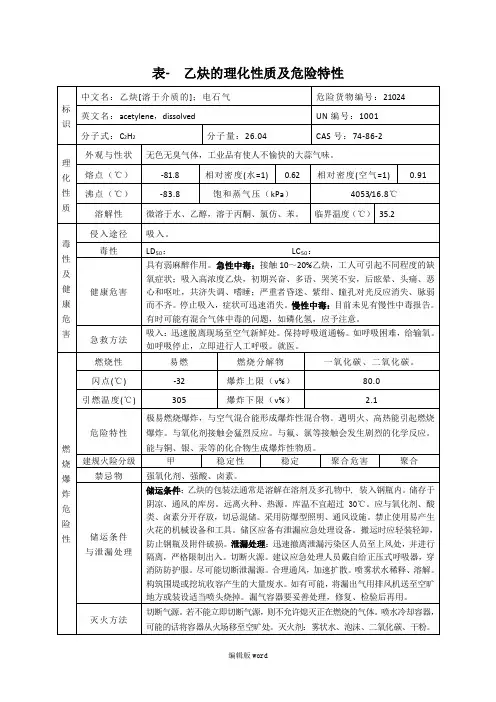
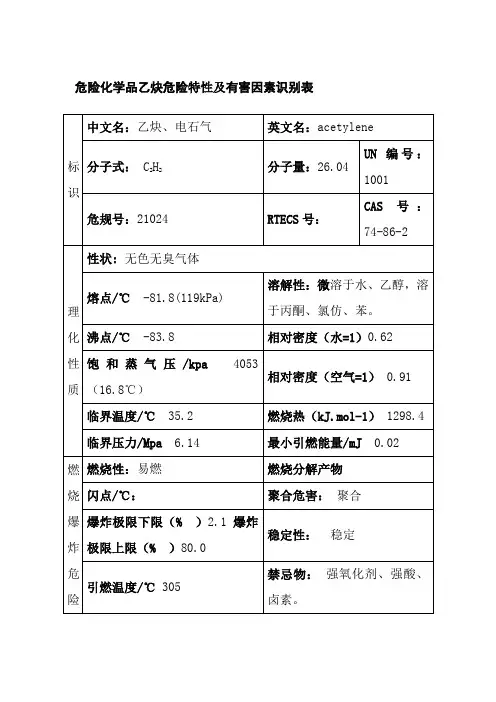
乙炔理化性质及危险特性表
1. 理化性质:
- 化学式:C₂H₂
- 分子量:26.04 g/mol
- 外观:无色气体
- 沸点:-84°C
- 熔点:-80.8°C
- 密度:0. g/cm³
- 溶解度:不溶于水,易溶于乙醇和乙醚
2. 危险特性:
- 爆炸性:乙炔与空气的混合物在一定条件下可形成爆炸性混
合物。
其爆炸范围为2.3% - 81.0%。
乙炔与氧气或其他氧化剂的接
触也可能引发爆炸。
- 易燃性:乙炔具有高度的易燃性,其自燃温度较低,为
305°C。
与火源接触时容易着火燃烧。
- 不稳定性:乙炔具有不稳定性,容易聚集形成易爆的混合物,并在一定条件下迅速发生分解反应,形成较强的爆炸性物质。
- 有毒性:乙炔吸入或接触人体后会对呼吸系统和中枢神经系统产生刺激作用,对皮肤和眼睛有腐蚀性。
3. 安全注意事项:
- 在储存和使用乙炔时,需采取严格的安全措施,确保排除火源、防止泄漏,保持通风良好。
- 使用乙炔时应佩戴适当的个人防护装备,如防护眼镜、手套和防护服等。
- 在储存和运输乙炔时,应遵循相关法规和标准,采用专用,并进行牢固的密封和固定。
- 遇到泄漏或事故时,应立即采取应急措施,并及时联系专业人士进行处理和清理。
以上为乙炔的理化性质及危险特性表。
在操作和处理乙炔时,请务必遵守相关安全规范和法规,以确保人员和环境的安全。
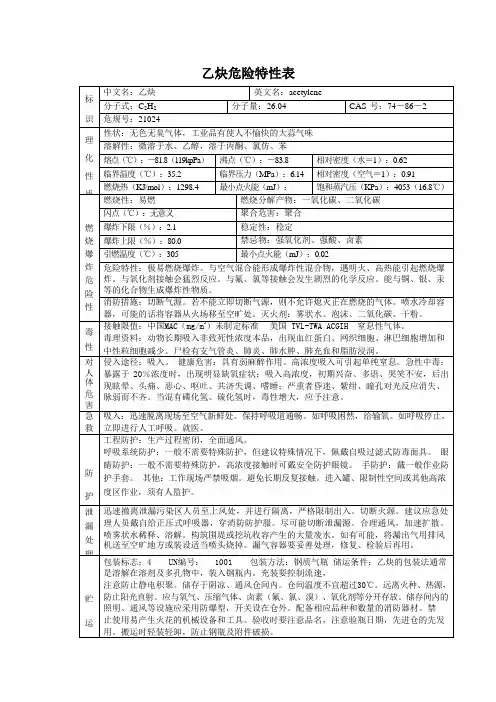
乙炔无色、无味、易燃的气体,微溶于水,易溶于乙醇、丙酮等有机溶剂。
主要成分:含量: 工业级≥97.5%。
外观与性状:无色无臭气体,工业品有使人不愉快的大蒜气味。
熔点(℃):-81.8(119kPa)。
沸点(℃):-83.8。
相对密度(水=1):0.62。
相对蒸气密度(空气=1):0.91。
蒸气压(kPa):4053(16.8℃)。
闪点:<-50℃。
燃烧热(kJ/mol):1298.4。
稳定性和反应活性:稳定。
禁配物:强氧化剂、强酸、卤素。
避免接触的条件:受热。
危险特性:极易燃烧爆炸。
与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。
与氧化剂接触猛烈反应。
与氟、氯等接触会发生剧烈的化学反应。
能与铜、银、汞等的化合物生成爆炸性物质。
溶解性:微溶于水、乙醇,溶于丙酮、氯仿、苯。
乙炔 - 化学性质乙炔化学性质很活泼,易起加成、氧化、聚合及金属取代等反应,生成多种重要的化工产品。
在氯化汞存在下与氯化氢加成,生成氯乙烯:HC≡CH+HCl→H2C = CHCl;在乙酸锌存在下与乙酸加成,生成乙酸乙烯酯:HC≡CH+CH3COOH→H2C = CHOCOCH3;能使高锰酸钾溶液的紫色褪去:3CH≡CH 10KMnO4 2H2O→6CO2↑ 10KOH 10MnO2↓乙炔的实验室制法:CaC2 2H-OH→Ca(OH)2 CH≡CH↑(1)氧化反应:a.可燃性:2C2H2 5O2 → 4CO2 2H2O现象:火焰明亮、带浓烟 , 燃烧时火焰温度很高(>3000℃),用于气焊和气割。
其火焰称为氧炔焰。
b.被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色。
(2)加成反应:可以跟Br2、H2、HX等多种物质发生加成反应。
如:现象:溴水褪色或Br2的CCl4溶液褪色。
所以可用酸性KMnO4溶液或溴水区别炔烃与烷烃。
与H2的加成:CH≡CH H2 → CH2=CH2与HX的加成:如:CH≡CH HCl →CH2=CHCl氯乙烯用于制聚氯乙烯(3)“聚合”反应:三个乙炔分子结合成一个苯分子:由于乙炔与乙烯都是不饱和烃,所以化学性质基本相似。