2019年中考化学试题汇编微粒结构示意图含解析
- 格式:docx
- 大小:151.06 KB
- 文档页数:4
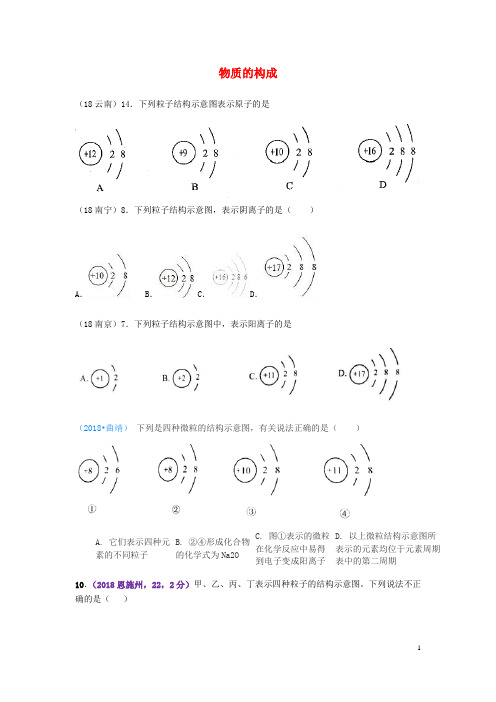
物质的构成(18云南)14.下列粒子结构示意图表示原子的是(18南宁)8.下列粒子结构示意图,表示阴离子的是()A.B. C.D.(18南京)7.下列粒子结构示意图中,表示阳离子的是(2018•曲靖)下列是四种微粒的结构示意图,有关说法正确的是()A. 它们表示四种元素的不同粒子B. ②④形成化合物的化学式为Na2OC. 图①表示的微粒在化学反应中易得到电子变成阳离子D. 以上微粒结构示意图所表示的元素均位于元素周期表中的第二周期10.(2018恩施州,22,2分)甲、乙、丙、丁表示四种粒子的结构示意图。
下列说法不正确的是()A.甲、乙属于同种元素 B.甲、乙、丙具有相似的化学性质C.丁中x=8 D.乙表示阴离子【答案】B【解析】A、质子数决定元素的种类,甲、乙属于同种元素,故正确;B、甲、丙最外层电子数相同,具有相似的化学,乙属于稳定结构,故错误;C、原子中质子数=核外电子数,丁中x=18-2-8=8,故正确;D、乙的核内质子数<核外电子数,表示阴离子,故正确。
故选:B。
【知识点】原子、离子结构示意图(18自贡)10. 已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是A.以上原子的核外都有三个电子层B.Na+和Mg2+的核外电子数不相同C.Na与S的形成化合物的化学式为Na2SD.在化学反应中氯原子容易得到电子(18泰安)16、如图是五种粒子的结构示意图,下列说法正确的是A.①②属于同种元素B.③⑤化学性质相似C.②③④均表示离子D.②④形成的化合物是MgCl(18衡阳)3.下列是几种粒了的结构示意图,有关它们的叙述,你认为正确的是①②③④A.②表示的是阴离子B.①②③④表示的是四种不同元素C.③属于金属元素D.①③所表示的粒子化学性质相似(18烟台)8.关于下列五种粒子结构示意图的说法中正确的是()A.①④属于不同种元素B.②⑤属于金属元素C.④⑤均具有稳定结构D.①③两种粒子可以形成化合物MgCl2(18西宁)15.如图为A、B、C、D、E五种粒的结构示意图,请按要求填空:(1)A,B,C、D、E种粒子中,属于同种元素的是(填序号)。

4.(2019·鄂尔多斯)宏观辨识和微观探析是化学学科核心素养之一,对下列微观图示的理解,正确的是A.参加反应的和微粒个数之比为32B.该反应的基本反应类型为置换反应C.反应前后分子的种类和数目均发生了改变D.由和分别构成的物质中同种元素化合价相同【答案】C4.(2019·达州)图为某化学反应的微观示意图,图中“”表示硫原子,“”表示氧原子。
下列说法中错误的是()A.甲是SO2B.该反应属于化合反应C.参加反应的甲、乙两种物质的分子个数比为1:1D.化学反应前后,原子种类、数目均不变【答案】C【解析】由化学反应的微观示意图可知,各物质反应的微粒个数关系是:由上图可知,该反应是二氧化硫和氧气在一定条件下反应生成了三氧化硫,反应的化学方程式是:2SO2+O22SO3。
由上述可知,甲是SO2;该反应由两种物质生成了一种物质,属于化合反应;反应中,甲、乙物质的分子个数比为2:1;由微粒的变化可知,反应前后,原子的种类没有改变,原子的数目没有改变。
7. (2019·永州)甲烷燃烧的微观示意图如下,其中方框中需要补充的是( )答案D15. (2019·云南)下图是某汽车尾气净化装置中发生反应的微观示意图。
下列说法正确的是( )A.乙、丁属于氧化物B.该反应的化学方程式为222NO NH N H O +=+催化剂C.甲物质由一个氧原子和一个氮原子构成D.反应前后,原子种类、原子数目不变 【答案】D【解析】由反应的微观示意图可以看出,反应物是NH 3和NO 两种分子,生成物是N 2和H 2O 两种分子,化学方程式为3226456NO NH N H O =++催化剂;氧化物是由两种元素组成的,其中一种是氧元素的化合物,乙是NH 3,不是氧化物;化学方程式为3226456NO NH N H O =++催化剂;甲物质是由一氧化氮分子构成的;反应前后,原子种类、原子数目不变。
11.(2019·龙东) 如图某反应的微观示意图,不同的球代表不同元素的原子,下列说法正确的是( )A .化学反应前后,分子种类不变 B. 参加反应的和的微粒个数比是1:1C.反应涉及的物质中,只有属于氧化物D. 在化学变化中,分子可分,原子不可分【答案】D【解析】根据质量守恒定律,反应前后原子的种类和数目不变,但是分子的种类一定改变;根据图示,原子种类不变,所以可以看出在化学变化中,分子可分,原子不可分;根据图示,参加反应的数目为2个,参加反应的个数为1个,所以二者的个数比为2:1;氧化物中含有两种元素,其中一种元素为氧元素,在涉及的物质中,氧化物有、。

2019中考真题-微粒的结构示意图2019年化学中考试题分类汇编微粒的结构示意图一.选择题1.(2019•毕节市)某微粒的结构示意图如图所示,下列有关该微粒的说法错误的是()二.解答题1.(2019•益阳)人教版九年级化学上册教材图3﹣12部分原子的结构示意图如下:请回答:(1)氧元素与硫元素化学性质相似的原因是两种原子的最外层电子数相同;(2)写出11号和17号元素组成化合物的化学式 NaCl ;(3)同一周期(横行)的原子结构示意图具有共同的特点是电子层数相同(任写一点).2.(2019•株洲)如图中A 、B 、C 、D 是四种粒子的结构示意图.请回答下列问题:(1)A 中x= 2 ;A 粒子的化学式是 S 2 .﹣(2)由B 粒子的结构示意图可知,B 粒子的名称是铝原子.(3)以上四种结构示意图所表示的粒子中,表示离子的是 AD (填字母代号).3.(2019•荆州)某粒子的结构示意图为(1)n 的最大值为 8 .(其中n≠0),请回答下列问题.(2)若该粒子带两个单位的负电荷,则其对应的化学符号为 S 2 ;由+6价的该元素形成的常见酸的化﹣(3)若m ﹣n=10,则该粒子对应的常见金属元素有 Na 、Mg 、Al (写元素符号).4.(2019•乌鲁木齐)如图为六种常见元素的原子结构示意图,依据图中信息回答下列问题:(1)上述六种元素中属于金属元素的是钠、铝(填元素名称),己元素的化学性质与丙(填元素符号)元素相似.(2)在化学反应中,戊元素的原子容易失去(填“失去”或得到)电子形成阳离子,该元素的离子符号是 Al 3+(35.(2019•威海)21世纪的能源金属﹣锂(Li )金属锂,被誉“21世纪的能源金属”,当前手机中广泛使用的电池,主要是高能锂电池.请回答下列问题:(1)锂原子的原子结构示意图如图所示;锂原子在化学反应中容易(填“得到”或“失去”)失去电子变成离子,其离子符号为 Li + .(2)研究表明,锂的金属活动性比较活泼.写出金属锂与稀硫酸反应的化学方程式(3)金属锂除了制造锂电池外,还可以用于储存氢气,其原理是金属锂与氢气化合生成白色粉末状的氢化锂(LiH ),氢化锂与水反应生成氢氧化锂和氢气.写出上述过程中发生反应的化学方程式6.(2019•宿迁)如图A 是某金属元素形成微粒的结构示意图:该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B 是该反应的微观示意图.请根据以上信息回答下列问题:(1)该金属元素原子核外电子数= 12 ,图A 所示微粒的符号为 Mg 2+ ;写出一种与图A 所示具有相同电子层结构的阴离子的符号 O 2 .﹣(2)图B7.(2019•武汉)如图1为某元素的原子结构示意图,利用该元素组成的单质可测定空气中氧气的含量,实验装置如图2所示.(1)该元素原子的核电荷数为 15 ,在化学反应中该原子易得到电子;(2)图28.(2019•菏泽)有A 、B 、C 、D 四种元素,其原子结构示意图如图:(1)D 元素的名称为硫,D 元素与图中 B (填写字母序号)元素的化学性质相似,D 元素的离子符号为 S 2 .﹣(2)A 、B 、C 三种元素能形成一种化合物,其水溶液的pH > 7(填>、<、=)(3)A 、B 两种元素的原子以1:1B 元素化合价为﹣1 .9.(2019•重庆)学习化学后,我们学会了从微观角度认识物质.(1)已知碳原子和氧原子的结构示意图分别为:和,两种原子中相等的是 C (填序号).A .质子数B .电子数C .第一层电子数D .第二层电子数(2)保持一氧化碳化学性质的粒子名称是一氧化碳分子.(3)如图是一氧化碳与氧气反应的微观模型图,请在如图框中以图示的方式完成该化学反应的微观过程(图中●表示氧原子,○表示碳原子).10.(2019•娄底)据《自然》杂志报道,科学家最近研究出一种以锶(Sr )做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如右图所示,请回答:(1)锶原子的核电荷数为 38 .(2)锶原子核外电子层数为 5 .(3)锶原子最外层容易失电子.(填“得”或“失”)11.(2019•日照)钙元素是构成人体的重要组分,它使得骨髓和牙齿具有坚硬的结构支架.如图①是钙原子的结构示意图请回答下列问题:(1)①中x= 8(2)图中A 、B 、C 、D 四种粒子属于 3 种元素(3)C 元素与D (4)A 、B 、C 、D 四种粒子中与图①所示的钙元素化学性质相似的是 D (填“A”、“B”、“C”或“D”)12.(2019•重庆)氧化铝是红宝石、蓝宝石的主要成份,它由铝离子和氧离子构成.(1(2)3个铝离子的化学符号是 3Al 3+ .(3)氧离子的结构示意图为,一个氧离子中有 8 个质子. 13.(2019•攀枝花)如图为六种原子的结构示意图.请回答下列问题:(1)图中六种元素之间的最本质区别是质子数不同;(2)镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学式为 Mg 2+ ;氧化钠由钠离子和氧离子构成,氧化钠的化学式为 Na(3)从原子结构上分析,图中哪两组元素具有相似的化学性质(填元素符号) Cl 、I .(4)在上述碘的原子结构示意图中,x= 18 .14.(2019•十堰)M 元素的一种粒子结构示意图是.(1)若M 元素组成的单质是空气的成分之一,约占空气总体积的,则该单质是氧气.(2)元素的化学性质与其原子的最外层电子数年有关.若x=9,M 元素与下列② (填序号)的元素化学性质相似.(3)若x=7,M 元素的这种粒子可与上图中的一种粒子相互作用形成化合物,该化合物由离子构成.写15.(2019•邵阳)根据下列粒子结构示意图,回答问题.(1)图A 、B 、C 、D 四种粒子共表示三种元素.(2)D 原子在化学反应中易得(填“得”或“失”)电子.(3)由C 元素和D 元素组成化合物的化学式为 MgCl .。

微粒结构示意图12.(2019·泰安)我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。
氮和镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法正确的是()A.镓元素位于第三周期,属于金属元素B.镓原子核内有31个中子C.镓的相对原子质量是69.72gD.氮化镓的化学式为GaN解析A、电子层数决定周期数,镓原子核外有4层,位于第四周期,镓元素带有钅字旁,属于金属元素,故错误;B、左上角属于原子序数等于核内质子数等于核电荷数,所以镓的核内质子数为31,不是中子数,故错误;C、由元素周期表的信息可知,镓的相对原子质量为69.72,没有单位g,故错误;D、镓的最外层电子数是3,显+3价,氮最外层5个电子易得3个电子,显-3价,所以氮化镓表示GaN,故正确;故选:D。
8.(2019·滨州)如图是氧元素,钠元素在元素周期表中的相关信息及有关粒子的结构示意图,下列说法错误的是()A. 氧元素的原子序数为8B. 的结构示意图是⑥C. 氧元素与钠元素的本质区别是最外层电子数不同D. ①②两种元素可组成化学式为的化合物【答案】C【解析】A、氧元素的原子序数为8,该选项说法正确;B、Na+的结构示意图是⑥,该选项说法正确;C、氧元素与钠元素的本质区别是核内质子数不同,该选项说法不正确;D、①②两种元素可组成化学式为Na2O的化合物,这是因为氧化钠中钠元素化合价是+1,氧元素化合价是-2,根据化合物中元素化合价代数和为零可以书写出氧化钠的化学式,该选项说法正确。
5.(2019·菏泽)硒元素具有抗衰老、抑制癌细胞生长的功能,其原子结构示意图及在元素周期表中的信息如图,下列说法错误的是()A. 硒原子核内有34个质子B. 硒元素的相对原子质量是C. 硒元素位于元素周期表中第四周期D. 硒元素在某些化合物中可显价【答案】B【解析】A、根据元素周期表中的一格可知,左上角的数字为34,表示原子序数为34;根据原子中原子序数=核电荷数=质子数=核外电子数,则硒原子核内有34个质子,故选项说法正确。

中考化学专项复习之微粒结构示意图练习汇总(九)1.如图是某粒子的结构示意图,下列有关该粒子的叙述中,错误的是()A.该粒子原子核内有8个质子B.该粒子是阳离子C.该粒子属于非金属元素D.该粒子呈电中性2.中国天眼FAST是目前世界唯一的天眼,它用到的高性能碳化硅是一种新型材料。
如图是硅的粒子结构示意图,根据示意图信息,下列说法正确的是()A.该粒子属于阳离子B.该粒子的中子数是14C.该元素位于元素周期表第四周期D.在化学反应中该粒子不容易得失电子3.画图可以帮助我们归纳很多的化学知识,以下是四种微粒的结构示意图,有关说法正确的是()A.①和②化学性质相似B.它们表示四种元素C.表示稳定结构的是②、③和④D.表示阳离子的是②4.如图是几种微粒的结构示意图,下列说法错误的是()A.如图共包含4种元素的微粒B.③的符号为Cl﹣C.①与④具有相似的化学性质D.①、②元素的原子序数相差65.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
以下选项正确的是()A.图1中两个微粒属于同种元素B.图2中C和D的化学性质相似C.硅的相对原子质量是28.09gD.铝原子的中子数为146.下列粒子结构示意图中表示阴离子的是()A.B.C.D.7.我国祝融号火星车成功着陆火星。
火星车采用了钛合金等多种材料,钛元素在元素周期表中的信息如图所示。
下列说法正确的是()A.钛元素的相对原子质量为47.87gB.钛原子中子数为22C.钛元素是第四周期元素D.钛在化学反应中易形成阴离子8.钾元素对人体健康有着重要作用,被喻为“心脏搏动的汽油”。
如图为钾原子的结构示意图,下列说法不正确的是()A.x=8B.钾原子的质量等于19C.钾原子在化学反应中易失电子D.钾元素位于元素周期表第四周期9.我国的北斗导航卫星系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的原子结构示意图如图所示。
下列说法不正确的是()A.铷元素属于金属元素B.m的值是37,n的值是1C.铷的相对原子质量为85.47D.氯化铷的化学式为RbCl210.根据如图提供的信息进行判断,不正确的是()A.该粒子原子核内有11个质子B.该粒子易形成阴离子C.属于金属元素D.其相对原子质量为22.9911.下列是一些微观粒子结构示意图,其中属于同一周期的原子的是()A.①②B.②③④⑤C.②④⑤D.①⑤12.我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。

中考化学专项复习之微粒结构示意图练习汇总(十三)1.下列四种粒子的结构示意图中,说法正确的是()A.它们表示四种不同的元素B.②表示的元素在化合物中通常显+2价C.①③④表示的元素都是非金属元素,其化学性质相似D.①④表示的是阳离子2.下列粒子结构示意图中,表示阳离子的是()A.B.C.D.3.下列粒子的结构示意图中,表示阳离子的是()A.B.C.D.4.钪(Sc)是一种“工业的维生素”。
如图为钪在元素周期表中的相关信息及其原子结构示意图。
下列说法错误的是()A.钪原子核内质子数为21B.钪原子结构示意图中x=8C.钪原子质量为44.96D.钪原子在化学反应中易失去最外层的2个电子5.5G通信芯片是用氮化镓材料制成。
氮和镓(Ga)的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法正确的是()A.氮化镓的化学式为Ga3N3B.镓原子在化学反应中易得到电子C.镓元素的相对原子质量为69.72gD.镓原子的核外有四个电子层6.嫦娥五号探测器探测到月球矿物中含有丰富的氦﹣3,氦﹣3是可控核聚变的重要原料。
如图是氦﹣3原子的构成示意图,下列说法正确的是()A.含有2个中子B.电子数和质子数相等C.核电荷数为1D.相对原子质量为47.下列有关各微粒的说法中,正确的是()A.①属于阴离子B.②化学性质比较稳定C.③在化学反应中容易得到电子D.④属于金属元素8.如图是甲、乙两种粒子的结构示意图。
下列有关两种粒子的说法中,错误的是()A.甲粒子核内有17个质子B.甲粒子属于金属元素C.乙粒子易形成阳离子D.甲、乙两种粒子都不显电性9.元素周期表是学习和研究化学的重要工具。
图甲是元素周期表的部分内容,图乙是某些粒子的结构示意图。
下列说法不正确的是()A.X的核电荷数为17B.两图共涉及五种元素C.图乙中,a易得到2个电子形成阴离子D.图乙中,b和d是具有相对稳定结构的原子10.磷元素在元素周期表中的信息和磷原子的结构示意图如图所示。
中考化学专项复习之微粒结构示意图练习汇总(十四)1.如图是三种微粒的结构示意图,下列说法正确的是()A.①和②化学性质相似B.它们表示三种元素C.表示稳定结构的是②和③D.表示阳离子的是②2.有一个带电的离子含有X、Y、Z三种粒子(质子、电子、中子,未依照顺序排列),且X、Y、Z的粒子数目依序为N X、N Y、N Z。
已知X粒子的质量最小,关于此离子的说明,下列说法最合理的是()A.若为阳离子,且N Y>N X=N Z,则Z为质子B.若为阳离子,且N Y>N X=N Z,则Z为电子C.若为阴离子,且N X=N Y>N Z,则Z为质子D.若为阴离子,且N X>N Y=N Z,则Z为电子3.铷(Rb)原子钟被称作北斗卫星的“心脏”,如图为铷原子的结构示意图,下列说法不正确的是()A.铷原子核内的质子数为37B.铷原子在化学变化中容易失去1个电子C.铷原子的核外电子分5层排布D.氯化铷的化学式为RbCl24.地壳中含有丰富的铝元素。
结合如图分析,关于铝的说法正确的是()A.铝原子中的质子数为13B.铝元素属于非金属元素C.铝原子在化学反应中容易得到电子D.铝元素的相对原子质量为26.98g5.“结构决定性质”是化学的核心观念。
下列有关钠原子结构与性质的说法错误的是()A.钠原子次外层有8个电子B.一个钠原子变成钠离子失去1个电子C.钠离子的结构示意图为D.钠呈+1价与钠原子的最外层电子数有关6.“含氟牙膏”中的氟元素在周期表中的信息及氟原子的结构示意图如图,下列说法不正确的是()A.氟属于非金属元素B.氟的原子序数是9C.氟的相对原子质量是19.00D.氟原子失去1个电子变成氟离子7.缺锌会导致生长迟缓,如图为锌元素的信息,下列说法不正确的是()A.锌原子的质量为65.38g B.锌的原子序数为30C.锌原子核外有四层电子D.锌在反应中易失去电子8.如图是四种微粒的结构示意图,下列有关说法错误的是()A.③在化学反应中易失去电子B.②是镁离子的结构示意图C.当x=4时,①表示一种原子D.③④属于同种元素9.中国科学家研究发现,锶离子(Sr2+)能改善心肌损伤,锶离子的结构示意图可表示为()A.B.C.D.10.下列微粒结构示意图中,表示阳离子的是()A.B.C.D.11.“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,如图是镓元素(Ga)在元素周期表中的相关信息及原子结构示意图。
中考化学专项复习之微粒结构示意图练习汇总(六)1.微粒a在一定条件下可转化为微粒b,过程如图所示,变化前后保持不变的是()A.核电荷数B.化学性质C.核外电子数D.最外层电子数2.北斗卫星导航系统(简称BDS)是中国自行研制的全球卫星导航系统,铷(Rb)原子钟被称为北斗卫星的“心脏”,如图为铷的一种粒子结构示意图,下列说法正确的是()A.铷属于非金属元素B.该粒子核外有5个电子层C.该粒子表示铷离子D.氯化铷的化学式为RbCl23.天和核心舱的太阳能电池翼由砷化镓材料制成。
如图为镓原子和砷原子的结构示意图,下列说法不正确的是()A.x=3B.镓原子和砷原子核外都有四个电子层C.镓原子的质子数为31D.砷原子易失电子4.下列关于四种粒子的结构示意图的说法中正确的是()A.共有四种元素B.①④属于阳离子C.①③的化学性质相似D.②表示的是钠原子5.高镍电池的发展和应用大大提升了新能源汽车的普及率。
如图是镍元素的原子结构示意图和在元素周期表中的部分信息,有关说法不正确的是()A.镍原子的核电荷数为28B.x=2C.该元素属于金属元素D.镍原子易得到电子6.如图为某粒子的结构示意图,有关该粒子的说法中,错误的是()A.该粒子的原子核内有19个质子B.该粒子的核外有四个电子层C.该粒子最外层上有一个电子D.该粒子是带负电的阴离子7.图为镓在元素周期表中的相关信息及其原子的结构示意图。
下列说法错误的是()A.镓属于金属元素B.镓的离子符号为Ga+3C.镓原子易失去电子D.镓原子结构示意图中x=38.下列因果关系错误的是()A.因为分子构成不同,所以水和过氧化氢的化学性质不同B.因为质子数不同,所以碳原子和氮原子所属的元素种类不同C.因为碳原子排列方式不同,所以金刚石和石墨的性质完全不同D.因为最外层电子数不同,所以钠原子和钠离子的化学性质不同9.如图是锂元素在元素周期表中的信息和锂的原子结构示意图,下列说法错误的是()A.锂元素的相对原子质量是6.941B.x=2,锂原子核内中子数为3C.锂元素位于元素周期表中第二周期D.氧化锂的化学式为Li2O10.下列四种粒子的结构示意图中,表示金属元素离子的是()A.B.C.D.11.根据图示信息判断,下列有关说法不正确的是()A.结构示意图③表示阴离子B.当x的数值小于10时,①表示阳离子C.结构示意图②③所对应的元素属于不同种元素D.结构示意图③④所对应的元素位于元素周期表的同一周期12.根据图示分析,下列说法正确的是()A.镁属于非金属元素B.镁原子的质子数为12C.镁离子最外层电子数为2D.镁的相对原子质量为24.31g13.碘元素被称为“智力元素”,是人体必需的微量元素之一。
物质的构成(2018•无锡)如图是某粒子的结构示意图,关于该粒子的说法正确的是()A. 质子数为10B. 是一种阳离子C. 属于金属元素D. 已形成相对稳定的结构(2018•黑龙江龙东地区)图例为镁原子的结构示意图,下列所示粒子化学性质与其相似的是()A. B.C.D.(18兰州)11.根据氯离子的结构示意图,判断以下说法错误的是()A.氯离子核内有17 个质子B.氯离子核外冇3个电子层C.氯离子在化学反应中易得到电子D.氯离子的符号C l—(18邵阳)17.某原子得到两个电子后的结构示意图为,则x的值是A.14 B.16 C.18 D.20 (18雅安)3.右图为钠的原子结构示意图。
下列说法错误的是A.钠原子的质子数为11 B.n=8C.钠原子在反应中容易失电子D.钠元素位于第二周期(18临沂)9.右图为某粒子结构示意图,下列说法错误的是A.该元素属于非金属元素B.该元素位于元素周期表第三横行C.该粒子核外电子数是17D.在化学反应中,该元素原子易得电子形成Cl- (18广州)4.右图为某粒子的结构示意图,下列说法正确的是A.该粒子有12个质子B.该粒子有2个电子层C.该粒子属于非金属元素D.该粒子已达到相对稳定结构(18黄石)6. 小明从下列某粒于结构示意图中,获取了下列信息,其中错误的是A.表示阴离子B.核电荷数为12C.有两个电子层D. 表示相对稳定结构(18河南)8.硅是信息技术的关键材料。
右图为硅的原子结构示意图,下列说法正确的是【】A.硅属于稀有气体元素 B.图中n的值为8C.硅的相对原子质量为14D.硅元素位于第三周期(18铜仁)13.(3 分)某原子的原子结构示意图如: 写出它的元素符号,,结构示意图判断该原子在化学反应中电子,写出与金属钠反应形成化合物的化学式。
(18武汉)28.(4分)在通常状况下,硫是一种黄色粉末,下图是硫元素的某种粒子的结构示意图:(1)硫原子的核内质子数为_________。
专题十微观示意图、归纳与推理、化学性质与物理性质【考点一】微观示意图1.(2019苏州中考)如图是某反应的微观示意图。
下列说法不正确的是()A.反应后硫元素化合价升高B.生成物均为氧化物C.反应后分子总数减少D.参加反应的甲、乙分子个数比为1:2【答案】D【解答】解:由微观反应示意图可知,该反应是由硫化氢与氧气在点燃的条件下反应生成二氧化硫和水,方程式为:2H2S+3O22SO2+2H2O。
A.由方程式和化合价原则可知,硫元素由﹣2价变为+4价,反应后硫元素化合价升高,故正确;B.生成物是二氧化硫和水,均为氧化物,故正确;C.由化学方程式可知,每5个分子变化成了4个分子,反应后分子总数减少,故正确;D.由化学方程式可知,参加反应的甲、乙分子个数比为2:3,故不正确。
故选:D。
2.(2019宿迁中考)如图是某汽车尾气净化装置中发生反应的微观示意图。
下列说法正确的是()A.该反应中,Z是由Y分解生成的B.化学反应前后,氢原子数目减少C.参加反应的X与生成的Z的质量比为15:14D.一个Y分子和一个W分子中均含有10个电子【答案】D【解答】解:由反应的微观示意图可以看出,反应物是NH3和NO两种分子,生成物是N2和H2O两种分子,所以化学反应方程式为:6NO+4NH35N2+6H2O;A、由微粒的构成可知,构成Z分子的原子在X、Y中都能有含有,不能确定Z是由Y分解生成的,故错误;B、化学反应前后原子的种类及数目不变,氢原子数目也不变,故错误;C、由方程式可知,参加反应的X与生成的Z的质量比为:[6(14+16)]:(28×5)=9:7,故错误;D、由图示可知:Y是NH3,一个Y分子中有7+(1×3)=10,W是H2O,一个W分子中有(1×2)+8=10,故正确。
故选:D。
3.(2019扬州中考)某反应前后分子变化的微观示意图如图。
下列说法正确的是()A.反应物中没有单质B.图中共表示3种物质C.反应后元素种类增多D.反应前后原子个数不变【答案】D【解答】解:A、由同种原子构成的分子为单质的分子,反应物中有一种单质,故选项说法错误。
全国2019年中考化学试题分单元汇编
微粒结构示意图
12.(2019年·泰安)我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。
氮和镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法正确的是()
A.镓元素位于第三周期,属于金属元素
B.镓原子核内有31个中子
C.镓的相对原子质量是69.72g
D.氮化镓的化学式为GaN
解析A、电子层数决定周期数,镓原子核外有4层,位于第四周期,镓元素带有钅字旁,属于金属元素,故错误;
B、左上角属于原子序数等于核内质子数等于核电荷数,所以镓的核内质子数为31,不是中子数,故错误;
C、由元素周期表的信息可知,镓的相对原子质量为69.72,没有单位g,故错误;
D、镓的最外层电子数是3,显+3价,氮最外层5个电子易得3个电子,显-3价,所以氮化镓表示GaN,故正确;故选:D。
8.(2019年·滨州)如图是氧元素,钠元素在元素周期表中的相关信息及有关粒子的结构示意图,下列说法错误的是()
A. 氧元素的原子序数为8
B. 的结构示意图是⑥
C. 氧元素与钠元素的本质区别是最外层电子数不同
D. ①②两种元素可组成化学式为的化合物
【答案】C
【解析】A、氧元素的原子序数为8,该选项说法正确;
B、Na+的结构示意图是⑥,该选项说法正确;
C、氧元素与钠元素的本质区别是核内质子数不同,该选项说法不正确;
D、①②两种元素可组成化学式为Na2O的化合物,这是因为氧化钠中钠元素化合价是+1,氧元素化合价是-2,根据化合物中元素化合价代数和为零可以书写出氧化钠的化学式,该选项说法正确。
5.(2019年·菏泽)硒元素具有抗衰老、抑制癌细胞生长的
功能,其原子结构示意图及在元素周期表中的信息如图,下列
说法错误的是()
A. 硒原子核内有34个质子
B. 硒元素的相对原子质量是
C. 硒元素位于元素周期表中第四周期
D. 硒元素在某些化合物中可显价
【答案】B
【解析】A、根据元素周期表中的一格可知,左上角的数字为34,表示原子序数为34;
根据原子中原子序数=核电荷数=质子数=核外电子数,则硒原子核内有34个质子,故选项说法正确。
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原
子质量为78.96,相对原子质量单位是“1”,不是“克”,故选项说法错误。
C、周期数=原子核外电子层数,硒元素的原子核外有4个电子层,则在元素周期表中,
硒元素位于第4周期,故选项说法正确。
D、硒原子的最外层电子数为6,在化学反应中易得到2个电子而形成带2个单位负电荷
的阴离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为-2价,故选项说法正确。
故选:B。
7.(2019年•烟台)如图是四种粒子的结构示意图。
下列说法错误的是()
A.①②③④均达到稳定结构B.④表示Cl﹣
C.①②③属于同种元素D.①③可形成化合物Na2O
解析①②③④最外层电子都为8,都具有相对稳定结构;④中质子数=17<核外电子数=18,属于阴离子,离子符号为Cl﹣;决定元素种类的是核内质子数,①②③属于三种不同的元素;①表示的是氧离子,③表示钠离子,①③可形成化合物Na2O。
答案C
23.(2019年·临沂)如图是A、B元素的离子结构示意图。
请回答:
(1)其中属于阴离子的是(填离子符号)Cl﹣,该元素原子的核外电子数为17 。
(2)A元素与地壳中含量最多的非金属元素组成化合物的化学式为Al2O3。
解析(1)由离子的结构示意图可知,在B中,质子数是17<电子数18,属于阴离子,离子符号为:Cl﹣,该元素原子的核外电子数为17。
(2)A元素是铝元素,化合价为+3价,地壳中含量最多的非金属元素是氧元素,化合价为﹣2价,二者组成的化合物为氧化铝,化学式为:Al2O3。
答案(1)Cl﹣,17(2)Al2O3
10、(2019年·枣庄)“宏观辨识与微观探析”’是化学学科核心素养
之一,化学学习要让学生既能够“见微知著”,也能够“见著知微”。
金属钠在氯气中燃烧生成氯化钠,右图为氯化钠形成的示意图。
根据所给信息,请回答:(1)钠原子的核外电子层数是,在化学反应中易(填“得到”或“失去”)电子。
(2)元素的化学性质主要是由原子的决定的。
(3)化学反应前后,氯元素的化合价为。
(4)构成氯化钠的离子是(填微粒符号)。
【答案】(1)3 失去(2)最外层电子数
(3)0 -1 (4)Na+、 Cl-
解析:(1)从钠原子的结构示意图可以得到,共有3个电子层,最外层上有一个电子,在化学反应中要达到8电子稳定结构,很容易失去一个电子,使次外层变为最外层达8电子稳定结构。
(2)最外层上的电子数决定着电子的得失,一般来说最外层电子数小于4易失去,使次外层变为最外层达8电子稳定结构,最外层电子数大于4较易得到电子达到最外层8电子稳定结构,因此说元素的化学性质主要是由最外层上的电子数决定。
(3)反应前氯原子没有电子得失,氯元素的化合价为零,反应后氯原子得到一个电子成为氯离子,所以氯元素的化合价为负一价。
(4)氯化钠是由离子构成的物质,离子符号为Na+和 Cl。
25.(2019年·青岛)联合国将 2019年年列为“国际化学元素周期表年”。
锶、镁元素在元素周期表中的部分信息及原子结构示意图如下,请回答下列问题。
(1)镁原子的核电荷数为_____,镁元素的相对原子质量为_____。
(2)锶原子在化学反应中容易_____(选填“得”或“失”)电子,锶的氧化物的化学式为____。
(3)元素的性质与其原子结构有密切关系。
原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,原子核对最外层电子的吸引力越小。
由此推测,锶的金属活动性比镁的金属活动性_____(选填“强”或“弱”)。
【答案】 (1) 12; 24.31 (2) 失;SrO (3) 强
【解析】(1)镁原子的原子序数为12,故核电荷数为12,镁元素的相对原子质量为24.31。
(2)锶原子最外层电子数为2,在化学反应中容易失电子,锶的氧化物的化学式为SrO。
(3)元素的性质与其原子结构有密切关系。
原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,原子核对最外层电子的吸引力越小,锶的金属活动性比镁的金属活动性强。
13.(2019年·日照)元素周期表是学习和研究化学的重要丁具,下表是元素周期表的一部分。
回答下列问题:
(1)若锂元素在周期表中的位置可表示为“第2周期I A族”,则地壳中含量最高的元素在周期表中的位置可表示为____________。
(2)氟元素和钙元素是帮助构造人体骨骼和牙齿的重要元素,二者组成的化合物的化学式为____。
(3)位于第4周期ⅣA族元素的单质是最早使用的半导体材料,该元素的名称是______,其原子核内有____个质子,属于______(填“金属”或“非金属”)元素。
(4)某粒子的结构示意图如图所示,若该粒子为某稀有气体元素的原子,则该元素的单质的相对分子质量为___(取整数);若该粒子为+3价阳离子,则x=____。
【答案】 (1) 第2周期ⅥA族 (2) CaF2 (3) 锗; 32;金属 (4) 20;13
【解析】(1)锂元素在周期表中的位置可表示为“第2周期I A族”,则地壳中含量最高的元素是O,在周期表中的位置可表示为第2周期ⅥA族;
(2)氟元素显-1价,钙元素显+2价,故二者组成的化合物的化学式为CaF2;
(3)位于第4周期ⅣA族元素的单质是最早使用的半导体材料,该元素的名称是锗,由元素周期表信息示意图可知,锗是第32号元素,又原子中原子序数=质子数,故其原子核内有32个质子,锗带“钅”字旁,属于金属元素;
(4) 由粒子的结构示意图可知,若该粒子为某稀有气体元素的原子,则核外电子数=质子数=10,又在原子中质子数=原子序数,故该元素为第10号元素氖,其相对分子质量为20;若该粒子为+3价阳离子,则x=2+8+3=13。