可溶性氯化物中氯含量的测定(莫尔法)经典教学提纲
- 格式:doc
- 大小:20.00 KB
- 文档页数:4

实验17 氯化物中氯含量的测定(莫尔法)
氯化物中氯含量的测定(莫尔法)是用于测定氯化物中氯含量的有效方法。
它可以用于
碱式氯化物和酸式氯化物的测定,最常用于测定氯代烃中的氯含量。
它的原理是通过测定
氯含量和非氯含量的比例来确定氯含量,即将氯含量和非氯含量用莫尔法进行关联,建立
一个比例关系式来表达氯含量。
莫尔法测定氯化物中氯含量的程序大致如下:首先,取样0.1g,用50ml甲醇-水混合液稀释;其次,加入不同浓度的碘指示剂和铅的离子搭桥剂;接着,加一定浓度的碱,引
发氯化物的氯化反应,并产生相应的比例;最后,将采集到的反应液用计量管定量分装,
并用光度计测定吸光度,绘制莫尔法曲线,可以直观地得出氯含量数据。
莫尔法测定氯化物中氯含量的准确度得益于其独特的程序和技术,比如内标式校正法,确保氢氧化物离子的检测准确度,并能够在测定时反映样品中离子的稳定性。
仪器的精准
度和准确度也是决定氯含量测定的结果的重要因素,因此,如果使用不同的仪器,在莫尔
法测定之前,要校准检测仪器,使仪器能够按照标准要求进行准确的测定。
莫尔法测定氯化物中的氯含量,是根据样品的反应液的吸光度,通过构建莫尔法曲线,计算出样品中氯含量的测定方法。
它是一种简单、有效、准确的测定氯含量的方法,在实
际应用中受到广泛重视,经常用于氯代烃中氯含量的测定。


氯化物中氯含量的测定实验报告莫
尔法
1.实验目的:本实验旨在使用莫尔法测定氯化物中氯含量。
2.试剂和材料: (1)硝酸银溶液:将5克硝酸银溶于100毫升0.1M硝酸中; (2)柠檬酸溶液:将5克柠檬酸溶于100毫升1M柠檬酸中; (3)硝酸氢钾溶液:将18克硝酸氢钾溶于100毫升水中; (4)标准氯化钠溶液:将0.2
克氯化钠溶于100毫升水中; (5)反应混合液:将上述4
种溶液混合,分别添加20毫升、50毫升、80毫升、120毫升; (6)待测样品:将待测样品溶于100毫升水中。
3.实验原理:氯化物与银离子发生反应,形成一定量的AgCl沉淀,从而可以确定氯化物中氯含量。
4.实验步骤:(1)将反应混合液和待测样品各取10毫升分别滴入2个分支比色皿中;(2)将硝酸溶液滴入分支比色皿中,搅拌均匀;(3)将柠檬酸溶液滴入分支比色皿中,搅拌均匀;(4)将硝酸氢钾溶液滴入分支比色皿中,搅拌均匀;(5)将标准氯化钠溶液滴入分支比色皿中,搅拌均匀;(6)将比色皿放置于热水浴中,煮沸15分钟;(7)冷却后,用1000毫升水冲洗比色皿,
然后放置于光箱中;(8)比较反应混合液和待测样品的比色,据此计算出氯含量。
5.实验结果:根据实验测得,待测样品中氯含量为XXX ppm。

可溶性氯化物中氯含量的测定实验可溶性氯化物中氯含量的测定常采用莫尔法,此法是以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
其实验步骤为:一、配制0.100mol·L-1AgNO3溶液准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO===Ag2CrO4↓(砖红色)]。
实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。
实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:(1)NaCl固体使用前,要将其置于坩埚中加热,并用不断搅拌,以除掉氯化钠晶体中的水。
(2)AgNO3溶液需要标定的主要原因是。
(3)指示剂CrO在溶液中存在下列的平衡:2H++2CrO2HCrO Cr2O+H2O,由此判断该滴定适宜的pH值范围可能是。
(填代号)A.1——6.5B.6.5——10.5C.10.5——14(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO)最大不能超过mol·L-1,因此,实验中对指示剂的浓度有较高的要求。
(已知:K sp(AgCl)=1.8×10-10,K sp(Ag2CrO4)=1.8×10-12)(5)CrO的黄色对滴定终点的判断没有影响的原因是。

氯化物中氯含量的测定(莫尔法)莫尔法是一种测定氯化物中氯含量的方法,其步骤简单,操作方便,适用于大部分氯化物。
下面将详细介绍莫尔法的测定步骤及注意事项。
一、所需试剂和仪器:氢氧化银试液:将2.142g 次氯酸钾溶解于去离子水1000ml中,称取10 ml 滴加于去离子水中,以饱和为度加入氯化银,并振荡至误差小于1%。
过滤,保管于棕色玻璃分液漏斗中,遮光保存,使用时再加去离子水至饱和。
用时每0.025ml 饱和氢氧化银试液相当于1毫克氯离子量。
氯化铂及其钠盐:将氯铂酸钠转化为氯铂酸铂,并将其还原,得到氯化铂及其钠盐。
二、操作步骤:1.称取0.2~0.3g样品(精确称量),放入250ml锥形瓶中。
2.加入75ml去离子水,振荡至样品溶解,再加入2~3滴甲醛。
3.将棕色分液漏斗中的氢氧化银试液振荡,使其均匀混合,然后将0.025ml的饱和氢氧化银试液加入样品中,振荡,使反应均匀进行。
4.反应完成后,第一次滴加氯化铂钠盐溶液,每滴多量到10ml毫升底线附近,然后每滴2~3滴,振荡均匀,使样品中的氯化银溶解成氯银离子,氯离子与氯铱酸钠在氯化铂钠的还原作用下生成铂和氯离子,铂沉积于铁棒上,样品中的氯离子浓度随之下降。
5.当样品中氯离子几乎消耗完后,反应混合物中的铂粒聚集形成灰色沉淀,停止反应。
6.用带苯酚酚红指示剂的1mol/L NaOH滴定底物中未消耗的氢氧化银试液,直至酚红变色为止,计算氯离子含量。
用下式计算样品中氯离子含量:%Cl-=V1x0.0025x1.0084x1000/m其中:V1为氢氧化银试液的体积,0.0025为每滴饱和氢氧化银试液相当于1毫克氯离子量,1.0084为碳-氢氧化银试液的分子量,m为样品质量。
三、注意事项:1.样品的重量要精确称量,以确保结果的准确性。
2.仪器仪表要保持干燥,不能受到潮湿的影响。
3.振荡均匀,使反应混合物均匀分布。
4.滴定时不能滴过头,以免影响结果的准确性。
5.使用过程中应避免阳光直射,保持暗处。

实验十二氯化物中氯含量的测定(莫尔法)重点:掌握莫尔法测定氯化物的基本原理及莫尔法测定的反应条件难点:AgN03标准溶液的配制和标定;滴定终点的控制;氯化物中氯含量的计算。
一、实验目的1、掌握莫尔法测定氯化物的基本原理2、掌握莫尔法测定的反应条件二、实验原理莫尔法是在中性或弱酸性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液直接滴定待测试液中的C1-。
主要反应如下:由于AgC1的溶解度小于Ag2CrO4,所以当AgC1定量沉淀后,微过量的Ag+即与CrO42-形成砖红色的Ag2CrO4沉淀,它与白色的AgC1沉淀一起,使溶液略带橙红色即为终点。
三、仪器和试剂AgNO3分析纯;NaC1优级纯,使用前在高温炉中于500-600℃下干燥2-3h,贮于干燥器内备用;K2CrO4溶液50g·L-1。
四、实验内容1、配制0.10mol·L-1AgN03溶液称取AgN03晶体8.5 g于小烧杯中,用少量水溶解后,转入棕色试剂瓶中,稀释至500mL左右,摇匀置于暗处、备用。
2、0.10mol·L-1AgN03溶液浓度的标定,准确称取0.55—0.60g基准试剂NaCl于小烧杯中,用水溶解完全后,定量转移到100 mL容量瓶中,稀释至刻度,摇匀。
用移液管移取20.00 mL此溶液置于250mL锥形瓶中,加20 mL水,1 mL 50g·L-1K2Cr04溶液,在不断摇动下,用AgN03溶液滴定至溶液微呈橙红色即为终点。
平行做三份,计算AgN03溶液的准确浓度。
3、试样中NaCI含量的测定准确称取含氯试样(含氯质量分数约为60%),1.6g左右于小烧杯中,加水溶解后,定量地转入250mL容量瓶中,稀释至刻度,摇匀。
准确移取25.00 mL此试液三份,分别置于250 mL锥形瓶中,加水20 mL,50g·L-1K2Cr04溶液1 mL,在不断摇动下,用AgN03标准溶液滴定至溶液呈橙红色即为终点。
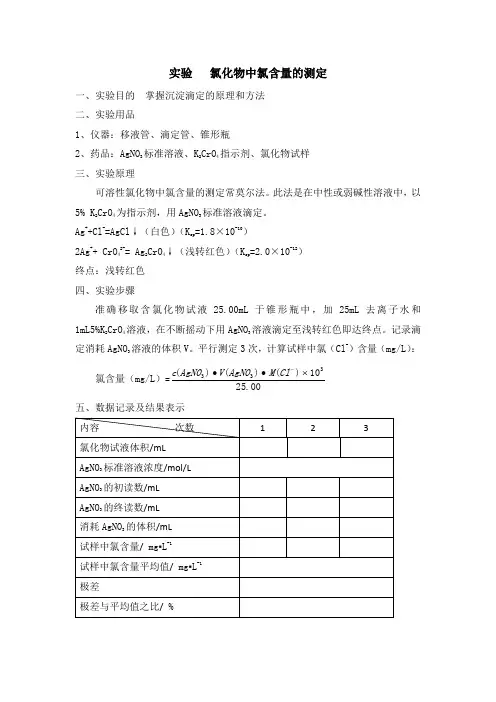
实验氯化物中氯含量的测定
一、实验目的 掌握沉淀滴定的原理和方法 二、实验用品
1、仪器:移液管、滴定管、锥形瓶
2、药品:AgNO 3标准溶液、K 2CrO 4指示剂、氯化物试样 三、实验原理
可溶性氯化物中氯含量的测定常莫尔法。
此法是在中性或弱碱性溶液中,以5% K 2CrO 4为指示剂,用AgNO 3标准溶液滴定。
Ag ++Cl -=AgCl ↓(白色)(K sp =1.8×10-10)
2Ag ++ CrO 42-= Ag 2CrO 4↓(浅转红色)(K sp =2.0×10-12) 终点:浅转红色 四、实验步骤
准确移取含氯化物试液25.00mL 于锥形瓶中,加25mL 去离子水和1mL5%K 2CrO 4溶液,在不断摇动下用AgNO 3溶液滴定至浅转红色即达终点。
记录滴定消耗AgNO 3溶液的体积V 。
平行测定3次,计算试样中氯(Cl -)含量(mg/L ):
氯含量(mg/L )=
00
.2510)()()(3
33⨯∙∙-Cl M AgNO V AgNO c
五、数据记录及结果表示
计算过程:
六、问题思考
1、AgNO
3
标准溶液用何种滴定管?
2、K
2CrO
4
指示剂的浓度过大或过小对测定结果有何影响?。

化学与制药工程学院工业分析专业实验实验题目:莫尔法测定氯化物中氯的含量班级:应化0704 学号:07220418 姓名:实验日期:实验题目:莫尔法测定氯化物中氯的含量一、摘要用NaCl基准试剂标定已配制的AgNO3标准溶液,然后用标定好的AgNO3溶液来滴定氯化钠试样,通过控制溶液的PH环境,以K2CrO4为指示剂,最终测得样品中氯的含量为为42.76%。
二、实验目的1.学习AgNO3标准溶液的配制和标定。
2.掌握用莫尔法进行沉淀滴定的原理、方法和实验操作。
三、实验原理某些可溶性氯化物中氯含量的测定通常采用莫尔法。
此法是在中性或弱碱性溶液中,以K2CrO4为指示剂,以AgNO3标准溶液进行滴定,由于AgCl沉淀的溶解度比Ag2CrO4小,因此溶液中首先析出AgCl沉淀。
当AgCl定量沉淀后,过量一滴AgNO3溶液,既与生成砖红色沉淀,指示达到终点。
主要反应为:Ag+ +Cl-= AgCl↓(白色),Ksp=2.0×10-12 , 2Ag++CrO42- = Ag2CrO4↓(砖红色) Ksp=1.8×10-10实验结果会受到诸多因素的影响:首先,指示剂一般以5×10-3mol/L 为宜,凡是能与Ag+生成难溶性化合物或络合物的阴离子都干扰测定,大量Cu2+、Ni2+、Co2+等有色离子将影响终点观察,Al3+、Fe3+、Bi3+、Sn4+等高价金属离子在中性或弱碱性溶液中易水解产生沉淀。
四、主要试剂NaCl基准试剂, AgNO3标准溶液,50g/L K2CrO4溶液五、实验内容1.溶液的标定:准确称取0.2-0.3gNaCl 基准试剂于小烧杯中,用蒸馏水溶解后转入100mL 容量瓶中,稀释至刻度,摇匀。
移取25.00mLNaCl 溶液于250mL 容量瓶中,加入25mL 水,滴加1mL K 2CrO 4溶液,不断摇动下用AgNO 3溶液滴定至砖红色,即为终点。
平行测定三次,根据消耗的AgNO 3溶液的体积和NaCl 的质量,计算AgNO 3溶液的浓度。

实验十(A)、莫尔(Mohr)法测氯化物中氯的含量
一、 目的要求:
1. 学习掌握AgNO 3、标准溶液的配制和标定;
2. 掌握莫尔(Mohr)法进行沉淀滴定的原理和方法。
二、 实验原理:
以 K 2CrO 4 为指示剂的银量法。
在中性或弱碱性(pH 6.5~10.5)介质中以AgNO 3标准溶液进行滴定。
Ag + + Cl - = AgCl ↓(白色) Ksp=1.8×10-10 2Ag +(过量) + CrO 42- = Ag 2CrO 4↓(砖红色) Ksp=2.0×10-12 指示剂用量不是1-2滴而是1mL 其用量对测定有影响, 必须定量加入. 为什么?
三、 实验内容:
1. 0.05mol·L -1 AgNO 3标准溶液的配制和标定.
2. 粗盐中Cl %的测定
AgNO 3滴定 终点(砖红色)
四、 结果处理:
标定 C AgNO3 mol.L -1
测定 Cl%
[M Nacl =58.44 g / mol ,M Cl =35.45 g / mol]
五、思考题: P217: 1、2 基准NaCl, 0.50—0.70g 定容至 250.0mL 移取 25.00mL 水25mL K 2CrO 4 1mL AgNO 3标液滴定 终点(淡红色) 溶解 粗盐 0.7---0.9g 溶解 定容至
250.0mL
移取 25.00mL ① 水25mL ② K 2CrO 41mL。

莫尔法测定可溶性氯化物中氯含量实验报告实验报告:莫尔法测定可溶性氯化物中氯含量一、实验目的本实验旨在掌握莫尔法测定可溶性氯化物中氯含量的原理和方法,了解实验过程中的影响因素和注意事项,提高实验操作技能和分析能力。
二、实验原理莫尔法是一种常用的沉淀滴定法,用于测定可溶性氯化物中氯含量。
该方法利用银离子与氯离子反应生成氯化银沉淀,通过滴定消耗的银离子量,计算出可溶性氯化物中的氯含量。
实验过程中需加入过量硝酸银溶液,以促使反应完全。
同时,为消除干扰离子(如硫酸根离子、亚硝酸根离子等)的影响,需加入掩蔽剂。
本实验采用铬酸钾作为掩蔽剂。
三、实验步骤1.准备试剂和仪器:硝酸银溶液(0.1mol/L)、铬酸钾溶液(50g/L)、氯化钠标准溶液(0.1mol/L)、酚酞指示剂(1g/L)、滴定管、容量瓶、三角瓶、电子天平等。
2.样品制备:称取适量可溶性氯化物样品于容量瓶中,加入适量蒸馏水溶解,摇匀。
3.滴定操作:将样品溶液移入三角瓶中,加入适量铬酸钾溶液和酚酞指示剂。
用硝酸银溶液滴定至终点,记录消耗的硝酸银溶液体积。
同时做空白实验,以消除试剂误差。
4.数据记录与处理:记录实验数据,包括样品质量、空白实验消耗硝酸银溶液体积、样品实验消耗硝酸银溶液体积等。
根据数据计算可溶性氯化物中氯含量。
四、实验结果与分析1.实验数据记录2.数据处理及分析根据实验数据,可得到可溶性氯化物中氯含量的平均值为:(69.5%+70.5%+68.5%)/3=69.5%通过分析实验数据,我们可以得出以下结论:(1)莫尔法测定可溶性氯化物中氯含量具有较高的准确性,适用于实际样品的分析。
(2)实验过程中需严格控制试剂用量和操作步骤,确保实验结果的可靠性。
(3)本实验采用铬酸钾作为掩蔽剂,有效消除了干扰离子对实验结果的影响。
(4)通过对不同样品的测定,可以发现不同来源的可溶性氯化物中氯含量存在一定差异,这可能与样品的地域、生产工艺等因素有关。
五、结论本实验通过莫尔法测定了可溶性氯化物中的氯含量,得到了较为准确的结果。

氯化物中氯含量的测定(莫尔法)一、目的1、学习AgNO3标准溶液的配制和标定立法。
2、掌握沉淀滴定法中以K2C r O4为指示剂测定氯离子的方法和原理。
二、原理某些可溶性氯化物中氯含量的测定常采用莫尔法。
此方法是在中性或弱碱性溶液中,以K2C r O4为指示剂,用AgNO3标准溶液进行滴定。
由于AgCl的溶解度比Ag2C r O4的小,因此溶液中首先析出AgCl沉淀,当AgCl定量沉淀后,过量的AgNO3溶液即与C r O42-离子生成砖红色AgC r O4沉淀,指示终点的到达。
反应式如下:Ag+ + Cl- = AgCl (白色) Ksp = 1.8 x l0-102Ag+ + CrO42- = Ag2CrO4(砖红色) Ksp= 2.0 x 10-12滴定必须在中性或弱碱性溶液中进行,最适宜的pH范围为6.5—10.5(如有NH4+离子在,pH应保持在6.5—7.2之间)。
酸度过高不产生Ag2C r O4沉淀,过低则形成Ag2O沉淀。
指示剂的用量不当对滴定终点的准确判断有影响,一般用量以5×10-3mol/L 为宜。
凡是能与Ag+离子生成难溶化合物或络合物的阴离子都干扰测定,如PO43-、AsO43-、SO32-、S2-、CO32-及C2O42-等离子,其中S2-离子可成H2S,经加热煮沸而除去,SO32-,离子可经氧化成SO42-而不发生干扰。
大量Cu2+,Ni2+,C O2+等有色离子将影响终点观察。
凡是能与CrO42-离子生成难溶化合物的阳离也干扰测定,如Ba2+、Pb2+离子与CrO42-离子分别生成BaCrO4和PbCrO4沉淀,但Ba2+离子的干扰可借加入过量Na2SO4而消除。
Al3+、Fe3+、Bi3+、Zr4+等高价金属离子,在中性或弱碱性溶液中易水解产生沉淀,也不应存在。
若存在,改用佛尔哈德法测定氯含量.三、试剂AgNO3(O.P或A.R.),NaCl(基准试剂),5%K2CrO4四、步骤1、0.05mol/L AgNO3溶液的配制:在台秤上称取配制500ml0.05mol/L AgNO3溶液所需固体AgNO3溶于500ml不含Cl-离子的水中,将溶液转入棕色细口瓶中,置暗处保存,以减缓因见光而分解的作用。
预习与思考:1、复习理论书中沉淀溶解平衡与沉淀滴定法的相关知识,复习滴定管、容量瓶、移液管、分析天平的使用方法。
2、思考并回答下列问题①AgNO3标准溶液应贮于棕色瓶中并置于暗处,为什么?如何标定AgNO3标液的浓度?②利用莫尔法时为什么溶液的 pH需控制在6.5~10.5?实验中如何控制 pH在这个范围?③空白实验有何意义?④莫尔法中,以K2CrO4作为指示剂时,其浓度太大或太小对滴定结果有何影响?一、实验目的1、掌握莫尔法的原理和实验操作。
2、进一步学习滴定管、容量瓶、移液管、分析天平的使用方法。
二、实验原理莫尔法是测定可溶性氯化物中氯含量常用的方法。
此法是在中性或弱碱性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
由于AgCl沉淀的溶解度比 AgCrO4小,溶液中首先析出白色AgCl沉淀。
当氯离子定量转化为AgCl沉淀后,过量的AgNO3溶液即与CrO42-生成砖红色 AgCrO4沉淀,指示终点到达。
主要反应为:Ag+ + Cl- = AgCl (白色) Kθsp = 1.8×l0-102Ag+ + CrO42- = Ag2CrO4(砖红色) Kθsp= 2.0×10-12滴定必须在中性或弱碱性溶液中进行,最适宜pH范围在6.5-10.5之间。
如果有铵盐存在,溶液的pH范围在6.5-7.2之间。
指示剂的用量对滴定有影响,一般K2CrO4浓度以5 ×10-3 mol/L 为宜。
凡是能与Ag+生成难溶化合物或络合物的阴离子,如PO43-、AsO43-、AsO33-、S2-、SO32- 、CO32-、C2O42-等均干扰测定,其中H2S可加热煮沸除去,SO32-可用氧化成SO42-的方法消除干扰。
大量Cu2+、Ni2+、Co2+等有色离子影响终点观察。
凡能与指示剂 K2CrO4生成难溶化合物的阳离子也干扰测定,如Ba2+、Pb2+等。
Ba2+的干扰可加过量Na2SO4 消除。
试剂级氯化钠中氯含量的测定(莫尔法)(3学时)一、目的要求1.学习AgNO3标准溶液的配制和标定2.掌握沉淀滴定法中以K2Cr2O7为指示剂测定氯离子原理和方法二、实验原理用K2Cr2O7作为指示剂的银量法称为莫尔法。
利用莫尔法可以测定一些可溶性氯化物中氯含量。
在含有Cl-的中性溶液中,以K2Cr2O7为指示剂,用AgNO3标准溶液进行滴定,由于AgCl 的溶解度小于Ag2CrO4溶解度,根据分步沉淀原理,溶液中首先析出白色AgCl沉淀。
当AgCl 完全沉淀后,过量一滴AgNO3溶液与K2Cr2O7生成砖红色的Ag2CrO4沉淀指示终点。
滴定必须在中性或弱碱性溶液中进行,最适宜的酸度范围为pH=6.5~10.5。
酸度过高,不利于产生Ag2CrO4沉淀;酸度过低,容易生成Ag2O沉淀。
指示剂用量对滴定有影响,一般用量以5×10-5mol⋅L-1为宜。
凡能与Ag+和Cr2O72-生成微溶化合物或配合物的离子,都干扰测定,应注意消除干扰。
一些高氧化态离子在中性或弱酸性介质中发生水解,故也应不存在。
三、仪器与试剂1.仪器分析天平,50mL酸式滴定管,常用玻璃仪器若干2.试剂NaCl(基准试剂),AgNO3(固体),K2Cr2O7(0.5%),NaCl(试样)四、参考步骤1.0.05mol⋅L-1AgNO3溶液的配制在台秤上称取4.4g AgNO3溶解于500mL不含Cl-离子的去离子水中,将溶液转入细口棕色试剂瓶中,置于暗处,避光保存。
2.NaCl基准溶液的配制在分析天平上准确的称取干燥的NaCl基准物0.35~0.5g(精确0.1mg)于小烧杯中,加去离子水溶解后,定量转移到150mL容量瓶中,稀释至刻度并摇均匀。
3.0.05mol⋅L-1AgNO3溶液的标定移取25.00mLNaCl基准溶液于250mL锥形瓶中,加入25mL去离子水和1mL0.5% K2Cr2O7溶液,在不断摇动下用AgNO3溶液滴定至白色沉淀中出现砖红色,即为终点,记录消耗的AgNO3溶液的体积,平行三次。
可溶性氯化物中氯含量的测定(莫尔法)经
典
实验十二氯化物中氯含量的测定(莫尔法)
重点:掌握莫尔法测定氯化物的基本原理及莫尔法测定的反应条件
难点:AgN03标准溶液的配制和标定;滴定终点的控制;氯化物中氯含量的计算。
一、实验目的
1、掌握莫尔法测定氯化物的基本原理
2、掌握莫尔法测定的反应条件
二、实验原理
莫尔法是在中性或弱酸性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液直接滴定待测试液中的C1-。
主要反应如下:
由于AgC1的溶解度小于Ag2CrO4,所以当AgC1定量沉淀后,微过量的Ag+即与CrO42-形成砖红色的Ag2CrO4沉淀,它与白色的AgC1沉淀一起,使溶液略带橙红色即为终点。
三、仪器和试剂
AgNO3分析纯;NaC1优级纯,使用前在高温炉中于500-600℃下干燥2-3h,贮于干燥器内备用;K2CrO4溶液50g·L-1。
四、实验内容
1、配制0.10mol·L-1AgN03溶液
称取AgN03晶体8.5 g于小烧杯中,用少量水溶解后,转入棕色试剂瓶中,稀释至500mL左右,摇匀置于暗处、备用。
2、0.10mol·L-1AgN03溶液浓度的标定,
准确称取0.55—0.60g基准试剂NaCl于小烧杯中,用水溶解完全后,定量转移到100 mL容量瓶中,稀释至刻度,摇匀。
用移液管移取20.00 mL此溶液置于250mL锥形瓶中,加20 mL水,1 mL 50g·L-1K2Cr04溶液,在不断摇动下,用AgN03溶液滴定至溶液微呈橙红色即为终点。
平行做三份,计算AgN03溶液的准确浓度。
3、试样中NaCI含量的测定
准确称取含氯试样(含氯质量分数约为60%),1.6g左右于小烧杯中,加水溶解后,定量地转入250mL容量瓶中,稀释至刻度,摇匀。
准确移取25.00 mL此试液三份,分别置于250 mL锥形瓶中,加水20 mL,50g·L-1K2Cr04溶液1 mL,在不断摇动下,用AgN03标准溶液滴定至溶液呈橙红色即为终点。
根据试样质量,AgN03标准溶液的浓度和滴定中消耗的体积,计算试样中Cl-的含量。
必要时进行空白测定,即取25.00mL蒸馏水按上述同样操作测定,计算时应扣除空白测定所耗AgN03标准溶液之体积。
五、数据记录与处理
六、注意事项:
1、适宜的pH=6.5-10.5,若有铵盐存在,pH=6.5-7.2
2、AgNO3需保存在棕色瓶中,勿使AgNO3与皮肤接触。
3、实验结束后,盛装AgNO3的滴定管先用蒸馏水冲洗2-3次,再用自来水冲洗。
含银废液予以回收。
七、实验讨论
1、配制好的AgNO3溶液要贮于棕色瓶中,并置于暗处,为什么?
答:因为AgNO3见光分解。
2、空白测定有何意义?K2CrO4溶液的浓度大小或用量多少对测定结果有何影响?
答:空白试验可校正由于AgNO3使用过量而引入的误差。
空白试验可校正由于AgNO3使用过量而引入的误差。
K2CrO4浓度过大,会使终点提前,且 CrO42-本身的黄色会影响终点的观察终点的观察,使测定结果偏低;若太小,会使终点滞后,使测定结果偏高。
3、能否用莫尔法以NaC1标准溶液直接滴定Ag+?为什么?
答:不能用NaCl滴定AgNO3,因为在Ag+中加入K2CrO4后会生成Ag2CrO4沉淀,滴定终点时
Ag2CrO4转化成AgCl的速率极慢,使终点推迟。
教学心得:
1、滴定时,最适宜的pH范围是6.5-10.5,若有铵盐存在,为避免生成
Ag(NH3)2+,溶液的pH范围应控制在6.5-7.2为宜。
2、AgNO3见光易分解,故需保存在棕色瓶中。
3、AgNO3若与有机物接触,则起还原作用,加热颜色变黑,所以不要使AgNO3与皮肤接触。
实验结束后,盛装AgNO3溶液的滴定管应先用蒸馏水冲洗2-3次,再用自来水冲洗,以免产生氯化银沉淀,难以洗净。
4、含银废液应予以回收,且不能随意倒入水槽。