1997年-1999年中科院《分析化学》考研真题
- 格式:pdf
- 大小:177.54 KB
- 文档页数:8
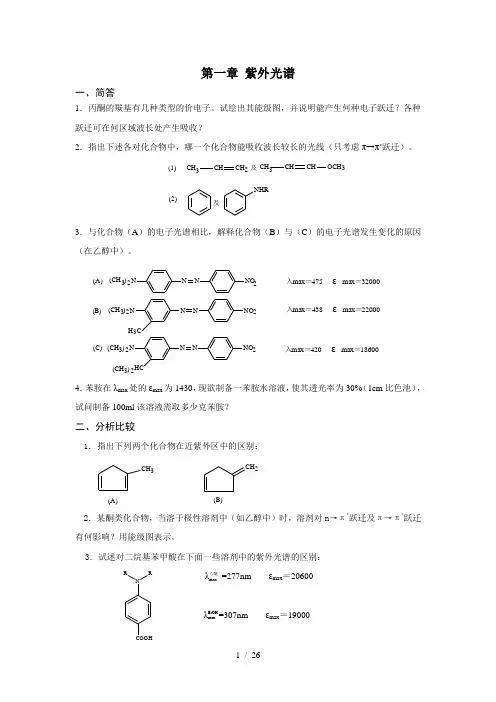
第一章 紫外光谱一、简答1.丙酮的羰基有几种类型的价电子。
试绘出其能级图,并说明能产生何种电子跃迁?各种跃迁可在何区域波长处产生吸收?2.指出下述各对化合物中,哪一个化合物能吸收波长较长的光线(只考虑π→π*跃迁)。
(2)(1)及NHR3CHCHOCH 3CH 及CH 3CH CH23.与化合物(A )的电子光谱相比,解释化合物(B )与(C )的电子光谱发生变化的原因(在乙醇中)。
(C)(B)(A)入max =420 εmax =18600入max =438 εmax =22000入max =475 εmax =320003N NNNO HC32(CH )2N NNNO H C 32(CH )2232(CH )(CH )23NNNNO4.苯胺在λmax 处的εmax 为1430,现欲制备一苯胺水溶液,使其透光率为30%(1cm 比色池),试问制备100ml 该溶液需取多少克苯胺?二、分析比较1.指出下列两个化合物在近紫外区中的区别:CH CH 32(A)(B)2.某酮类化合物,当溶于极性溶剂中(如乙醇中)时,溶剂对n →π*跃迁及π→π*跃迁有何影响?用能级图表示。
3.试述对二烷基苯甲酸在下面一些溶剂中的紫外光谱的区别:λ乙醚max =277nm εmax =20600λEtOH max =307nm εmax =19000NRRCOOHλHCl max =307nm εmax =970三、试回答下列各问题1.某酮类化合物λhexanemax =305nm ,其λEtOH max =307nm,试问,该吸收是由n→π*跃迁还是π→π*跃迁引起的?2. 1,1二苯乙烯(A )在环己烷中的UV 光谱与蒽(B )的UV 光谱有相当大的区别。
在浓硫酸中这两个化合物UV 光谱非常相似,见表1-5,而在稀硫酸中又与环己烷中的UV 光谱相同,试问在浓硫酸中这两个化合物发生了什么变化?表1-1 化合物(A )和(B )在不同溶剂中的λma四.计算下述化合物的λmax :1. 计算下列化合物的λmax :2.计算全反式西红柿烯(结构如下)的λmax 及εmax :3.计算一叶萩碱在乙醇中的λmax :NOO4.计算下列化合物的λmax :(D )(C )(B )(A )2NH COOH3OH COCH O 33OOCH CH O五、结构判定1.由某挥发油中分得一种成分,其UVλhexane max =268nm,由其它方法初步确定该化合物的结构可能为A 或B ,试问可否用UV 光谱做出判断?(A)(B)2. 一化合物初步推断其结构不是A 就是B ,经测定UV λEtOH max =352nm,试问其结构为何?O O(A)(B)3. 2-(环己-1-烯基)-2-丙醇在硫酸存在下加热处理,得到主要产物的分子式为C 9H 14,产物经纯化,测紫外光谱λmax =242nm (εmax =10100),推断这个主要产物的结构,并讨论其反应过程。

中国科学院大学2020年招收攻读硕士学位研究生入学统一考试试题科目名称:分析化学考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、单项选择题(每题2分,共40分)1衡量样本平均值的离散程度应采用A变异系数B标准偏差C全距D平均值的标准偏差2下列关于有效数字说法错误的是A 分析化学计算中,倍数、分数关系的有效数字位数可认为没有限制B 有效数字的位数,直接影响测定的相对误差C 有效数字位数越多,表明测量越准确D 在分析工作中实际上能测量到的数字为有效数字3 甲基橙的变色范围为pH = 3.1 ~ 4.4(p K a = 3.4),若用0.1 mol·L-1 NaOH滴定0.1 mol·L-1的HCl,则看到混合色时,[In-]/[HIn]的比值为A 1.0B 2.0C 0.5D 10.04 配置pH = 9.0的缓冲溶液,缓冲体系最好选择A一氯乙酸(p K a = 2.86)~一氯乙酸盐B氨水(p K b = 4.74)~氯化铵C六亚甲基四胺(p K b = 8.85)~盐酸D醋酸(p K a = 4.74)~醋酸盐5 某碱样溶液,以酚酞为指示剂,用盐酸标准溶液滴定至终点时,耗去的体积为V1,继续以甲基橙为指示剂滴定,又耗去盐酸的体积为V2,若V2小于V1,则此碱样溶液是A Na2CO3B NaOH + Na2CO3C Na2CO3 + NaHCO3D NaHCO36 对于不可逆电对而言,实测电势与理论计算值存在一定差异的原因是A 不可逆电对一般为含氧酸,实际电势较难测准B 不可逆电对一般不对称,因此存在差异C 不可逆电对反应速度较慢,无法达到平衡状态D 不可逆电对的氧化态和还原态无法达成动态相互转化7 对于下列氧化还原反应的滴定曲线,化学计量点处于滴定突跃中点的是A 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+B Ce4+ + Fe2+ = Ce3+ + Fe3+C Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2OD I2 + 2S2O32- = 2I- + S4O62-8 如不知所测样品的组分,若要想检验方法有无系统误差,应采取的方法是A 加入回收实验B 人工合成试样C 多次测量D 标准试样9有一瓶看不到明显颜色的溶液,其与分光光度测定有关的正确说法是A 不能进行光度分析B 显色后可进行光度分析C 光度分析灵敏度低D 无法判别是否能进行光度分析10 微量稀土离子可以通过生成CaC2O4来进行共沉淀分离,它属于A 利用生成混晶进行共沉淀分离B 利用形成离子缔合物进行共沉淀分离C 利用生成螯合物进行共沉淀分离D 利用表面吸附作用进行共沉淀分离11 在萃取分离过程中,判断分离难易程度的参数是A 分配系数B 回收率C 分离因子D回收因子12 用含少量Cu2+离子的蒸馏水配制EDTA溶液,于pH = 5.0时,用锌标准溶液标定EDTA溶液的浓度。

考研药学综合(分析化学)历年真题试卷汇编3(题后含答案及解析)题型有:1. 简答题 2. 多项选择题 3. 判断题请判断下列各题正误。
4. 计算题5. 单项选择题1.请设计一种氧化还原滴定分析方法测定CaO的含量,要求写出化学反应式、指示剂,确定终点方法及计算公式。
正确答案:首先应该进行定性分析,了解石灰石样品中的金属杂质是什么,按一般情况,即金属杂质主要是Mg2+和Fe3+来考虑。
(1)试样准备取m克的试样用盐酸溶解,加NaOH调pH=10,过滤并用冷水洗涤沉淀,滤液和洗出液收集在一起。
(2)测定将试样用盐酸或者硫酸酸化,加入过量的(NH4)2C2O4,然后用稀氨水中和至甲基橙显黄色,并陈化一段时间,过滤,用冷水按“少量多次”的方法洗涤沉淀。
将以上的沉淀溶于热的稀硫酸中(70~85℃),用KMnO4标准溶液滴定。
有关反应为:Ca2++(NH4)2C2O4→CA,C2O4↓(白色)+2NH4+2MnO4- 5C2O42-+16H+=2Mn2++10CO2+8H2O 设KMnO4标准溶液的物质的量浓度为Cmol/L,用去体积Vml样品,Ca2+的物质的量为n,2MnO4-+5C2O4+16H+=2Mn2++10CO2+8H2O n=5cV/2000mol 样品中CaO质量为n×56,钙含量(用CaO表示)为56n/m。
涉及知识点:分析化学多项选择题下列各题的备选答案中,至少有一个是符合题意的,请选出所有符合题意的备选答案。
2.在重量分析中,使用有机沉淀剂代替无机沉淀剂进行沉淀的优点是( )。
A.沉淀吸附杂质少,沉淀干净B.沉淀溶解度小,有利于被测组分沉淀完全C.可以避免局部过浓,生成大晶粒沉淀D.沉淀摩尔质量大,分析准确度高E.沉淀剂品种多,能与大多数离子起沉淀反应正确答案:A,B,D解析:在重量分析中,使用有机沉淀剂代替无机沉淀剂进行沉淀的优点是:①可选择的种类多,选择性高;②生成的沉淀溶解度小,沉淀完全;⑧吸附杂质少,沉淀纯净;④沉淀摩尔质量大,分析准确度高。

《分析化学》(下)试题A卷本试卷需:答题纸 4 页草稿纸2 页试卷审核时间:年月日第 1 页共 4 页考试时间:120分钟考试方式:闭卷(提示:答案必须依试题顺序做在答题册上,并标明大、小题号,否则不予计分)一、选择题(每小题1分,共20分)1、于pH=5.0时,用2.0×10-2mol/L EDTA 溶液滴定50.00mL2.0×10-2mol/LCu 2+溶液。
当加入100.0mLEDTA 溶液时,下列正确的说法是:()A 、'2]lg[CuY pK Cu =+ ;B 、'lg CuY K pCu -= ;C 、'2lg ]lg[CuY K Cu =+ ;D 、'CuY pK pCu = 。
2、用EDTA 滴定Zn 2+,正确的说法是:()A 、H +浓度越低,反应越完全;B 、在低pH 时可以准确进行滴定;C 、在0.01mol/L NH 3溶液中进行滴定比在0.10mol/L NH 3溶液中更不易进行;D 、在高pH 时很难准确进行滴定。
3、在Ca 2+、Mg 2+的混合溶液中,用EDTA 法测定Ca 2+,要消除Mg 2+的干扰,宜用:()A 、沉淀掩蔽法;B 、配位掩蔽法;C 、氧化还原掩蔽法;D 、离子交换法。
4、含有Cl -的试液(pH = 4),采用下列哪种方法测定氯的含量:()A 、莫尔法;B 、佛尔哈德法;C 、法扬斯法(用曙红作指示剂)。
5、在1mol/L H 2SO 4溶液中,用0.1000mol/L Ce(SO 4)2溶液滴定20.00ml 0.1000mol/L Fe 2+溶液,E ep =1.06V ,此滴定最适宜的指示剂是:()A 、二苯胺磺酸钠(E of In = 0.85V );B 、邻苯氨基苯甲酸(E of In = 1.08V ); C 、邻二氮菲(E of In = 1.06V ); D 、硝基邻二氮菲(E of In = 1.25V )。

分析化学一选择题 (每题2 分,共40 分)1 使用分析天平进行称量过程中,加、减砝码或取、放物体时,应把天平梁托起,这是为了A 称量快速B 减少玛瑙刀口的磨损C 防止天平盘的摆动D 防止指针的跳动2 若试样的分析结果精密度很好,但准确度不好,可能原因是A 试样不均匀B 使用试剂含有影响测定的杂质C 有过失操作D 使用的容量仪器经过了校正3 有一组平行测定所得的分析数据,要判断其中是否有异常值,应该用A F 检验法加t 检验法B F 检验法C t 检验法D Q 检验法4 共轭酸碱对的K a 和K b 的关系是A K a=K bB K a K b=1C K a K b= K WD K a/K b= K W5 若测定污水中痕量三价铬与六价铬应选用下列哪种方法A 原子发射光谱法B 原子吸收光谱法C 荧光光度法D 化学发光法6 金属离子M 与L 生成逐级配位化合物ML、ML2···MLn,下列关系式中正确的是A [MLn]=[M][L]nB [MLn]=Kn[M][L]C [MLn]=βn[M]n[L]D [MLn]=βn[M] [L] n7 指出下列叙述中错误的结论A 酸效应使配合物的稳定性降低B 水解效应使配合物的稳定性降低C 配位效应使配合物的稳定性降低D 各种副反应均使配合物的稳定性降低8 下列四种萃取剂中对金属离子萃取效率最好的是ANOH B CH3CH2OH C CH3CH2OCH2CH3 D CH3(CH2)3OH9 循环伏安法主要用于A 微量无机分析B 定量分析C 定性和定量分析D 电极过程研究10 在制备纳米粒子时,通常要加入表面活性剂进行保护,这主要是为了防止A 颗粒聚集长大B 均相成核作用C 表面吸附杂质D 生成晶体形态11 在EDTA 配位滴定中,下列有关掩蔽剂的叙述错误的是A 配位掩蔽剂必须可溶且无色B 沉淀掩蔽剂生成的沉淀,其溶解度要很小C 氧化还原掩蔽剂必须能改变干扰离子的氧化态D 掩蔽剂的用量越多越好12 气液色谱中,保留值实际上反映的是下列哪两者间的相互作用A 组分和载气B 载气和载体C 组分和固定液D 组分和载体13 下列化合物中,不能发生麦氏重排的是A BC D14 下列化合物中,所有质子是磁等价,在NMR 光谱中只有一个吸收峰的结构是A CH3CH2CH2BrBC CH2=CHClD CH3OH15 下列化合物中,同时有n→π*,π→π*,σ→σ*跃迁的化合物是A 一氯甲烷B 丙酮C 1,3-丁二烯D 甲醇16 下列化合物中,νC=O 最大的是A COR ClB COR R'C COR OR'D COR科目名称:分析化学第 3 页共 5 页17 关于荧光效率,下面错误的叙述是A 具有长共轭的π→π*跃迁的物质具有较大的荧光效率B 分子的刚性和共平面性越大,荧光效率越大C 顺式异构体的荧光效率大于反式异构体D 共轭体系上的取代基不同,对荧光效率的影响也不同18 原子吸收光谱由下列哪种粒子产生的?A 固态物质中原子的外层电子B 气态物质中基态原子的外层电子C 气态物质中激发态原子的外层电子D 气态物质中基态原子的内层电子19 使用重铬酸钾法测铁时,滴定前先要在铁盐溶液中滴加适量的Sn2+溶液,其目的是A 防止Fe2+被氧化B 作为指示剂C 还原Fe3+D 作为催化剂20 预测某水泥熟料中的SO3 含量,由4 人分别进行测定。

考研药学综合(分析化学)历年真题试卷汇编5(题后含答案及解析)题型有:1. 简答题 2. 综合题3. 名词解释题 4. 判断题请判断下列各题正误。
5. 多项选择题 6. 单项选择题1.请说明以下两个化合物:(1)IR光谱有何不同;(2)1H—NMR谱各有几组峰(并说出各组几重峰),写出各结构的偶合系统。
正确答案:(1)A:酮类:由于C=O和C=C共轭而降低了40cm-1。
B:芳酮类:C=O,1700~1630很强的谱带,可能是VC=O与其他部分振动的耦合。
(2)A:三组峰(苯环5H单峰、亚甲基2H单峰、甲基3H单峰),苯环上的H:A283耦合。
B:三组峰(苯环5H多重峰、亚甲基2H四重峰、甲基3H三重峰)。
涉及知识点:分析化学2.化合物C8H12O4的红外光谱中1700cm-1附近有一强吸收,其1H—NMR 谱如下,请推测该化合物的结构。
(积分高度a:b:c=3:2:1)正确答案:在1700cm-1附近有强吸收,含有羰基。
(1)不饱和度(2×8+2—12)/2=3,为脂肪族化合物。
(2)氢分布以c峰的积分高度为公约数,得氢分布比为a:b:c=3:2:1。
分子式含氢数为12H,则氢分布为6H:4H:2H。
说明未知物是具有对称结构的化合物。
(3)耦合系统a,b间△δ/J=(4.19—1.31)×60/7=24.7,为一级耦合A2X3系统。
根据氢分布,可知未知物含有两个化学环境完全一致的乙基(a:CH3,b:CH2)。
(4)δ=6.71ppm的质子是烯氢,由于是单峰,说明两个烯氢的化学环境完全一致,烯氢的基准值为5.25,说明烯氢与电负性较强的基团相邻。
(5)连接方式由分子式C6H12O6中减去2个乙基及1个乙烯基,余C2O4,说明有2个一COO一基团。
连接方式有两种可能。
①CH2与—COOR相连,计算δCH2=1.2+1.05=2.25ppm。
②CH2与一O一COR相连,计算δCH2=1.20+2.98=4.12ppm。

分析化学考研试题及答案一、选择题(每题2分,共10分)1. 在分析化学中,下列哪种方法不是用于分离混合物的?A. 蒸馏B. 萃取C. 沉淀D. 滴定答案:D2. 标准溶液的配制过程中,下列哪项操作不是必需的?A. 称量B. 溶解C. 稀释D. 过滤答案:D3. 原子吸收光谱法中,原子化器的作用是什么?A. 产生电子B. 产生光C. 产生原子D. 产生分子答案:C4. 色谱法中,固定相的作用是什么?A. 移动B. 保持不变C. 吸附D. 溶解答案:B5. 酸碱滴定中,指示剂的作用是什么?A. 改变溶液的pHB. 指示终点C. 改变溶液的颜色D. 改变溶液的浓度答案:B二、填空题(每题2分,共10分)1. 原子吸收光谱法中,______是测定元素含量的重要参数。
答案:波长2. 在滴定分析中,滴定管的校准是为了确保______的准确性。
答案:体积3. 色谱图上,保留时间可以用来判断______。
答案:物质的纯度4. 紫外-可见光谱法中,最大吸收波长对应的是______。
答案:最大吸收峰5. 电位滴定法中,电位的突跃点指示的是______。
答案:终点三、简答题(每题10分,共20分)1. 简述什么是标准物质及其在分析化学中的应用。
答案:标准物质是指具有一种或多种已知特性的稳定物质,用于校准测量仪器、评价测量方法或给材料赋值。
在分析化学中,标准物质用于确保分析结果的准确性和可比性。
2. 描述色谱法中,色谱柱的作用及其对分离效果的影响。
答案:色谱柱是色谱分析中用于分离混合物的装置,它包含固定相和流动相。
色谱柱的作用是允许混合物中的不同组分在固定相和流动相之间进行分配,从而实现分离。
色谱柱的类型、尺寸、固定相的性质以及流动相的流速和组成都会影响分离效果。
四、计算题(每题15分,共30分)1. 在酸碱滴定中,已知酸的浓度为0.1 mol/L,滴定体积为25.0 mL,碱的浓度为0.05 mol/L,求碱的滴定体积。

中科院1996生化与分子1、从血红蛋白规水解得到的氨基酸的手性光学性质:A.都是L型的;B。
都是左旋的;C。
并非都是L型的;D。
有D型的也有L型的。
2、生物膜的厚度在A.100nm左右B.10nm左右C.1nm左右3、真核生物中经RNA聚合酶Ⅲ催化转录的产物是A.mRNA B.hnRNA C.rRNA和5SRNA D.tRNA和5SRNA4、消化系统的水解酶,大多是以非活性的酶原形式合成出来的,但也有例外,如A.核糖核酸酶B.羟肽酶C.胃蛋白酶5、在染色体中DNA的构型主要是A.A型B.B型C.C型D.Z型6、超过滤于凝胶过滤A.是两种性质不同,用处不同的蛋白质制备方法B.是一种性质,但表现方法不同的蛋白质制备方法C.是同一种方法的两种名词7、研究蛋白质结构常用氧化法打开二硫键,所用的化学试剂是A.亚硝酸B.过氯酸C.硫酸D.过甲酸8、雄激素对物质代谢最显著的一项重要作用是A.促进肝脏糖原分解B.增加脂肪贮存C.加强蛋白质的同化作用D。
钾、钙、磷等物质的吸收9、核苷酸从头合成中,嘧啶环的1位氮原子来自A.天冬氨酸B.赖氨酸C.谷氨酰胺D.甘氨酸10、羧肽酶C专门水解C端倒数第二位是哪个氨基酸形成的肽链A.精氨酸B.赖氨酸C.脯氨酸11、将RNA转移到硝基纤维素膜上的技术叫A.Southern blotting B.Northern blotting C.Western blotting D.Eastern blotting 12、甘氨酸的解离常数分别为K1=2.34和K2=9.60,它的等电点(PI)是A.7.26 B.5.97 C.7.14 D.10.7713、对一个克隆的DNA片段做物理图谱分析,需要用A.核酸外切酶B.限制性内切酶C.DNA连接酶D.脱氧核糖核酸酶14、原核生物基因上游的TA TA盒一般处于什么区A.-10 B.-35 C.-200 D.1K15、通常使用什么测定多肽链的氨基末端A.CNBr B.丹磺酰氯C.6N HCl D.胰蛋白酶16、蛋白质的变形伴随着结构上的变化是A.肽键的断裂B.丹基酸残基的化学修饰C.一些侧链基团的暴露D.二硫键的折开17、生物膜主要成分是脂质蛋白质,其主要通过什么相连接A.氢键B.离子键C.疏水作用D.共价键18、粗糙型内质网系的主要功能是A.糖类的合成B.脂类的合成C.分泌性蛋白质的合成D.必需氨基酸的合成19、脂肪酸的合成中,每次肽链的延长都需要什么参加A.乙酰辅酶A B.草酰乙酸C.丙二酸单酰辅酶A D.甲硫氨酸20、PPGPP在下列情况下被合成A.细菌缺乏氮源时B.细菌缺乏碳源时C.细菌在环境温度太高时D.细菌在环境温度太低时答案:1、A;2、B;3、D 真核生物RNA聚合酶Ⅲ的别名叫小分子RNA聚合酶,负责包括tRNA和5SrRNA在内的小分子RNA的合成;4、A 核糖核酸酶没有酶原形式,具有酶原形式的酶多数是蛋白酶,以免自溶;5、B;6、A 超滤指大分子不能通过滤膜,仅通过分子,而凝胶过滤时大分子不能进入分离介质,故先被洗脱;7、D;8、C 雄性激素对物质代谢最重要的作用就是促使蛋白质合成;9、A;10、C;11、B;12、B 甘氨酸的pI是其两个pK的平均值;13、B;14、A;15、B;16、C;17、C;18、C;19、C;20、A中科院1997生化与分子1、在凝血过程中发挥作用的许多凝血因子的生物合成依赖于下述哪一种维生素A.维生素K B.维生素E C.维生素C D.维生素A2、目前已经知道某种金属离子在细胞信号传导使细胞供能时起十分重要作用,它是A.Na+ B.K+ C.Ca2+ D.Mg2+3、镰刀状细胞血病是最早被认识的一种分子病,它是由于血红蛋白的两条B链中的两个谷氨酸分别为下属的氨基酸所代替A.丙氨酸B.缬氨酸C.丝氨酸D.苏氨酸4、1996年P。

分析化学考研选择题及答案一、选择题原子吸收1. 原子吸收分析中光源的作用是: (C )(A)提供试样蒸发和激发所需要的能量( B )产生紫外光(C)发射待测元素的特征谱线(D)产生具有足够浓度的散射光2. 原子吸收分析法测定铷(Rb )时,加入1%钠盐溶液其作用是:(C)(A)减少背景( B )提高火焰温度( C )减少Rb 电离( D )提高Rb+ 的浓度3. 采用测量峰值吸收系数的方法来代替测量积分吸收系数的方法必须满足下列那些条件:( AC )(A)发射线轮廓小于吸收线轮廓( B )发射线轮廓大于吸收线轮廓( C )发射线的中心频率与吸收线中心频率重合( D )发射线的中心频率小于吸收线中心频率4. 空心阴极灯中对发射线宽度影响最大的因素:( C)(A )阴极材料( B )填充气体( C )灯电流(D )阳极材料5. 原子吸收分析中,吸光度最佳的测量范围是:( A)( A ) 0.1-0.5( B ) 0.01-0.05( C ) 0.6-0.8( D ) >0.96. 下列有关原子吸收法的叙述中错误的是:(AC ) ( A )在原子吸收测定中,做到较高准确度的前提是保证100% 的原子化效率( B )背景吸收是一种宽带吸收,其中包括分子吸收、火焰气体吸收和光散射引起的损失( C )分析难挥发元素采用贫燃火焰较好( D )背景吸收在原子吸收光谱分析中会使吸光度增加,导致分析结果偏高7. 在原子吸收光谱分析中,加入消电离剂可以抑制电离干扰。
一般来说,消电离剂的电离电位:( B )( A )比待测元素高( B )比待测元素低( C )与待测元素相近( D )与待测元素相同8. 测定钾、钠、铁时,光谱通带应选: ( A)( A )钾、钠选0.4nm ,铁选0.1nm( B )钾、钠选0.1nm ,铁选0.4nm( C )钾、钠、铁均选0.1nm( D )钾、钠、铁均选 1.0nm9. 非火焰原子吸收法的主要优点为: ( D)(A )谱线干扰小(B )背景低(C)稳定性好(D)试剂用量少10. 下列有关原子发射光谱分析发的叙述不正确的是:(C)( A )要判断某元素是否存在,至少应有2-3 条灵敏线出现( B )光谱线的自吸现象对发射光谱定量分析影响很大( C )分析线中必须包含着最后线( D )谱线的灵敏度标记数字越大,说明谱线越灵敏11. 在原子吸收分析中,当溶液的提升速度较低时,一般在溶液中混入表面张力小、密度小的有机溶剂,其目的是: ( B)( A )使火焰容易燃烧( B )提高雾化效率( C )增加溶液黏度( D )增加溶液提升量12. 已知原子吸收光谱计狭缝宽度为0.5mm 时,狭缝的光谱通带为1.3nm ,所以该仪器的单色器的倒线色散率为: ( A )( A )每毫米2.6nm( B )每毫米0.38nm( C )每毫米26nm( D )每毫米3.8nm13. 影响原子吸收线宽度的最主要因素是: (D )(A)自然宽度( B )赫鲁兹马克变宽( C )斯塔克变宽( D )多普勒变宽14. 空心阴极灯内充的气体是: ( D )(A)大量的空气( B )少量的空气(C)大量的氖或氩等惰性气体(D)少量的氖或氩等惰性气体分离与富集1.在约6mol/LHCl 介质中,用乙醚萃取10.0mgFe 3+,已知分配比为取后,分出有机相,又用等体积6mol/LHCl 洗一次,Fe3+将损失A .0.001mgB 0.01mgC. 0.09mg D 0.1mg配位滴定法1. 已知EDTA 的pKa i ?pKa6分别为0.9,1.6,2.0, 2.67,6.16, 10.26含有 c mol/LEDTA 溶液中,下列叙述中正确的是 ( B)A. [HY]=[Y]B. c(Y) =[Y]C.[H 2Y]=[Y]D.[H 2Y]=[HY]2. 已知EDTA 的各级离解常数分别为1 0 -0.9 ,10-1.6 , 1 0 -2.0 , 10-2.67pH=2.67-6.16 的溶液中,EDTA 最主要的存在形式是(B) 99 ,经二次等体积萃D)在pH=13.0 时,10-6.16 , 1 0 -10.26 ,在A.H3Y- B.H 2Y 2- C.HY 3- D Y4-3?用指示剂(In),以EDTA (Y)滴定金属离子M时常加入掩蔽剂(X)消除某干扰离子(N )的影响,不符合掩蔽剂加入条件的是(A)A ? K NX < K NY B.K NX >> K NYC.K MX << K MYD.K MIn > K MX4. 对于EDTA (Y)配位滴定中的金属指示剂(In),要求它与被测金属离子(M )形成的配合物的条件稳定常数(B)A . > K' MY B. < K' MYC. M K'MYD. >108.05 .用EDTA滴定含NH3的Cu2+溶液,则下列有关pCu突跃范围大小的叙述,错误的是(BD )A. Cu 2+的浓度越大,pCu 突跃范围越大。

一、是非题:20题,共20分。
答“是”写“+”,答案“非”写“一”,写在题后的()中。
1、单克隆和多克隆抗体的差别在于制备方式的不同。
2、气体分子,如NO,是可以作为信号分子在生物体内行使功能的。
3、二硫键和蛋白质的三级结构密切有关,因此没有二硫键的蛋白质就只有一级和二级结构。
4、所有信号肽的位置均在新生肽的N端。
5、对于可逆性抑制剂的抑制作用,抑制50%时的抑制剂浓度等于其抑制解离常数Ki。
6、在酶的催化反应中,HIS残基的咪唑基既可以起碱催化作用,也可以起酸催化作用。
7、蛋白激酶对蛋白质磷酸化的部位除了Ser、Thr、和Tyr外,还有His、Cys、Asp等。
8、维生素B1的化学名称为硫胺素,它的磷酸酯为脱羧辅酶。
9、线粒体内膜与外膜的结构完全不同,它们是完全分开互不接触的两种膜。
10、细胞色素氧化酶与细胞色素b-c1复合物的三维空间结构已得到阐明。
11、氧化磷酸化也是可逆的。
12、嗜盐菌视紫红蛋白与视网膜视紫红蛋白不同,前者经光照后导致跨膜质子梯度,后者经光照后导致跨膜钠离子流动。
13、端粒酶(telomerase)是一种反转录酶。
14、转录不需要引物,而反转录必须有引物。
15、DNA复制时,前导链合成方向是5’→3’,后随链则是3’→5’生成。
16、人基因组的碱基对数目为2.9×109,是自然界最大的。
17、细胞器DNA的复制并不限于S期,可在细胞周期的各期中进行。
18、基因转录的终止信号应位于被转录的序列以外的下游区。
19、真核生物细胞核内不均一RNA(hnRNA)分子量虽然不均一,但其半衰期长,比胞质成熟mRNA 更为稳定。
20、DNA复制是在起始阶段进行控制的,一旦复制开始,它即进行下去,直到整个复制子完成复制。
二、选择题:25题,每题一分,共25分。
1、生长调节素(omtomedin)是A.胰岛素B.生长激素C.胰岛素样生长激素Ⅰ和ⅡD.表皮生长因子2、生物体内氨的转运主要通过A.尿素循环B.谷氨酰胺C.尿酸3、识别信号肽的是一种信号识别颗粒,它是A.糖蛋白B.信号肽C.脂蛋白D.核蛋白4、微管蛋白的异二聚体上的结合位点是A.GTP B.ATP C.cAMP D.ADP5、基因剔除(knock out)的方法主要是用来阐述A.基因的结构B.基因的调控C.基因的表达D.基因的功能6、胰凝乳蛋白酶的活性中心中构成一个电荷中继网的三个氨基酸残基是A.His,Arg,Glu B.Ser,Lys,Asp C.Ser,His,Asp D.Ser,Arg,Glu7、MWC模型和KNF模型的一个区别是A.MWC模型可以解释正协同性,而KNF模型不能B.MWC模型可以解释负协同性,而KNF模型不能C.MWC模型不能解释正协同性,而KNF模型能D.MWC模型不能解释负协同性,而KNF能8、琥珀酸脱氢酶所需要的辅酶(基)是A.CoA B.FAD C.NAD+ D.NADP+9、对于一个遵守米氏方程的酶,当活性达到最大反应速度的99%时,底物浓度是其Km值的倍数为A.10 B.100 C.90 D.9910、一个酶有多种底物,判断其底物专一性强弱应依据参数A.Kcat B.Km C.Kcat/Km11、NO的生成主要来自A.组氨酸B.赖氨酸C.精氨酸D.谷氨酸胺12、哺乳动物细胞质膜的标志酶是 A.钠钾ATP酶B.细胞色素氧化酶C.H+-ATP D.谷氨酸胺13、辅酶Q是一种化合物,它含A.硫胺素B.异咯嗪结构C.异戊二烯单位的醌类D.铁、硫14、典型哺乳动物细胞内外的Na+,K+离子浓度A.细胞内Na+,K+均比细胞外高 B.细胞内Na+,K+均比细胞外低C.细胞内K+比细胞外高,Na+比细胞外低 D.细胞内Na+比细胞外高,K+比细胞外低15、当线粒体呼吸处于状态4时,内膜两侧的pH差可以达到A.0.1PH单位B.1PH单位C.1.5PH单位D.>2PH单位16、端粒酶(telomerase)是一种蛋白质-RNA复合物,其中RNA起A.催化作用B.延伸作用C.引物作用D.模板左右17、新生多肽链的信号肽与下列哪种物质识别,从而引导肽链进入内质网A.核糖体B.核糖体亚基C.信号肽酶D.信号肽识别颗粒(SRP)18、真核生物mRNA帽子结构中,m7G与多核苷酸链通过三个磷酸基连接,其方式是A.2’-5’B.3’-5’C.3’-3’D.5’-5’19、与核酸中嘌呤环和嘧啶环上的原子来源都有关的氨基酸是A.丙氨酸B.天冬氨酸C.亮氨酸D.甲硫氨酸20、大肠杆菌mRNA上起始密码子上有的SD序列可与某种RNA的3’端配对,然后启动多肽链生成,这种RNA是 A.tRNA B.SnRNA C.16srRNA D.23srRNA21、染色质DNA的碱基可被甲基化,DNA甲基化的作用是A.关闭某些基因B.活化某些基因C.可关闭某些基因,同时可以活化另一些基因D.与基因表达的调节无关22、遍在蛋白(ubiquitin)广泛分布于各类细胞,它与蛋白质结合后,造成A.蛋白质更加稳定B.蛋白质有效转运C.蛋白质迅速降解D.蛋白质固定在细胞膜上23、DNA损伤的光修复作用是一种高度专一的修复方式,它只作用于紫外线引起的A.嘧啶二聚体 B.嘌呤二聚体 C.嘧啶-嘌呤二聚体24、λ噬菌体侵入寄主细胞后,决定它进入裂解循环的基因产物是A.N B.Q C.Cro D.CI25、环状的线粒体DNA进行复制的方法采用A.多起点双向B.滚环C.D-环 D.单起点双向三、填空题;12题,共25分,一空一分。

1997年攻读硕士学位研究生入学考试试题考试科目:无机化学专业:无机化学、分析化学、有机化学、物理化学、环境化学 研究方向:以上专业所有方向一、选择题(共15分)1、 在常温下,Cl 2 、、Br2、I 2与NaOH 作用正确的是--------( )(a) Br 2生成NaBr 、NaBrO(b) Cl 2生成NaCl 、NaClO(c) I 2生成NaI 、NaIO(d) Cl 2生成NaCl 、NaClO 2、 既能溶于又能溶于的硫化物是--------( ) (a) ZnS(b) As 2S 3 (c) HgS(d) CuS3、 在磷酸二氢钠溶液中加入硝酸银溶液后主要产物---------( ) (a) Ag 2O(b) AgH 2PO 4(c) Ag 3PO 4(d) Ag 2HPO 44、 试判断Ge 、Sn 、Pb 分别与浓硝酸作用时,正确的说法是-------( ) (a) 三元素都被氧化成+2价 (b) 三元素都被氧化成+4价(c) Ge 和Sn 被氧化成+4价,但却Pb 被氧化成+2价 (d) Ge 被氧化成+4价,但Sn 和Pb 只被氧化成+2 价5、 InCl 2为逆磁性化合物,其中 的化合价为--------( ) (a) +1(b) +2(c) +3(d) +1和+36、 将高锰酸钾溶液调节到酸性时,可以观察到的现象是---------( ) (a) 紫红色褪去 (b) 绿色加深(c) 有棕色沉淀生成(d) 溶液变成紫红色且有棕色沉淀生成7、 某金属离子在八面体弱场中的磁矩是4.90B.M,而在八面体强场中的磁矩为0,该中心金属离子可能是-( )(a) Cr 3+(b) Mn 2+(c) Mn 3+(d) Fe 2+8、 CrO 5中Cr 的真实氧化数为------------( ) (a) 4(b) 6(c) 8(d) 109、 以下说法正确的是-------------( ) (a) 放热反应都可以自发进行(b) 凡ΔG θ>0 的反应都不能自发进行(c) Δr H m θ>0及Δr S m θ>0 的反应在高温下有可能自发进行 (d) 纯单质的Δf H θ、Δf G θ及S θ 皆为010、食用碘盐中,碘以何种形式存在---------------( ) (a) I -(b) I -3(c) IO -3(d) IO -411、如下两种异构体,比较他们的熵值大小-------------( ) (a) S θ298(丙酮)>S θ298(氧杂环丁烷) (b) S θ298(丙酮)>S θ298(氧杂环丁烷) (c) S θ298(丙酮)>S θ298(氧杂环丁烷) (d) 不能比较12、下列各组元素中 ,性质最相似的两个元素是---------( ) (a) Zr Hf(b) Mg Al(c) LiBe(d) FeCo13、在下列氢氧化物中,能溶于过量 ,又能溶于氨水的是---------( ) (a) Ni(OH)2(b) Zn(OH)2(c) Al(OH)3(d) Cr(OH)314、除去硫酸铜酸性溶液中的少量,加入下列哪种试剂效果最好----------( ) (a) 氨水(b) NaOH(c) H 2S(d) Cu 2(OH)2CO15、下列各酸中 ,属于一元酸的是------------------------( ) (a) H 3PO 4(b) H 3BO 3(c) H 3PO 2(d) H 3PO 3二、填空题(共25分) 1、以X 代表卤素,则X 2+2OH -0℃`XO -+X -+H 2O;X 2主要是指________________和_______________________;KX(s)+H 2SO 4() —KHSO 4+HX;X 主要是指____________________和____________________; AgX()+2S 2O 32-—[Ag(S 2O 3)2]3-+X -;X 主要是指___________________和___________________。
考研分析化学试题及答案一、选择题(每题2分,共10分)1. 分析化学中,用于检测和定量分析的仪器分析方法不包括以下哪一项?A. 紫外-可见光谱法B. 原子吸收光谱法C. 质谱法D. 热重分析法答案:D2. 在酸碱滴定中,指示剂的变色范围通常与哪种物质的浓度有关?A. 酸B. 碱C. 指示剂D. 缓冲溶液答案:C3. 下列哪种物质不是分析化学中常用的基准物质?A. 碳酸钠B. 硫酸钾C. 氢氧化钠D. 硫酸亚铁答案:D4. 采用电位滴定法测定溶液中氯离子含量时,通常使用的指示电极是?A. pH电极B. 铂电极C. 银-氯化银电极D. 玻璃电极答案:C5. 在气相色谱分析中,用于分离混合物的固定相是?A. 气体B. 液体C. 固体D. 离子交换树脂答案:B二、填空题(每题2分,共10分)1. 在原子吸收光谱法中,______是用于产生待测元素原子化的条件。
答案:火焰或电热2. 质谱分析中,______是用于将样品分子离子化的方法。
答案:电子轰击3. 热重分析法中,样品的质量变化与______成正比。
答案:温度4. 在酸碱滴定中,滴定终点的确定可以通过______来实现。
答案:指示剂或电位变化5. 气相色谱分析中,色谱柱的作用是______。
答案:分离混合物中的组分三、简答题(每题10分,共20分)1. 简述原子吸收光谱法的基本原理及其在分析化学中的应用。
答案:原子吸收光谱法的基本原理是利用待测元素的基态原子对特定波长的光有选择性吸收的特性,通过测量光的吸收强度来定量分析元素含量。
在分析化学中,原子吸收光谱法广泛应用于金属元素的定量分析,具有灵敏度高、选择性好、操作简单等优点。
2. 描述气相色谱分析中固定相和流动相的作用及其对分离效果的影响。
答案:在气相色谱分析中,固定相是涂布在色谱柱内壁上的液体或固体,流动相是载气,如氮气、氢气或氦气。
固定相的作用是为样品组分提供吸附或溶解的场所,而流动相则携带样品组分通过色谱柱。
考研药学综合(分析化学)历年真题试卷汇编6(题后含答案及解析)题型有:1. 论述题 2. 名词解释题 3. 多项选择题 4. 计算题 5. 单项选择题6. 判断题请判断下列各题正误。
7. 简答题1.简述反相离子抑制色谱法、离子对色谱法、离子色谱法的使用原理及其使用目的。
正确答案:反相离子抑制色谱法把离子对试剂加入到含水流动相中,被分析的组分离子在流动相中与离子对试剂的反离子生成不带电荷的中性离子,从而增加溶质与非极性固定相的作用,使分配系数增加,改善分离效果。
离子对色谱法是将一种(或多种)与溶质分子电荷相反的离子(称为对离子或反离子)加到流动相或固定相中,使其与溶质离子结合形成疏水型离子对化合物,从而控制溶质离子的保留行为。
离子对色谱法(特别是反相)解决了以往难以分离的混合物的分离问题,诸如酸、碱和离子、非离子混合物,特别是一些生化试样如核酸、核苷、生物碱以及药物等分离。
离子色谱法是指将改进后的电导检测器安装在离子交换树脂柱的后面,以连续检测色谱分离的离子的方法。
离子色谱主要用于测定各种离子的含量,特别适于测定水溶液中低浓度的阴离子,例如饮用水水质分析,高纯水的离子分析,矿泉水、雨水、各种废水和电厂水的分析,纸浆和漂白液的分析,食品分析,生物体液(尿和血等)中的离子测定,以及钢铁工业、环境保护等方面的应用。
涉及知识点:分析化学2.色谱检测限正确答案:检测限系指试样在确定的实验条件下,被测物能被检测出的最低浓度或含量。
它是限度检验效能指标,无需定量测定,只要指出高于或低于该规定浓度即可。
涉及知识点:分析化学3.定量限正确答案:指样品被测物能测定的最低量,结果应具有一定准确度和精密度要求。
涉及知识点:分析化学多项选择题下列各题的备选答案中,至少有一个是符合题意的,请选出所有符合题意的备选答案。
4.表示色谱柱柱效的物理量是( )。
A.HR</sub>“ value1=“B”>B.tRC.n1/2</sub>“ value1=“D”>D.W1/2E.R正确答案:A,C,D解析:B是色谱法的基本定性参数,不能用来衡量柱效。
分析化学试题及答案考研一、选择题(每题2分,共20分)1. 以下哪种方法不是分析化学中常用的分离技术?A. 蒸馏B. 萃取C. 色谱D. 沉淀答案:D2. 原子吸收光谱法中,原子化过程通常发生在哪个部分?A. 火焰B. 石墨炉C. 雾化器D. 单色器答案:B3. 红外光谱中,分子振动的类型不包括以下哪种?A. 伸缩振动B. 弯曲振动C. 转动振动D. 电子跃迁答案:D4. 质谱分析中,质荷比(m/z)是指什么?A. 分子质量与电荷量的比值B. 分子质量与电荷量的乘积C. 分子质量与电荷量的平方比D. 分子质量与电荷量的平方根比答案:A5. 在酸碱滴定中,滴定终点的判断依据是?A. 滴定体积B. 溶液pH的变化C. 指示剂的颜色变化D. 溶液的电导率变化答案:C6. 紫外-可见光谱分析中,最大吸收波长称为?A. 吸收峰B. 吸收带C. 光谱带D. 光谱峰答案:A7. 电位滴定法中,电位突跃是指?A. 溶液电位的突然变化B. 溶液电位的逐渐变化C. 溶液pH的突然变化D. 溶液pH的逐渐变化答案:A8. 以下哪种仪器不适用于原子吸收光谱分析?A. 原子吸收光谱仪B. 原子发射光谱仪C. 原子荧光光谱仪D. 质谱仪答案:B9. 色谱分析中,保留时间是指?A. 样品组分从进样到检测器的时间B. 溶剂组分从进样到检测器的时间C. 样品组分从进样到分离柱的时间D. 溶剂组分从进样到分离柱的时间答案:A10. 以下哪种方法不是分析化学中常用的定量分析方法?A. 重量分析B. 滴定分析C. 电导分析D. 核磁共振分析答案:D二、填空题(每题2分,共20分)1. 在酸碱滴定中,滴定剂的浓度为0.1 mol/L,消耗体积为25.0 mL,则被滴定溶液的浓度为 _______ mol/L。
答案:0.12. 原子吸收光谱法中,火焰的三个区域分别是 _______ 区、中间区和 _______ 区。
答案:预混合,氧化3. 红外光谱中,分子振动的类型包括伸缩振动和 _______ 振动。
1999年中科院硕士研究生入学考试真题(生物化学AB卷)生物化学(一)试题解答中科院1999年生物化学A卷一、是非题:20题,每题1分,共20分。
答“是”写“+”,答“非”写“一”,写在题后的()中。
题目:1. 单克隆和多克隆抗体的差别在于制备方式的不同()考查点:单克隆抗体的概念。
答案:非,制备方式不同,其根本的区别是反应性质不同。
相关内容:单克隆抗体的制备过程。
题目:2.气体分子,如 NO,是可以作为信号分子在生物体内行使功能的()考查点:信号及信号转导。
答案:是,+相关内容:信号转导的分类。
题目:3.二硫键和蛋白质的三级结构密切有关,因此没有二硫键的蛋白质就只有一级和二级结构()考查点:蛋白质的结构层次。
答案:非,—相关内容:结构域,单体蛋白(由几个独立的肽段以S-S连接的小分子蛋白)。
题目:4.所有信号肽的位置均在新生肽的N端()考查点:信号肽学说。
答案:非,—相关内容:蛋白质修饰及转运。
题目:5.对于可逆性抑制剂的抑制作用,抑制 50%时的抑制剂浓度等于其抑制解离常数 K i ()考查点:可逆抑制(竞争性抑制、非竞争性抑制)。
答案:非,—相关内容:抑制反应的米氏方程。
特点。
题目:6.在酶的催化反应中,HIS残基的咪唑基既可以起碱催化作用,也可以其酸催化作用()考查点:酶催化的高效性。
课本内容:HIS残基的咪唑基,其解离常数为6。
在中性条件下一半以酸性形式存在,另一半以碱性形式存在。
即咪唑基既可作为质子供体,又可作为质子受体在催化中发挥作用。
因此咪唑基是一个最有效最活泼的一个催化功能基团。
答案:是,+相关内容:酶催化的特点。
题目:7.蛋白激酶对蛋白质磷酸化的部位除了Ser、Thr和Tyr外,还有His,Cys,Asp 等()考查点:磷酸化的部位。
要有-OH基团。
答案:非,—相关内容:磷酸化的概念。
题目:8.维生素B1的化学名称为硫胺素,它的磷酸酯为脱羧辅酶()考查点:维生素B1。
课本内容:维生素B1,又称为硫胺素,广泛分布于植物中,特别是种子外皮和胚芽,与ATP 作用转变为焦磷酸硫胺素(TPP),是催化丙酮酸和α-酮戊二酸脱羧的辅酶。
中国国科学院一九九七年招收硕士学位研究生入学考试试题试题名称:分析化学一,选择题(22分)1,若某矿石中铜的含量约为0.05%,则应采用下面哪种方法测定A,碘量法 B,EDTA置换滴定法 C,比色法 D,用铜试剂沉淀法2,用0.10 M HCl滴定0.10 M NH3 应选用下面何种指示剂A,甲基橙 B,甲基红 C,酚酞 D,百里酚酞3,某一含"OO"型螯合剂,他同Fe3+,Cu2+,Na+形成螯合物稳定性的次序是A,Fe>Cu>Na B,Fe>Na>Cu C,Cu>Na>Fe D,Cu>Fe>Na4,用EDTA作滴定剂滴定时,Fe3+,Cu2+,Ca2+能被准确滴定的最低pH值依次为A,Fe>Cu>CaB,Cu>Ca>Fe C,Ca>Cu>Fe D,Cu>Fe>Cu5,用NaOH滴定某一弱酸HB(Ka=1.0*10-6),现选一指示剂,其ΔpH=0.21,要使滴定误差小与0.1%,则HB的初始浓度应大于A,0.12M B,0.02M C,0.06M D,0.10M6,用10-2M EDTA 滴定10-2M Pb2+溶液,若ΔpM=±0.2,TE=0.1%,则滴定的最高pH 为(已知Pb(OH)2的Ksp=1.2*10-15,logKPbY=18.04)A,6.5 B,7.5 C,8.5 D,9.57,下列电对Fe3+/Fe2+的电位E10,Fe(phen)33+/ Fe(phen)32+的电位E20,Fe(CN)63-/Fe(CN)64-的电位E30的大小顺序为A,E1>E2>E3 B,E2>E3>E1 C,E3>E1>E2 D,E2>E1> E38,用碘量法测定铜合金中铜时,若有Fe3+存在,则对分析结果有什么影响A,偏高 B,偏低 C,无影响 D,不能确定9,以FeSO4溶液滴定0.02000M Ce(SO4)2溶液至等当点时,它们的体积比(VFe(II)/VCe(IV)为0.5000,FeSO4溶液的浓度为A,0.01000M B,0.02000M C,0.03000M D,0.04000M10,在Fe3+,Al3+,Ca2+,Mg2+混合溶液中,用EDTA法测定Fe3+,Al3+,要消除Ca2+,Mg2+的干扰,最简单的方法是A,沉淀分离法 B,控制酸度法 C,络合掩蔽法 D,溶剂萃取法11,用BaSO4重量法测定Ba2+的含量,若结果偏高,可能是A,沉淀包含了BaCl2 B,沉淀剂H2SO4在灼烧时挥发C,沉淀中含有Fe3+等杂质 D,沉淀灼烧时间过长二,填充题(23分)1,定量分析测定中,消除干扰的方法主要有两种,一种是,一种是2,滴定分析通常用于滴定,即被测组份的含量一般在以上3,为了准确测定明矾中铝的含量,以尽可能减少其系统误差,应采用作基准物质来标EDTA.4,若在酸性溶液中用AgNO3滴定Cl-,应采用方式滴定.5,用KMnO4法测定某样品中钙的含量,大量镁存在时,应采用方法来减少镁的沉淀.6,若对某样品的组成不完全清楚,应采用,以此来判断分析过程中有无系统误差.7,HB4O7-的Kb为(已知H2B4O7的Ka1=1.0*10-4,Ka2=1.0*10-9).8,NH2CH2COOH的质子条件为9,对单色指示剂,若指示剂的用量增大,指示剂的变色点会向pH 的方向移动. 10,硼酸是一极弱的酸,但如果于溶液中加入大量的甘油,则可用NaOH准确滴定,这是由于11,对于极弱的酸,可采用下列方法以便准确滴定(1) ,(2) ,(3) .12,用蒸馏法测定铵盐中的氮,通常试样用硫酸消化,然后加,将蒸馏出来,吸收在溶液中.13,对某一分析方法,进行对照实验的目的是为了 .14,小体积沉淀分离法一般是在尽量小的体积和尽量大的浓度,同时有大量没有干扰作用的存在下进行的,由于,所以得到的沉淀的含水量少且比较紧密.三,计算题(35分)1,在100ml pH=10.00的0.05.M EDTA溶液中,加入1g AgCl,问能溶解百分之几(KspAgCl=1.8*10-10,pH=10.00时,logαY(H)=0.45,logKAgY=7.32,AgCl式量:143.32)2,已知Ag+ + e = Ag ;E0=0.80V,Ag2SO3的Ksp=1.5*10-14,计算下列半反应Ag2SO3(s) + 2e = 2Ag + SO32- 的E0.3,在含Zn2+,Ca2+浓度均为0.02000M的pH为10的氨性溶液中,加KCN掩蔽Zn2+,且以同浓度的EDTA溶液滴定Ca2+.若终点时,NH3的浓度c1=0.10M,CN-的浓度c2=0.10M,以甲基百里酚蓝为指示剂,pCaep=5.5,问终点误差有多大(logKZny=16.50,logKCaY=10.69,Zn2+与CN- logβ4=16.7,Zn2+与NH3的logβ1~logβ4分别为2.37,4.81,7.31,9.46.NH3的Kb=1.8*10-5,HCN的Ka=6.2*10-10四,问答题(10分)1,有一试样溶液为强酸性(H+的浓度约为2M),现要在pH=5.0测定试样溶液中的某一组分,问应如何处理才能保证溶液的pH在5.0左右.2,在pH=10.00的氨性溶液中,以铬黑T(EBT)为指示剂,用0.020M EDTA滴定0.020M Ca2+溶液,终点误差高达-1.5%,在不改变现有条件的情况下,如何使滴定终点误差控制在允许的误差范围内五,综合题(10分)试设计采用EDTA络合滴定法,测定Fe3+,Al3+,Ca2+,Mg2+中的Mg2+的简要方案(组分的浓度为2*10-2M)(请写明主要步骤,如酸度,指示剂,掩蔽剂等)(logKFeY=25.1,logKAlY=16.3,logKCaY=10.69,logKMgY=8.70)中国科学院一九九八年招收硕士学位研究生入学考试试题试题名称:分析化学一,选择题:(15分)1,定量化学分析中最难过滤的沉淀类型是:A,凝乳状 B,晶体 C,不可溶的 D,胶凝状 E,同晶的2,下面的酸中哪一种酸最强A,HClO4 B,HF C,H3PO4 D,HCN E,HCl3,计算0.01mol/L氯化钡溶液中的离子强度A,0.03 B,0.04 C,0.01 D,0.025 E,0.0154,有关碳酸盐的误差,如下哪一种叙述是不真实的A,若用甲基橙作指示剂,误差会最大B,若用氢氧化钠作滴定剂,误差会减少C,所配制的氢氧化钠溶液加以保护以防止此类误差D,若装有滴定剂的瓶子配上烧碱石棉剂的保护管,这类误差会减少E,若装有溶液的瓶子的底部有碳酸钠,这类误差会最少5,在实验中,与碱相比,常选择酸作为永久性参考标准.在选择某一酸作为标准溶液时,如下各种因素中哪一种不属考虑范围A,此酸应是高离解的B,此酸应是挥发性的C,此酸的盐应是可溶解的D,此酸应是一强氧化剂E,此酸的溶液应是稳定的6,已知的许多化学反应中,能用作滴定过程而满足必要要求的反应不多.下面所列出的要求中哪一种不能满足滴定的要求A,该反应无副反应B,该反应的平衡常数必须很大C,该反应按一定化学方程式进行D,该反应进行得很慢,以利于观察终点E,应有某些仪器方法以告知分析家停止加入滴定剂7,一溶液含0.01mol/L Ag+和0.01mol/L Ca2+,为选择性沉淀银,应加入哪一种阴离子A,SO42-(Ksp(CaSO4)=4.2*10-5;Ksp(Ag2SO4)=1.2*10-5)B,OH-(Ksp(Ca(OH)2=1.3*10-6;Ksp(AgOH)=2.6*10-8)C,PO43-(Ksp(Ca3(PO4)2=1.3*10-32;Ksp(Ag3PO4)=1.8*10-18)D,如上任何一种E,如上均无8,一溶液含0.10mol/LH2CO3和0.10mol/L NaHCO3,然后加入0.01mol HCl到1L 此溶液中,所得溶液的pH值应是A,6.37 B,6.28 C,5.84 D,4.35 E,2.109,草酸H2C2O4的pKa1=1.22和pKa2=4.19,它的水溶液处在哪一pH值时,HC2O4 -的浓度达到最大值A,1.23 B,4.19 C, 7.55 D,2.17 E,14.0010,用1.00L 1.00mol/L氢氧化钠溶液完全中和50ml硫酸溶液,此硫酸溶液的浓度(mol/L)是A,2.0 B,0.1 C,1.0 D,0.2 E,10二,填空题:(15分)1,系统误差影响分析结果的;偶然误差影响分析结果的;在没有误差的情况下,总体平均值就是 .2,按照有效数字规则,计算下式所得的结果=%100*3000*000.100.52*)55.5*05032.000.20*0500.0(3,NaNH4HPO4溶液的质子条件式是4,六甲基四胺(CH2)6N4的pKb=8.85,它的共轭酸的化学式是;其酸式离解常数pKa= .若以(CH2)6N4与HCl构成一缓冲溶液,它的缓冲范围是pH= ,当缓冲剂(CH2)6N4的浓度c一定时,它的缓冲容量在[(CH2)6N4]:[HCl]= 时最大. 5,于一溶液体系中,某一金属离子M2+与配位体H2Y2-反应生成配合物MY2-,但M2+,H2Y2-和MY2-均发生副反应,其副反应系数分别是αM,αY和αMY,则此配合物的稳定常数KMY与条件稳定常数K'MY间的关系是 .6,用Fe3+滴定Sn2+至50.00%处,溶液的电位为+0.14V;滴定至化学计量点处,溶液的电位为+0.32V.则Fe3+/Fe2+电对的克式量电位是 V;Sn4+/Sn2+电对的克式量电位是V.7,常将各种检测仪器与色谱相连接,当分离的溶质出现在检测器中时而检测之.评估某一检测器性能的指标是 .8,用来测定某一质子的质量及电子的质量并具有照相形式的记录能力的仪器是 .9,原子吸收光谱线宽度受外界影响,主要有变宽和变宽.10,酸性溶液中的Li+,Na+和K+的最佳的分离方法是 .三,计算题:(共70分)1,用一新方法测得铁矿石中的百分含量时,得到如下7个数据:66.29,66.40,66.35,66.61,66.02,66.50和66.42,求出结果的平均值和变异系数(相对标准偏差).若Fe含量的标准值为66.60%,问此新方法是否存在系统误差(置信度为95%). (10分)tα,f值f 4 5 6 7 8 9α=0.10 2.132.021.941.901.861.83α=0.05 2.782.572.452.362.312.262,欲将100ml 0.10mol/LHCl溶液的pH值从1.00增加至4.44时,需加固体醋酸钠CH3COONa多少克(不考虑加入CH3COONa后溶液的体积变化)Mr(CH3COONa)=82.0g/mol;pKa(CH3COOH)=4.74 (5分)3,用0.20mol/L NaOH溶液滴定0.20mol/L HCl溶液(其中含有0.1mol/L NH4Cl).(1)计算化学计量点处的pH值(2)若滴定至pH=7.00,问终点时有百分之几的NH4+被滴定及其滴定误差(NH4+的pKa=9.26). (10分)4,计算在pH=10.00,[NH3]=0.10mol/L的情况下,用0.0200mol/L EDTA溶液滴定0.0200mol/L Zn2+ 溶液时,化学计量点处的pZn和pZn'值.(logKZnY=16.5;pH=10.00时,logαY(H)=2.4;Zn(NH3)1~42+的logβ1~logβ2分别是2.37,4.81,7.31和9.46) (10分)5,称取含有KI试样0.5000g,溶解于水中.用Cl2将I-氧化成IO3-,煮沸除去过量的Cl2后,加入过量KI并酸化,析出的I2耗去0.02082mol/L Na2S2O3溶液21.30ml.计算此试样中KI%.(Mr(KI)=166.0g/mol) (5分)6,重量法测定铁,将Fe(OH)3沉淀灼烧成称量形式Fe2O3的质量测得试样中铁的含量为10.11%.若灼烧过的Fe2O3中含有3.00%的Fe3O4,求试样中铁的真实含量.Mr(Fe)=55.85g/mol,Mr(Fe2O3)=159.69g/mol,Mr(Fe3O4)=231.54g/mol (10分) 7,将15mol氯化银沉淀置于500ml氨水中,已知平衡时,[NH3]=0.50mol/L.计算溶液中的Ag+的浓度.(已知:Ag+-NH3络合物的β1=103.24,β2=107.05,Ksp(AgCl)=1.8*10-10) (5分) 8,用25.00ml 苯萃取一100ml 0.1000mol/L的有机弱酸HA,取水相25.00ml,用0.02000mol/LNaOH溶液滴定,消耗20.00ml.计算该一元弱酸在两相中的分配数KD (8分)9,将Na2HPO4,NaH2PO4和H3PO4各1m mol溶解在10ml 水中,将此溶液注入一Na+型离子交换柱(溶液中呈酸的H+和其它阳离子从柱上交换出Na+)上,再加入100ml 水淋洗交换柱并收集在一烧杯中(1)烧杯中Na+的浓度是多少(2)溶液的pH值是多少(H3PO4之pKa1,pKa2和pKa3分别是2.12,7.20和12.36) (7分)中国科学院一九九九年招收硕士学位研究生入学考试试题试题名称:分析化学(乙)一,选择题(共21分)1,在有过量I-时,碘在水溶液中的存在形式主要是I3-,亦有少量I2,而被有机溶剂萃取的是I2,则分配比D可表示成( ).(O表示有机相,W表示水相)A,D = [I2]O / [I2]W B,D = {[I3-]W + [I2]W} / [I2]OC,D = [I2]W / [I2]O D,D = [I2]O / {[I3-]W + [I2]W}2,在金属离子M和N等浓度的混合液中,以HIn为指示剂,用EDTA标准溶液直接滴定其中的M,若TE≤0.1%, pM=±0.2,则要求( ).A,logKMY-logKNY ≥ 6 B,K'MY Ca3(PO4)2;利用氧化还原反应使弱酸转变为强酸,如H2SO3-->H2SO4;在某些酸性比水更弱的非水介质中滴定12,浓碱NaOH,NH313,检验是否存在系统误差14,盐类,离子的水合程度低三,计算题1,11.7%2,0.392V3,0.048%四,问答题1,HAc的pKa=4.74,采用HAc-NaAc缓冲溶液.向强酸性溶液中加入4M的NaAc. 2,在溶液中加入少量的MgY五,综合题NH4F络合掩蔽Fe3+,Al3+;EDTA滴定Ca2+,Mg2+总量.Ca2+ --> CaC2O4↓,分离单独滴定.中国科学院一九九八年分析化学考研试题参考答案一,选择题AAA DBBDE二,填空题1,准确度,精密度,真实值3,[NH3]+[OH-]+[PO43-]=[H+]+[H2PO4-]+2[H3PO4]4,(CH2)6N4+,5.15,4.15-6.15,2:15,lgK'MY = lgKMY - lgαM - lgαY + lgαMY6,0.68,0.147,桑德尔指数(灵敏度)8,9,多普勒,洛伦兹10,离子交换柱三,计算题1,有2,1.23g3,5.28,0.54%,0.27%4,10.8,5.315,2.45%6,10.12%7,8*10-8(要判断是否全溶)8,219,0.0545mol/L,9.65中国科学院一九九九年分析化学考研试题参考答案一,选择题DAACC AADCD BBBAA CAAAD D二,填空题1,NH3~NH4+溶液作为缓冲液,维持滴定弱碱性环境;NH3作为辅助络合剂,防止Zn2+沉淀2,最低酸度,指示剂3,柱层析分离,纸色谱分离4,直接滴定法,置换滴定法,间接滴定法,返滴定法5,二,加入大量NH4Cl的作用:1)控制溶液的pH值为8~9,2)利用NH4+作抗衡离子,减少氢氧化物沉淀物对其他金属离子的吸附,3)铵盐是一种电解质,可促进胶状沉淀凝聚.6,13.00,16.307,H+ + OH- = H2O8,实际部分,溶液离子强度,理想溶液9,2.0010,K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 7H2O + 3I2,I2 + 2Na2S2O4 = 2NaI + Na2S4O611,偏低,偏高三,计算题1,-0.0017%3,舍,无系统误差4,1.01,3.7*10-10,10-24.685,题目不完整6,13,10.6,2.6%第6题第3小问是一道很典型的题目强碱和弱碱并存,不能用终点误差公式.化学计量点时:[H+]+[HCN]=[OH-],题目是酸滴定碱,所以TE%= [H+]+[HCN]-[OH-])/CHCl若题目是碱滴定酸,则TE%=([碱]-[酸])/C碱,这公式在任何滴定条件下都适用.。