高职药学专业无机化学练习题
- 格式:doc
- 大小:260.50 KB
- 文档页数:36

化学平衡1.平衡常熟的数值是反应进行程度的标志,所以对某反应不管是正反应还是逆反应其平衡常数均相同。
()2.在某温度下,密闭容器中反应2NO(g)+O2(g)=2NO2 (g)达到平衡,当保持温度和体积不变充入惰性气体,总压将增加,平衡向气体分子数减少即生成NO2 的方向移动。
()3.质量作用定律适用于一步完成的简单反应,而化学平衡定律适用于任何可逆反应。
()4.恒温下,当一化学平衡发生移动时,虽然其平衡常数不发生变化,但转化率却会改变。
()5.可逆反应达平衡后,各反映物和生成物的浓度一定相等。
()6.反应前后分子数相等的反应,改变体系的总压强力对平衡没有影响。
()7.标准平衡常数随起始浓度的改变而变化。
( )8.对任何可逆反应而言,其正反应和逆反应的平衡常数之积等于1。
( )酸碱平衡1、下列物质中,属于质子酸的是()A.HAcB. CN-C. Ac-D.Na+ E.S2-2、下列物质中,属于质子碱的是()A. K+B. NH3C. HClD. H3PO4E. NH4+3、下列物质中,属于两性物质的是()A. H2OB. H2SC. HCND. NH4+E. K+4、H3O+、H2S的共轭碱分别是()A.OH-、S2-B. H2O、HS-C. H2O、S2-D. OH-、HS-E. H2O、H2S5、HPO42-的共轭酸是()A. H3PO4B. H2OC. H2PO4-D. PO43-E. HPO42-6、共轭酸碱对的酸度常数K a和碱度常数K b 之间的关系式为()A. K a÷K b=K WB. K a+K b=K WC. K a -K b= K WD. K a×K b= K WE. K a× K b× K W = 07、已知温度下,K a,HAc=1.76×10-5,K a,HCN=4.93×10-10则下列碱的碱性强弱次序为()A. Ac-> CN-B、Ac-= CN-C、Ac-< CN-D、 Ac->> CN-E、Ac-<< CN-8、在可逆反应:HCO3-(aq)+OH-(aq)CO32-+H2O(L)中,正逆反应中的布朗斯(aq)台德酸分别是()A、HCO3-和CO2-B、 HCO3-和H2OC、 OH -和HO2D、OH-和CO2-E、 H2O和CO2-9、对于反应HPO42-+H2O H2PO4-+OH-,正向反应的酸和碱各为()A、H2PO4-和OH-B、HPO42-和H2OC、H2O和HPO42-D、H2PO4-和HPO42-E、H2PO4-和H2O10、在HAc溶液中,加入下列那种物质可使其电离度增大()A、A. HCl B.NaAc C.HCN D.KAcE.NaCl11、往氨水溶液中加入一些固体NH4Cl,会使()A、氯化铵的电离度变小B、氨水的电离度不变C、氨水的电离度增大D、氨水的电离度变小E、氯化铵的电离度变大12、下列关于缓冲溶液的叙述,正确的是()A. 当稀释缓冲溶液时, pH值将明显改变B. 外加少量强碱时,pH值将明显降低C. 外加少量强酸时,pH值将明显升高D. 有抗酸、抗碱、抗稀释,保持pH值基本不变的能力E. 外加大量强酸时,pH值基本不变13、影响缓冲溶液缓冲能力的主要因素是()A. 弱酸的pK aB. 弱碱的pK aC. 缓冲对的总浓度D. 缓冲时的总浓度和缓冲比E. 缓冲比14、下列哪组溶液缓冲能力最大()A. 0.1mol·L-1HAc-0.1 mol·L-1NaAcB. 0.2 mol·L-1HAc-0.2mol·L-1NaAcC. 0.1 mol ·L-1HAc-0.2 mol·L-1NaAcD. 0.2mol·L-1HAc-0.01mol·L-1NaAcE. 0.2mol·L-1HAc-0.1mol·L-1NaAc15、欲配制pH=3的缓冲溶液,应选用()A、HCOOH-HCOONa(pK a,HCOOH =3.74)B、HAc-NaAc(pK a,HAc=4.75)C、NH4Cl-NH3(P Ka,NH4+ =9.25)D、NaH2PO4-Na2HPO4(pK a,H2PO4-=7.21)E、NaHCO3-Na2CO3(pK a,HCO3-=10.25)16、H2PO4-—HPO42-缓冲系的pH缓冲范围是()(已知pK a H2PO4-=7.21,pK b HPO42-=6.79)A. 7.00-10.0B. 8.00-12.0C. 9.00-14.0D. 5.79-7.79E. 6.21-8.2117、根据酸碱质子理论,下列叙述中错误的是()A. 酸碱反应实质是质子转移B. 质子论中没有了盐的概念C. 酸越强其共轭碱也越强D. 酸失去质子后就成了碱E. 酸碱反应的方向是强酸与强碱反应生成弱碱与弱18、下列叙述错误的是()A. [H+]越大,pH越低B. 任何水溶液都有[H+][OH-]=K WC. 温度升高时,K W值变大D. 溶液的pH越大,其P OH就越小E.在浓HCl溶液中,没有OH-存在19、于氨水中加入酚酞,溶液呈红色,若加入固体NH4Cl,下列说法不正确的是()(酚酞的酸色为无色,碱色为红色)A. 溶液的红色变浅B. pH值降低C.氨水的电离度减小D.氨水的电离平衡向左移动E.溶液的红色加深20、下列各组等体积混合溶液,无缓冲作用的是()A. 1.0 mol·L-1HCl和1.0 mol·L-1KClB. 0.2 mol·L-1HCl和0.2 mol·L-1NH3·H2OC. 0.2 mol·L-1KH2PO4和0.2 mol·L-1Na2HPO4D. 0.2 mol·L-1NaOH和0.4 mol·L-1HAcE. 1.0 mol·L-1KOH和1.0 mol·L-1KCl21、获得较大的[S2-],需向饱和H2S水溶液中加入A. 适量的蒸馏水B. 适量的HCI溶液C. 适量的NaOH溶液D. 适量的硫粉末E. 大量的HCI溶液22、于0.1mol·mol.L-1 HAc溶液中,加入NaAc晶体会使溶液的pHA. 增大B. 不变C. 减小D. 先增大后变小 E. 先变小后增大23、下列离子中碱性最强的是A. CN-B.Ac-C.NO2-D.NH4+E. CI-24、H2AsO4-共轭碱是()A. H3AsO4B. HAs O42-C. AsO43-D. H2AsO3-E. HAsO4下列各组分子或离子中不属于共轭酸碱关系的是A. Cr[(H2O)6]3+和Cr[(OH)(H2O)5]2+B. H2CO3和CO32-C. H2NCH2COO-和H3NCH2COO-D. H2PO4-和HPO42-A、H2OB、NH3C、H2PO4-D、HPO42-E、PO42-25、OH-的共轭酸是()26、HPO42-的共轭碱是()A、CN-(K a,HCN=4.93×10-10)B、S2-(K a,HS-=1.1×10-12)C、F-(K a,HF=3.5×10-4)D、Ac-(K a,HAc=1.76×10-5)E、Cl-27、在水溶液中,碱性最强的是()28、在水溶液中,碱性最弱的是()A、Cu2+B、NH3C、HAcD、HCNE、H2S29、路易斯酸是()30、既是路易斯碱也是布朗斯台德碱的是()A、0.02 mol.L-1HCl和0.02 mol.L-1NH3·H2OB、0.5 mol.L-1H2PO4-和0.5 mol.L-1HPO42-C、0.5 mol.L-1H2PO4-和0.2 mol.L-1HPO42-D、0.1 mol.L-1H2PO4-和0.1 mol.L-1HPO42-E、0.05 mol.L- H2PO4-和0.05 mol.L-1 HPO42-缓冲溶液1.欲配制pH=5的缓冲溶液,应选用那种共轭酸碱对较为合适A. NaH2PO4-Na2HPO4(pKa,H2PO4-=7.21)B. NaHCO3-Na2CO3(pKa,HCO3-=10.25)C. NH3·H2O-NH4Cl(pKa,NH4+ =9.25)D. HAc-NaAc(pKa,HAc=4.75)E. HCOOH-HCOONa(pKa,HCOOH =3.77)2.NH4Ac在水中存在如下平衡:NH3+H2O NH4++OH-K1 NH4++Ac-NH3+HAc K22H2O OH-+H3O+ K3 HAc+ H2O Ac-+H3O+ K4这四个反应的平衡常数之间的关系是A. K3=K1·K2·K4 B. K4=K1·K2·K3C. K3·K4= K1·K2D. K1·K4=K2·K3E. K3=(K1·K2)/K43.计算弱酸的电离常数,通常用电离平衡时的平衡浓度而不用活度,这是因为A.活度即浓度B.稀溶液中误差很小 C.活度与浓度成正比D.活度无法测定E.稀溶液中误差很大4.经测定强电解质溶液的电离度总达不到100%,其原因是A. 电解质不纯B. 电解质与溶剂有作用 C. 有离子氛和离子对存在D. 电解质没有全部电离E. 电解质很纯5.既是路易斯碱又是布朗斯台德碱的物质是A. Cu2+B. NH3C. HAcD. HCNE. Ag+6.沉淀生成的必要条件是A. Q C = KspB. Q C < KspC. 保持Q C不变 D. Q C > Ksp E. 温度高7.稀溶液依数性的本质是A. 渗透压B. 沸点升高C. 蒸气压降低D. 凝固点降低E. 蒸气压上升8.在多电子原子中,决定电子能量的量子数为A.n B. n和l C. n, l 和m D.l E. n和m9.下列叙述错误..的是A.[H+]越大,酸性越强,溶液的pH值越大。
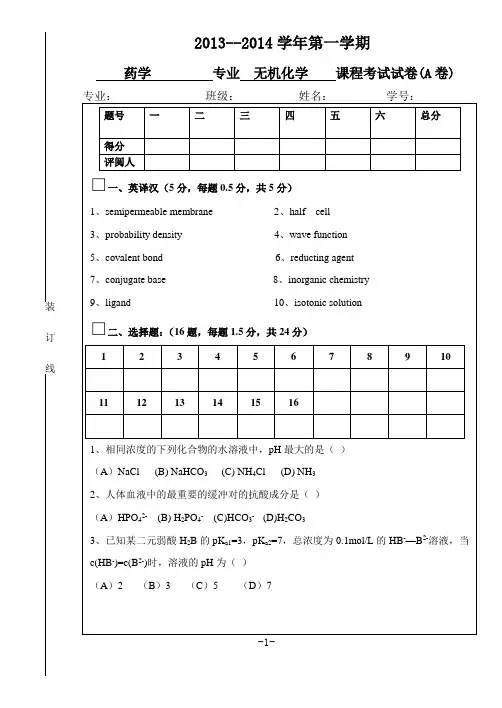

药学无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪项不是无机化合物的特点?A. 含有碳元素B. 大多数无机化合物是离子化合物C. 通常具有高熔点和高沸点D. 容易形成晶体2. 根据元素周期表,下列元素中属于非金属元素的是:A. 锂(Li)B. 钠(Na)C. 氧(O)D. 铁(Fe)3. 以下哪种化合物不是盐类?A. 硫酸钠B. 硝酸钾C. 氢氧化钠D. 碳酸钙4. 根据离子键理论,下列哪种情况离子键最强?A. 离子半径大B. 离子电荷高C. 离子半径小D. 离子电荷低5. 以下哪种反应不是氧化还原反应?A. 铁与氧气反应生成铁的氧化物B. 氢气与氧气反应生成水C. 碳酸钠与盐酸反应生成氯化钠、水和二氧化碳D. 铜与硝酸银反应生成硝酸铜和银二、填空题(每空2分,共20分)6. 原子序数为11的元素是_________。
7. 元素周期表中,第IA族元素的特点是具有_________个价电子。
8. 根据路易斯酸碱理论,能给出质子的物质是_________。
9. 硫酸的化学式为H2SO4,其中S的氧化态为_________。
10. 根据酸碱质子理论,能结合质子的物质是_________。
三、简答题(每题10分,共30分)11. 简述什么是配位化合物,并给出一个例子。
12. 描述什么是酸碱中和反应,并解释其原理。
13. 解释什么是氧化数,并给出一个具体元素的氧化数计算例子。
四、计算题(每题15分,共30分)14. 某溶液中含有0.01摩尔的NaOH,若用0.02摩尔/升的HCl溶液滴定至终点,求消耗的HCl溶液体积。
15. 已知某化合物的化学式为Fe2O3,求其摩尔质量,并计算1摩尔Fe2O3中含有多少摩尔的铁原子。
答案:一、选择题1. A2. C3. C4. B5. C二、填空题6. 钠(Na)7. 一8. 酸9. +610. 碱三、简答题11. 配位化合物是由中心金属离子或原子与配体通过配位键结合形成的化合物。

无机化学试题及答案大专一、选择题(每题2分,共20分)1. 以下哪种元素属于碱土金属?A. 钠B. 镁C. 铝D. 钾答案:B2. 化合物H2O中氢元素的化合价是:A. +1B. -1C. +2D. -2答案:B3. 以下哪种化合物是共价化合物?A. NaClB. H2OC. MgOD. NaOH答案:B4. 元素周期表中,第IA族元素的价电子数是:A. 1B. 2C. 3D. 4答案:A5. 以下哪种晶体属于分子晶体?A. NaClB. SiO2C. H2OD. MgO答案:C6. 以下哪种化合物是离子化合物?A. CO2B. H2OC. NaClD. CH4答案:C7. 以下哪种元素的原子半径最大?A. 氟B. 钠C. 铝D. 氧答案:B8. 以下哪种元素的电负性最高?A. 氟B. 氧C. 钠D. 铝答案:A9. 以下哪种化合物的熔点最高?A. 干冰(CO2)B. 冰(H2O)C. 氯化钠(NaCl)D. 氯化镁(MgCl2)答案:C10. 以下哪种元素的原子序数是26?A. 铁B. 钴C. 锌D. 铁答案:C二、填空题(每题2分,共20分)1. 原子序数为11的元素是______。
答案:钠2. 元素周期表中,第ⅦA族元素的价电子数是______。
答案:73. 化合物Na2O的化学式表示的是______。
答案:氧化钠4. 元素周期表中,第ⅢB族元素的价电子数是______。
答案:2或35. 化合物NH3中氮元素的化合价是______。
答案:-36. 元素周期表中,第ⅠB族元素的价电子数是______。
答案:17. 化合物HCl的化学式表示的是______。
答案:氯化氢8. 元素周期表中,第ⅥA族元素的价电子数是______。
答案:69. 化合物CaF2的化学式表示的是______。
答案:氟化钙10. 元素周期表中,第ⅡA族元素的价电子数是______。
答案:2三、简答题(每题5分,共30分)1. 请解释什么是离子键?答案:离子键是由正离子和负离子之间的静电吸引力形成的化学键。

一、选择题1.下列元素中最可能形成共价化合物的是( )A Ca B Mg C Na D Li2.氯化铁溶于水时发生下列反应:FeCl 3+3H 2O Fe(OH)3+3HCl(吸热),为了抑制水解,得到澄清的溶液,可采取的措施是 ( )(A) 升高温度; (B) 大量加水; (C) 加少量NaOH ; (D) 加少量盐酸。
3. 下列物质沸点最低的是( )。
(A )NH 3; ( B )PH 3; (C ) AsH 3;(D )SbH 3。
4.n 、l 、m 确定后,仍不能确定该量子数组合所描述的原子轨道的 ( )(A) 数目; (B) 形状; (C) 能量; (D) 所填充的电子数目5. 已知θϕ(A / B) <θϕ(C / D),在标准状态下自发进行的反应为 ( )(A)A+B→C+D; (B)A+D→B+C; (C) B+C→A+D; (D) B+D→A+C。
6.已知N2(g)+3H2(g)=2NH3(g),1/2N2(g)+3/2H2(g)=NH3(g) 1/3N2(g)+H2(g)=2/3NH3(g)的平衡常数分别为K1,K2和K3,则其关系是( )A K1=K2=K3 B K1=(K2)2=(K3)3 C K1=1/2K2=1/3K3 D K1=(K2)1/2=(K3)1/3 7.下列元素在性质上最相近的是 ( )(A) B 和Si ; (B) B 和Al ; (C) B 和Mg ; (D)B 和C8.下列反应达到平衡时,2SO2(g)+O2(g)=2SO3(g),保持体积不变,加入惰性气体He,使总压力增加一倍,则( )A 平衡向左移动 B 平衡向右移动 C 平衡不发生移动 D 条件不充足,不能判断9.往0.1mol/LHAc溶液中,加入一些NaAc晶体,会使( )A HAc的Ka增大 B HAc的Ka减小 C HAc的解离度增大 D HAc的解离度减小10. 某可逆反应在一定条件下达到平衡,其平衡常数为Ka ,当加入催化剂后,下列说法正确的是( )(A)正反应速率提高,逆反应速率降低;平衡常数不变(B)正反应速率降低,逆反应速率提高;平衡常数不变(C)正反应速率和逆反应速率同时提高或降低;平衡常数变大(D)正反应速率和逆反应速率同时提高或降低;平衡常数不变11.下图中表示基 态Fe原子的3d和4s轨道中8电子排布正确的是( );;12.下列化合物中,不存在氢键的是 ( )(A) HNO 3; (B) H 2S ; (C) H 3BO 3; (D) H 3PO 3。

药用无机化学试题及答案一、选择题(每题2分,共20分)1. 下列哪个元素不是人体必需的微量元素?A. 铁B. 锌C. 硒D. 铅答案:D2. 钙离子在体内主要参与哪种生理功能?A. 神经传导B. 肌肉收缩C. 细胞信号转导D. 以上都是答案:D3. 以下化合物中,哪一个不是无机化合物?A. 氯化钠B. 硫酸钾C. 葡萄糖D. 碳酸氢钠答案:C4. 以下哪种物质是胃酸的主要成分?A. 盐酸B. 硫酸C. 硝酸D. 醋酸5. 哪种元素在体内过量会导致氟骨病?A. 钙B. 氟C. 镁D. 钾答案:B6. 以下哪种元素是人体必需的宏量元素?A. 铜B. 铁C. 锌D. 钠答案:D7. 以下哪种化合物不是抗酸药?A. 氢氧化铝B. 碳酸氢钠C. 硫酸镁D. 碳酸钙答案:C8. 以下哪种元素是维生素B12的组成部分?A. 钴B. 铁C. 锌D. 铜答案:A9. 以下哪种化合物是常用的消毒剂?B. 碘化钾C. 过氧化氢D. 碳酸氢钠答案:C10. 以下哪种元素是人体必需的微量元素?A. 钠B. 钾C. 钙D. 碘答案:D二、填空题(每题2分,共20分)1. 人体必需的微量元素包括____、____、____、____、____、____、____、____、____、____。
答案:铁、锌、铜、硒、碘、钴、钼、铬、氟、锰2. 钙离子在体内参与的主要生理功能包括____、____、____。
答案:神经传导、肌肉收缩、细胞信号转导3. 胃酸的主要成分是____,其化学式为____。
答案:盐酸,HCl4. 以下化合物中,____是无机化合物,____是有机化合物。
答案:氯化钠,葡萄糖5. 氟骨病是由于体内____元素过量引起的。
答案:氟6. 人体必需的宏量元素包括____、____、____、____、____、____、____、____。
答案:钠、钾、钙、镁、磷、硫、氯、碳7. 抗酸药主要包括____、____、____、____。

医专无机化学试卷(AB)--附答案医专无机化学试卷(A)一、选择(2×15)1. 1. 基态K原子的外层钠原子的四个量子数是()A. 4,0,0,+1/2B. 4,3,0,+1/2C. 4,2,0, +1/2D. 4,1,0, -1/22.某元素的价电子构型为3d14s2,则该元素的原子序数为()A.20B.21C.30D.253.下列运动状态中,正确的是( )A.n=1,l=2 ,m=0B.n=2,l=0,m=±1C. .n=3,l=3,m=±3D.n=4,l=3,m=±24.NH3分子中的碳采取sp3杂化,分子的空间构型为()A. 三角形B. 直线形C.正四面体形D. 三角锥形5.下列分子中偶极矩不等于零的是( )A.CO2 B.CH4C.H2O D.BF36.下列关于分散系概念的描述错误的是( )A.分散系由分散相和分散介质组成B.分散系包括均相体系和非均相体系C.高分子溶液属于胶体分散系D.分散相颗粒直径大于100nm的体系成为胶体分散系7.淀粉溶液中含有少量的NaCl,出去NaCl可用的方法是( )A.萃取B.渗析C.过滤D.盐析8.下列分散系由丁达尔现象,加少量电解质不聚沉的是( )A. NaCl溶液B.AgI溶胶C.蛋白质溶液D.泥浆水9.表面张力与下述哪些因素无关( )A.物质的本性B.物质总的体积C.温度D.与物质接界的其它物质10.可逆反应2A+B 2C已达到平衡,升高温度时,生成物C的浓度增加,这个可逆反应的正反应是( )A.放热反应B.吸热反应C.没有明显的热效应D.无法判断11.下列物质中能组成缓冲对的是( )A.NH3H2O NaOH b.HCl NaCl C. NaHCO3Na2CO3D. NH3H2O CH3COOH12.关于速率常数k的叙述不正确的是( )A. k与反应物浓度成反比B.条件一定时,反应的k值恒定不变C. k值越大,说明该反应速率越快D. k值随温度的改变而改变13.今有四种溶液, ①1.0mol.L NaCl; ②1.0mol.LC 6H12O6; ③1.0mol.LH24; ④1.0mol.LCaCl2,其沸点由高到低的排列顺序为( )A. ①>②>③>④B.③>②>①>④C. ④>③>①>②D.③>①>②>④14.下列物质中加入少量AgNO 3,能产生AgCl沉淀的是( )A.[Pt(NH3)2Cl2] B.K2[PtCl4] C.[Ag(NH3)2] Cl D.H[AuCl4]15.下列属于共轭酸碱对的是( )2SO4- SO42- B.H3PO4- H3PO4- C.HAc-Cl- D. HCl-Ac-二、填空题(每题2分,共30分)1.描述电子运动状态的四个量子数是, , 和.2.原子序数为17的元素位于周期表的周期, 族.3.某元素的价电子构型是3s23p4,其应在周期表的周期, 族,属于区元素.4.下列分子是极性分子, 非极性分子.BCl3H2S CCl4CHCl35.碘酒,葡萄糖溶液,NaCl溶液,泥浆都属于分散系,其中分散质分别是,分散剂分别是.6.晶体渗透压是由产生的,其主要的生理功能为;胶体的渗透压是由产生的,主要生理功能是.7.溶胶稳定的因素有, , ,加入可增加溶胶的稳定性.影响表面张力的因素有, , .8.溶液产生渗透现象的条件是和,从净结果看,总是由溶液向溶液渗透. 9活化能是指活化分子的与反应物分子的平均能量之差。

医学无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪个元素不属于碱金属族元素?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 钙(Ca)2. 人体中含量最多的无机元素是:A. 碳(C)B. 氧(O)C. 氢(H)D. 氮(N)3. 以下哪种化合物是强酸?A. 碳酸(H2CO3)B. 醋酸(CH3COOH)C. 硫酸(H2SO4)D. 磷酸(H3PO4)4. 以下哪种化合物属于两性化合物?A. 氧化铝(Al2O3)B. 氧化锌(ZnO)C. 氧化铁(Fe2O3)D. 氧化铜(CuO)5. 以下哪种元素的化合物在医学上常用作抗酸药?A. 镁(Mg)B. 钙(Ca)C. 铝(Al)D. 铁(Fe)6. 以下哪种元素的离子在血液中运输氧气?A. 铁(Fe)B. 铜(Cu)C. 锌(Zn)D. 锰(Mn)7. 以下哪种元素的缺乏会导致甲状腺功能减退?A. 碘(I)B. 硒(Se)C. 钼(Mo)D. 钴(Co)8. 以下哪种元素的过量摄入会导致水俣病?A. 汞(Hg)B. 铅(Pb)C. 砷(As)D. 镉(Cd)9. 以下哪种化合物是常用的消毒剂?A. 过氧化氢(H2O2)B. 氯化钠(NaCl)C. 碳酸氢钠(NaHCO3)D. 硫酸钠(Na2SO4)10. 以下哪种化合物是常用的止血剂?A. 硫酸铁(FeSO4)B. 氯化钙(CaCl2)C. 硫酸铝(Al2(SO4)3)D. 硫酸铜(CuSO4)二、填空题(每空1分,共20分)11. 人体中的常量元素包括氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁等,其中含量最高的元素是_________。
12. 人体必需的微量元素包括铁、钴、铜、锌、铬、锰、钼、氟、碘、硒等,其中对甲状腺功能至关重要的元素是_________。
13. 钙是构成人体骨骼和牙齿的主要成分,它在血液中的浓度需要维持在一定范围内,过高或过低都会引起疾病,血钙过低会引起_________。

高职药学专业《无机化学》练习题[第01章物质的量]一、名词解释1、气体摩尔体积2、阿伏伽德罗定律二、单项选择题1、摩尔是()A、物质的量的单位B、摩尔质量的单位C、体积的单位D、物质微粒的单位2、SO42-的摩尔质量是()A、96gB、48g/molC、96g/molD、98g/mol3、H2SO4的摩尔质量是()A、98gB、49g/molC、96g/molD、98g/mol4、NaOH的摩尔质量是()A、40gB、40g/molC、40 molD、40 L5、Na+的摩尔质量是()A、23 g/molB、22 g /molC、24g/molD、11g/mol6、1 mol水蒸汽、1 mol液态水、1 mol冰各自所含的分子个数()A、一定相等B、水蒸汽含水分子多C、液态水含水分子多D、冰含水分子多7、下列叙述中,错误的是()A、90 g H2O中,含有的水分子数为5N AB、90 g H2O中,含有的氢原子数为10N AC、90 g H2O中,含有的氧原子数为5N AD、90 g H2O中,含有的水分子数为N A8、下列叙述中不正确的是()A、摩尔是物质的量的单位B、氢气的摩尔质量是2g/molC、物质的摩尔质量如果用克做单位,数值上就等于它的相对分子质量D、物质的摩尔质量如果用g/mol做单位,在数值上就等于该物质的化学式量9、下列物质中,物质的量最大的是()A、4℃时10mL水B、0.8 mol H2SO4C、54 g 的铝D、3.01×1022个的氧分子10、2 mol MgCl2和1mol AlCl3中,Cl- 的物质的量之比为()A、3:2B、2:3C、4:3D、3:411、相同质量的下列物质,所含分子数最多的是()A、H2SO4B、O2C、CO2D、H212、相同质量的下列物质,所含分子数最少的是()A、H2SO4B、O2C、CO2D、H213、标准状况下,体积相同的下列气体,质量最大的是()A、N2B、CO2C、SO2D、CH414、相同数目的NO2和CO2在标准状况下的体积比为()A、1:1B、1:2C、3:2D、2:315、在同温同压下,相同体积的氧气和二氧化碳气的分子数目比为()A、1:4B、1:2C、2:1D、1:116、在标准状况下,下列气体中密度最小的是()A、H2B、N2C、O2D、Cl217、下列叙述中,错误的是()A、1 mol 任何物质含有的基本单元数都为阿伏伽德罗常数B、同温同压下,相同体积的任何气体都含有相同数目的分子C、标准状况下,1 mol 任何气体的体积都约为22.4LD、标准状况下,相同质量的任何气体具有相同的体积三、填空题1、物质的量的符号是,单位是。

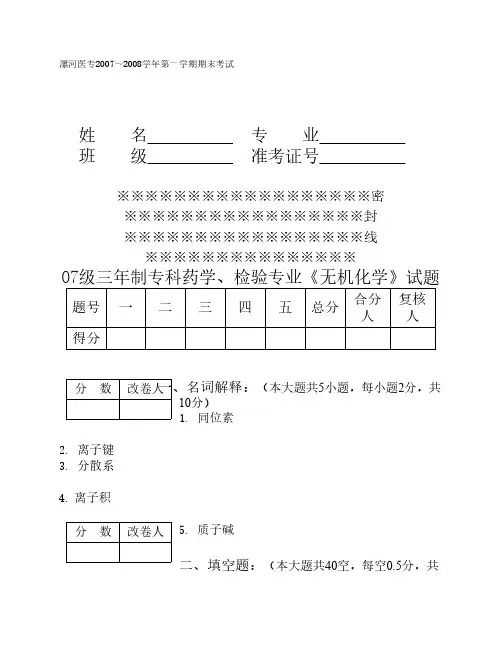
漯河医专2007~2008学年第一学期期末考试07级三年制专科药学、检验专业《无机化学》试题一、名词解释:(本大题共5小题,每小题2分,共10分)1. 原子轨道2. 化学键3.渗透压4.溶度积5.氧化还原反应二、填空题:(本大题共40空,每空0.5分,共20分)1.根据分散相粒子直径的大小,可将分散系分为______、______、______三大类。
2. A 原子L 层的电子总数跟M 层(最外层)中p 轨道的电子数的差为3 。
则A 原子核外电子总数是__个,它有__个电子层,有__个未成对电子。
3.原子间通过__而形成的化学键称为共价键。
共价键具有__性和__性。
4. 各溶液组成表示法可相互换算。
换算的依据是__。
需要时可借助__和__实现换算。
5. 溶胶稳定的因素有______、______、______,加入______可增加溶胶的稳定性。
6.已知合成氨反应的浓度数据如下:初始浓度(mol/L) 3.0 1.0 02秒末浓度(mol/L) 1.8 0.6 0.80则v NH 3 =______v H 2 =______v N2 =______v NH3:v H 2:v N2 =______7. K a、K b、、K w分别称为______、______和______,它们的大小与______和______有关而与______无关。
8. 铜锌原电池工作时,电子从______流向______,电流的方向是从______到______。
正极发生了______反应,负极发生了______反应9.NH3分子中有多少个配位原子,乙二胺作配体,则有______个配位原子。
它们分别属于______配体和______配体。
10.锂和钠在空气中燃烧,生成氧化物的名称是______和______,化学式分别为______和______。
11. 漂白粉的有效成分为____________。
三、单项选择题:(本大题共40小题,每小题1分,共40分)1. 室温下1.0 mol/L氨水中,水的离子积常数K w为A. 1.0 ×10 -10B. 1.0 ×10 -4C. 1.0 ×10 -14D. 1.0 ×10 -82. 下列溶液中酸性最强的是A. pH = 5B. pH = 2C. [H+] = 0.1 mol/LD. [OH-] = 0.01 mol/L3. 反应 2 HBr (气)H2(气)+ Br2(气)- Q达到平衡时,要使混合气体颜色加深,可采取的方法A. 减小压强B. 增大H2 浓度C. 升高温度D. 使用催化剂4.将As2S3胶体中混有的NaCl分离出来的方法是A. 透析B. 冷却结晶C. 过滤D. 凝聚5.下列分子中属于极性分子的是A. NH3B. CH4C. CO2D. O26. N电子层最多可容纳的电子数目为A. 8B. 10C. 18D.327.决定氢原子中电子能量的量子数是A. n和lB. nC. lD. l和m8.氮分子中的化学键是A. 3个σ键B. 1个σ键,2个π键C. 3个π键D. 2个σ键,1个π键9. CCl4分子中C原子采取sp3杂化,分子的空间构型为A.直线形B. 三角形C. 三角锥形D. 正四面体形10. H2O的沸点比H2S高,主要是因为其存在A. 取向力B. 诱导力C. 色散力D. 氢键11. 34.2 g/L 蔗糖溶液的物质的量浓度为(蔗糖摩尔质量为342 g/mol)A. 0.01 mol/LB. 0.1 mol/LC. 0.001 mol/LD. 1mol/L12.静脉滴注0.9 g/L的NaCl溶液,结果会A. 正常B. 基本正常C. 胞浆分离D. 溶血13.下面叙述错误的是A. 在维持细胞内外渗透平衡方面,胶体渗透压其主要作用B. 在维持毛细血管内外渗透平衡方面,胶体渗透压其主要作用C. 血浆中胶体渗透压较小D. 晶体渗透压和胶体渗透压都很重要14.在KI过量时所形成的AgI溶胶中,其结构可写成[( AgI)m nI-(n-x)K+]x- xK+,则下述表达式为胶粒的A. AgI)mB. ( AgI)m nI-(n-x)K+C. ( AgI)m nI-D. [( AgI)m nI-(n-x)K+]x- xK+15.液体中溶入溶质后,其表面张力的变化情况是A. 增大B. 减小C. 先增大、后减小D. 不一定16.在N2 + 3H2 2NH3 +Q 反应中,加入催化剂的作用是A. 使平衡向左移动B. 使平衡向右移动C. 加大正反应速度D. 缩短达到平衡的时间17.经验表明,如果温度每升高10℃,反应速率就增大到原来的2倍;若使反应温度由原来的20℃升高到60℃,则反应速率增加到原来的A. 4倍B. 8倍C. 16倍D. 64倍18.已知HCN的K a =5.0 ×10 -10,则CN-的K b为A. 2.0 ×10 -5B. 5.0 ×10 -10C. 5.0 ×10 -4D. 5.0 ×10 -1419.将0.1 mol/L HAc和0.1 mol/L HCl溶液分别冲稀一倍时,其[H+]的变化是A. HAc溶液中[H+]减半B. 均减半C. HCl溶液中[H+]减半D. 均无变化20. 100 ml 0.6 mol/L的盐酸与等体积的0.4 mol/L的NaOH溶液混合,混合后的溶液A. pH = 2B. pH = 1C. [OH-] = 1×10 -3 mol/LD. [H+] = 0.2 mol/L21. AB型沉淀的溶解度为1×10-6 mol/L 其K sp为A. 1×10-10B. 2×10-12C.D. 2×10-1022. Ag2S的溶度积常数表达式正确的是A. K sp = [ Ag+ ] [ S2- ]B. K sp = [ Ag+ ] [ S2- ]2C. K sp = [ Ag+ ]2 [S2- ]D. K sp = 2 [ Ag+ ]2 [S2- ]23.在的BaSO4饱和溶液中加入适量NaNO3,会使BaSO4在水中溶解度A. 增大B. 减小C. 不变D. 无法判断24. 使AgCl沉淀溶解,采用的方法是A. 加NaOHB. 加H2SO4C. 加H2O2D. 加NH3 · H2O25. 对于Na2CO3和NaHCO3的叙述,错误的是A. 都是强碱弱酸盐B. 水溶液都显碱性C. 能相互转化D. 不能组成缓冲溶液26. 能与碳酸组成缓冲溶液的钠盐是A. NaHSO4B. NaHCO3C. NaClD. NaAc27. 过氧化钠吸收二氧化碳后将会产生A. COB. O2C. NaHCO3D. Na2O28. 碱金属与碱土金属元素中,性质最相似的是A. K和NaB. Li和BeC. Li和MgD. Na和Mg29. 下列为多卤化物的是A. I2B. PCl3C. KI3D. KIO330. 下列物质溶解度最大的是A. AgSCNB. Pb(SCN)2C. KSCND. HgSCN31. 下列物质即是常用的氧化既又是常用的还原剂的是A. 铅丹B. 二氧化碳C. 二氧化锰D. 过氧化氢32. 下列气体中,不能用浓硫酸干燥的是A. SO2B. HClC. H2SD. CO233. 与血红蛋白携带O2能力无关的毒物是A.NO2-B. H2SC. SO2D. CO34.难溶于水的白色硫化物是A. CaSB. ZnSC. CdSD. HgS35.下列元素的氢氧化物中,不属于两性氢氧化物的是A. CuB. ZnC. CrD. Ca36.下列铁盐不属于配合物的是A. 黄血盐B. 普鲁士蓝C. 滕士蓝D. 铁铵矾37.过氧化氢溶液在什么介质中可将Cr3+氧化成CrO42-A. 酸性B. 碱性C. 中性D. 强酸性38.下列金属元素的氢氧化物不溶于氨水的是A. CuB. ZnC. FeD. Co39.在AgBr处于沉淀-溶解平衡状态时,向此溶液中加入AgNO3溶液后,溶液中的沉淀A. 增加B. 减小C. 数量不变D. [Br- ]浓度增加40.下列属于可逆反应的是A. 碘受热变成碘蒸气,遇冷又变成碘固体B. 在一定条件下NO2反应生成N2O4,N2O4同时又反应生成NO2C.NH4Cl受热分解生成NH3和HCl,NH3和HCl反应生成NH4ClD. 点燃H2和O2生成H2O,电解H2O生成和H2和O2四、简答题:(本大题共3小题,每小题5分,共15分)1.根据下列化合物的名称写出配合物的化学式。
药剂专业《无机与分析化学基础》试题姓名:学号:成绩:一、单项选择题:每小题1分,共40分。
1.决定原子种类的是()A、核电荷数B、核内质子数C、核外电子数D、核内中子数E、核内质子数和中子数2、某元素二价阴离子的核外有18个电子,质量数为32,该元素原子核内的中子数为()A、10 B 、12 C 、14 D 、16 E 、183、最稳定的原子最外层含有的电子数为()A、4个B、6个C、8个D、18个E、32个4、元素化学性质发生周期性变化的根本原因是()A、元素的核电荷数逐渐增多B、元素原子的核外电子排布呈周期性变化C、元素原子半径呈周期性变化D、元素的化合价呈周期性变化E、元素的金属性和非金属性呈周期性变化5、元素周期表里金属元素和非金属元素分界线附近能找到可以用来制成()A、催化剂的元素B、新农药的元素C、半导体的元素D、耐高温的合金元素E、耐腐蚀的合金元素6、下列原子中,原子半径最小的是()A、LiB、NaC、KD、RbE、Cs7、下列说法中,正确的是()A、在周期表里,主族元素所在的族序数等于原子核外电子数B、在周期表里,元素所在的周期序数等于原子核外电子层数C、最外层电子数为8的粒子是稀有气体元素的原子D、元素的原子序数越大,其原子半径也越大E、每种元素都只有一种原子8、下列物质中,只有共价键的是()A、NaOHB、NaClC、KBrD、MgOE、H2O9、下列说法不正确的是()A、含有离子键的化合物一定是离子化合物B、含有共价键的化合物一定是共价化合物C、离子化合物中可能存在共价键D、共价化合物中不可能存在离子键E、双原子单质分子中的共价键一定是非极性键10、从200ml 1.5mol/LNaOH溶液中取出50ml,剩余溶液的物质的量浓度为()A、6mol/LB、3mol/LC、2mol/LD、1.5mol/LE、0.5mol/L11、阿伏加德罗常数有数值是()A、3.01*1022B、3.01*1023C、6.02*1022D、6.02*1023E、6.02*102412、9gH2O中所含氧原子数与一定质量的NH3中所含氮原子数相等,则NH3的质量是()A、17gB、34gC、8gD、8.5gE、27g13、胶体分散系的分散质颗粒的直径为()A、小于1nmB、1~100 nmC、大于100 nmD、大于1 nmE、小于100 nm14、下列物质中,物质的量为1.5mol的是()A、147g H2SO4B、22g CO2C、58.5g NaClD、80g NaOHE、5g H215、生理盐水的质量浓度为()A、19g/LB、19mol/LC、9mol/LD、9g/LE、0.9g/L16、配制0.1mmol/L的甘油溶液200ml,所需甘油的毫升数为()A、10mlB、100mlC、1000mlD、400mlE、40ml17、200ml生理盐水中含NaCl的质量为()A、0.018gB、0.18gC、1.8gD、18gE、36g18、决定化学反应速率的最主要因素是()A、温度B、反应物的浓度C、催化剂D、压强E、反应物的本性19、在反应C(s)+H2O(g) CO(g)+H2(g)-Q达到平衡状态时,欲使平衡向右移动,可采取的措施是()A、降低温度B、减小H2O(g) 的浓度C、加入催化剂D、升高温度E、增大CO的浓度20、对于某一可逆反应来说,使用催化剂的作用是()A、提高反应物的平衡转化率B、增大正反应速率,减小逆反应速率C、改变平衡混合物的组成D、能使平衡向逆反应方向移动E、改变化学反应速率,缩短反应达到平衡所需的时间21、T NaOH/HCI=0.003 646g/ml,表示()。
药学无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪个元素不是人体必需的微量元素?A. 铁(Fe)B. 锌(Zn)C. 铜(Cu)D. 铅(Pb)2. 根据周期表,下列元素中属于非金属元素的是:A. 钠(Na)B. 碳(C)C. 氧(O)D. 钙(Ca)3. 以下化合物中,属于共价化合物的是:A. NaClB. MgOC. H2OD. FeS4. 氧化还原反应中,氧化剂和还原剂的判断依据是:A. 电子的转移B. 原子的重新排列C. 化学键的形成D. 能量的释放5. 根据酸碱理论,下列物质属于酸的是:A. NaOHC. NH3D. KOH6. 根据配位化学,下列说法不正确的是:A. 配位化合物含有配位键B. 中心原子可以是金属或非金属C. 配体只能是阴离子D. 配位数是配体与中心原子结合的数量7. 以下化合物中,属于离子化合物的是:A. CO2B. N2C. CaCl2D. CH48. 根据酸碱中和反应,下列说法正确的是:A. 中和反应一定生成盐和水B. 中和反应是放热反应C. 中和反应是氧化还原反应D. 中和反应是酸碱性反应9. 根据化学平衡理论,下列说法不正确的是:A. 化学平衡是动态平衡B. 化学平衡受温度影响C. 化学平衡不随浓度改变D. 化学平衡可以被催化剂影响10. 以下化合物中,属于有机化合物的是:A. H2OB. CO2D. SO2答案:1. D2. C3. C4. A5. B6. C7. C8. B9. D 10. C二、填空题(每空1分,共10分)1. 元素周期表中,第______周期的元素最多,含有______种元素。
2. 氧化还原反应中,失去电子的物质被称为______,获得电子的物质被称为______。
3. 根据酸碱质子理论,能够释放质子(H+)的物质被称为______,能够结合质子的物质被称为______。
4. 配位化合物中,中心原子与配体结合的键称为______。
《无机与分析化学基础》第1—3章复习题一、名词解释1.同位素:质子数相同而中子数不同的同种元素的不同原子互称为同位素2.元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化的规律3.离子键:阴、阳离子间通过静电作用所形成的化学键4.共价键:原子间通过共用电子对所形成的化学键5.分散系:一种或几种物质以细小粒子,分散在另一种物质里所形成的体系6.摩尔质量:摩尔质量就是质量除以物质的量7.物质的量浓度:溶质B的物质的量除以溶液的体积二、填空1.原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成。
原子核是由质子和中子两种粒子构成。
2.各电子层最多容纳的电子数目是2n2个,最外层电子数目不超过8个。
3.同位素可分为放射性同位素和稳定性同位素两类。
4.元素周期表中有7个周期,其中3个短周期,3个长周期,1个不完全周期。
周期表中共有16个族,其中7个主族,7个副族,1个Ⅷ族,1个0族。
5.同周期元素的原子,在原子结构上具有相同的电子层数,同周期元素性质的递变规律是,从左到右,金属性逐渐减弱,非金属性逐渐增强;同主族元素的原子,在原子结构上具有相同的最外层电子数,同主族元素性质的递变规律是,从上到下,金属性逐渐增强,非金属性逐渐减弱。
6.物质B的物质的量的符号为n(B),单位符号是mol。
7.阿伏伽德罗常数的符号为N A,数值是6.02×1023 。
8.物质B的摩尔质量的符号为M ,单位符号是g/mol。
9.粗分散系根据其分散质的状态不同,分为悬浊液和乳浊液两类。
12.影响化学反应速率的因素主要有浓度、温度、催化剂和压强。
三、选择(E )1.决定原子种类的是A.核电荷数 B.核内质子数 C.核外质子数 D.核内中子数E.核内质子数和中子数(C )2.最稳定的原子最外层含有的电子数为A.4个 B.6个 C.8个 D.18个 E.32个(D )3.19世纪门捷列夫的突出贡献是A.提出了原子学说 B.提出了分子学说C.发现了稀有气体D.发现了元素周期律E.发现了镭元素(B )4.元素性质发生周期性变化的根本原因是A.元素的核电荷数逐渐增多 B.元素原子的核外电子排布呈周期性变化 C.元素原子半径呈周期性变化 D.元素的化合价呈周期性变化E.元素的金属性和非金属性呈周期性变化(A )5.下列物质中,既有离子键,又有共价键和配位键的是A. NH4Cl B. CaCl2 C. KOH D. CO2 E. H2(C )6.下列叙述正确的是A.化学键包括离子键、共价键、氢键 B.化学键是相邻的分子之间强烈的相互作用力 C.化学键是相邻的原子之间强烈的相互作用 D.甲烷分子中的C—H 键是非极性键 E.氯气分子中的Cl—Cl键是极性键(B )7.下列说法不正确的是A.含有离子键的化合物一定是离子化合物 B.含有共价键的化合物一定是共价化合物C.离子化合物中可能存在共价键 D.共价化合物中不可能存在离子键E.双原子单质分子中的共价键一定是非极性键( B )8.胶体分散系的分散质颗粒的直径为 A.小于1nm B.1~100nm C.大于100nm D.大于1nm E.小于100nm(C )9.下列物质属于胶体溶液的是A.生理盐水B.泥浆 C.血浆 D.注射用葡萄糖 E.氨水( D )10.阿伏伽德罗常数的数值是A.3.01×1022 B. 3.01×1023 C. 6.02×1022 D.6.02×1023 E.6.02×1024(C )11. 6.02×1023个氢原子是A.1mol原子 B.1mol原子氢 C. 1mol氢原子 D. 1mol氢元素 E. 1mol氢分子(C)12.下列叙述正确的是 A.摩尔是物质质量的单位 B.摩尔是物质数量的单位C.1molH2O的质量是18g D.1mol任何物质都含有6.02×1023个原子 E.氧气的摩尔质量是32g(D )13.生理盐水的质量浓度为A.19g/L B.19mol/L C.9mol/L D.9g/L E.0.9g/L (E )14.决定化学反应速率的最主要因素是A.温度 B.反应物的浓度 C.催化剂 D.压强E.反应物的本性(E )15.影响化学反应速率的主要外界因素有 A.浓度 B.压强 C.温度 D.催化剂 E.以上都是四、计算题(15分)5. 将2mol NaOH制成500ml溶液,溶液的物质的量浓度是多少?解:500ml=0.1LC NaOH=2mol/0.1L=20 mol/L 答:。
药学无机化学试题及答案一、选择题(每题2分,共10分)1. 下列元素中,属于碱金属元素的是()。
A. NaB. MgC. AlD. Cl答案:A2. 以下化合物中,属于共价化合物的是()。
A. NaClB. NaOHC. HClD. MgO答案:C3. 根据元素周期表,以下元素中原子半径最大的是()。
A. LiB. NaC. KD. Rb答案:D4. 下列反应中,属于氧化还原反应的是()。
A. 2H2 + O2 → 2H2OB. CO2 + Ca(OH)2 → CaCO3 + H2OC. 2NaOH + H2SO4 → Na2SO4 + 2H2OD. 2H2O → 2H2 + O2答案:A5. 以下化合物中,属于离子晶体的是()。
A. SiO2B. NaClC. C6H12O6D. H2O答案:B二、填空题(每题3分,共15分)1. 元素周期表中,周期数等于电子层数,主族族序数等于最外层电子数。
2. 金属晶体的构成微粒是金属阳离子和自由电子。
3. 根据鲍林规则,离子晶体中离子的配位数一般为4、6或8。
4. 共价键的形成是由于两个原子之间通过共用电子对形成的化学键。
5. 根据路易斯酸碱理论,能够提供电子对的物质是碱,能够接受电子对的物质是酸。
三、简答题(每题5分,共20分)1. 简述离子键和共价键的区别。
答案:离子键是由正负离子之间的静电吸引力形成的化学键,通常在活泼金属和活泼非金属之间形成。
共价键是由两个原子通过共享电子对形成的化学键,通常在非金属元素之间形成。
2. 为什么金属晶体具有良好的导电性?答案:金属晶体具有良好的导电性是因为金属晶体中存在自由电子,这些自由电子可以在晶体中自由移动,从而形成电流。
3. 什么是配位键?请举例说明。
答案:配位键是一种特殊的共价键,其中一个原子提供空轨道,另一个原子提供孤对电子。
例如,氨分子(NH3)中的氮原子可以提供孤对电子,与氢离子(H+)形成配位键。
4. 简述氧化还原反应的实质。
药学无机化学试题及答案药学无机化学是一门研究药物中无机物质的化学性质、结构、反应及其在药物制备和作用中应用的学科。
以下是一份药学无机化学的模拟试题及答案,供参考:药学无机化学模拟试题一、选择题(每题2分,共20分)1. 以下哪种元素不属于周期表中的主族元素?A. 氧(O)B. 钠(Na)C. 铁(Fe)D. 氯(Cl)2. 根据离子半径的比较,下列哪种说法是正确的?A. Na+ > Mg2+ > Al3+B. O2- > F- > Na+C. Cl- > K+ > Ca2+D. S2- > Cl- > K+3. 以下化合物中,哪种是共价化合物?A. NaClB. CaOC. H2OD. MgS4. 根据酸碱质子理论,下列哪种物质是酸?A. H2OB. NH3C. NaOHD. HCl5. 以下哪种反应属于氧化还原反应?A. 2H2O → 2H2 + O2B. 2Na + Cl2 → 2NaClC. CaO + H2O → Ca(OH)2D. CO2 + H2O → H2CO3二、填空题(每空2分,共20分)6. 根据周期表,第IA族元素的原子序数依次为______、______、______。
7. 原子半径最大的元素位于周期表的______区。
8. 金属元素通常具有______电性,而非金属元素通常具有______电性。
9. 根据路易斯酸碱理论,H2O是一个______,因为它能______质子。
10. 氧化还原反应中,氧化剂的氧化态______,还原剂的氧化态______。
三、简答题(每题15分,共30分)11. 简述离子键和共价键的区别。
12. 描述氧化还原反应的基本概念,并给出一个例子。
四、计算题(每题15分,共30分)13. 给定一个化学反应:2Fe + 3Cl2 → 2FeCl3。
计算反应物和生成物的摩尔质量。
14. 假设有1.0摩尔的Fe和3.0摩尔的Cl2参与上述反应,计算反应后生成FeCl3的摩尔数。
第一章无机化学第一章无机化学一、单项选择题1. 下列反应中属于歧化反应的是:()A BrO3-+5Br-+6H+ = 3Br2+3H2OB 3Cl2+6KOH = 5KCl+KClO3+3H2OC 2AgNO3 = 2Ag+2NO2+O2↑D KClO3+6HCl(浓) = 3Cl2↑+KCl+3H2O该题您未回答:х该问题分值: 1答案:B2. 卤素的原子特性是:()(1)最外电子层结构是ns2np5 (2)半径随原子序数增加而增大(3)都有获得一个电子成为卤离子的强烈倾向(4)随着原子序数增加,核对价电子的引力逐渐增大A (1)、(3)B (2)、(4)C (1)、(3)、(4)D (1)、(2)、(3)该题您未回答:х该问题分值: 1答案:D3. 在NaH2PO4溶液中加入AgNO3溶液,主要产物是:()A AgOHB AgH2PO4C Ag3PO4D Ag2O该题您未回答:х该问题分值: 1答案:C4. 下列说法正确的是:()A 胶体是物质以一定分散粒度存在的一种状态,它有一定黏度,因此称为胶体B 用FeCl3和H2O加热制Fe(OH)3胶体的方法是凝聚法C 高分子溶液有很大的黏度D 将硫的无水酒精溶液滴于水中形成硫的水溶胶该题您未回答:х该问题分值: 1答案:A5. 用金属铜作电极,电解硫酸铜溶液时,阳极的主要反应是:()A 4OH- - 4e- = O2+ 2H2OB 2SO42- - 2e- = S2O82-C Cu - 2e- = Cu2+D Cu2+ + 2e- = Cu该题您未回答:х该问题分值: 1答案:C6. 下列酸根在酸性条件下氧化能力强弱顺序正确的是:()A ClO2->ClO3->ClO4->ClO-B ClO3->ClO4- >ClO->ClO2-C ClO4->ClO->ClO2->ClO3-D ClO->ClO2->ClO3->ClO4-该题您未回答:х该问题分值: 1答案:D7. 下列反应方程式中哪个反应放出的热量最多:()A CH4(g)+2O2(g) = CO2(g)+2H2O(L)B 2CH4(g)+4O2(g) = 2CO2(g)+4H2O(L)C CH4(g)+2O2(g) = CO2(g)+2H2O(g)D 2CH4(g)+4O2(g) = 2CO2(g)+4H2O(g)该题您未回答:х该问题分值: 1答案:B8. 在1.0×10-2mol/LHAc溶液中,其水的离子积为:()A 1.0×10-12B 2C 10-14D 10-16该题您未回答:х该问题分值: 1答案:C9. 下列不能表述卤化氢性质的选项是:() A 在室温下是无色的液体B 在空气中形成“白烟”C 具有刺激性气味D 易溶于水该题您未回答:х该问题分值: 1答案:A10. 下列关于分子论的论点, 正确的是:() A 一切物质都是由分子组成的B 分子是保持原物质性质的最小微粒C 分子是保持原物质化学性质的微粒D 以上论述都不正确该题您未回答:х该问题分值: 1答案:D11. 醋酸铵在水中存在着如下平衡: NH3+H2O = NH4+ + OH-……K1 HAc+H2O = Ac- + H3O+ ……K2 NH4+ + Ac-= HAc+NH3……K3 2H2O = H3O+ + OH-…………K4 以上四个反应平衡常数之间的关系是:()A K3=K1K2K4B K4=K1K2K3C K3K2=K1K4D K3K4=K1K2该题您未回答:х该问题分值: 1答案:B12. H - 1、H - 2、H - 3与O - 16 、O - 17、O - 18六种核素, 组成水的分子类型总数是:() A 6种B 9种C 18种D 27种该题您未回答:х该问题分值: 1答案:C13. 下列哪种物质不是电解NaCl水溶液的直接产物:()A NaHB NaOHC H2D Cl2该题您未回答:х该问题分值: 1答案:A14. 已知 MNO2(s) MNO(s)+1/2 O2(g) =134.8kJ/molMNO2(s)+M(s)+1/2 N(g)2MNO(s) △H =-250.1 kJ/mol,则MNO2(s)的为:()A -519.7 kJ/molB 519.7 kJ/molC -115.3 kJ/molD 115.3 kJ/mol 该题您未回答:х该问题分值: 1答案:15. 元素S的燃烧热与下列哪种物质的标准生成热相等:()A SOB SO2C SO3D H2SO4该题您未回答:х该问题分值: 1答案:B16. 在相同条件下, 10 L N2的质量为7.95 g, 2.00 L某气体质量为2.5 g, 则该气体的相对分子质量为:()A 17B 44C 30D 无法计算该题您未回答:х该问题分值: 1答案:B17. 对于可逆反应:PCl5(g)PCl3(g)+Cl2(g),下列说法正确的是:()A 恒温下,增大压力,由于产物分子数多,Kc值减小,平衡逆向移动B 升高温度,反应速度加快,PCl5的分解率增大C 减小总压力,反应速度减慢,PCl5转化率降低D 降低温度,PCl5的分解率降低,此反应为吸热反应该题您未回答:х该问题分值: 1答案:D18. 下列说法正确的是:()A 电子的自旋量子数mS=±1/2是从薛定谔方程中解出来的B 磁量子数m = 0的轨道都是球形对称的轨道C 角量子数l的可能取值是从0到n的正整数D 多电子原子中,电子的能量决定于主量子数n和角量子数l。
高职药学专业《无机化学》练习题
[第01章物质的量]
一、名词解释
1、气体摩尔体积
2、阿伏伽德罗定律
二、单项选择题
1、摩尔是()
A、物质的量的单位
B、摩尔质量的单位
C、体积的单位
D、物质微粒的单位
2、SO42-的摩尔质量是()
A、96g
B、48g/mol
C、96g/mol
D、98g/mol
3、H2SO4的摩尔质量是()
A、98g
B、49g/mol
C、96g/mol
D、98g/mol
4、NaOH的摩尔质量是()
A、40g
B、40g/mol
C、40 mol
D、40 L
5、Na+的摩尔质量是()
A、23 g/mol
B、22 g /mol
C、24g/mol
D、11g/mol
6、1 mol水蒸汽、1 mol液态水、1 mol冰各自所含的分子个数()
A、一定相等
B、水蒸汽含水分子多
C、液态水含水分子多
D、冰含水分子多
7、下列叙述中,错误的是()
A、90 g H2O中,含有的水分子数为5N A
B、90 g H2O中,含有的氢原子数为10N A
C、90 g H2O中,含有的氧原子数为5N A
D、90 g H2O中,含有的水分子数为N A
8、下列叙述中不正确的是()。