原子的构成
- 格式:doc
- 大小:340.35 KB
- 文档页数:20

YHG-1200移动闪光焊现场施工工艺探讨随着科技的不断发展,焊接技术也不断得到改进和提升,移动闪光焊技术便是其中的一种。
YHG-1200移动闪光焊设备是目前市场上比较先进的设备之一,它在施工现场可以快速、高效地完成焊接工作。
在现实工程施工中,我们对YHG-1200移动闪光焊现场施工工艺进行了探讨和实践,积累了丰富的经验,现将YHG-1200移动闪光焊现场施工工艺进行深入探讨。
一、YHG-1200移动闪光焊概述YHG-1200移动闪光焊设备是一种采用电磁感应加热原理的新型焊接设备,它利用高能量密度的脉冲电流使工件迅速加热到熔点,再利用压力把工件连接起来,是一种高效、环保、节能的焊接方式。
YHG-1200移动闪光焊设备适用于各种金属材料的焊接,包括钢、铝、铜等。
在进行YHG-1200移动闪光焊现场施工时,需要进行充分的准备工作,确保施工的顺利进行。
首先是选择好施工地点,要求地面平整、干燥,并且通风良好。
其次是检查YHG-1200移动闪光焊设备,确保设备完好无损,操作正常。
然后是准备好所需的焊接材料、工具和保护用具。
最后是对施工人员进行安全教育和操作培训,确保他们能够正确使用YHG-1200移动闪光焊设备。
1. 工件预热在进行YHG-1200移动闪光焊时,对工件进行预热是非常重要的。
预热可以使工件的温度均匀,减少焊接时的热变形,同时也可以提高焊接接头的质量。
根据不同的材料和厚度,预热的温度和时间也有所不同,一般情况下,可以采用气焰加热或者电磁感应加热的方式进行预热。
2. 设定焊接参数在进行YHG-1200移动闪光焊时,需要根据工件的材料、厚度和焊接要求来设定焊接参数,包括脉冲电流的大小、频率、电磁感应加热时间等。
通过合理的参数设定,可以保证焊接接头的质量,同时也可以提高焊接效率。
3. 确定焊接位置在进行YHG-1200移动闪光焊时,需要首先确定好焊接位置,确保工件的接头位置清洁、平整,并且能够方便进行焊接操作。

构成原子的三种粒子
“原子的构成是什么?”这是科学家探索宇宙的最终目标,从20世纪以来,关于原子的研究一直受到关注。
原子由三种基本粒子构成:电子,中子和质子。
电子是最著名的原子粒子之一,它是原子结构中最轻,最小的粒子。
电子有极少的质量,它们在原子的外层中围绕着原子核运行。
这些电子的外壳可分为若干能层,每个能层都有一定数量的能量水平。
当电子跃迁到较高的能量水平时,原子就会发出光谱,从而显示出原子的状态。
中子也是原子的组成部分,它们与电子一样,但他们的质量比电子要大得多。
中子质量非常大,比电子质量大20多倍,但它们的电荷为零,它们不会吸引或排斥电子,因而不会对原子结构产生影响。
质子是原子结构中最重要的粒子,它们有极大的质量,质量是电子的1800多倍,它们是原子核的主要组成部分。
质子有正电荷,它们吸引电子,使其围绕原子核运行并产生原子结构。
总而言之,原子由三种基本粒子构成:电子,中子和质子。
电子在原子的外层中围绕着原子核,中子的质量比电子大得多,而质子则有正电荷,用于吸引电子,使其形成原子结构。
各种分子的性质,如弹性,硬度,熔点和溶解性等,都决定于原子的组成。
因此,研究原子的组成对于我们了解宇宙是非常重要的。
- 1 -。


《原子的构成》说课稿《原子的构成》说课稿开场白:各位评委好,我是XXX号考生,今天我说课题目是《原子的构成》,下面开始我的说课,根据新课标理论我将以教什么,怎样教,为什么这样教为设计思路,从教材分析,学情分析,教学目标,教学重难点等几个方面进行说明,首先说一下我对教材的认识。
一、说教材《原子的构成》是八年级全一册第3单元《构成物质的奥秘》第1节的内容。
本节课主要是认识原子的内部结构。
前面已经学过了化学反应中分子的可分性、原子的不可分性,本节课立足于此继续发展对于原子的认识:除去“化学反应”这个前提的约束,原子也具有可分性。
由此“打开”原子,步步深入了解原子的构成,辩证认识其中各种粒子的一些基本特点和相互关系。
探索原子结构的化学史料中蕴含着极为丰富的方法、情感态度价值观内涵,藉此可以帮助学生充分体验科学研究过程中实验、假说、模型、推证等科学方法的重要作用和质疑、反思、严谨等科学态度的重要作用。
过渡:这是对教材的认识,下面说一下本班学生的情况。
二、说学情通过前面的学习,学生已经从微观角度认识了水的三态变化、水的电解、氢气燃烧等变化事实,并且以此为载体形成了对于分子、原子的一些基本认识。
本节课帮助学生进一步发展上述认识,但鉴于目前的实验条件还难以让学生直接看到微观真相,而学生本身又处于化学启蒙阶段,缺乏推断原子结构的知识基础,因此适宜通过多媒体展示相关史料及微观模拟动画或者示意图,变抽象为具象,辅助学生的想象、推理,促进学生的体验和理解。
过渡:结合教材分析和学情分析,我制定了如下教学目标:三、说教学目标[知识与技能]以汤姆森阴极射线实验和卢瑟福α散射实验事实为基础,推论物质的原子是由居于中心的原子核和核外电子构成的。
根据“原子核由质子和中子构成”的结论,结合质子、中子及电子的电性、电量和质量数据,推证“质子数=核外电子数=核电荷数”。
以氯化钠的形成为例,初步认识电子在化学反应中的表现。
通过对分子、原子、离子关系的梳理,知道原子可以结合成分子,同一元素的原子和离子可以相互转化——原子更“基本”。

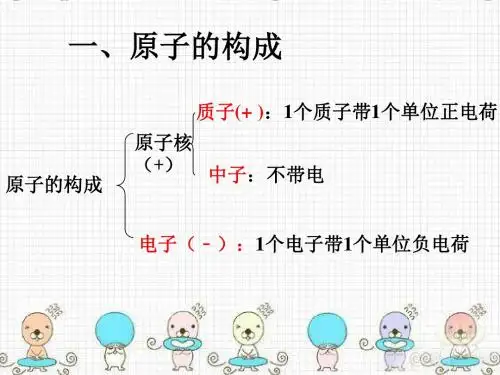
原子的构成知识点一:原子的构成1.原子是由下列粒子构成的:原子由原子核和核外电子(带负电荷)构成,原子核由质子(带正电荷)以及中子(不带电)构成,但并不是所有的原子都是由这三种粒子构成的。
例如:普通的氢原子核内没有中子。
2.原子中的等量关系:核电荷数=质子数=核外电子数在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),每个质子带1个单位正电荷,每个电子带一个单位负电荷,原子整体是呈电中性的粒子。
3.原子内部结构揭秘—散射实验(如下图所示):1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔时,发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。
实验结论:(1)原子核体积很小,原子内部有很大空间,所以大多数α粒子能穿透金箔;(2)原子核带正电,α粒子途经原子核附近时,受到斥力而改变了运动方向;(3)金原子核的质量比α粒子大得多,当α粒子碰到体积很小的金原子核被弹了回来。
【要点诠释】1.原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷(核电荷数)和核外电子所带负电荷相等,但电性相反,所以整个原子不显电性。
2.区分原子的种类,依据的是原子的质子数(核电荷数),因为不同种类的原子,核内的质子数不同。
知识点二:相对原子质量1.概念:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,就是这种原子的相对原子质量(符号为Ar)。
根据这个标准,氢的相对原子质量约为1,氧的相对原子质量约为16。
2.计算式:【要点诠释】1.相对原子质量只是一个比值,单位是“1”(一般不读也不写),不是原子的实际质量。
2.每个质子和每个中子的质量都约等于1个电子质量的1836倍,即电子质量很小,跟质子和中子相比可以忽略不计。

第 1 页 共 1 页 初三化学:原子的构成
一、原子的构成
1. 原子的构成
原子由原子核和电子构成,原子核由质子和中子构成。
2. 每个质子带一个单位正电荷,每一个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数为核电荷数。
电子的质量很小,可忽略不计,原子的质量主要集中在原子核上。
3. 构成原子的粒子一般是质子、中子、电子。
构成原子的必要粒子是质子和电子,决定原子种类的是质子。
4. 原子核所带正电荷数(核电荷数)和核外电子所带负电荷数相等,但电性相反,所以整个原子不显电性。
5. 在原子中
核电荷数=质子数=电子数,
原子核内质子数不一定等于中子数。
二、相对原子量
国际上以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子量(A r )。
注意:相对原子量只是一个比,不是原子的实际质量。
相对原子量的计算公式:
12
112r ⨯=原子的质量碳一个原子的质量A 电子的质量很小,跟质子和中子相比可以忽略不计,所以
A r ≈质子数+中子数。


《原子的构成》板书设计【优秀8篇】(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如计划报告、合同协议、心得体会、演讲致辞、条据文书、策划方案、规章制度、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays, such as plan reports, contract agreements, insights, speeches, policy documents, planning plans, rules and regulations, teaching materials, complete essays, and other sample essays. If you would like to learn about different sample formats and writing methods, please stay tuned!《原子的构成》板书设计【优秀8篇】化学是我们常考的科目之一、化学中有哪些知识点需要我们掌握?它山之石可以攻玉,下面本店铺为您精心整理了8篇《《原子的构成》板书设计》,如果能帮助到亲,我们的一切努力都是值得的。

4.1原子的构成【学习目标】1.了解原子的构成.2.了解相对原子质量.3.理解核电荷数、质子数、核外电子数的关系.【基础知识精讲】※课文全解一、原子的构成原子是由居于原子中心带正电的原子核和核外带负电的电子构成的.原子核是由质子和中子构成的.位置电性特点原子核居原子中心带正电体积小质量大(原子的主要质量都集中在核上) 核外电子居于核外带负电绕核按一定规律高速运动原子核为什么带正电呢?是因为原子核是由带正电的质子和不带电的中子构成.原子核所带的正电荷数(又称核电荷数)等于核内的质子数,质子数与核外电子数相等,原子核所带的电量与核外电子的电量相等,电性相反,所以原子作为一个整体不显电性.电性电量相对质量质子带正电一个单位正电荷 1中子不带电不带电 1电子带负电一个单位负电荷1/1836原子是很小的微粒,原子核更小,它的半径约为原子半径的万分之一.质子的质量与中子的质量大致相等,电子的质量约为质子质量的1/1836,原子的质量主要集中在原子核上.电子在原子核外空间里围绕着原子核作高速运动.二、相对原子质量原子的质量极小,不同的原子质量又不同,如何衡量原子的质量呢?为了书写和使用方便,国际上采用相对质量.以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得的比值,就作为这种原子的相对原子质量(符号为A r),根据这个标准氢的相对原子质量约为1,氧的相对原子质量约为16,碳的相对原子质量为12.跟质子、中子相比,电子质量很小,可以忽略不计,所以,原子的质量主要集中在原子核上,质子和中子的相对质量均为1,所以原子的相对质量又近似等于质子数和中子数之和.原子种类质子数中子数核外电子数相对原子质量氢 1 0 1 1碳 6 6 6 12氧8 8 8 16钠11 12 11 23硫16 16 16 32※问题全解1.什么是12C原子?答:12C原子是指含有6个质子和6个中子的碳原子,它的质量的1/12 等于1.66×10-27 kg.2.原子的构成是怎样的?核电荷数=质子数=核外电子数3.为什么原子不显电性?答:因为在原子内核电荷数=质子数=核外电子数,所带电量相等,但电性相反,所以原子不显电性.4.如何计算相对原子质量,它与原子质量有何区别?相对原子质量是原子质量的相对质量,它是一个比值,国际上规定它的单位为“一”,而原子质量是原子的实际质量,国际单位为“kg”.【学习方法指导】原子的构成是微观世界中的一个现象,肉眼看不到,因此让人觉得很抽象,但是如果同学们在学习的时候将微观世界宏观化,参考恰当的比喻,直观的图象,相信你一定能学好.[例]下列说法是否正确?1.原子是构成物质的一种粒子.2.因为二氧化碳里含有氧分子,所以二氧化碳也具有氧气的化学性质.3.一切原子核都是由质子和中子构成.4.原子的质量主要集中在原子核上.5.原子中质子和电子所带电量相等,电性相反,所以整个原子不显电性.答案:1.对2.错3.错4.对5.对点拨:1.构成物质的微粒有多种,有的物质是由分子构成的,如氧气、水等,有些物质是由原子直接构成的,如铁、氦气等,所以此说法正确.2.二氧化碳属于纯净物,它是由同一种分子——二氧化碳分子构成,每个二氧化碳分子又是由一个碳原子和两个氧原子构成,其中并不含氧分子,也就不具有氧气的化学性质,所以此说法是错误的.3.绝大多数原子核都是由质子和中子构成,但是有一种最常见的氢原子核却只有一个质子,而没有中子,所以“一切”的提法是不正确的.4.原子是由原子核和核外电子构成,原子核又是由质子和中子构成,由于原子质量很小,一个电子的质量只约等于一个质子(或一个中子)质量的1/1836,所以原子的质量主要集中在原子核上.5.原子是由带正电的原子核和核外带负电的电子构成,而且原子的核外电子数等于质子数即核电荷数,这样正负电荷的电量相等而且互相抵消,所以原子是显电中性的.[例2]原子R 核外有26个电子,核内有30个中子,它的质子数为_________,相对原子质量约为_________.解:已知R 原子核外有26个电子,则核内有26个质子,又因核内有30个中子,所以相对原子质量约为56.答案:26,56.点拨:此题是应用了两个相等关系,即原子内核电荷数=质子数=核外电子数,相对原子质量≈质子数+中子数.[例3]碳—12原子的质量为1.993×10-26kg ,某原子的相对原子质量是80,则该原子的质量是_________ kg .解:碳—12原子质量的121为12kg 10993.126-⨯≈1.66×10-27 kg 则该原子的质量为:1.66×10-27kg ×80=1.328×10-25kg .答案:1.328×10-25点拨:本题考查的是原子的质量和相对原子质量关系的计算,解题的关键是要搞清原子的质量和相对原子质量二者的区别和联系.(1)相对原子质量不是原子的实际质量,而是一个比值. (2)相对原子质量=121C 12⨯原子质量该原子质量【拓展训练】 一、道尔顿道尔顿(1766~1844),英国科学家,近代原子学说的奠基人.道尔顿与法拉第、布朗、歌德等属同一时代的人.他从15岁起就开始了边教课,边自学,边研究,边写作的道路,他的科学启蒙老师是一位双目失明的学者.道尔顿的第一部科学著作是《气象观测论文集》.他曾经连续亲自记录气象数据达56年之久,全部观测记录超过22万条.这对他日后提出并用实验证明他的原子学说起到了有益的作用.道尔顿一生勤奋、坚韧,他患有色盲症,但却从不妥协,而且把色盲症作为自己的一个研究课题.道尔顿原子学说的主要观点是:一切物质都是由分子组成的,各种分子又是由更小的粒子——原子构成的.道尔顿利用化学分析法进行研究,发现了著名的倍比定律,也正是这一定律的发现,确立了原子论的实验基础,从而使道尔顿成为近代原子论的奠基人.道尔顿一生著书50多部,其中最重要的是《化学哲学新体系》(中国科学院藏有此书).为了纪念他,英国曼彻斯特大学于1853年设立了道尔顿奖学金.二、扫描隧道显微镜扫描隧道显微镜是80年代初期发展起来的新型显微仪器,能达到原子级的超高分辨率.扫描隧道显微镜不仅作为观察物质表面结构的重要手段,而且可以作为在极其细微的尺度——即纳米尺度(1 nm=10-9m)上实现对物质表面精细加工的新奇工具.目前科学家已经可以随心所欲地操纵某些原子.一门新兴的学科——纳米科学技术已经应运而生.中国科学院化学研究所隧道显微学研究室的科学家正奋力投入纳米科学技术的研究,运用扫描隧道显微学方法.1993年,中国科学院北京真空物理实验室的研究人员,在常温下以超真空扫描隧道显微镜为手段,通过用探针拨出硅晶体表面的硅原子的方法,在硅晶体的表面形成了一定规整的图形(见图4—2).这种在晶体表面开展的操纵原子的研究,达到了世界水平.图中的“中国”两字就是这样形成,并经放大约180万倍在计算机屏幕上显示出来的.这两个字的“笔画”宽度约2 nm,是目前已知的最小的汉字.。

原子结构和元素【知识点】:一、原子的构成1. 原子结构示意图的认识注:1) 在原子中 核电荷数=质子数=核外电子数决定元素种类: 质子数(核电荷数)三决定 决定元素化学性质 :最外层电子数决定原子的质量 :原子核2) 原子的质量主要集中在 原子核 上 ,近似相对原子质量=质子数+中子数。
3) 最外层电子数决定元素的化学性质。
一般金属元素的原子最外层电子数小于4,在化 学反应中易失 去电子;非金属元素的原子最外层电子数大于4,在化学反应中易得到电子;稀有气体元素的原子既不易失去电子,也不易得到电子,化学性质稳定,最外层电子数为8(当只有1个电子层时,电子数为2的结构是稳定结构)。
4)最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2)最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构)2. 相对原子质量:碳12原子质量的112作为标准,其他原子的质量跟它的比值。
相对原子质量的单位是1。
相对原子质量=某种原子的质量(kg)/一个碳原子质量的1/12(kg )相对原子质量越大,原子的实际质量越大;两种原子的相对原子质量之比等于两种原子的质量之比。
相对原子质量≈质子数+中子数3. 分子、原子化学变化的实质:在化学变化中分子分裂为原子,原子重新合成新的分子(或原子重新组合)例题1 (2010·河北)右图是钠元素的原子结构示意图,下列叙述不正确...的是( )A .钠原子的质子数为11B .钠原子的最外层电子数为1C .钠原子易失去电子形成阳离子D .钠元素为非金属元素例题2 下列有关分子、原子和离子的说法正确的是( )A .分子是保持物质性质的一种粒子B .物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变C .分子、原子、离子都可以直接构成物质D .在化学反应中,任何离子都不能再分二.元素1.元素:具有相同核电荷数(即质子数)的一类原子的总称。
元素是组成物质的基本成分,是宏观概念,只讲种类不讲个数。
)定义:具有相同核电荷数(即核内质子数)的一类原子的总称。
氧元素最多,其次是碳元素和氢元素。
如果第一个字母相同,还必须附加一个小写字母以示区别
”中的数字表示一个水分子中含有两个氢原子。
按原子序数递增的顺序从左到右排列。
②将电子层数相同的元素排成一个横行。
按照最外层电子数递增的顺序从左到右排列;元素周期表是元素性质的周期性
:
非金属元素的原子易得到电子形成阴离子。
,共价化合物是由分子构成的。
五、物质的构成与组成:
纯净物是由同种或不同种组成的。
大多数纯净物是由分子构成的,如氧气、水……
少数物质是由原子构成的,如铁、氖气等。
还有少数物质是由离子构成的。
如NaCl是由Na+和Cl-构成
氯、钠两元素的原子结构示意图分别为。
填“原子”、“阳离子”或“阴离子”
(1)在元素周期表中,原子序数为12的元素符号是___________,其原子结构示意图为,在化学反应中该原子易________(填“得到”或“失去”)电子。
(2)写出原子序数为1、6、8、11四种元素所组成化合物的化学式。
课题1原子的构成趣味导读原子是由原子核和核外电子构成的,那么电子离核有多远?在一张纸上,画一个比钱币小的圆圈,用它来代表原子核,即原子模型的中心。
量一下圆圈的直径是多少厘米。
现在请你估算一下,这个原子模型的最外边缘在哪里?比如,是否超出这张纸?是否超出桌子的边缘、教室、教学大楼……想知道吗?智能点拨例1以美国为首的北约在轰炸南联盟时,广泛使用了美制贫铀弹,造成了严重的后果。
已知贫铀弹中含有铀236(236是铀的相对原子质量)是一种放射性元素,其质子数为92,则这种铀原子里中子数和核外电子数之差为。
分析本题的解题关键是理清原子中各种离子之间的关系。
根据核电荷数=质子数=核外电子数相对原子质量=质子数+中子数可以推导出:中子数=236-92=144电子数=92中子数-电子数=144-92=52答案52例2 道尔顿的原子学说对化学的发展起到了十分重要的作用。
它的原子学说中,包括以下三个论点:①原子是不能再分的粒子;②同种元素的原子的各种化学性质和质量都相同;③原子是微小的实心球体。
而现代科学实验证明,同种元素的原子内部有相同的质子数和不一定相同的中子数。
从现代的观点来看,你认为道尔顿的三个论断中,不确切的是(填序号)。
分析原子不是构成物质的最小微粒,还可以再分,原子由具有原子中心的带正电的原子核和核外带负电的电子构成。
原子核比原子小得多,其半径约为原子半径的十万分之一,原子核的体积只占原子体积的几千亿分之一。
故三个论点都不确切,。
答案①②③启示本题是对化学发展史的考察。
从本题可以看出,任何科学理论都是在不断总结前人的经验并不断完善的。
它激励学生努力开拓,为科学的发展而拼搏。
随堂反馈1.在化学的发展发面,很多科学家作出了重大贡献,请把科学家名字的序号填在后面的横线上。
科学家:①拉瓦锡②汤姆生③道尔顿④阿伏加德罗(1)提出近代原子学说的是;(2)提出分子的概念的是;(3)发现电子的是。
2.我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。
铟元素的核电荷数为49,相对原子质量为115。
铟原子的核外电子数为()A.115B.49C.66D.1643.著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动的放射出一些固定的粒子。
一种元素的原子经过放射变成了另一种元素的原子,据此推断出放射出的粒子一定有()A.电子B.中子C.质子D.原子核火眼金睛1.下列有关原子的说法中正确的是()A.原子都是由质子、中子和核外电子构成的B.原子的类别是由原子核内的质子数所决定的C.原子中不存在带电微粒,因而整个原子不显电性D.原子的质量主要集中在质子和电子上2.一个碳原子的质量是1.993×10-26Kg,碳的相对原子质量为()A. 12 gB. 1/12C.12D.1.993×10-26Kg/123、据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城的年代。
碳-14原子的核电荷数为6,相对原子质量为14。
下列关于碳-14原子的说法中,错误的是( )A.中子数为6B.质子数为6C.电子数为6D.质子数和中子数之和为144.碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量最之比为( )A.12:1B.2:12C.2:1D.1:2画龙点睛5.原子是由位于原子中心带电的和核外带电的构成的,由于所带电量和所带电量相等,但,因此整个原子不显电性。
原子核一般是由、构成的,质子带,中子,原子的质量主要集中在上。
6.已知镁的相对原子质量为24,铜的相对原子质量为64,铁的相对质子质量为56。
现在有这三种金属各10 g,则这三种金属所含的原子个数比镁:铜:铁为。
课外阅读卢瑟福的小故事卢瑟福1871年8月30日生于新西兰纳尔逊附近的泉林村。
父亲是农民和工匠,母亲是乡村教师。
他在小学就对科学实验产生了兴趣。
由于成绩优秀,学习期间曾获一系列奖学金。
卢瑟福是20世纪初最伟大的实验物理学家,他1908年获诺贝尔化学奖。
一生发表论文约215篇,著作6种,培养了10位诺贝尔奖获得者。
1937年10月19日患肠阻塞并发症逝世,葬于伦敦威斯敏斯特大教堂牛顿墓旁。
故事一:现代原子物理学的奠基者卢瑟福对思考极为推崇。
一天深夜,他看到一位学生还在埋头实验,便好奇地问:“上午你在做什么?”学生回答:“在做实验”。
“下午呢?”“做实验”。
卢瑟福不仅皱起了眉头,继续追问:“那晚上呢?”“也在做实验。
”卢瑟福大为恼火,厉声斥责:“你一天到晚都在做实验,什么时间用于思考呢?”故事二:苏联来的青年彼得·卡皮查,初登卡文迪许的门时卢瑟福并不准备收他,因为这里几乎每天都有人想跻身其中,能当卢瑟福的一名研究生是青年人的最高荣誉。
卡皮查问:“卢瑟福先生,我能来卡文迪许做一名研究生吗?”“对不起,我这里的名额已经满员。
”“实验室里的名额允许不允许有一点误差啊?”“一般不得超过百分之十。
”“那就好办,你们一共三十人,加我一个还在允许范围之内。
”卢瑟福笑了,他一看这就是个十分聪明的青年,便高兴地说:“好,收下你。
”课题2元素趣味导读某天清晨,你被一阵闹钟惊醒,赶紧从床上跳起,穿衣涮洗吃饭,正准备上学。
突然,你问自己,今天是上学的日子吗?查了日历以后发现,今天不是上学的日子,因为是星期天。
日历是将每月中的日子以星期为周期排列而成的。
周一是上学的第一天,周六则是周末的开始。
由于将每一年中的每一天都进行了有序的排列,因而日历给我们的日常生活提供了许多便利。
在化学中,化学家也对元素进行了有序的排列,其排列方式类似于日历中日期的排列。
你将马上了解到,其实“化学家的日历”就是“元素周期表”智能点拨例1 1977年8月,国际化学会无机化学分会作出一项决议:从104号元素以后,不再以人名、国名来命名,一律以新元素的原子序数(核电荷数)的拉丁文所写来命名,即nil-0,un-1,tri-3,quad-4,pent-5,hex-6,sept-7,dct-8,enn-9,照此规定,第104号元素的拉丁文名称按照“un-nil quad+ium(词缀)”应为“unnilquadium”,其元素符号为:“Unq”,第105号元素的拉丁文名称是:“unnilpentium”,元素符号为:“Uuu”,以此类推,请分别给下列元素命名:(1)第109号元素的拉丁文名称为“”,其元素符号为:“”;(2)第111号元素的拉丁文名称为“”,其元素符号为:“”;(3)第116号元素的拉丁文名称为“”,其元素符号为:“”。
分析新课程标准中的教学目标之一:“过程与方法”。
我们已经学习了很多元素符号,但是这些元素符号都怎样来的呢?同学们肯定都想知道,通过这道题,同学们不但知道元素符号的来历,而且还增长了一点拉丁文的知识。
仔细阅读题中所给信息,以109号元素为例:Un-nil-enn-ium,元素符号为Une。
例2 正确认识相关事物的相同点与不同点,是学好化学的关键之一。
我们可用下图来表示事物的异同点。
将两种事物的共同点写在两个圆重叠的区域内,每种事物的不同点则写在相应圆重叠区域以外的部分。
请参照下图左侧事例,另外确定一组化学事物,填写右侧的空格中。
分析单质和化合物的内在联系为都是纯净物,不过单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
本题为开放性填充简答题,只要合乎事实即是对的。
答案举例:A分子 B原子;a在化学反应中可以再分;b构成物质的基本粒子;c在化学反应中不能再分;随堂反馈1.下列各组元素符号的第一个字符相同的是()A.铁、锌、钠B.钙、铝、铜C.铝、银、镁D.碳、钙、氯2.大多矿泉水瓶的标签上印有如下字样:Ca≥4.0mg/L、Mg≥0.5mg/L、K≥0.35mg/L、Na≥0.8m g/L等,这里的Ca、Mg、K、Na是指( )A.元素B.分子C.原子D.都不是3.元素外文名称往往都有一定含义,有的是以发现这种元素的科学家的祖国名称来命名,有的是以发现这种元素的科学家发姓氏来命名。
“锿”(Ai)这种元素是纪念()A.门捷列夫B.居里夫人C.拉瓦锡D.爱因斯坦4.猜谜语黄金丢失(打一元素);品质高尚(打三种元素);华盛顿的货币(打一元素);流水退尽现暗礁(打一元素)。
火眼金睛1.一种元素和另一种元素的本质区别是()A.原子最外层电子数不同B.原子的质子数不同C.原子的电子层数不同D.原子的中子数不同2.下列说法正确的是()A.同种元素组成的物质一定是单质B.含有多种元素的物质一定属于混合物C.不同的物质可以含有相同的元素D.单质都是由同一种原子构成的纯净物3.表示4个氢原子的符号是()A.4H2B.4HC.2H2D.H4.空气中含量最多元素、地壳中含量最多金属元素和非金属元素可组成化合物是()A. Al2(SO4)3B. Al(NO3)3C. Fe(NO3)3D.Al2O35.科学家发现了一种质子数与氢原子相同,但中子数比氢原子多一个的新原子,关于此原子的说法中,正确的是()A.属于一种新元素B.跟氢原子相同的原子C.是氢元素的另一种原子D.与氢元素不同类的原子画龙点睛6.用肇庆特产之一桂皮蒸镏可以得到桂油,其主要成分是肉桂醛,化学式为C9H8O,它可作为饮料和食品的增香剂。
则肉桂醛中含有种元素,1个肉桂醛分子中有原子。
7.若将铝、铁、氯、硅、氢、氧、锌、硫、磷、铜、氮、碳、银、钙等分成A和B两组,且A组中必须包括氧,应该如何分?试把分组结果用它们的元素符号表示出来:A组:;B组。
数据处理8.在元素周期表中氟(F)、氯(Cl)、溴(Br)、碘(I)四种元素具有相似的原子结构,化学上把他们统称为卤族元素;卤族元素的单质具有相似的组成、结构和化学性质,其单质的物理性质随着质子数的递增呈现规律性的变化,请你利用上述信息和下表中给出的卤族元素单质的一些性质,推测表中有关卤族元素单质的组成和性质,填写表中空格。
课外阅读超重元素你知道最重的元素与我们的生活有什么关系吗?科学家能够“制造”出当今最重的元素,可谓是一项重大的发现,这些“超重元素”具有极大的应用价值。
例如,铀就能用作核能发电,而同样属于重元素的镭,就是一种放射性元素,放射性比铀还要强几百倍。
镭放射出的射线,可以用于治疗癌症(近年来,镭已经被较易控制的钴所取代)。
此外,科学家凭着锲而不舍的探索精神,不断发掘新的元素,人类将会更了解这个世界,进一步拓宽知识的领域课题3离子趣味导读某天放学后,小健和小康一起到学校附近的文具店买圆珠笔。
圆珠笔的价格为8元,小健的钱包里有9元,要买一支圆珠笔绝对没有问题,可是,小康只有7元,怎么办呢?向来乐于助人的小健,不假思索的把自己的多余的1元借给小康。